0% acharam este documento útil (0 voto)
36 visualizações2 páginasModelos Atomicos e Semelhanças Atomicas
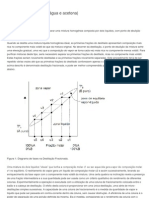
O documento descreve a evolução dos modelos atômicos ao longo do tempo, começando pelas ideias de Demócrito e Leucipo na Grécia antiga de que a matéria era constituída por átomos indivisíveis. O modelo atômico de Dalton propôs que cada elemento químico possui um tipo único de átomo e que as reações químicas envolvem a recombinação desses átomos. Posteriormente, os modelos de Thomson, Rutherford e Rutherford-Bohr introduziram as noções de elétrons e núcleo
Enviado por
Emanuel RibeiroDireitos autorais
© © All Rights Reserved
Levamos muito a sério os direitos de conteúdo. Se você suspeita que este conteúdo é seu, reivindique-o aqui.
Formatos disponíveis
Baixe no formato PDF, TXT ou leia on-line no Scribd
0% acharam este documento útil (0 voto)
36 visualizações2 páginasModelos Atomicos e Semelhanças Atomicas
O documento descreve a evolução dos modelos atômicos ao longo do tempo, começando pelas ideias de Demócrito e Leucipo na Grécia antiga de que a matéria era constituída por átomos indivisíveis. O modelo atômico de Dalton propôs que cada elemento químico possui um tipo único de átomo e que as reações químicas envolvem a recombinação desses átomos. Posteriormente, os modelos de Thomson, Rutherford e Rutherford-Bohr introduziram as noções de elétrons e núcleo
Enviado por
Emanuel RibeiroDireitos autorais
© © All Rights Reserved
Levamos muito a sério os direitos de conteúdo. Se você suspeita que este conteúdo é seu, reivindique-o aqui.
Formatos disponíveis
Baixe no formato PDF, TXT ou leia on-line no Scribd