Escolar Documentos
Profissional Documentos
Cultura Documentos
Questões Cinética
Enviado por
rubens.costaTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Questões Cinética
Enviado por
rubens.costaDireitos autorais:
Formatos disponíveis
Química – Cinética Química - 2° ano Prof: Rubens Costa
1 – UFPE Em qual das condições a seguir o Para tornar essa reação mais rápida, pode-se
processo de deterioração de 1 kg de carne de repetir o experimento fazendo o seguinte:
boi será mais lento? I. aquecer a solução de ácido
a) Peça inteira colocada em nitrogênio liquido. II. usar solução de ácido mais diluída
b) Fatiada e colocada em gelo comum. III. triturar o prego
c) Fatiada e colocada em gelo-seco (CO2) A rapidez SOMENTE é aumentada quando se
sólido realiza
d) Peça inteira em gelo comum a) I b) II c) III
e) Fatiada, cada fatia envolvida individualmente d) I e II e) I e III
em plástico e colocada em freezer de uso 7 - U. F. Juiz de Fora-MG Muitas das reações
doméstico. químicas que ocorrem no nosso organismo, nas
2 – Puccamp-SP Considere as duas fogueiras indústrias químicas e na atmosfera são afetadas por
representadas a seguir, feitas, lado a lado, com certos catalisadores. Por exemplo, no homem, as
o mesmo tipo e quantidade de lenha. enzimas são os catalisadores das reações
bioquímicas. A função destes nas reações químicas
é:
a) diminuir a energia de ativação da reação.
b) tornar espontânea uma reação não espontânea.
1 2 c) deslocar o equilíbrio da reação.
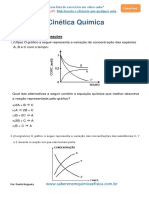
A rapidez da combustão da lenha será: d) diminuir a entalpia total de uma reação.
a) maior na fogueira 1, pois a superfície de 8 - PUC-PR No gráfico abaixo, estão representadas
contato com o ar é maior. as concentrações, ao longo do tempo, de quatro
b) maior na fogueira 1, pois a lenha está mais substâncias – A, B, C e D – que participam de uma
compactada, o que evita a vaporização de reação hipotética.
componentes voláteis.
c) Igual nas duas fogueiras, uma vez que a
quantidade de lenha é a mesma e estão no
mesmo ambiente.
d) Maior na fogueira 2, pois a lenha está menos
compactada, o que permite maior retenção
de calor pela madeira.
e) Maior na fogueira 2, pois a superfície de
contato com o ar é maior.
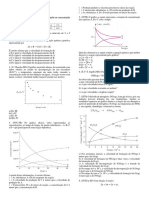
3 – UECE Seja a reação: X ë Y + Z. A variação
na concentração de X em função do tempo é
A partir destas informações, é correto afirmar:
( ) As substâncias A e B são reagentes da reação.
A velocidade média da reação no intervalo de 2 ( ) A velocidade de produção de C é menor que a
a 5 minutos é: velocidade de produção de A.
a) 0,3 mol/L.min b) 0,1 mol/L.min ( ) Transcorridos 50 s do início da reação, a
c) 0,5 mol/L.min d) 1,0 mol/L.min concentração de C é maior que a concentração de
4 - UFV A formação do dióxido de carbono B.
(CO2) pode ser representada pela equação ( ) Nenhum produto se encontra presente no início
C(s) + O2 (g) CO2 (g). da reação.
Se a velocidade de formação do CO2 for de ( ) A mistura das substâncias A e D resulta na
4mol/minuto, o consumo de oxigênio, em produção de B.
mol/minuto, será: ( ) As substâncias A, B e D estão presentes no
a) 8 b) 16 c) 2 início da reação.
d) 12 e) 4 9 - Mackenzie-SP A combustão do butano é
5 – UFV Para a reação representada pela equação
CH3Br + Cl - CH3Cl + Br -
as afirmativas a seguir estão corretas,
EXCETO: Se houver um consumo de 4 mols de butano a cada
a) aumentando-se a concentração de CH3Br, 20 minutos de reação, o número demols de dióxido
aumenta-se a velocidade da reação. de carbono produzido em 1 hora será:
b) aumentando-se a concentração de Cl -, a) 16 mols/h b) 5 mols/h c)48 mols/h
aumenta-se a velocidade da reação. d) 8 mols/h e) 4 mols/h
c) aumentando-se a temperatura, aumenta-se a 10 - UFSE Em geral, reação química não ocorre
velocidade da reação. toda vez que acontece uma colisão entre espécies
d) aumentando-se as concentrações de Cl - e potencialmente reativas. A reação ocorre quando as
CH3Br, diminui-se a velocidade da reação. espécies reativas possuem um mínimo de energia
e) utilizando-se um catalisador, aumenta-se a no momento da colisão. É uma barreira que as
velocidade da reação. espécies que colidem devem suplantar para
6 - Unifor-CE Um prego de ferro foi colocado produzir os produtos. Esse mínimo de energia
em uma solução aquosa ácida e aconteceu a denomina-se energia de
reação representada pela equação: a) reação. b) ativação.
Fe(s) + 2H + (aq) → Fe2+ (aq) + H2(g) c) dissociação. d) ionização.
e) combustão.
Você também pode gostar
- Quím CinéticaDocumento8 páginasQuím CinéticaJoão Ribeiro Franco NetoAinda não há avaliações
- Fase_3_Lista_2_cinética (1)Documento2 páginasFase_3_Lista_2_cinética (1)ventiladoramoebaAinda não há avaliações
- Lista Exercicio Cinetica QuimicaDocumento4 páginasLista Exercicio Cinetica QuimicaKely GontijoAinda não há avaliações
- Cinética QuímicaDocumento4 páginasCinética QuímicaGerson LimaAinda não há avaliações
- DF Quimica Welson 5e790946badf2 PDFDocumento27 páginasDF Quimica Welson 5e790946badf2 PDFKeverto. SoaresAinda não há avaliações
- Lista 8 - Cinética Química - Físico-Química - Cursinho VitorianoDocumento9 páginasLista 8 - Cinética Química - Físico-Química - Cursinho Vitorianoana biaAinda não há avaliações
- 2º Ano - Exercício Avaliativo - Cinética QuimicaDocumento2 páginas2º Ano - Exercício Avaliativo - Cinética Quimicahelenafrancoamorimfox2Ainda não há avaliações
- Velocidade média de reações químicasDocumento2 páginasVelocidade média de reações químicasRtyu IuytAinda não há avaliações
- LISTA DE TERMOQUÍMICA E CINÉTICA - 2º ANODocumento24 páginasLISTA DE TERMOQUÍMICA E CINÉTICA - 2º ANOFernanda BarretoAinda não há avaliações
- Qui MicaDocumento6 páginasQui MicaIanne PinhoAinda não há avaliações
- Lista de Exercícios I (2º Bimestre) - 3º AnoDocumento3 páginasLista de Exercícios I (2º Bimestre) - 3º AnoMikeas LimaAinda não há avaliações
- Cinetica Quimica 21 Questoes Com GabaritoDocumento6 páginasCinetica Quimica 21 Questoes Com GabaritoCíntia GhettiAinda não há avaliações
- Cinética química exercíciosDocumento6 páginasCinética química exercíciosNazareno BragaAinda não há avaliações
- Lista de exercícios de química geralDocumento4 páginasLista de exercícios de química geralMary Eduarda MoraesAinda não há avaliações
- Lista de Exercícios Cinética QuimicaDocumento7 páginasLista de Exercícios Cinética Quimicatrilha AAinda não há avaliações
- CINÉTICADocumento7 páginasCINÉTICAVaneilton ReynaudAinda não há avaliações
- Cinetica 04Documento2 páginasCinetica 04Sandro BaldezAinda não há avaliações
- Atividade Extra - Episódio 11 - Cinética QuímicaDocumento9 páginasAtividade Extra - Episódio 11 - Cinética QuímicaGabriel BoaventuraAinda não há avaliações
- Velocidade reação cinéticaDocumento50 páginasVelocidade reação cinéticagabriellelAinda não há avaliações
- Quimica 4Documento4 páginasQuimica 4João PedroAinda não há avaliações
- Fatores que influenciam a cinética químicaDocumento4 páginasFatores que influenciam a cinética químicaAndreia AnnaAinda não há avaliações
- Fatores que alteram a velocidade de reações químicasDocumento27 páginasFatores que alteram a velocidade de reações químicasLuiza FreitasAinda não há avaliações
- Cinetica - Fatores Que Alteram A Velocidade - 20220215124854 - U2FsdDocumento7 páginasCinetica - Fatores Que Alteram A Velocidade - 20220215124854 - U2FsdJoao MaiaAinda não há avaliações
- Cinética Química: exercícios sobre energia de ativação e velocidade de reaçõesDocumento14 páginasCinética Química: exercícios sobre energia de ativação e velocidade de reaçõesFrancis Francisco Johane SemanaAinda não há avaliações
- Rapidez Das Reações 28 QuestõesDocumento13 páginasRapidez Das Reações 28 QuestõesBraga 333Ainda não há avaliações
- Cinetica QuimicaDocumento2 páginasCinetica QuimicaCMJ O caderno mágico do JamesAinda não há avaliações
- Lista 1.cinética QuímicaDocumento6 páginasLista 1.cinética Químicagiovannaluiza1323Ainda não há avaliações
- Química - Simulado sobre reações exo e endotérmicasDocumento1 páginaQuímica - Simulado sobre reações exo e endotérmicasEder SoaresAinda não há avaliações
- Avaliação Termoquímica - 2ºano QuímicaDocumento2 páginasAvaliação Termoquímica - 2ºano QuímicaFrannn22duran DuranAinda não há avaliações
- Cinética química: reações e fatores que influenciam a velocidadeDocumento9 páginasCinética química: reações e fatores que influenciam a velocidaderafael souzaAinda não há avaliações
- Fundamentos de TermoquímicaDocumento7 páginasFundamentos de TermoquímicaFelipe ZataAinda não há avaliações
- Lista Geral de TermoquímicaDocumento8 páginasLista Geral de TermoquímicaLucas de CarvalhoAinda não há avaliações
- Reações químicas: velocidade, entalpia e energia de ativaçãoDocumento4 páginasReações químicas: velocidade, entalpia e energia de ativaçãoRtyu IuytAinda não há avaliações
- Termoquímica - exercícios de químicaDocumento5 páginasTermoquímica - exercícios de químicakAMILAAinda não há avaliações
- Lista - 1 Série E.M - P3 - IfDocumento3 páginasLista - 1 Série E.M - P3 - IfKamilla FerreiraAinda não há avaliações
- Química lista exercícios fixação AV02Documento6 páginasQuímica lista exercícios fixação AV02Natalia AmaralAinda não há avaliações
- Ssa 2 - 2023 - Cinética QuímicaDocumento15 páginasSsa 2 - 2023 - Cinética Químicahannahbeatriz.m.b.feitosaAinda não há avaliações
- Alfa - Módulo 37Documento23 páginasAlfa - Módulo 37Jackson Rodrigo Sousa PintoAinda não há avaliações
- Lista CinéticaDocumento18 páginasLista Cinéticamoitinhamhsp2Ainda não há avaliações
- Exercícios de Revisão Termoquímica 2º ANODocumento2 páginasExercícios de Revisão Termoquímica 2º ANOPaulo MancinoAinda não há avaliações
- Cinética Química - Objetivas - BásicoDocumento4 páginasCinética Química - Objetivas - BásicoLeonardo JacquesAinda não há avaliações
- Lista de ExercícioDocumento16 páginasLista de ExercíciojuliocesarjcAinda não há avaliações
- Físico-Química - Cinética Química (20 Questões)Documento10 páginasFísico-Química - Cinética Química (20 Questões)Ciencias PPT100% (1)
- Velocidade Média das Reações: Fatores que Afetam e Exercícios ResolvidosDocumento28 páginasVelocidade Média das Reações: Fatores que Afetam e Exercícios ResolvidosIque Castro MarianoAinda não há avaliações
- Exam 978460 1Documento60 páginasExam 978460 1Caio LimmaAinda não há avaliações
- Termoquímica: Processos Exotérmicos e EndotérmicosDocumento37 páginasTermoquímica: Processos Exotérmicos e Endotérmicosjose492432Ainda não há avaliações
- Fatores Que Alteram A Velocidade Da Reação QuímicaDocumento3 páginasFatores Que Alteram A Velocidade Da Reação QuímicaGiovani AraújoAinda não há avaliações
- Revisà o 2 Sã© Rie Termoquà - Mica - SagradoDocumento6 páginasRevisà o 2 Sã© Rie Termoquà - Mica - SagradoNoemia CarolinaAinda não há avaliações
- Lista Da Aula 3 - Cinética QuímicaDocumento5 páginasLista Da Aula 3 - Cinética QuímicaE P Som RJAinda não há avaliações
- Química - Teste com 5 questões sobre cinética e equilíbrio químicoDocumento2 páginasQuímica - Teste com 5 questões sobre cinética e equilíbrio químicoAlexandreAinda não há avaliações
- Cola 2Documento1 páginaCola 2faAinda não há avaliações
- Cinética QuímicaDocumento5 páginasCinética QuímicaJames OliverAinda não há avaliações
- Termoquímica-Primeira ParteDocumento3 páginasTermoquímica-Primeira PartesrfesjiunAinda não há avaliações
- Estudo Dirigido Provão 4º BimestreDocumento5 páginasEstudo Dirigido Provão 4º BimestreJerusaFreitasAinda não há avaliações
- Apostila Química Orgânica: Carbono, Dienos E AromáticosNo EverandApostila Química Orgânica: Carbono, Dienos E AromáticosAinda não há avaliações
- Apostila Química Orgânica: Terpenos E Rotas De SínteseNo EverandApostila Química Orgânica: Terpenos E Rotas De SínteseAinda não há avaliações
- Enem 2018 - Ciências Da Natureza E Suas TecnologiasNo EverandEnem 2018 - Ciências Da Natureza E Suas TecnologiasAinda não há avaliações
- ls2 Qe 2 6 6 Energia de Ligac3a7c3a3o br1Documento1 páginals2 Qe 2 6 6 Energia de Ligac3a7c3a3o br1Jackson Rodrigo Sousa PintoAinda não há avaliações
- Fispq Hidro C-10 01-2019Documento7 páginasFispq Hidro C-10 01-2019williamAinda não há avaliações
- Atividade Experimental - TermoquimicaDocumento4 páginasAtividade Experimental - TermoquimicaDragon지Ainda não há avaliações
- ENSINO FUNDAMENTAL NÍVEL A 9a ANODocumento4 páginasENSINO FUNDAMENTAL NÍVEL A 9a ANOJoãoAinda não há avaliações
- II LaboratorioDocumento24 páginasII LaboratorioGOSMEAinda não há avaliações
- ASTM D 4007_BSW_TraduzidaDocumento21 páginasASTM D 4007_BSW_TraduzidacarolccamposAinda não há avaliações
- Norma Técnicas ABNTDocumento3 páginasNorma Técnicas ABNTKaline MirellaAinda não há avaliações
- Cuprolux Banho de Cobre Ácido InstruçõesDocumento4 páginasCuprolux Banho de Cobre Ácido InstruçõesMarcelo MoraisAinda não há avaliações
- Aula 3 - Química Orgânica - 2 PDFDocumento40 páginasAula 3 - Química Orgânica - 2 PDFCaic FigueiredoAinda não há avaliações
- Roteiro Aula Prática 01 - Extração de Ácidos Nucleicos - BiomolDocumento2 páginasRoteiro Aula Prática 01 - Extração de Ácidos Nucleicos - BiomolMARIA RODRIGUESAinda não há avaliações
- Exercício Sobre Escalas TermométricasDocumento5 páginasExercício Sobre Escalas TermométricasMayza OliveiraAinda não há avaliações
- Et Geen 005. Abertura de Vala para Construção de Redes e Ramais Rev.1Documento18 páginasEt Geen 005. Abertura de Vala para Construção de Redes e Ramais Rev.1Sebastião AmaroAinda não há avaliações
- Avaliação de Ciências sobre Reações QuímicasDocumento2 páginasAvaliação de Ciências sobre Reações QuímicasFrancisco GuiaAinda não há avaliações
- Cartilha Qualidade Do Ar Interior Ceaj DigitalDocumento40 páginasCartilha Qualidade Do Ar Interior Ceaj DigitalRICARDO100% (1)
- Creme protetor para mãos testado e aprovadoDocumento6 páginasCreme protetor para mãos testado e aprovadoSHELLAMARIAAinda não há avaliações
- Quimica OrganicaDocumento3 páginasQuimica OrganicaLuanda OliveiraAinda não há avaliações
- Entalpia de combustão e reações químicasDocumento3 páginasEntalpia de combustão e reações químicasItarralyss HericoAinda não há avaliações
- Eq11 Dossie Prof Teste Aval 1 CriteriosDocumento3 páginasEq11 Dossie Prof Teste Aval 1 CriteriosClaudia QueirosAinda não há avaliações
- Poliol - AMIPOL PPS 295Documento1 páginaPoliol - AMIPOL PPS 295Geovane LinoAinda não há avaliações
- Manual de Instruções Hi98108Documento2 páginasManual de Instruções Hi98108FERNANDO TARDIAinda não há avaliações
- Eficácia Antifúngica de Extratos de Folha e de SementeDocumento2 páginasEficácia Antifúngica de Extratos de Folha e de SementeRailton MoraisAinda não há avaliações
- Geometria molecular e hibridação de orbitais: determinando a forma das moléculasDocumento102 páginasGeometria molecular e hibridação de orbitais: determinando a forma das moléculasBruna Lopes100% (1)
- Técnicas de reforço de vigas de concreto armado: características e aplicaçõesDocumento8 páginasTécnicas de reforço de vigas de concreto armado: características e aplicaçõesSavio CarvalhoAinda não há avaliações
- Aula 06 - PavimentaçãoDocumento2 páginasAula 06 - PavimentaçãoGUSTAVOAinda não há avaliações
- Reações de oxirredução: experimentos com ferro, cobre, zinco e outros agentes oxidantes/redutoresDocumento24 páginasReações de oxirredução: experimentos com ferro, cobre, zinco e outros agentes oxidantes/redutoresNatália NetoAinda não há avaliações
- Vilankulo PDFDocumento1 páginaVilankulo PDFCarlos MaroveAinda não há avaliações
- SANEAMENTO - Estudo de CoagulaçãoDocumento9 páginasSANEAMENTO - Estudo de CoagulaçãoJoão Luiz FernandesAinda não há avaliações
- Orientação para escopos de laboratórios de ensaios ambientaisDocumento34 páginasOrientação para escopos de laboratórios de ensaios ambientaisAdrianaAinda não há avaliações
- Atividade 2 Tntva 2Documento8 páginasAtividade 2 Tntva 2Alexandre Augusto Rogatti de MeloAinda não há avaliações
- Amostragem de LíquidosDocumento7 páginasAmostragem de LíquidosJúlia Ferreira CanellaAinda não há avaliações