Escolar Documentos
Profissional Documentos
Cultura Documentos
Cinética Básica
Enviado por
James OliverDescrição original:
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Cinética Básica
Enviado por
James OliverDireitos autorais:
Formatos disponíveis
Cintica Qumica - Bsica
d) 1,0 mol L1h1 e) 2,3 mol h1 3. (MACK SP/2007)
C 2 H 6 O 3 O 2 2 CO 2 2 H 2 O
1.
(UFMG/2006)
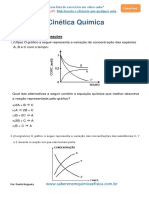
Analise este grfico, em que est representada a variao da concentrao de um reagente em funo do tempo em uma reao qumica:
A equao acima representa a combusto do etanol. Se aps 2 horas de reao forem produzidos 48 mol de CO2, a quantidade em mol de etanol consumido em 1 minuto de a) 0,5 mol. b) 24,0 mol. c) 0,04 mol. d) 0,2 mol. e) 12,0 mol. Considerando-se as informaes desse grfico, CORRETO afirmar que, no intervalo entre 1 e 5 minutos, a velocidade mdia de consumo desse reagente de: a) 0,200 (mol / L) / min . b) 0,167 (mol / L) / min . c) 0,225 (mol / L) / min . d) 0,180 (mol / L) / min . 2. (UFPE/2006) 4. (Unimontes MG/2007)
O grfico abaixo mostra a decomposio do iodeto de hidrognio, a 508C, segundo a equao:
2 HI(g) H 2 (g) I 2 (g)
A reao de decomposio da amnia gasosa foi realizada em um recipiente fechado: 2NH3 N2 + 3H2 A tabela abaixo indica a variao na concentrao de reagente em funo do tempo. [NH3] mol/l Tempo em horas 8 0 6 1 4 2 1 3
Qual a velocidade mdia de consumo do reagente nas duas primeiras horas de reao? a) 4,0 mol L1h1 b) 2,0 mol L1h1 c) 10 km h1
No tempo de 100 s, a taxa de decomposio do HI igual a 0,00025 mol L1s1. Baseandose nas informaes fornecidas, pode-se afirmar que a) a taxa de formao de I2, a 100 s, igual a 0,00050 mol L1s1. b) a velocidade da reao maior nos primeiros 50 s de tempo. c) a taxa de decomposio do HI, a 300 s, maior do que a 100 s. d) a concentrao de HI aumenta no decorrer do tempo de reao. 5. (Unimontes MG/2008)
Professor Carvalho Professor Cirilo www.especificadequimica.com.br
Cintica Qumica - Bsica
A combusto do gs butano representada pela seguinte equao no balanceada:
C 4 H10 O 2 CO 2 H 2 O
caminhos reacionais diferentes, ambos nas mesmas condies de temperatura e de presso.
Considerando-se que foram consumidos 4 mols de butano a cada 20 minutos de reao, o nmero de mols de gs carbnico produzido em uma hora de queima a) 16 mol/h. b) 48 mol/h. c) 6,0 mol/h. d) 12 mol/h. 6. (Unicamp 2012) Glow sticks ou light sticks so pequenos tubos plsticos utilizados em festas por causa da luz que eles emitem. Ao serem pressionados, ocorre uma mistura de perxido de hidrognio com um ster orgnico e um corante. Com o tempo, o perxido e o ster vo reagindo, liberando energia que excita o corante, que est em excesso. O corante excitado, ao voltar para a condio no excitada, emite luz. Quanto maior a quantidade de molculas excitadas, mais intensa a luz emitida. Esse processo contnuo, enquanto o dispositivo funciona. Com base no conhecimento qumico, possvel afirmar que o funcionamento do dispositivo, numa temperatura mais baixa, mostrar uma luz
A respeito desse diagrama, INCORRETO afirmar que a) a diferena entre os valores de energia, representados pelas letras A e B, corresponde diminuio da energia de ativao do processo, provocada pelo uso de um catalisador. b) o valor de energia representado pela letra C identifica a entalpia do produto. c) o valor de energia representado pela letra D se refere entalpia dos reagentes. d) a diferena entre os valores de energia, representados pelas letras A e D, corresponde energia de ativao do processo catalisado. e) a diferena entre os valores de energia, representados pelas letras C e D, corresponde variao da entalpia do processo. 8. (Ufsm 2012) O alumnio reciclado das latas de refrigerantes usado para a produo de esculturas. A chuva cida pode destruir as esculturas de alumnio, pois ele reage em meio cido conforme a reao a seguir.
a) mais intensa e de menor durao que numa temperatura mais alta. b) mais intensa e de maior durao que numa temperatura mais alta. c) menos intensa e de maior durao que numa temperatura mais alta. d) menos intensa e de menor durao que numa temperatura mais alta. 7. (Mackenzie 2012) O diagrama abaixo se refere a um processo qumico representado pela equao qumica X2(g) + Y2(g) 2XY(g) realizado por meio de dois
2A (s) 3H2SO4(aq) A 2 (SO4 )3(aq) 3H2(g)
Com referncia a essa reao, so feitas as seguintes observaes experimentais: - A reao libera calor. - Duplicando a concentrao de cido sulfrico,
Professor Carvalho Professor Cirilo www.especificadequimica.com.br
Cintica Qumica - Bsica
duplica a velocidade de desprendimento do gs. - A velocidade de desprendimento do gs aumenta com a temperatura. - A diminuio do tamanho das partculas de alumnio aumenta a velocidade da reao. Com base nessas observaes, correto afirmar: a) A reao endotrmica, pois a entalpia dos produtos maior que a dos reagentes. b) A velocidade da reao aumenta com o aumento da concentrao de cido sulfrico, pois a adio desse reagente diminui a energia de ativao da reao. c) A temperaturas mais altas, a energia cintica molecular aumenta, por isso as colises entre as molculas ocorrem com maior energia, levando a um aumento da velocidade da reao. d) A reao endotrmica, portanto a velocidade da reao aumenta com o aumento da temperatura. e) A superfcie de contato diminui com a diminuio do tamanho das partculas de alumnio, por isso a velocidade da reao aumenta. 9. (Unioeste 2012) A ao de um catalisador sobre uma reao qumica to importante para a cincia e para a indstria que existe um ramo de pesquisas que se destina ao estudo de reaes que so realizadas com catalisador. Um exemplo de utilizao industrial de catalisadores est na produo do oxignio (O2) a partir do clorato de potssio (KClO3) utilizando como catalisador o dixido de mangans (MnO2) KClO3(s) 2KCl(s) + 3 O2(g) A respeito dos catalisadores e de suas reaes, pode-se afirmar que a) as reaes com catalisadores so reaes que no podem ser realizadas sem a sua utilizao. b) as reaes com catalisadores sempre fornecem maiores rendimentos.
c) o catalisador faz com que ocorra uma diminuio na energia de ativao, e com isso a reao ocorre mais rapidamente. d) o catalisador faz com que ocorra um aumento na energia de ativao, e com isso a reao ocorre mais rapidamente. e) os catalisadores tambm podem ser chamados de inibidores de produtos indesejados. 10. (Uepa 2012) Um dos grandes problemas ambientais na atualidade relaciona-se com o desaparecimento da camada de oznio na atmosfera. importante notar que, quando desaparece o gs oznio, aparece imediatamente o gs oxignio de acordo com a equao abaixo: 2 O3(g) 3 O2(g)
Considerando a velocidade de aparecimento de O2 igual a 12 mol/l.S a velocidade de desaparecimento do oznio na atmosfera em 12 mol/l.S : a) 12 b) 8 c) 6 d) 4 e) 2 11. (UEL PR/2003) O oznio prximo superfcie um poluente muito perigoso, pois causa srios problemas respiratrios e tambm ataca as plantaes atravs da reduo do processo da fotossntese. Um possvel mecanismo que explica a formao de oznio nos grandes centros urbanos atravs dos produtos da poluio causada pelos carros, representada pela equao qumica a seguir: NO2 (g) + O2 (g) NO (g) + O3 (g) Estudos experimentais mostram que essa reao ocorre em duas etapas:
NO (g) + O (lenta) I. NO2(g) II. O2(g) + O O3 (g) (rpida)
Luz
Professor Carvalho Professor Cirilo www.especificadequimica.com.br
Cintica Qumica - Bsica
De acordo com as reaes apresentadas, a lei da velocidade dada por: a) v = k [O2] [O] b) v = k [NO2] c) v = k [NO2] + k [O2] [O] d) v = k [NO] [O3] e) v = k [O3] 12. (UNIMAR SP/2006) Para a reao:
A B C Produtos
Em uma experincia para determinar a lei de velocidade desta reao, os dados da tabela a seguir foram obtidos:
[ N 2 ], molL1 [H 2 ], molL1 0,03 0,01 0,06 0,01 0,03 0,02 velocidade , molL1 min 1 4,2 105 1,7 104 3,4 104
Com base nas informaes do enunciado, assinale a(s) proposio(es) CORRETA(S). 01. A lei de velocidade da reao de formao da amnia v = k[N2]2.[H2]3. 02. A partir de 10g de N2 so obtidos 17g de NH3. 04. Se a velocidade de formao da amnia igual a 3,4 x 104 molL1min1, ento a velocidade de consumo do nitrognio de 1,7 x 104 molL1min1. 08. A reao de formao da amnia de segunda ordem em relao ao nitrognio e ao hidrognio. 16. Quando a concentrao de N2 duplica, a velocidade da reao se reduz metade. 32. A expresso da constante de equilbrio para a reao : K = [NH3]2 / [N2].[ H2]3. 64. A velocidade de consumo do hidrognio um tero da velocidade de consumo do nitrognio. 14. (FEPECS DF/2008)
Os seguintes dados foram coletados: [A]mol/l [B]mol/l [C]mol/l Vmol/l.s 0,5 0,5 0,5 0,015 0,5 1,0 0,5 0,015 0,5 1,0 1,0 0,060 1,0 0,5 0,5 0,030 1,0 1,0 1,0 0,120
A lei de velocidade para a reao : a) v = K[A][B][C] b) v = K[A][B][C]2 c) v = [A][C]2 d) v = K[A]2[C]4 e) v = K[A]2[B][C]4 13. (UFSC/2008) O nitrognio do ar no assimilvel, mas por uma ao simbitica entre os legumes e certas bactrias que existem nos ndulos das razes, ele fixado no solo em forma de compostos amoniacais. A cada ano, em toda a superfcie terrestre, um bilho de toneladas de nitrognio atmosfrico transformado em N2 fixado, sendo que, dentre todas as reaes qumicas realizadas, a sntese da amnia a partir de hidrognio e nitrognio atmosfrico a mais importante, conhecida como Processo de Haber : N2(g) 3H2(g) 2NH3(g)
O 2-butanol um lcool que apresenta isomeria tica e pode ser obtido, em condies apropriadas, a partir da reao do 2-cloro-butano com uma base forte. A tabela abaixo apresenta algumas experincias realizadas envolvendo diferentes concentraes iniciais dos reagentes:
Experincia [OH ](mol.L1 ) I II III IV 0,15 0,30 0,15 0,18 [2 cloro bu tan ol] v(mol.L1. min 1 ) (mol.L1 ) 0,03 0,012 0,03 0,024 0,15 0,060 0,15 0,072
Professor Carvalho Professor Cirilo www.especificadequimica.com.br
Cintica Qumica - Bsica
O nmero de ismeros oticamente ativos do 2-butanol e a ordem da reao de obteno desse composto so, respectivamente: a) 2 e 2; b) 1 e 2; c) 2 e 1; d) 3 e 1; e) 1 e 3.
GABARITO 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. Letra A Letra B Letra D Letra B Letra B Letra C Letra D Letra C Letra C Letra B Letra B Letra C Soma = 37 Letra A
Professor Carvalho Professor Cirilo www.especificadequimica.com.br
Você também pode gostar
- Exercicios de Cinetica QuimicaDocumento11 páginasExercicios de Cinetica QuimicaMauro RomeroAinda não há avaliações
- Lista de Exercicio de Fixacao de Quimica A Av02 - 3o Bim. - 2o AnoDocumento6 páginasLista de Exercicio de Fixacao de Quimica A Av02 - 3o Bim. - 2o AnoNatalia AmaralAinda não há avaliações
- Atividade Cinética II SGDocumento7 páginasAtividade Cinética II SGademairmoreiraAinda não há avaliações
- Exercícios Cinética Química LivretoDocumento8 páginasExercícios Cinética Química LivretoJoão Ribeiro Franco NetoAinda não há avaliações
- Alfa - Módulo 37Documento23 páginasAlfa - Módulo 37Jackson Rodrigo Sousa PintoAinda não há avaliações
- Exercícios Revisão CinéticaDocumento20 páginasExercícios Revisão CinéticaIara DaherAinda não há avaliações
- Cinética Química - Expressão e Cálculo Da Velocidade - 130 QuestõesDocumento72 páginasCinética Química - Expressão e Cálculo Da Velocidade - 130 Questõesani_matrixx4733100% (1)
- Exercícios Cinética Com RespostaDocumento29 páginasExercícios Cinética Com Respostagreicifrauches57% (7)
- Cinetica CompletaDocumento5 páginasCinetica CompletaConta ReservaAinda não há avaliações
- Quimica ADocumento10 páginasQuimica Ahelenaquevedo64Ainda não há avaliações
- Lista Exercícios CinéticaB - 23Documento8 páginasLista Exercícios CinéticaB - 23isamatias01Ainda não há avaliações
- Cinética Química - Expressão e Cálculo Da Velocidade - 130 QuestõesDocumento72 páginasCinética Química - Expressão e Cálculo Da Velocidade - 130 QuestõesrafelAinda não há avaliações
- Lista de Exercícios Cinética QuímicaDocumento6 páginasLista de Exercícios Cinética QuímicagabezmirandaAinda não há avaliações
- Exercícios Cinética e EquilíbrioDocumento8 páginasExercícios Cinética e EquilíbrioBruna FerreiraAinda não há avaliações
- Cinetica-Quimica EXERCICIOSDocumento2 páginasCinetica-Quimica EXERCICIOScarlostucupiAinda não há avaliações
- CNPJDocumento5 páginasCNPJDavi AraújoAinda não há avaliações
- Cinética Química - Exercicios 08-10-2022Documento8 páginasCinética Química - Exercicios 08-10-2022FELIPE SILVAAinda não há avaliações
- Velocidade Das Reações - ÍtaloDocumento8 páginasVelocidade Das Reações - ÍtaloItalo PiresAinda não há avaliações
- Exercicios Cinetica C RespostasDocumento6 páginasExercicios Cinetica C RespostasSirlei Gonçalves PoffoAinda não há avaliações
- Alfa - Módulo 39Documento27 páginasAlfa - Módulo 39Luiza FreitasAinda não há avaliações
- Segunda Lista de Exercícios 2016 PDFDocumento2 páginasSegunda Lista de Exercícios 2016 PDFjonas leiteAinda não há avaliações
- Lista de Exercícios - Cinética QuímicaDocumento6 páginasLista de Exercícios - Cinética QuímicaNazareno BragaAinda não há avaliações
- Lista de Exercícios Cinética QuimicaDocumento7 páginasLista de Exercícios Cinética Quimicatrilha AAinda não há avaliações
- Lista 1.cinética QuímicaDocumento6 páginasLista 1.cinética Químicagiovannaluiza1323Ainda não há avaliações
- Físico-Química - Cinética Química (20 Questões)Documento10 páginasFísico-Química - Cinética Química (20 Questões)Ciencias PPT100% (1)
- Lista de Exercicios Cinetica Quimica EQM061Documento13 páginasLista de Exercicios Cinetica Quimica EQM061Mariana DomicianoAinda não há avaliações
- Lista de Exercícios I (2º Bimestre) - 3º AnoDocumento3 páginasLista de Exercícios I (2º Bimestre) - 3º AnoMikeas LimaAinda não há avaliações
- 2º Ano - Exercício Avaliativo - Cinética QuimicaDocumento2 páginas2º Ano - Exercício Avaliativo - Cinética Quimicahelenafrancoamorimfox2Ainda não há avaliações
- LISTA9Documento12 páginasLISTA9Amanda Tenório BatistaAinda não há avaliações
- 2012 cm0690 Cinetica Quimica 02Documento22 páginas2012 cm0690 Cinetica Quimica 02R4d1c4lDr34m3rAinda não há avaliações
- Lista Geral de TermoquímicaDocumento8 páginasLista Geral de TermoquímicaLucas de CarvalhoAinda não há avaliações
- Quimica 2o Ano - Ficha Pre-Rec PDFDocumento10 páginasQuimica 2o Ano - Ficha Pre-Rec PDFPriscilla Lyra BarbalhoAinda não há avaliações
- Bloco 2 Aula 17 A 21 Estudo Dos GasesDocumento12 páginasBloco 2 Aula 17 A 21 Estudo Dos GasesMax NunesAinda não há avaliações
- Cinetica QuimicaDocumento2 páginasCinetica QuimicaCMJ O caderno mágico do JamesAinda não há avaliações
- Lista Cinética 2023 - 2TDocumento2 páginasLista Cinética 2023 - 2TRafael playeraleAinda não há avaliações
- Quimica Cinetica Quimica ExerciciosDocumento28 páginasQuimica Cinetica Quimica ExerciciosIque Castro MarianoAinda não há avaliações
- Exercício de CinéticaDocumento7 páginasExercício de CinéticaIsaque MouraAinda não há avaliações
- Exercícios de Cinética Química (Lista 1)Documento7 páginasExercícios de Cinética Química (Lista 1)gabriel.kenzo18Ainda não há avaliações
- Cinetica Quimica If ExercDocumento5 páginasCinetica Quimica If ExercRaquel Andreola ValenteAinda não há avaliações
- 48 20cin C3 A9tica 20qu C3 ADmicaDocumento14 páginas48 20cin C3 A9tica 20qu C3 ADmicaFrancis Francisco Johane SemanaAinda não há avaliações
- Alunos Exercícios CinéticaDocumento3 páginasAlunos Exercícios CinéticaRiaAinda não há avaliações
- TERMOQUIMICADocumento9 páginasTERMOQUIMICAWelff Junior100% (4)
- Rapidez Das Reações 28 QuestõesDocumento13 páginasRapidez Das Reações 28 QuestõesBraga 333Ainda não há avaliações
- Lista CinéticaDocumento18 páginasLista Cinéticamoitinhamhsp2Ainda não há avaliações
- 156Documento4 páginas156Danielle GianniniAinda não há avaliações
- CinéticaDocumento6 páginasCinéticaCarlos LiraAinda não há avaliações
- 6 Lista de Exercícios - 2019 1Documento3 páginas6 Lista de Exercícios - 2019 1Pedro FelipeAinda não há avaliações
- Cinetica Quimica UniDocumento6 páginasCinetica Quimica UnicarlostucupiAinda não há avaliações
- Exercícios de Cinética Química Prof. Flokinho: 2 3 2 (G) 3 (G) 3 (G) 2 (G)Documento2 páginasExercícios de Cinética Química Prof. Flokinho: 2 3 2 (G) 3 (G) 3 (G) 2 (G)Sara LunaAinda não há avaliações
- Apostila Química Orgânica: Carbono, Dienos E AromáticosNo EverandApostila Química Orgânica: Carbono, Dienos E AromáticosAinda não há avaliações
- Varetas Combustíveis Nucleares: Desgaste Mecânico Mitigação através do Recobrimento Superficial de Ligas de ZircônioNo EverandVaretas Combustíveis Nucleares: Desgaste Mecânico Mitigação através do Recobrimento Superficial de Ligas de ZircônioAinda não há avaliações
- Análise das tensões em estruturas de concreto devido a variações de temperatura entre os anos de 2009 e 2018No EverandAnálise das tensões em estruturas de concreto devido a variações de temperatura entre os anos de 2009 e 2018Ainda não há avaliações
- Acionamento De Jato-ventilador De Acordo Com A Medição De Co2 Programado No PicNo EverandAcionamento De Jato-ventilador De Acordo Com A Medição De Co2 Programado No PicAinda não há avaliações
- Apostila Química Orgânica: Terpenos E Rotas De SínteseNo EverandApostila Química Orgânica: Terpenos E Rotas De SínteseAinda não há avaliações
- Telemetria Com Envio De E-mail Para Medir Co2 Com Base No Esp8266 Programado Em ArduinoNo EverandTelemetria Com Envio De E-mail Para Medir Co2 Com Base No Esp8266 Programado Em ArduinoAinda não há avaliações
- Como Projetar uma Estação de Medição de Gás Natural Veicular: um guia práticoNo EverandComo Projetar uma Estação de Medição de Gás Natural Veicular: um guia práticoAinda não há avaliações
- Odm Gestao Municipal30526Documento88 páginasOdm Gestao Municipal30526James OliverAinda não há avaliações
- Escadas Rolantes (ELIAS) 2.1. Introdução 2.2. Tipos de Escadas RolantesDocumento2 páginasEscadas Rolantes (ELIAS) 2.1. Introdução 2.2. Tipos de Escadas RolantesJames OliverAinda não há avaliações
- Aula8 ManualDimensionamentoDER SPDocumento53 páginasAula8 ManualDimensionamentoDER SPMarcelo Alberto RosaAinda não há avaliações
- NúmerosDocumento12 páginasNúmerosNOIVODALAGOAAinda não há avaliações
- ForroDocumento6 páginasForroJames OliverAinda não há avaliações
- GestaltDocumento10 páginasGestaltJames OliverAinda não há avaliações
- Marketing Und 01 e 02Documento104 páginasMarketing Und 01 e 02James OliverAinda não há avaliações
- LAJESDocumento30 páginasLAJESJames OliverAinda não há avaliações
- A Teoria Da Empresa No Novo Código Civil E A Interpretação Do Art. 966: Os Grandes Escritórios de Advocacia Deverão Ter Registro Na Junta Comercial?Documento7 páginasA Teoria Da Empresa No Novo Código Civil E A Interpretação Do Art. 966: Os Grandes Escritórios de Advocacia Deverão Ter Registro Na Junta Comercial?James OliverAinda não há avaliações
- Modelo Inclusao Simples NacionalDocumento1 páginaModelo Inclusao Simples NacionalJulio Cesar SouzaAinda não há avaliações
- 1 - EnquadramentoDocumento1 página1 - EnquadramentoJames OliverAinda não há avaliações
- Czerny TabelasDocumento10 páginasCzerny TabelashpartegmailAinda não há avaliações
- Aula 4 - Estresse e Manejo Pré-Abate Na Qualidade Da Carne ZAZ0073Documento19 páginasAula 4 - Estresse e Manejo Pré-Abate Na Qualidade Da Carne ZAZ0073James OliverAinda não há avaliações
- Web Reforço Físico Química Dos AlimentosDocumento9 páginasWeb Reforço Físico Química Dos AlimentosJames OliverAinda não há avaliações
- Clulasdeschwann 130925144220 Phpapp02Documento40 páginasClulasdeschwann 130925144220 Phpapp02James OliverAinda não há avaliações
- Necros eDocumento25 páginasNecros eJames Oliver100% (1)
- PênfigoDocumento4 páginasPênfigoJames OliverAinda não há avaliações
- Atividade 3Documento1 páginaAtividade 3James OliverAinda não há avaliações
- Tabela Consumo Equipamentos Procel EletrobrasDocumento2 páginasTabela Consumo Equipamentos Procel Eletrobrasskilin100% (4)
- Constantino I e Santa Helena Slide OficialDocumento25 páginasConstantino I e Santa Helena Slide OficialJames OliverAinda não há avaliações
- A Implantação de Recursos HumanosDocumento2 páginasA Implantação de Recursos HumanosJames OliverAinda não há avaliações
- Atlas de PatologiaDocumento32 páginasAtlas de PatologiaNonato Oliveira Carvalho Junior100% (1)
- 3AulaÁguaTermologiaBiofísicaUFMA2013AdrianaCamara PDFDocumento15 páginas3AulaÁguaTermologiaBiofísicaUFMA2013AdrianaCamara PDFJames OliverAinda não há avaliações
- Dicas HP 50gDocumento12 páginasDicas HP 50gJames OliverAinda não há avaliações
- Apostila Cinetica QuimicaDocumento5 páginasApostila Cinetica QuimicaJames OliverAinda não há avaliações
- Atividade 2 EmpreendedorismoDocumento1 páginaAtividade 2 EmpreendedorismoJames OliverAinda não há avaliações
- UFB - HiperestáticaDocumento98 páginasUFB - HiperestáticaAlex Roda MacielAinda não há avaliações
- Apostila Botanica IDocumento3 páginasApostila Botanica IJames OliverAinda não há avaliações
- UNIVERSIDADE FEDERAL DO MARANHÃO MaxilarDocumento4 páginasUNIVERSIDADE FEDERAL DO MARANHÃO MaxilarJames OliverAinda não há avaliações
- ABRASÃODocumento46 páginasABRASÃOleko200783% (6)
- Avaliação - Origem Da VidaDocumento6 páginasAvaliação - Origem Da VidaNilma BastosAinda não há avaliações
- Aula 1Documento60 páginasAula 1Anthony RodriguesAinda não há avaliações
- Arquivo Aberto 28 - Pegmatitos Quartzo-Feldspático de Castro AlvesDocumento72 páginasArquivo Aberto 28 - Pegmatitos Quartzo-Feldspático de Castro AlvesLuana AmaralAinda não há avaliações
- Lei de Fick PDFDocumento23 páginasLei de Fick PDFTiagoAinda não há avaliações
- Questões Ciências Provão 9° Ano 2° BimestreDocumento5 páginasQuestões Ciências Provão 9° Ano 2° BimestreCarlos GeorgeAinda não há avaliações
- Aula 41 - FresagemDocumento10 páginasAula 41 - FresagemDouglas Gomes88% (8)
- Ação Do Ácido Salicílico Na Acne VulgarDocumento174 páginasAção Do Ácido Salicílico Na Acne VulgarAna Paula Pereira CunhaAinda não há avaliações
- HidrodinâmicaDocumento3 páginasHidrodinâmicaLaís RezendeAinda não há avaliações
- ManualSamurai97 PDFDocumento114 páginasManualSamurai97 PDFRodrigo DiazAinda não há avaliações
- 17 - 18 - Concentracao e DiluicaoDocumento7 páginas17 - 18 - Concentracao e DiluicaoJackson FranciscoAinda não há avaliações
- Prospecto Tecnico Jet Vap 2016-08-03Documento2 páginasProspecto Tecnico Jet Vap 2016-08-03VibenatAinda não há avaliações
- Biooo)Documento6 páginasBiooo)Alícia Dal PozzoAinda não há avaliações
- Ae bg11 Rochas MagmaticasDocumento5 páginasAe bg11 Rochas MagmaticasTomas NicolauAinda não há avaliações
- Trabalho de Progressão Parcial de QuímicaDocumento4 páginasTrabalho de Progressão Parcial de QuímicaLuc-iano VaderAinda não há avaliações
- Apostila BioquimicaDocumento16 páginasApostila BioquimicaJandira CostaAinda não há avaliações
- Simulação Da Interação Entre Subsistemas TerrestresDocumento3 páginasSimulação Da Interação Entre Subsistemas Terrestreszeluisalves100% (1)
- (Apostila) Tecnologia de Solda - SENAIDocumento89 páginas(Apostila) Tecnologia de Solda - SENAIEduardo Bandeira100% (3)
- Massa Molar e Número de MolDocumento5 páginasMassa Molar e Número de MolhombedjoAinda não há avaliações
- Ciências para o 9 Ano Jogos DidáticosDocumento8 páginasCiências para o 9 Ano Jogos DidáticosStela Yara SilvaAinda não há avaliações
- O Nascimento de Células ComplexasDocumento33 páginasO Nascimento de Células ComplexasdiascrisAinda não há avaliações
- 4 MineraisDocumento27 páginas4 MineraisJoao AzevedoAinda não há avaliações
- FISPQ - DCA-4 Liquid - REV01Documento16 páginasFISPQ - DCA-4 Liquid - REV01CleniltonAndreGomes100% (1)
- Corrente de ConvecçãoDocumento7 páginasCorrente de ConvecçãoAmorimdbAinda não há avaliações
- Relatorio Pratico Bioquimica II - LucasDocumento10 páginasRelatorio Pratico Bioquimica II - LucasMauricio Paro100% (2)
- DLS e Potencial Zeta PDFDocumento39 páginasDLS e Potencial Zeta PDFandrezpesAinda não há avaliações
- Apostila - Molde Permanente Por GravidadeDocumento79 páginasApostila - Molde Permanente Por GravidadeAna Carolina MunizAinda não há avaliações
- Isolamento Termico Tradicional Camara Fria - Tutorial TecnicoDocumento5 páginasIsolamento Termico Tradicional Camara Fria - Tutorial TecnicomelieneideaAinda não há avaliações
- New Holland Fiat 50 86 55 86 60 86 70 86 Tractors Operators Manual 06910285Documento22 páginasNew Holland Fiat 50 86 55 86 60 86 70 86 Tractors Operators Manual 06910285rucac124100% (32)
- Exercicios Corrosao 09.2Documento3 páginasExercicios Corrosao 09.2carlinhatai100% (2)