0% acharam este documento útil (0 voto)
40 visualizações9 páginasMorfologia e Vigor do Sêmen de Pacu
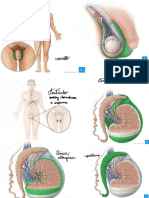
O estudo avaliou as alterações morfológicas dos espermatozoides de Piaractus mesopotamicus após criopreservação, revelando uma redução significativa no percentual de espermatozoides normais e um aumento nas patologias primárias. A motilidade progressiva e o vigor espermático também diminuíram após a descongelação. Além disso, novas patologias foram observadas no sêmen pós congelação, enquanto algumas anormalidades foram exclusivas do sêmen in natura.
Enviado por
Mara Cristina de AlmeidaDireitos autorais
© © All Rights Reserved
Levamos muito a sério os direitos de conteúdo. Se você suspeita que este conteúdo é seu, reivindique-o aqui.
Formatos disponíveis
Baixe no formato PDF, TXT ou leia on-line no Scribd
0% acharam este documento útil (0 voto)
40 visualizações9 páginasMorfologia e Vigor do Sêmen de Pacu
O estudo avaliou as alterações morfológicas dos espermatozoides de Piaractus mesopotamicus após criopreservação, revelando uma redução significativa no percentual de espermatozoides normais e um aumento nas patologias primárias. A motilidade progressiva e o vigor espermático também diminuíram após a descongelação. Além disso, novas patologias foram observadas no sêmen pós congelação, enquanto algumas anormalidades foram exclusivas do sêmen in natura.
Enviado por
Mara Cristina de AlmeidaDireitos autorais
© © All Rights Reserved
Levamos muito a sério os direitos de conteúdo. Se você suspeita que este conteúdo é seu, reivindique-o aqui.
Formatos disponíveis
Baixe no formato PDF, TXT ou leia on-line no Scribd