Escolar Documentos
Profissional Documentos
Cultura Documentos
Constante Universal Dos Gases Perfeitos
Enviado por
gatoofelixDescrição original:
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Constante Universal Dos Gases Perfeitos
Enviado por
gatoofelixDireitos autorais:
Formatos disponíveis
Constante universal dos gases perfeitos
A constante universal dos gases perfeitos uma constante fsica que relaciona a quantidade de um gs (medida em nmero de molculas) com a presso e a temperatura. Um gs perfeito um gs imaginrio que respeita esta constante a qual assume que o volume da molcula zero. A maioria dos gases aproximam-se deste comportamento desde que em condies de presso e temperatura suficientemente afastados do ponto de liquefao ou sublimao.
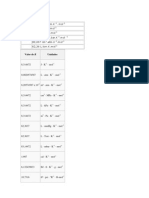
(A constante R igual ao produto da constante de Avogadro pela constante de Boltzmann: R = NAKB )
Valor de R 8,314472 0,082057459
Unidades J K-1 mol-1 L atm K-1 mol-1
8,20574587 x m atm K-1 mol-1 10-5 8,314472 cm3 MPa K-1 mol-1 8,314472 L kPa K-1 mol-1 8,314472 62,3637 62,3637 m3 Pa K-1 mol-1 L mmHg K-1 mol-1 L Torr K-1 mol-1
83,14472 L mbar K-1 mol-1 1,987 cal K-1 mol-1
1
6,132439833 lbf ft K-1 g mol10,7316 8,63 x 10-5 ft psi R-1 lbmol-1 eV K-1 atom-1
1
0,7302 ft3atmR-1lb-mole1,987 Btu lb-mol-1 R-1
Valor verdadeiro convencional para a constante R Atualmente o CODATA[1] recomenda para o valor da constante R de um gs ideal, o seguinte valor: (notao concisa) ou
Este o melhor valor estimado para a constante molar dos gases, conhecido tambm como valor verdadeiro convencional (de uma grandeza)[2] A constante R utilizada na frmula dos gases ideais:
onde P a presso do gs T a temperatura (absoluta) do gs V o volume ocupado pelo gs n a quantidade de gs (usualmente expresso em nmero de moles) Vm o volume molar do gs A forma
tambm bastante conhecida.
Você também pode gostar
- Capítulo 5 - Gases e VaporesDocumento12 páginasCapítulo 5 - Gases e VaporesaldedarkAinda não há avaliações
- Exercicio Transferência de MassaDocumento3 páginasExercicio Transferência de MassaPaulo HenriqueAinda não há avaliações
- Cinéma, Les Succès 2018 en FranceDocumento27 páginasCinéma, Les Succès 2018 en FranceThierry Rodrigues100% (1)
- Lista de Exercícios 01 UFFSDocumento3 páginasLista de Exercícios 01 UFFSRafael Godô50% (2)
- LISTA 3 CalculosDocumento3 páginasLISTA 3 CalculosMax Nunes0% (1)
- Lista de TermodinâmicaDocumento3 páginasLista de Termodinâmicamoises20ca0% (1)
- Atividade Extra Sobre Vol de PrecipitaçãoDocumento4 páginasAtividade Extra Sobre Vol de PrecipitaçãoEdilliane Nogueira100% (1)
- 1 Lista de ExerciciosDocumento3 páginas1 Lista de ExerciciosTaiana SlongoAinda não há avaliações
- Relatório Campo Magnético Da TerraDocumento7 páginasRelatório Campo Magnético Da TerraLucas Carvalho50% (2)
- Lista de Exercícios 1 - GasesDocumento3 páginasLista de Exercícios 1 - GasesArilson Campos100% (2)
- Relatório 2 - Gases IdeiasDocumento8 páginasRelatório 2 - Gases IdeiasNíkolas SouzaAinda não há avaliações
- Determinação Da Ordem de Uma ReaçãoDocumento12 páginasDeterminação Da Ordem de Uma ReaçãoBruno ThomaziniAinda não há avaliações
- Pre Relatorio 1 - Determinação Da Densidade de Liquidos Por Picnometria e DensimetriaDocumento2 páginasPre Relatorio 1 - Determinação Da Densidade de Liquidos Por Picnometria e DensimetriaWanderson BrunoAinda não há avaliações
- Relatório 6 - Equilíbrio QuímicoDocumento17 páginasRelatório 6 - Equilíbrio QuímicoJanaina100% (5)
- Exercicios Propostos Sala de Aula Resolucao FRSensatoDocumento6 páginasExercicios Propostos Sala de Aula Resolucao FRSensatomalikvieAinda não há avaliações
- Caderno de Exercicios - Eletromagnetismo - Moyses - Vol3 - 4edDocumento41 páginasCaderno de Exercicios - Eletromagnetismo - Moyses - Vol3 - 4edMarcelMoralesAinda não há avaliações
- Gases IdeaisDocumento12 páginasGases IdeaisFernandoAinda não há avaliações
- Determinação Da Constante de Velocidade e Tempo de Meia Vida Da Reação de Decomposição Do Peróxido de HidrogênioDocumento18 páginasDeterminação Da Constante de Velocidade e Tempo de Meia Vida Da Reação de Decomposição Do Peróxido de HidrogênioLeonardo FreitasAinda não há avaliações
- Lista de Exercícios Gases GabaritoDocumento11 páginasLista de Exercícios Gases GabaritoGabriel Maia0% (1)
- Prática 5Documento2 páginasPrática 5lucas roniery100% (1)
- ExercicioDocumento2 páginasExercicioKarollyne Santana PaixãoAinda não há avaliações
- Teoria de Debye-HuckelDocumento11 páginasTeoria de Debye-HuckelDiego HenriqueAinda não há avaliações
- Relatorio 3 - Fotometria de ChamaDocumento13 páginasRelatorio 3 - Fotometria de ChamaSergio Britanico100% (1)
- Troca de Calor - RelatorioDocumento6 páginasTroca de Calor - RelatorioRebeca Araújo Ribeiro100% (1)
- Determinação de Ordem de Reação Entre Violeta Cristal e Hidróxido de SódioDocumento6 páginasDeterminação de Ordem de Reação Entre Violeta Cristal e Hidróxido de SódioAna Flávia Caldeira MachadoAinda não há avaliações
- Lista de Exercicios Termodinâmica IIDocumento28 páginasLista de Exercicios Termodinâmica IIDavid Santos de França33% (3)
- Relatório 04-Calibração de Um TermoparDocumento9 páginasRelatório 04-Calibração de Um TermoparJoão Victor Azevedo Gonçalves100% (1)
- Atkins Exercicios BDocumento3 páginasAtkins Exercicios BVictor Saide75% (8)
- Lista8 ResolucaoDocumento6 páginasLista8 ResolucaoxotunredmailtopAinda não há avaliações
- Campo A Partir Do Potencial - Relatório Física ExperimentalDocumento8 páginasCampo A Partir Do Potencial - Relatório Física ExperimentalVictor SoteroAinda não há avaliações
- Destilação Multicomponente - AZEVEDO E ALVES 2009Documento7 páginasDestilação Multicomponente - AZEVEDO E ALVES 2009ChaosHo100% (1)
- Determinação Da Viscosidade Pelo Viscosímetro de OstwaldDocumento8 páginasDeterminação Da Viscosidade Pelo Viscosímetro de OstwaldLeonardo Andrade100% (3)
- Relatório 2 - Densidade de Sólidos e LíquidosDocumento20 páginasRelatório 2 - Densidade de Sólidos e LíquidosRodrigo Santos Aguiar100% (2)
- Lista de Exercicios Termodinamica IIDocumento28 páginasLista de Exercicios Termodinamica IIGuilherme Fernando0% (1)
- Aula 20 - Propriedade em Excesso e Coeficiente de AtividadeDocumento39 páginasAula 20 - Propriedade em Excesso e Coeficiente de AtividadeLuiz Carlos Alves JuniorAinda não há avaliações
- Relatório - Determinação Experimental Da Viscosidade de LíquidosDocumento11 páginasRelatório - Determinação Experimental Da Viscosidade de LíquidosRaimunda Branco100% (9)
- Relatório - Propriedades PeriódicasDocumento16 páginasRelatório - Propriedades PeriódicasCarolineSoares100% (4)
- Exercício 02 - CorrigidoDocumento5 páginasExercício 02 - CorrigidoRobson SilvaAinda não há avaliações
- Relatório Técnico - Pilhas Galvânicas e Pilhas de ConcentraçãoDocumento23 páginasRelatório Técnico - Pilhas Galvânicas e Pilhas de Concentraçãocadu121100% (1)
- Estequiometria Industrial I - Aula 4 - Balanço de Massa Com Reação QuímicaDocumento31 páginasEstequiometria Industrial I - Aula 4 - Balanço de Massa Com Reação QuímicaErika VieiraAinda não há avaliações
- Balanço de Massa - RespostasDocumento6 páginasBalanço de Massa - RespostasHeron SoaresAinda não há avaliações
- Problemas (201 300)Documento34 páginasProblemas (201 300)Pedro Sônego100% (1)
- Relatório Lei de CharlesDocumento7 páginasRelatório Lei de CharlesJerusaFreitasAinda não há avaliações
- Compostos de CoordenacaoDocumento59 páginasCompostos de CoordenacaoDouglas Leonardo100% (1)
- Relatório de Fisico-Química Experimental I - A Lei de BoyleDocumento9 páginasRelatório de Fisico-Química Experimental I - A Lei de BoyleThiago LopesAinda não há avaliações
- Aula 03Documento28 páginasAula 03MatheusRodrigues100% (1)
- Lista 02 - Diagrama de Fase Substancia PuraDocumento4 páginasLista 02 - Diagrama de Fase Substancia PuraLucas CamargoAinda não há avaliações
- Exercícios Callister - CorrosãoDocumento2 páginasExercícios Callister - CorrosãoMarcos Vinicios Lima dos Santos0% (1)
- Relatório de Fisico-Química Experimental I - Determinação Da Tensão Superficial Pelo Método Da GotaDocumento4 páginasRelatório de Fisico-Química Experimental I - Determinação Da Tensão Superficial Pelo Método Da GotaThiago Lopes100% (3)
- Relatório de Aula Prática - Sedimentação PDFDocumento13 páginasRelatório de Aula Prática - Sedimentação PDFAndré SilvaAinda não há avaliações
- EXP 7 - Energia de AtivaçãoDocumento4 páginasEXP 7 - Energia de AtivaçãoFábio OliveiraAinda não há avaliações
- Lista10 ResolucaoDocumento5 páginasLista10 ResolucaoxotunredmailtopAinda não há avaliações
- Ordem Reação e Lei de ArrheniusDocumento17 páginasOrdem Reação e Lei de ArrheniusNinki CoelhoAinda não há avaliações
- PolarimetriaDocumento5 páginasPolarimetriaingritirsAinda não há avaliações
- Relatório 05 - Evidências de Reações QuímicaDocumento7 páginasRelatório 05 - Evidências de Reações QuímicaBruno CoelhoAinda não há avaliações
- Relatório 1 - Reflexão Da LuzDocumento13 páginasRelatório 1 - Reflexão Da LuzUrbano0% (1)
- Constante Universal Dos Gases PerfeitosDocumento2 páginasConstante Universal Dos Gases PerfeitospattypgpattyAinda não há avaliações
- Cte RDocumento5 páginasCte RPâmela BarbosaAinda não há avaliações
- GasesDocumento59 páginasGasesCici PersonAinda não há avaliações
- Aula 1 - GasesDocumento30 páginasAula 1 - Gasesluiza lanzaAinda não há avaliações