Escolar Documentos
Profissional Documentos
Cultura Documentos
Teorias de ácidos e bases de Arrhenius, Brönsted-Lowry e Lewis
Enviado por
Felipe RungueTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Teorias de ácidos e bases de Arrhenius, Brönsted-Lowry e Lewis
Enviado por
Felipe RungueDireitos autorais:
Formatos disponíveis
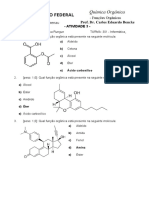
Nome: Felipe Israel Silva Rungue Turma: 301 -
Informática
- Atividade 4
-
1) [peso: 3,0]: Em 1923, o físico-químico norte-americano Gilbert Newton Lewis
desenvolveu a sua teoria ácido-base, a qual é bastante eficaz na determinação
do caráter ácido ou básico das substâncias em Química Orgânica. Além de
representar o fim do “culto ao próton” na classificação de ácidos e bases, a
Teoria de ácidos e bases de Lewis é mais abrangente, fazendo que
substâncias antes não classificadas como ácidos ou bases assim o sejam,
além disso, ela não invalida as demais classificações de ácidos e bases.
Assim, descreva as Teorias de ácidos e bases de Arrhenius, Brönsted-Lowry e
Lewis, fazendo um comparativo das definições e apresentando um exemplo de
ácido e base para cada uma das teorias:
R) Na teoria de Brönsted – Lowry de ácidos e bases era estudado a doação dos
prótons e também o recebimento de elétrons do ácido, e por fim o recebimento de
prótons da base.
HCN + H2O --> CN- + H3O+
CN + H3O+ --> HCN + H2O
Já a teoria de bases e ácidos de Arrhenius estou o comportamento deles na água,
notando-se que o ácido libera somente o hidrogênio como cátion e a base libera
hidroxila como ânion.
Ácido --> HCl (g) + H2O(l) --> H3O + (aq) + Cl – (aq)
Base --> Ca (OH)2 --> Ca2 + 2 OH-
Por fim a teoria de Lewis falava que as bases eram as doadoras e os ácidos
aqueles que reciam esse par doado.
2) [peso: 3,0]: À partir da definição de ácidos e bases de Brönsted-Lowry,
classifique as seguintes moléculas em ácidos ou bases:
a) HCl →Ácido
d) NH3 →Base
b) CH3CH2O2- →Base
c) NaOH →Base e) NH4+ →Ácido
f) CH3COOH →Ácido
3) [peso: 4,0]: À partir da definição de ácidos e bases de Lewis, classifique as
seguintes moléculas em ácidos ou bases:
a) HCl →Ácido e) NH4+ →Ácido
b) CH3CH2O2- →Base f) CH3COOH→Ácid
o
c) CN- →Base g) AlCl3 →Ácido
d) NH3 →Base h) Cu+ →Ácido
Prof. Dr. Carlos Eduardo
Bencke
Você também pode gostar
- Aula 4 - Teoria de Ácidos e BasesDocumento30 páginasAula 4 - Teoria de Ácidos e Basesmevtorres1977Ainda não há avaliações
- Ácidos e Bases: Teorias Ácido-BaseDocumento4 páginasÁcidos e Bases: Teorias Ácido-BaseElaine CristinaAinda não há avaliações
- Trabalho de QuimicaDocumento14 páginasTrabalho de QuimicaManuel RafaelAinda não há avaliações
- Série Didática para o Apoio a Formação de Professores de Química: Volume 2: MoléculasNo EverandSérie Didática para o Apoio a Formação de Professores de Química: Volume 2: MoléculasNota: 5 de 5 estrelas5/5 (1)
- Acidos e Bases ModernosDocumento3 páginasAcidos e Bases ModernosRubenigue SouzaAinda não há avaliações
- Ácidos e Bases de Brönsted e Lowry: Uma visão aplicada ao meio ambienteNo EverandÁcidos e Bases de Brönsted e Lowry: Uma visão aplicada ao meio ambienteAinda não há avaliações
- Documento A4 Branco e Lilás - 20231203 - 174117 - 0000Documento7 páginasDocumento A4 Branco e Lilás - 20231203 - 174117 - 0000Gustavo SantosAinda não há avaliações
- Série Didática para o Apoio à Formação de Professores de Química – Volume 1 – ÁtomosNo EverandSérie Didática para o Apoio à Formação de Professores de Química – Volume 1 – ÁtomosAinda não há avaliações
- Acidez e Basicidade em Compostos OrgânicosDocumento9 páginasAcidez e Basicidade em Compostos OrgânicosArtur_Ainda não há avaliações
- Equilíbrio iônico: aplicações em química analíticaNo EverandEquilíbrio iônico: aplicações em química analíticaAinda não há avaliações
- Teoria ácido-base de Brønsted-LowryDocumento18 páginasTeoria ácido-base de Brønsted-LowryIsis MoreiraAinda não há avaliações
- Separação ácido-baseDocumento6 páginasSeparação ácido-baseCBA CREDAinda não há avaliações
- Aula3 - Acidos e Bases Duros e MaciosDocumento20 páginasAula3 - Acidos e Bases Duros e MaciosTatianyAinda não há avaliações
- Exercícios Arrhenius Lewis Bronsted LowryDocumento6 páginasExercícios Arrhenius Lewis Bronsted LowryAnderson Oliveira100% (1)
- Resumo Sobre Ácidos e BasesDocumento7 páginasResumo Sobre Ácidos e BasesRobson Timoteo Damasceno100% (2)
- Moysés Sander - 33O - Exp. n.2 - Soluções SalinasDocumento17 páginasMoysés Sander - 33O - Exp. n.2 - Soluções SalinasMoysesAinda não há avaliações
- Ácidos e Bases- conceitos, pares conjugados, nomenclatura - Toda MatériaDocumento5 páginasÁcidos e Bases- conceitos, pares conjugados, nomenclatura - Toda Matérialucio flavio santosAinda não há avaliações
- Teoria ÁcidoDocumento4 páginasTeoria ÁcidoRozi FreitasAinda não há avaliações
- A - Teorias Ácido-BaseDocumento7 páginasA - Teorias Ácido-BaselfsytpAinda não há avaliações
- Ácidos e bases: Teorias de Arrhenius e Brønsted-LowryDocumento8 páginasÁcidos e bases: Teorias de Arrhenius e Brønsted-LowrybeaAinda não há avaliações
- 11ano Q 2 1 1 Acidos e BasesDocumento8 páginas11ano Q 2 1 1 Acidos e BasesInês JuliãoAinda não há avaliações
- Ácidos, bases e suas propriedades: uma introduçãoDocumento14 páginasÁcidos, bases e suas propriedades: uma introduçãoGustavo Txai TorresAinda não há avaliações
- Definições históricas de ácidos e basesDocumento6 páginasDefinições históricas de ácidos e basesMarcos Venícius De OliveiraAinda não há avaliações
- Acidos e Bases Quimica OrganicaDocumento3 páginasAcidos e Bases Quimica OrganicaGuilherme Patrocinio de FreitasAinda não há avaliações
- Teorias AcidoBase Arrhenius Brönsted Lowry e LewisDocumento3 páginasTeorias AcidoBase Arrhenius Brönsted Lowry e Lewisjose eduardo florentinoAinda não há avaliações
- Essinate Fania Raul Saisse-Q.geraLDocumento17 páginasEssinate Fania Raul Saisse-Q.geraL708237092Ainda não há avaliações
- Aula26PlantaodeQuimicaProf Manueljunior26 10 17gabarito pdf27102017024940Documento2 páginasAula26PlantaodeQuimicaProf Manueljunior26 10 17gabarito pdf27102017024940Artur Pereira Neto artur.netoAinda não há avaliações
- Ácidos e bases: introdução às definiçõesDocumento33 páginasÁcidos e bases: introdução às definiçõesAllan Batista100% (1)
- AULA 16 - Ácidos e BasesDocumento56 páginasAULA 16 - Ácidos e BasesGlaucio TestaAinda não há avaliações
- Relatório Da Prática 9 Identiicação de Alguns Ácidos e BasesDocumento7 páginasRelatório Da Prática 9 Identiicação de Alguns Ácidos e BasesHana KogaAinda não há avaliações
- Atividade funções inorgânicasDocumento2 páginasAtividade funções inorgânicasMARIA FERNANDA SCHMIDTAinda não há avaliações
- Teorias Ácido-Base, Escrito GERAL IIDocumento5 páginasTeorias Ácido-Base, Escrito GERAL IIAna HeloisaAinda não há avaliações
- Acidos Bases 1Documento37 páginasAcidos Bases 1David VieiraAinda não há avaliações
- Equilíbrio Ácido-Base: Teorias e Forças emDocumento21 páginasEquilíbrio Ácido-Base: Teorias e Forças emLorena Melo100% (1)
- Ácido BaseDocumento3 páginasÁcido BaseLuciara MafraAinda não há avaliações
- Teoria ácido-base de Arrhenius, Brønsted-Lowry e LewisDocumento15 páginasTeoria ácido-base de Arrhenius, Brønsted-Lowry e LewisSimovelAinda não há avaliações
- Teoria Lewis ácidos basesDocumento33 páginasTeoria Lewis ácidos basesMário António NhanombeAinda não há avaliações
- O que são ácidos e basesDocumento101 páginasO que são ácidos e basesTony Villa NovaAinda não há avaliações
- Reações Ácido-Base: Eliana Midori Sussuchi Samísia Maria Fernandes Machado Valéria Regina de Souza MoraesDocumento15 páginasReações Ácido-Base: Eliana Midori Sussuchi Samísia Maria Fernandes Machado Valéria Regina de Souza MoraesMichel Vilarinho CarvalhoAinda não há avaliações
- Slides Aula 05Documento11 páginasSlides Aula 05otavio augusto hegler silvaAinda não há avaliações
- Teorias modernas de ácido e baseDocumento4 páginasTeorias modernas de ácido e baseAline OliveiraAinda não há avaliações
- Teorias ácido-base do século XXDocumento39 páginasTeorias ácido-base do século XXSebastiao RochaAinda não há avaliações
- Aula 3 - Ácidos e BasesDocumento54 páginasAula 3 - Ácidos e BasesGeovane de OliveiraAinda não há avaliações
- Teorias de Ácidos e Bases: Arrhenius, Brønsted-Lowry e LewisDocumento19 páginasTeorias de Ácidos e Bases: Arrhenius, Brønsted-Lowry e Lewisleon155Ainda não há avaliações
- Equilibrio Acido Base - Parte 1 - 15maio2020Documento13 páginasEquilibrio Acido Base - Parte 1 - 15maio2020Beatriz DuarteAinda não há avaliações
- 10 - Acidez Dos Compostos OrgânicosDocumento5 páginas10 - Acidez Dos Compostos OrgânicosDam LaignierAinda não há avaliações
- Conceitos de ácidos e bases de Brønsted-LowryDocumento59 páginasConceitos de ácidos e bases de Brønsted-LowryWardwarf VieiraAinda não há avaliações
- ACIDOBASEQGERALDocumento25 páginasACIDOBASEQGERALJOAOJOAQUIM2012Ainda não há avaliações
- FQAnalitica Aula4Documento10 páginasFQAnalitica Aula4Erick LucasAinda não há avaliações
- Funções InorgânicasDocumento45 páginasFunções InorgânicasSandro A. JúniorAinda não há avaliações
- FUNÇÕES INORGÂNICAS IIDocumento5 páginasFUNÇÕES INORGÂNICAS IIHenrique Anderson da SilvaAinda não há avaliações
- Qui MicaDocumento93 páginasQui MicaGabriela DallAgnolAinda não há avaliações
- Funções inorgânicas: ácidos, bases, sais e óxidosDocumento12 páginasFunções inorgânicas: ácidos, bases, sais e óxidosDiego NascimentoAinda não há avaliações
- Acidosebases 111101133643 Phpapp02Documento160 páginasAcidosebases 111101133643 Phpapp02Otacio CandidoAinda não há avaliações
- Química - Analitica - .11 Classe.Documento6 páginasQuímica - Analitica - .11 Classe.basharbahackjocksonAinda não há avaliações
- Funções Químicas: Ácidos, Bases e SalDocumento15 páginasFunções Químicas: Ácidos, Bases e SalFernando Silva SantosAinda não há avaliações
- 6 Material de Apoio Fundamentos Do ProcessoDocumento10 páginas6 Material de Apoio Fundamentos Do ProcessoFelipe RungueAinda não há avaliações
- Atividade 3 - Funes OrgnicasDocumento4 páginasAtividade 3 - Funes OrgnicasFelipe RungueAinda não há avaliações
- Avaliação Geografia V1 T1 2021Documento4 páginasAvaliação Geografia V1 T1 2021Felipe RungueAinda não há avaliações
- Atividade Sobre Crase - PTDocumento3 páginasAtividade Sobre Crase - PTFelipe RungueAinda não há avaliações
- Atividade 1 - Introduo Qumica OrgnicaDocumento1 páginaAtividade 1 - Introduo Qumica OrgnicaFelipe RungueAinda não há avaliações
- O guia definitivo do alemão - 40 dicas essenciais para aprender sozinhoDocumento98 páginasO guia definitivo do alemão - 40 dicas essenciais para aprender sozinhoLuiz Paulo Diniz50% (4)
- As 12 camadas da personalidade humanaDocumento19 páginasAs 12 camadas da personalidade humanaGustavo Matheus Rahal91% (11)