Escolar Documentos
Profissional Documentos
Cultura Documentos
Quimica 2
Enviado por
vintage closet0 notas0% acharam este documento útil (0 voto)
7 visualizações1 páginaO documento descreve as propriedades dos compostos iônicos e das substâncias covalentes. Para os compostos iônicos, destaca que são sólidos, duros e quebradiços, com pontos de fusão e ebulição elevados, e que conduzem corrente elétrica quando dissolvidos. Para as substâncias covalentes, ressalta que seus pontos de fusão e ebulição são menores, não conduzem corrente e possuem solubilidade dependente da polaridade.
Descrição original:
Propriedades de compostos iônicos e substâncias covalentes.
Título original
quimica2
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
DOCX, PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoO documento descreve as propriedades dos compostos iônicos e das substâncias covalentes. Para os compostos iônicos, destaca que são sólidos, duros e quebradiços, com pontos de fusão e ebulição elevados, e que conduzem corrente elétrica quando dissolvidos. Para as substâncias covalentes, ressalta que seus pontos de fusão e ebulição são menores, não conduzem corrente e possuem solubilidade dependente da polaridade.
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato DOCX, PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
7 visualizações1 páginaQuimica 2
Enviado por
vintage closetO documento descreve as propriedades dos compostos iônicos e das substâncias covalentes. Para os compostos iônicos, destaca que são sólidos, duros e quebradiços, com pontos de fusão e ebulição elevados, e que conduzem corrente elétrica quando dissolvidos. Para as substâncias covalentes, ressalta que seus pontos de fusão e ebulição são menores, não conduzem corrente e possuem solubilidade dependente da polaridade.
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato DOCX, PDF, TXT ou leia online no Scribd
Você está na página 1de 1
Aline Almeida
Mat.: 2023120060035 Data: 29/03/2023
Curso: Lic. Biologia/1º período Prof.: George Wallace
Química Geral
Propriedades dos compostos iônicos
Os compostos iônicos são aqueles que apresentam pelo menos uma ligação iônica entre
seus componentes. Por exemplo: o cloreto de sódio (NaCl - sal de cozinha), o nitrato de sódio
(NaNO3), o sulfato de sódio (Na2SO4), carbonato de cálcio (CaCO3), etc.
As propriedades que fazem esses compostos serem diferenciais são:
São sólidos em condições normais de temperatura (25°C) e pressão (1 atm);
São duros e quebradiços;
Possuem pontos de fusão e de ebulição elevados. Visto que a atração elétrica entre os
íons é muito forte, é necessário fornecer uma grande quantidade de energia para
quebrá-la. Um exemplo é o cloreto de sódio, que apresenta ponto de fusão igual a
801°C, e ponto de ebulição de 1413°C;
Em solução aquosa (dissolvida em água) ou em líquidos, eles conduzem corrente
elétrica, pois seus íons com cargas positivas e negativas ficam com liberdade de
movimento e fecham o circuito elétrico, permitindo que a corrente continue fluindo;
Seu melhor solvente é a água, pois, assim como ela, estes compostos são polares. No
entanto, apesar de serem polares nem todos os compostos iônicos se dissolvem na
água. Alguns exemplos de compostos que não solubilizam em água são: carbonato de
cálcio (CaCO3), de estrôncio (SrCO3) e de bário (BaCO3), além do cloreto de prata
(AgCl), que é praticamente insolúvel em água.
Propriedades das substâncias covalentes
As substâncias covalentes são sólidos cristalinos formados somente por ligações covalentes
e que formam macromoléculas.
Suas propriedades que as permitem ser distinguidas entre as demais substâncias são:
Estado Físico em temperatura ambiente;
Os pontos de fusão e ebulição dessas substâncias são menores que os das substâncias
iônicas;
Em suas formas puras, tanto líquidos como sólidos não conduzem corrente elétrica;
Solubilidade: Polares se dissolvem em polares e apolares se dissolvem em apolares;
Tenacidade: A resistência das substâncias covalentes ao impacto ou choque mecânico
é baixa. Em geral, são sólidos quebradiços, como mostra o caso do vidro, que é
formado por silicatos de sódio e de cálcio;
Dureza: Em geral, possuem elevada dureza. Com exceção da grafita, porque seus
átomos de carbono encontram-se ligados a outros três átomos de carbono, formando
placas hexagonais com certa mobilidade, fazendo com que ela seja macia. Devido a
isso, ela é até mesmo usada como lubrificante.
Você também pode gostar
- Ligações Químicas Intramoleculares e IntermolecularesDocumento3 páginasLigações Químicas Intramoleculares e IntermolecularesLuana BiniAinda não há avaliações
- RELATORIOquimica 3Documento12 páginasRELATORIOquimica 3silvamoraisb15Ainda não há avaliações
- Influência Das Ligações Químicas Sobre As Propriedades Dos MateriaisDocumento4 páginasInfluência Das Ligações Químicas Sobre As Propriedades Dos MateriaisgilsoneduAinda não há avaliações
- Relatório - Forças IntermolecularesDocumento6 páginasRelatório - Forças IntermolecularesAntônia Vitória CavalcanteAinda não há avaliações
- Influência Das Ligações Químicas Sobre As Propriedades Dos MateriaisDocumento2 páginasInfluência Das Ligações Químicas Sobre As Propriedades Dos MateriaisSergio R. TolentinoAinda não há avaliações
- Apostila Ligações Ionicas e CovalentesDocumento3 páginasApostila Ligações Ionicas e Covalentesjufontana7Ainda não há avaliações
- CondutividadeDocumento6 páginasCondutividadeGuilherme LinsAinda não há avaliações
- Ligações Químicas - EJA - 4º PeríodoDocumento20 páginasLigações Químicas - EJA - 4º PeríodoRossiel Aslan100% (1)
- Curso Invictus Preparatório: Professor: Thalyssa SantosDocumento6 páginasCurso Invictus Preparatório: Professor: Thalyssa SantosThalyssa SantosAinda não há avaliações
- Relatorio de QuimicaDocumento6 páginasRelatorio de QuimicaStorie Everson ZoioAinda não há avaliações
- QuimicqDocumento3 páginasQuimicqmaria eduarda silva oliveiraAinda não há avaliações
- Experiência Soluções EletrolíticasDocumento2 páginasExperiência Soluções Eletrolíticasgustavoassuncao022008Ainda não há avaliações
- Química II (Versão Simplificada - Capítulos 5 Ao 8)Documento57 páginasQuímica II (Versão Simplificada - Capítulos 5 Ao 8)prazer, nanaAinda não há avaliações
- Introdução Sólidos IônicosDocumento8 páginasIntrodução Sólidos Iônicosarturpanda panzoAinda não há avaliações
- Ligações QuímicasDocumento13 páginasLigações QuímicasNicole PacíficoAinda não há avaliações
- Química - Pré-Vestibular Impacto - Forças Intermoleculares e Ligaçao MetálicaDocumento2 páginasQuímica - Pré-Vestibular Impacto - Forças Intermoleculares e Ligaçao MetálicaQuímica Qui100% (3)
- Relatorio QuimicaDocumento4 páginasRelatorio QuimicaRomuloAinda não há avaliações
- Sólidos IônicosDocumento10 páginasSólidos IônicosMarcosAinda não há avaliações
- Eletroquímica Corrosão - 3a Aula (Modo de Compatibilidade)Documento104 páginasEletroquímica Corrosão - 3a Aula (Modo de Compatibilidade)murilocost18Ainda não há avaliações
- Metais Parte 2Documento11 páginasMetais Parte 2Bts SvtAinda não há avaliações
- Química - Pré-Vestibular Impacto - Forças IntermolecularesDocumento2 páginasQuímica - Pré-Vestibular Impacto - Forças IntermolecularesQuímica Qui100% (2)
- Resumo QuímicaDocumento2 páginasResumo QuímicaThe TruthAinda não há avaliações
- Os Elementos e Suas PropriedadesDocumento86 páginasOs Elementos e Suas Propriedadesluiz13eduardoAinda não há avaliações
- Aula 1 - AnaliticaDocumento40 páginasAula 1 - AnaliticaCaic FigueiredoAinda não há avaliações
- SólidosDocumento19 páginasSólidosJéssica CostaAinda não há avaliações
- PDF 20220819 165706 0000Documento8 páginasPDF 20220819 165706 0000Daniel PereiraAinda não há avaliações
- Trabalho em GrupoDocumento14 páginasTrabalho em GrupoBantù GamerAinda não há avaliações
- Ligações Químicas - Teoria Do Octeto, Ligação Iônica, Ligação Metálica e CovalenteDocumento15 páginasLigações Químicas - Teoria Do Octeto, Ligação Iônica, Ligação Metálica e CovalentePedroAinda não há avaliações
- 1EM Ligações QuímicasDocumento17 páginas1EM Ligações QuímicastiagooyarzabalpAinda não há avaliações
- Água: Importância e SolubilidadeDocumento6 páginasÁgua: Importância e SolubilidadekieloppAinda não há avaliações
- Slides Ligações QuímicasDocumento24 páginasSlides Ligações Químicasluamaria9wjoaquinaAinda não há avaliações
- Aula 3 - Química Orgânica - 2 PDFDocumento40 páginasAula 3 - Química Orgânica - 2 PDFCaic FigueiredoAinda não há avaliações
- Aula 06 - Ligacoes QuimicasDocumento11 páginasAula 06 - Ligacoes QuimicasBianca de OliveiraAinda não há avaliações
- BM G5 P2 Trab2Documento5 páginasBM G5 P2 Trab2InêsAinda não há avaliações
- Resumos Fisico Quimica EletricidadeDocumento5 páginasResumos Fisico Quimica EletricidadeCristina SousaAinda não há avaliações
- Química Inorgânica - Ligação IonicaDocumento3 páginasQuímica Inorgânica - Ligação Ionicamaria.ribasAinda não há avaliações
- Quimica Organica Propriedades CompostosDocumento9 páginasQuimica Organica Propriedades CompostosFabricio DutraAinda não há avaliações
- Propriedades Físicas Dos Compostos OrgânicosDocumento15 páginasPropriedades Físicas Dos Compostos Orgânicosarantheo100% (1)
- RelatórioDocumento2 páginasRelatórioEryck BrenoAinda não há avaliações
- Forcas IntermolecularesDocumento40 páginasForcas IntermolecularesAna Cristina GarcezAinda não há avaliações
- Íons e Ligações QuímicasDocumento8 páginasÍons e Ligações Químicaserika.poa.rsAinda não há avaliações
- Aula Experimental - Compostos Iônicos e MolecularesDocumento4 páginasAula Experimental - Compostos Iônicos e MoleculareslaviniaAinda não há avaliações
- Ligações Químicas e Interações IntermolecularesDocumento8 páginasLigações Químicas e Interações Intermolecularesluiza lanzaAinda não há avaliações
- Relatório Polaridade - 06.05.2022Documento10 páginasRelatório Polaridade - 06.05.2022Lu QrAinda não há avaliações
- Quimica - Tipos de SólidosDocumento19 páginasQuimica - Tipos de SólidosIasmim santosAinda não há avaliações
- Aula 5 - Colóides (Sóis)Documento7 páginasAula 5 - Colóides (Sóis)Tatiane MathiasAinda não há avaliações
- Aula 3 - Como Os Átomos Formam A MatériaDocumento19 páginasAula 3 - Como Os Átomos Formam A MatériaCarlos SchirmerAinda não há avaliações
- Clube - Roteiro Ligações Químicas - 1-2Documento6 páginasClube - Roteiro Ligações Químicas - 1-2Juliana FlauzinoAinda não há avaliações
- Ligações Químicas - PráticaDocumento11 páginasLigações Químicas - PráticaRenato Dieckson OliveiraAinda não há avaliações
- Ligações Químicas AlunosDocumento2 páginasLigações Químicas AlunosjosianeAinda não há avaliações
- Aula Pratica 6Documento9 páginasAula Pratica 6Sthefany de Souza SantosAinda não há avaliações
- Ligações QuimicasDocumento3 páginasLigações QuimicasNathanAinda não há avaliações
- NaturezaDocumento59 páginasNaturezarth moAinda não há avaliações
- Relatório de Química Orgânica ExperimentalDocumento12 páginasRelatório de Química Orgânica Experimentalheitor furlan trevizanAinda não há avaliações
- Tabela PeriódicaDocumento9 páginasTabela PeriódicagetulioAinda não há avaliações
- Apostila Química CEFET 2P TeoriaDocumento158 páginasApostila Química CEFET 2P Teoriaandre_sardinha7847100% (1)
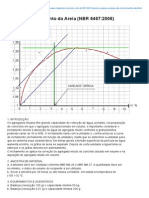
- Clube Do Concreto - Ensaio de Inchamento Da Areia (NBR 6467 - 2006)Documento4 páginasClube Do Concreto - Ensaio de Inchamento Da Areia (NBR 6467 - 2006)Everton TanisAinda não há avaliações
- Dalton Eletricidade 03 PDFDocumento9 páginasDalton Eletricidade 03 PDFArtur MartinsAinda não há avaliações
- Exercicios Introducao A Biologia Metodo CientificoDocumento5 páginasExercicios Introducao A Biologia Metodo CientificoLeidimar LustosaAinda não há avaliações
- Espectroscopia RamanDocumento19 páginasEspectroscopia RamanDiego MontesAinda não há avaliações
- Caderno de Questões Química - Ciclo IDocumento45 páginasCaderno de Questões Química - Ciclo ISabrina MaraAinda não há avaliações
- Trocadores de CalorDocumento17 páginasTrocadores de CalorDouglas RamosAinda não há avaliações
- Alcinos 1Documento27 páginasAlcinos 1Arlindo Mario JuniorAinda não há avaliações
- Ensaio de Fluência Trabalho Final SlidesDocumento23 páginasEnsaio de Fluência Trabalho Final SlidesLucas LimaAinda não há avaliações
- Mananejo de Solução NutritivaDocumento119 páginasMananejo de Solução NutritivaFábio PedroAinda não há avaliações
- Ensaio DPL PDFDocumento5 páginasEnsaio DPL PDFJoão LuzAinda não há avaliações
- Aula 1Documento31 páginasAula 1Bruno OliveiraAinda não há avaliações
- Manual Alta Vazao StratemaDocumento34 páginasManual Alta Vazao StratemaLuiz Claudio Moura Combat100% (2)
- REGULAMENTO E Normas Gerais de Uso Da Sala de Cultura 213C Atualizada em 09 09 2019Documento9 páginasREGULAMENTO E Normas Gerais de Uso Da Sala de Cultura 213C Atualizada em 09 09 2019Vanessa MendesAinda não há avaliações
- Fisiopatologia - Tenossinovite de QuervainDocumento2 páginasFisiopatologia - Tenossinovite de QuervainMateus EspindolaAinda não há avaliações
- Estado Da ArteDocumento14 páginasEstado Da Arte20080275970% (1)
- Termoquímica: Trocas de Energia CalorDocumento17 páginasTermoquímica: Trocas de Energia Caloreng civil Paulo Vitor MedeirosAinda não há avaliações
- Dnit139 2010 EsDocumento8 páginasDnit139 2010 EsAlysson SantosAinda não há avaliações
- Manual Materias+Técnicas Tradicionais Assentamento AzulejosDocumento38 páginasManual Materias+Técnicas Tradicionais Assentamento AzulejosvitorcscostaAinda não há avaliações
- 68684ebd-f28f-4ee6-ae36-13b4eeb0bd21Documento260 páginas68684ebd-f28f-4ee6-ae36-13b4eeb0bd21Davi Marciano100% (2)
- Exp - Equilíbrio Químico Ácido-Base - VinagreDocumento2 páginasExp - Equilíbrio Químico Ácido-Base - VinagreRebeca NicolleAinda não há avaliações
- Volume MolarDocumento1 páginaVolume MolarDarlan SilvaAinda não há avaliações
- Edital PPGQ 2020Documento10 páginasEdital PPGQ 2020Marina PiresAinda não há avaliações
- Luz Pulsada EscritoDocumento9 páginasLuz Pulsada EscritoBia PeronAinda não há avaliações
- C NBR 6971 - Defensas Metálicas - Projeto e ImplantaçaoDocumento44 páginasC NBR 6971 - Defensas Metálicas - Projeto e ImplantaçaopaullovictorAinda não há avaliações
- Estudo Do Fabrico e Da Degradação de Azulejos Portugueses HistóricosDocumento252 páginasEstudo Do Fabrico e Da Degradação de Azulejos Portugueses HistóricosCesarAinda não há avaliações
- Química 10º AnoDocumento5 páginasQuímica 10º AnoMatildeAinda não há avaliações
- Manual Geral Trocadores de Calor A Placas BERMODocumento64 páginasManual Geral Trocadores de Calor A Placas BERMOPatricio AbraaoAinda não há avaliações
- RelatorioLNEC PrevençaoDocumento63 páginasRelatorioLNEC PrevençaoXZ LabAinda não há avaliações
- Pe Ex - Revisao.av2 Ciencias 9ano 1tri PDFDocumento4 páginasPe Ex - Revisao.av2 Ciencias 9ano 1tri PDFAdeptus XiaoAinda não há avaliações
- Aula 1 - Perspectiva Histórica Do Estudo Dos NutrientesDocumento31 páginasAula 1 - Perspectiva Histórica Do Estudo Dos NutrientesFernanda Maria Vital OliveiraAinda não há avaliações