Escolar Documentos
Profissional Documentos
Cultura Documentos
Quimica 5
Enviado por
Marlon BrunoDescrição original:
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Quimica 5
Enviado por
Marlon BrunoDireitos autorais:
Formatos disponíveis
Ligações Químicas
Regra do Octeto: os átomos ligam-se para Geometria Molecular Polaridade das moléculas
A geometria molecular baseia-se nas ligações covalentes.
obter a configuração eletrônica de um gás
nobre (8 elétrons na camada de valência). Nuvens de Elétrons Exemplo Geometria Polaridade
Ligações Iônicas metal + ametal ou hidrog. x
x Linear
(Cede Elétrons ) (Recebe Elétrons) Apolar
O C O
x+ y
A y B x
2
Observação:
1) Elementos Eletropositivos: Tendência a perder elétrons xx Angular
2) Todo composto iônico é sólido. S Polar
O (Elétrons em
3) Altos pontos de fusão e ebulição O sobra)
4) Conduz corrente elétrica no meio aquoso ou líquido
( íons dissociados) 3
5) Não conduz corrente elétrica quando sólido O Trigonal
6) Grande diferença de eletronegatividade entre os átomos
(Família IA, IIA, IIIA e VA, VIA, VIIA) Diferença >1,7 S Apolar
7) São solúveis em solventes polares; O O
8) Principais metais: Na, Mg, Ca, Rb, Sr, Li e K
Ligações Covalentes ametal + ametal (hidrog.)
xx
xx
O Angular Polar
(Compartilhamento ) (Elétrons em
(Ligações Simples)
..
. .. + xH = Hx. O.xH (ou H-O-H ) H H sobra)
H + .O
x
.. ..
Observação: xx Polar
4 N Piramidal (Elétrons em
1) Alta eletronegatividade (tendência a receber elétrons)
H H sobra)
2) O hidrogênio compartilha um elétron, adquirindo a H
configuração eletrônica do gás nobre hélio (He)
3) Baixos pontos de fusão e ebulição
4) Não conduz corrente elétrica no estado sólido. H
(não há íons) Tetraétrica
H C H Apolar
5) Pequena diferença de eletronegatividade entre os átomos
(Familia VA, VIA e VIIA) Diferença <1,7 H
6) Semelhante (apolar ou polar) dissolve semelhante;
7) Principais ametais: Polaridade das Ligações
Família IIIA B (3 elétrons na camada de valência) 1) Polar Eletronegatividades diferentes Vetor momento dipolar U=0
-
/ ex: H-O
Família IVA C e Si (4 elétrons na camada de valência) 2) Apolar Eletronegatividades iguais -
Vetor momento dipolar U=0 ex: Cl-Cl
Família VA N, P e As (5 elétrons na cama de valência) ( ou Vetor polaridade)
Família VIA O, S e Se (6 elétrons na camada de valência) Observação:
Família VIIA F, Cl e Br (7 elétrons na camada de valência) 1) Todo hidrocarboneto (com Hidrogênio e Carbono) é apolar.
2) Toda molécula que apresenta o fator base (OH) é polar.
(Ligações Dativas ou Coordenadas)
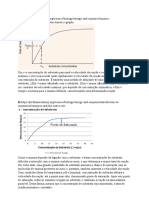
.. H + Forças InterMoleculares Propriedades físicas
.
H O .
. H+H= H
x x + Observação:
O H 1) São as forças que mantém as moléculas unidas nos estados
x sólidos e líquidos.
H H 2) Fatores que Influenciam nas tempraturas de fusão e ebulição:
Observação: - Intensidade das forças interpartículas
- as dimensões das superfícies ou massa moleculares
1) Com a regra do Octeto completa no átomo central, já
estável, " doa-se " um par de elétron livre. - ramificações das cadeias carbônicas
2) Capacidade de ligações simples e dativas: 3) Fator Força Intermoleculares (ponto de ebulição e fusão):
Família IVA 4 (simples) Lig. Hidrog. > Dipolo Permanente > Dipolo Induzido
Família VA 3 (simples) e 1 (dativa)
Família VIA 2 (simples) e 2 (dativas) Pontes de Hidrogênio (FON)
Família VIIA 1 (simples) e 3 (dativas)
Observação: H+ F O N ou ou
Ligações Metálicas metal + metal
1) Ocorre quando o Hidrogênio liga-se a átomos fortemente
eletronegativos: o Flúor, o Oxigênio e o Nitrogênio
Observação: 2) São moléculas polares
1) Altos pontos de fusão e ebulição (exceto:Hg)
2) Todo composto metálico é sólido
3) Conduz corrente elétrica no estado sólido e líquido. Ligações Dipolo-Dipolo Permanente
4) boa condutividade térmica e elétrica (elétrons livres)
5) Ductibilidade e maleabilidade: Laminação Observação: H + ...
1) Ocorre quando o Hidrogênio liga-se a átomos diferentes
dos átomos do Flúor, Oxigênio e Nitrogênio.
2) São moléculas polares
Força de Van Der Waals (Dipolo Induzido)
Observação: ... + ...
1) Em moléculas apolares
Você também pode gostar
- Teoria e Exercícios Ligações QuímicasDocumento32 páginasTeoria e Exercícios Ligações QuímicasSandrts100% (1)
- Este Exercício Vai Te Ajudar A Encontrar Seu Propósito de VidaDocumento3 páginasEste Exercício Vai Te Ajudar A Encontrar Seu Propósito de VidaGiovanna SilvaAinda não há avaliações
- Resumo de Química 12 º AnoDocumento25 páginasResumo de Química 12 º AnoDiana Lopes100% (1)
- Corrosão e LubrificaçãoDocumento21 páginasCorrosão e LubrificaçãoGeovanna MariaAinda não há avaliações
- Apostila Refrigeração Domiciliar Caprerj...Documento62 páginasApostila Refrigeração Domiciliar Caprerj...Wagner LucianoAinda não há avaliações
- Lista Cap08 20231o GabaritoDocumento7 páginasLista Cap08 20231o GabaritoPedro HenriqueAinda não há avaliações
- Estrutura Atômica e Ligação Interatômica PDFDocumento21 páginasEstrutura Atômica e Ligação Interatômica PDFAbraao Zuza CostaAinda não há avaliações
- Ligações QuímicasDocumento45 páginasLigações QuímicasLarissa Santos100% (1)
- Aula QG - Regra Do Octeto e Ligações Químicas PDFDocumento49 páginasAula QG - Regra Do Octeto e Ligações Químicas PDFEder Cezano Gonçalves100% (1)
- Aula 3 Ligações QuímicasDocumento37 páginasAula 3 Ligações QuímicasBarbara IsabelyAinda não há avaliações
- Ligações QuímicasDocumento45 páginasLigações QuímicasAlexandre de JesusAinda não há avaliações
- Aula - 3 - Ligações QuímicasDocumento45 páginasAula - 3 - Ligações QuímicasJuliano AugustusAinda não há avaliações
- Aula - 3 - Ligações QuímicasDocumento45 páginasAula - 3 - Ligações QuímicasTiago_Merces100% (1)
- Aula 3 Ligações QuímicasDocumento45 páginasAula 3 Ligações QuímicasgghghjghAinda não há avaliações
- Turma Oficial - ReposiçãoDocumento3 páginasTurma Oficial - ReposiçãovalterjonnyAinda não há avaliações
- LigaçãoionicaDocumento21 páginasLigaçãoionicaMarcia BayAinda não há avaliações
- Materiais Cerâmicos-Unidade I-Ligações Quimicas 1Documento16 páginasMateriais Cerâmicos-Unidade I-Ligações Quimicas 1Willian SilveiraAinda não há avaliações
- Aula de Ligação QuímicaDocumento21 páginasAula de Ligação QuímicamichelAinda não há avaliações
- Ligações QuímicasDocumento35 páginasLigações QuímicasSophia VelameAinda não há avaliações
- Aula 2 - Ligações Químicas, Propriedades e CristalinidadeDocumento52 páginasAula 2 - Ligações Químicas, Propriedades e CristalinidadeRodrigo de Oliveira PezzinAinda não há avaliações
- ProvaDocumento6 páginasProva9 ano 01 dandhara SantosAinda não há avaliações
- Introdução A Ligação QuimicaDocumento43 páginasIntrodução A Ligação QuimicaElnanaAinda não há avaliações
- Ligações Químicas 160519Documento46 páginasLigações Químicas 160519Guilherme LucchiniAinda não há avaliações
- Ligações Químicas Ligação Iônica ANTONIODocumento26 páginasLigações Químicas Ligação Iônica ANTONIOWilliam Jesus PereiraAinda não há avaliações
- Aula Ligações QuímicasDocumento41 páginasAula Ligações Químicassz.kayooAinda não há avaliações
- Aula 2Documento56 páginasAula 2jailson suquitodoceAinda não há avaliações
- Lig Químicas PDFDocumento30 páginasLig Químicas PDFEder Cezano GonçalvesAinda não há avaliações
- Resumo - Geometria e Interações - Aula 06Documento14 páginasResumo - Geometria e Interações - Aula 06Endro PeixotoAinda não há avaliações
- Ligações Químicas DefinitivaDocumento60 páginasLigações Químicas DefinitivaLayzza Tardin da Silva SoffnerAinda não há avaliações
- Aula 03 Ligações Químicas (Iônica J Covalente e Metálica)Documento37 páginasAula 03 Ligações Químicas (Iônica J Covalente e Metálica)Diego FreitasAinda não há avaliações
- Documento PDFDocumento89 páginasDocumento PDFjulival netoAinda não há avaliações
- Aula 09 - Ligações Químicas e Determinação de Fórmulas de Compostos IônicosDocumento8 páginasAula 09 - Ligações Químicas e Determinação de Fórmulas de Compostos IônicosvicfborgesAinda não há avaliações
- 1 - Introdução A QODocumento34 páginas1 - Introdução A QOAmanda DanuelloAinda não há avaliações
- Química - Fascículo 02 - Ligação CovalenteDocumento11 páginasQuímica - Fascículo 02 - Ligação CovalenteConcurso Vestibular100% (6)
- Ligações QuímicasDocumento63 páginasLigações QuímicaswilliamAinda não há avaliações
- TCC TCL UbirajaraDocumento68 páginasTCC TCL UbirajaraDouglas RamosAinda não há avaliações
- Aula 6 - Ligações Covalentes, Geometria e PolaridadeDocumento51 páginasAula 6 - Ligações Covalentes, Geometria e PolaridadeGiovana CarvalhoAinda não há avaliações
- 4 Ligacoes Quimicas - Simbolos de Lewis e ADocumento26 páginas4 Ligacoes Quimicas - Simbolos de Lewis e AhitcarAinda não há avaliações
- Aula 4 - MoléculasDocumento34 páginasAula 4 - Moléculasaugusto cesar januarioAinda não há avaliações
- Ligação Interatômica: Área Do Conhecimento de Ciências Exatas e Engenharias FBX 4006A Química GeralDocumento41 páginasLigação Interatômica: Área Do Conhecimento de Ciências Exatas e Engenharias FBX 4006A Química GeralIago FacchinAinda não há avaliações
- SlidesDocumento37 páginasSlidesVictor LopesAinda não há avaliações
- Resumo de QuímicaDocumento20 páginasResumo de QuímicaWillian Sian HerzogAinda não há avaliações
- Tabela Periódica e Os Metais - Química 1Documento6 páginasTabela Periódica e Os Metais - Química 1Elena DetierAinda não há avaliações
- Capítulo 1 - Átomos, Moléculas e Ligações QuímicasDocumento168 páginasCapítulo 1 - Átomos, Moléculas e Ligações QuímicasMatheus Henrique Barbosa OliveiraAinda não há avaliações
- Ligações Químicas e Interações Intermoleculares.: Prof Dra. Francisca de Assiz CarvalhoDocumento41 páginasLigações Químicas e Interações Intermoleculares.: Prof Dra. Francisca de Assiz CarvalhoIsadora FerreiraAinda não há avaliações
- 09 - Ligações Químicas FINALDocumento47 páginas09 - Ligações Químicas FINALprofnonocmmAinda não há avaliações
- Tabela PeriódicaDocumento9 páginasTabela PeriódicagetulioAinda não há avaliações
- 6 Classificação Periódica e Propriedades Dos ElementostDocumento33 páginas6 Classificação Periódica e Propriedades Dos ElementostnianAinda não há avaliações
- Edil Química Orgânica Unidade 1 - Teoria EstruturalDocumento132 páginasEdil Química Orgânica Unidade 1 - Teoria Estruturalleticia trindadeAinda não há avaliações
- 7.0.apreentacao Geometria MolecularDocumento41 páginas7.0.apreentacao Geometria MolecularAndréa Marli Dos Santos100% (1)
- QuímicaDocumento9 páginasQuímicaItalo Rafael Machado SantosAinda não há avaliações
- Ligações AtômicasDocumento20 páginasLigações AtômicasRubens SantosAinda não há avaliações
- Aula 5 Ligacoes QuimicasDocumento15 páginasAula 5 Ligacoes QuimicasJúnior AlbuquerqueAinda não há avaliações
- Aula - Regra Do Octeto e Tipos de Ligaà à Es Quà MicasDocumento21 páginasAula - Regra Do Octeto e Tipos de Ligaà à Es Quà Micashanic51870Ainda não há avaliações
- QG 2Documento60 páginasQG 2Ana CarolinaAinda não há avaliações
- Ligações QuímicasDocumento6 páginasLigações QuímicasWuazoAinda não há avaliações
- LigaçõesDocumento2 páginasLigaçõesKelly Miranda CostaAinda não há avaliações
- Exercicíos Gerais QUIMICA GERALDocumento13 páginasExercicíos Gerais QUIMICA GERALWylace AndradeAinda não há avaliações
- Aula - 4 - Ligações Químicas e GeometriaDocumento65 páginasAula - 4 - Ligações Químicas e GeometriaLucas FreitasAinda não há avaliações
- Ligacoes QuimicasDocumento54 páginasLigacoes QuimicasBruna AlexandraAinda não há avaliações
- Formulário de Química-13Documento1 páginaFormulário de Química-13Marlon BrunoAinda não há avaliações
- Quimica 4Documento1 páginaQuimica 4Marlon BrunoAinda não há avaliações
- 02 - Fiscal de Contrato e COMREC (ICA 65-8) (Conteúdo Novo)Documento1 página02 - Fiscal de Contrato e COMREC (ICA 65-8) (Conteúdo Novo)Marlon BrunoAinda não há avaliações
- 01 - Hélices de Aeronaves (Volume 01 e Volume 02)Documento1 página01 - Hélices de Aeronaves (Volume 01 e Volume 02)Marlon BrunoAinda não há avaliações
- DeterminantesDocumento17 páginasDeterminantesMarlon BrunoAinda não há avaliações
- Ok - Prova 60 - Técnico (A) Químico (A) de Petróleo JúniorDocumento13 páginasOk - Prova 60 - Técnico (A) Químico (A) de Petróleo JúniorDébora GuimarãesAinda não há avaliações
- Precipitação QuímicaDocumento14 páginasPrecipitação QuímicaAna Júlia CairesAinda não há avaliações
- Fisqp 1623859386Documento6 páginasFisqp 1623859386Luiz RicardoAinda não há avaliações
- Bastidores Da Eficiência Industrial (Parte 1 e 2) - Balanço de Massa em Açúcares Redutores Totais (ART)Documento17 páginasBastidores Da Eficiência Industrial (Parte 1 e 2) - Balanço de Massa em Açúcares Redutores Totais (ART)Rodrigo Rocha de LimaAinda não há avaliações
- Atividade 3 - EnzimasDocumento3 páginasAtividade 3 - EnzimasAna JúliaAinda não há avaliações
- 10 10 Friazinc - RDocumento3 páginas10 10 Friazinc - RSérgio LuisAinda não há avaliações
- NE 40-010 - Rev R - CadmioDocumento13 páginasNE 40-010 - Rev R - CadmioLuiz felipe Pereira guerraAinda não há avaliações
- Roteiro Extração Sólido-LíquidoDocumento3 páginasRoteiro Extração Sólido-LíquidoEllen MoraisAinda não há avaliações
- Questionário Sobre Química OrgânicaDocumento2 páginasQuestionário Sobre Química Orgânicamariana.nascimenttoAinda não há avaliações
- Cadetes Do ExercitoDocumento48 páginasCadetes Do ExercitoNathan LageAinda não há avaliações
- FISPQ Barrilha - QuimitextilDocumento5 páginasFISPQ Barrilha - QuimitextilPROQUIMICA INDÚSTRIA E COMÉRCIO DE PRODUTOS LTDAAinda não há avaliações
- Texto Etapa 1Documento1 páginaTexto Etapa 1Ryan LemosAinda não há avaliações
- Relatório - Cromatografia em Camada Delgada de Sílica GelDocumento9 páginasRelatório - Cromatografia em Camada Delgada de Sílica GelMaria EduardaAinda não há avaliações
- Ficha de Especificação Técnica VitaplusDocumento6 páginasFicha de Especificação Técnica VitaplusValdenice OliveiraAinda não há avaliações
- Tabela PeriodicaDocumento16 páginasTabela PeriodicaHenny MamedesAinda não há avaliações
- Amidas Aminas e TióisDocumento27 páginasAmidas Aminas e TióisNickAinda não há avaliações
- Instrucciones de Instalación SOL 250 ECO y SOL 250-H ECO.Documento12 páginasInstrucciones de Instalación SOL 250 ECO y SOL 250-H ECO.Walid Serroukh Al MansouriAinda não há avaliações
- Exer ANOVADocumento13 páginasExer ANOVAbruna fontouraAinda não há avaliações
- Relatório 09 - Síntese de BenzoínaDocumento7 páginasRelatório 09 - Síntese de BenzoínaCesar Policarpo FelisbinoAinda não há avaliações
- Catalogo Artenafex VisualizacaoDocumento6 páginasCatalogo Artenafex VisualizacaoDenis FreireAinda não há avaliações
- Aula 5 Introdução Ao MetabolismoDocumento16 páginasAula 5 Introdução Ao MetabolismoBeni QuímicoAinda não há avaliações
- 02 Eq12 Teste Aval 1 Metais Lig Met Enunciado v1Documento10 páginas02 Eq12 Teste Aval 1 Metais Lig Met Enunciado v1MNAinda não há avaliações
- 2054 - Fispq - IsopropanolDocumento9 páginas2054 - Fispq - IsopropanolRudã VidalAinda não há avaliações
- Valeos BulaDocumento14 páginasValeos BulaOsmar Garcia de AlmeidaAinda não há avaliações
- Fispq VerdesanDocumento7 páginasFispq VerdesanfgjamesgubertAinda não há avaliações
- Fispq - Detergente Power Det-10Documento7 páginasFispq - Detergente Power Det-10Flavio Furtuoso RoqueAinda não há avaliações