Escolar Documentos
Profissional Documentos
Cultura Documentos
Roteiro Experimental - Espectrometria QUIP2
Enviado por
marcio-motoDireitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Roteiro Experimental - Espectrometria QUIP2
Enviado por
marcio-motoDireitos autorais:
Formatos disponíveis
IFSP
QUIP2
ROTEIRO Laboratório de Química
Espectrofotometria UV/Vis
OBJETIVO
Construir uma curva de calibração e determinar a concentração de uma solução de CuSO4 por
espectrofotometria.
PROCEDIMENTO EXPERIMENTAL
a) Preparo das soluções para montagem da curva padrão
1. Transfira 10mL da solução de estoque de CuSO4 para uma proveta e complete o volume até 100mL com
água destilada. Esta será a sua “solução A”.
2. Complete a tabela abaixo com os volumes da solução A e de água destilada que devem ser adicionados
para produzir 50mL de cada uma das soluções indicadas:
Concentração Volume da Volume de água Absorbância
Solução
(mol/L) “solução A” (mL) destilada (mL) medida
estoque 0,500
A 0,050
B 0,020
C 0,010
D 0,005
E 0,002
F 0,001
3. Utilizando pipeta graduada e balões volumétricos de 50mL, prepare as soluções B, C, D, E e F, seguindo
os dados da tabela.
b) Construção da curva padrão do espectrofotômetro
CUIDADO! Nunca encoste nas laterais lisas das cubetas porta-amostra. As cubetas devem ser sempre
manuseadas pelas laterais riscadas.
1. No espectrofotômetro, utilize a cubeta preta e uma contendo apenas água destilada para calibrar o 0 e
o 100% de transmitância.
2. Depois de calibrar o aparelho, introduza uma cubeta com a 3mL da solução B e anote o sinal de
absorbância registrado.
3. Repita o procedimento, utilizando uma cubeta nova para cada uma das soluções preparadas.
c) Determinação da concentração da solução problema
1. Meça a absorbância da solução problema recebida pelo grupo. A concentração desta solução deverá
ser determinada por comparação com os dados da curva padrão.
QUESTÕES
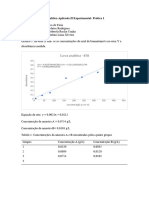
1) Monte o gráfico que apresenta a absorbância de cada solução em função das concentrações.
2) Obtenha a equação da reta de regressão linear que expressa a relação entre a absorbância e a concentração
do CuSO4 em solução.
3) Aponte no gráfico o ponto P, representando a absorbância obtida para a solução problema. Utilize a
equação de reta obtida para determinar a concentração desta solução.
5) Pesquise o significado da lei de Beer-Lambert. Explique como ela relaciona a absorbância com a
transmitância de um material.
4) Neste experimento, utilizamos luz com comprimento de onda de 650nm. Explique porque esta é uma boa
escolha. O que se deveria esperar de diferente nos resultados se utilizássemos feixes de 450nm?
BIBLIOGRAFIA
RUSSEL, J. B. – Química Geral. Vol. 1 e 2, São Paulo: Editora Makron Books do Brasil, 1994.
Você também pode gostar
- Relatório 8 - Potenciomeria Do FluoretoDocumento11 páginasRelatório 8 - Potenciomeria Do FluoretoFatybioAinda não há avaliações
- Programando O Pic Usando O Flowcode Parte V - Baseado Na Versão 6 E Pic16fNo EverandProgramando O Pic Usando O Flowcode Parte V - Baseado Na Versão 6 E Pic16fAinda não há avaliações
- Análise Pelo Espectrofotômetro e Curva Padrão.Documento6 páginasAnálise Pelo Espectrofotômetro e Curva Padrão.Gesiane G. Ferreira100% (2)
- Exercà Cios-Cap 3Documento5 páginasExercà Cios-Cap 3Luana MatosAinda não há avaliações
- Relatorio 5 - CompletoDocumento15 páginasRelatorio 5 - CompletoFernanda BonfimAinda não há avaliações
- 66 A 10 ADocumento6 páginas66 A 10 AFilipe Moreth0% (1)
- Relatório 2 - CondutometriaDocumento8 páginasRelatório 2 - CondutometriaJulianaFalcãoAinda não há avaliações
- 14 Divisões Da CircunferênciaDocumento2 páginas14 Divisões Da CircunferênciaMarcelo RamassottiAinda não há avaliações
- Calculo Hepes PDFDocumento11 páginasCalculo Hepes PDFCharlle LimaAinda não há avaliações
- Exp. 8 Condutância Molar E.F.Documento10 páginasExp. 8 Condutância Molar E.F.Anderson SalesAinda não há avaliações
- Lista de Operações UnitáriasDocumento4 páginasLista de Operações UnitáriasMariana CunhaAinda não há avaliações
- Lista de Espectrofotometria UV-VISDocumento3 páginasLista de Espectrofotometria UV-VISDebora CostaAinda não há avaliações
- Determinação de Proteínas Totais LOWRYDocumento3 páginasDeterminação de Proteínas Totais LOWRYEyner GodinhoAinda não há avaliações
- Relatório 6 - Espectroanalítica - Victória ChagasDocumento6 páginasRelatório 6 - Espectroanalítica - Victória ChagasVictoria Hellen ChagasAinda não há avaliações
- Curva de Calibração CompletoDocumento4 páginasCurva de Calibração CompletoLucas SeccattoAinda não há avaliações
- Resolução Lista de Exercicio Análise InstrumentalDocumento4 páginasResolução Lista de Exercicio Análise Instrumentalccq256867100% (8)
- Relatório Físico-Química Experimental - Soluçao Tampão - Preparação e PropriedadesDocumento14 páginasRelatório Físico-Química Experimental - Soluçao Tampão - Preparação e PropriedadesBombomqpAinda não há avaliações
- Lista de Exercicios QuimicaDocumento4 páginasLista de Exercicios QuimicaAnna LauraAinda não há avaliações
- Relatório - Adsorção AMDocumento4 páginasRelatório - Adsorção AMPaulo Vitor Lima CarvalhoAinda não há avaliações
- 2020 - PCP - C19 - 5EX - 5EY - 5EZ - QAI - 37 - Espectrometria Atômica - Lista4 PDFDocumento2 páginas2020 - PCP - C19 - 5EX - 5EY - 5EZ - QAI - 37 - Espectrometria Atômica - Lista4 PDFAline PolicarpoAinda não há avaliações
- Prova 3 2021-2 Ainstrumental T01 2022Documento2 páginasProva 3 2021-2 Ainstrumental T01 2022Irene Vargas de CarvalhoAinda não há avaliações
- Captura de Tela 2023-12-13 À(s) 11.13.24Documento4 páginasCaptura de Tela 2023-12-13 À(s) 11.13.24perfectgamer010101Ainda não há avaliações
- Relatório de Química - Prática Nº 1Documento7 páginasRelatório de Química - Prática Nº 1IzadoraAinda não há avaliações
- 2º BimestreDocumento24 páginas2º BimestreMariana KoglinAinda não há avaliações
- Karen - Biotec ExpDocumento6 páginasKaren - Biotec ExpKaren GomesAinda não há avaliações
- SSA - Ficha de QuimicaDocumento19 páginasSSA - Ficha de Quimica010260100% (1)
- Diluição e MisturaDocumento15 páginasDiluição e MisturaozikaaapedrinhoAinda não há avaliações
- cpq126 Banco de Questoes q2Documento6 páginascpq126 Banco de Questoes q2Pedro FloresAinda não há avaliações
- 2ano Diluicao de SolucoesDocumento16 páginas2ano Diluicao de Solucoesmarcos rodriguesAinda não há avaliações
- CONCENTRA+ç+òES E DILUI+ç+òESDocumento21 páginasCONCENTRA+ç+òES E DILUI+ç+òESEmily RochaAinda não há avaliações
- Prova 2 2020-1 Ainstrumental T01 - Ece 2021Documento3 páginasProva 2 2020-1 Ainstrumental T01 - Ece 2021Irene Vargas de CarvalhoAinda não há avaliações
- Potenciometria - Teoria Da PráticaDocumento18 páginasPotenciometria - Teoria Da PráticaLucas PereiraAinda não há avaliações
- Exercà Cios Capã Tulos 1, 2 e 3Documento8 páginasExercà Cios Capã Tulos 1, 2 e 3Luana MatosAinda não há avaliações
- Ficha Apoio Exercícios 1 - Espectrofotometria - Resolução 191222Documento3 páginasFicha Apoio Exercícios 1 - Espectrofotometria - Resolução 191222RAinda não há avaliações
- Trabalho Laboratorial 1Documento12 páginasTrabalho Laboratorial 1Íris MesquitaAinda não há avaliações
- 2018 - Apostila de ProblemasDocumento16 páginas2018 - Apostila de ProblemasLuiz WohlkAinda não há avaliações
- CONCENTRAÇÕES E DILUIÇÕES Jun2019Documento26 páginasCONCENTRAÇÕES E DILUIÇÕES Jun2019Ademario JuniorAinda não há avaliações
- Portfólio de Desafios - Eletrônica AplicadaDocumento8 páginasPortfólio de Desafios - Eletrônica AplicadaLeandro Moretti De Lima100% (2)
- Karen - Biotec ExpDocumento6 páginasKaren - Biotec ExpKaren GomesAinda não há avaliações
- Relatório Titulação Ácido 1.0Documento6 páginasRelatório Titulação Ácido 1.0Stefani Laise da SilvaAinda não há avaliações
- Relatorio T7 MIADocumento8 páginasRelatorio T7 MIAdidiAinda não há avaliações
- MIA I - Teste de Recuperaç o 2015Documento2 páginasMIA I - Teste de Recuperaç o 2015Angelique ViannyAinda não há avaliações
- Aula Excel 1 RDocumento20 páginasAula Excel 1 REsperança CandeleAinda não há avaliações
- Volumetria de Ácido-Base - ExercíciosDocumento1 páginaVolumetria de Ácido-Base - ExercíciosLaura F. VianaAinda não há avaliações
- 2ANODocumento5 páginas2ANOCarlos OliveiraAinda não há avaliações
- Exp. 02 - Distribuição de Espécies - Aula PráticaDocumento3 páginasExp. 02 - Distribuição de Espécies - Aula PráticaMarina LeiteAinda não há avaliações
- Relatório 2Documento13 páginasRelatório 2Elizandra Goncalves da SilvaAinda não há avaliações
- Problema de Engenharia (Classificação de Fluidos) ADocumento2 páginasProblema de Engenharia (Classificação de Fluidos) AHudsson //Ainda não há avaliações
- Lista de Exercícios - Aula 06-11Documento2 páginasLista de Exercícios - Aula 06-11David GuimarãesAinda não há avaliações
- Relatório Volumetria OxirreduçãoDocumento4 páginasRelatório Volumetria OxirreduçãoLarizza MarianneAinda não há avaliações
- Relatório 8 - Determinação de Sodio e Potássio Por Fotometria de ChamaDocumento10 páginasRelatório 8 - Determinação de Sodio e Potássio Por Fotometria de ChamaJulianaFalcãoAinda não há avaliações
- Relatório 1 de Química Analítica II EDITADODocumento4 páginasRelatório 1 de Química Analítica II EDITADOEdilene MatosAinda não há avaliações
- Trabalho Laboratorial 3Documento14 páginasTrabalho Laboratorial 3Íris MesquitaAinda não há avaliações
- N1 - 1º Bimestre - Curso: EAL - Turma: EA3 09/09/2020Documento3 páginasN1 - 1º Bimestre - Curso: EAL - Turma: EA3 09/09/2020mayyvidooAinda não há avaliações
- Prova 200701Documento8 páginasProva 200701Fábio HenriqueAinda não há avaliações
- VOD-Diluição e Misturas de Soluções-2019.Documento7 páginasVOD-Diluição e Misturas de Soluções-2019.Luís FernandoAinda não há avaliações
- Problemas Termodinamica IDocumento5 páginasProblemas Termodinamica IModestoAinda não há avaliações
- ED - C.H., B.H. e Precipitação 2017.2Documento3 páginasED - C.H., B.H. e Precipitação 2017.2luisAinda não há avaliações
- Bloco 2 Aula 6 A 8 Mistura de Soluções e TitulometriaDocumento2 páginasBloco 2 Aula 6 A 8 Mistura de Soluções e TitulometriaMax NunesAinda não há avaliações
- Gilberto FreyreDocumento7 páginasGilberto FreyreGustavo PizettaAinda não há avaliações
- Design Sem Fronteiras - A Relação Entre o Nomadismo e A Sustentabilidade - 2008Documento412 páginasDesign Sem Fronteiras - A Relação Entre o Nomadismo e A Sustentabilidade - 2008Luana Toralles CarbonariAinda não há avaliações
- Arranjos, Combinações - Exercícios Provas FinaisDocumento39 páginasArranjos, Combinações - Exercícios Provas FinaisMafalda RochaAinda não há avaliações
- Trabalho Tolerancia e AjusteDocumento15 páginasTrabalho Tolerancia e Ajustematheus perinAinda não há avaliações
- Relatório Ponte LevadiçaDocumento13 páginasRelatório Ponte LevadiçaCarlos GuarinoAinda não há avaliações
- Trânsitos Planetários - Marte em Trânsito em Aspecto Com Planetas NataisDocumento18 páginasTrânsitos Planetários - Marte em Trânsito em Aspecto Com Planetas Nataispatricia100% (1)
- Manual Falhas - DieselDocumento37 páginasManual Falhas - DieselAnderson Coutinho80% (5)
- Jogos PS2 No Pen DriveDocumento4 páginasJogos PS2 No Pen DrivereapervanhellAinda não há avaliações
- Método de Gauss Não Serve Como Alternativa de Juros Simples - Luiz Donizete TelesDocumento21 páginasMétodo de Gauss Não Serve Como Alternativa de Juros Simples - Luiz Donizete TelesbrulimoliAinda não há avaliações
- Roteiro de AtividadesDocumento16 páginasRoteiro de Atividadesloterica fruchiAinda não há avaliações
- A Correlação Corpo-Alma Platônica, Uma Interpretação PossívelDocumento12 páginasA Correlação Corpo-Alma Platônica, Uma Interpretação PossíveljoaquicarlosAinda não há avaliações
- FICHA DE GEOGRAFIA DE 7º AnoDocumento10 páginasFICHA DE GEOGRAFIA DE 7º AnoDaniela FernandesAinda não há avaliações
- 2014 - ECSH - DEP - Dissertação - Maria João Carvalho Barbosa - ANGOLA PDFDocumento140 páginas2014 - ECSH - DEP - Dissertação - Maria João Carvalho Barbosa - ANGOLA PDFDavicerada Vic CarterAinda não há avaliações
- Procedimento - Certificado 1Documento5 páginasProcedimento - Certificado 1pasquale100% (1)
- Transtornos Dissociativos e ConversivosDocumento14 páginasTranstornos Dissociativos e ConversivosLarissa Borges GregolettoAinda não há avaliações
- Renascimento 7 AnoDocumento3 páginasRenascimento 7 AnoProfessora Valtilia DiasAinda não há avaliações
- E.V.G Acesso À Informação ATIVIDADE 3Documento7 páginasE.V.G Acesso À Informação ATIVIDADE 3ROSANGELAAinda não há avaliações
- Atividade ADMDocumento1 páginaAtividade ADMSamuel Victor Soares Maia33% (3)
- DB 142 (Especial - Tablet)Documento134 páginasDB 142 (Especial - Tablet)totonho05Ainda não há avaliações
- CASO GM - VigenteDocumento5 páginasCASO GM - VigenteRamiele Silva100% (1)
- Exercícios Matéria Orgânica Do SoloDocumento18 páginasExercícios Matéria Orgânica Do SoloTatiana AgroBastosAinda não há avaliações
- Planejamento WedilaDocumento4 páginasPlanejamento Wedilaclaudiego2Ainda não há avaliações
- OLIVEIRA, Marlene de - Ciência Da Informação e Biblioteconomia (Novos Conteúdos e Espaços de Atuação) (2005)Documento120 páginasOLIVEIRA, Marlene de - Ciência Da Informação e Biblioteconomia (Novos Conteúdos e Espaços de Atuação) (2005)Livia Serpa71% (7)
- Regimento Interno Museu Da Casa Brasileira - Final - AtaDocumento53 páginasRegimento Interno Museu Da Casa Brasileira - Final - Atarominacapparelli-1Ainda não há avaliações
- Metodos e TemposDocumento47 páginasMetodos e TemposMafalda SofiaAinda não há avaliações
- Karl FischerDocumento15 páginasKarl FischerRuth OliveiraAinda não há avaliações
- AV1 - Estética e História Da Arte 15 04 2021 - CAPA DE PROVA E FOLHA DE RESPOSTAS INDIVIDUAL Subjetiva-1 (Recuperação Automática)Documento5 páginasAV1 - Estética e História Da Arte 15 04 2021 - CAPA DE PROVA E FOLHA DE RESPOSTAS INDIVIDUAL Subjetiva-1 (Recuperação Automática)johabe machadoAinda não há avaliações
- Modelo de Contrato - Servicos de Organizacao de EventosDocumento15 páginasModelo de Contrato - Servicos de Organizacao de EventosJade Ramos FeltrinAinda não há avaliações
- Executivo Diário Oficial: Decretos NumeradosDocumento200 páginasExecutivo Diário Oficial: Decretos NumeradosPatricia FilardiAinda não há avaliações
- As 13 Lições de Liderança Do Filme LincolnDocumento3 páginasAs 13 Lições de Liderança Do Filme Lincolncicero_csAinda não há avaliações