Escolar Documentos
Profissional Documentos
Cultura Documentos
66 Quim
Enviado por
Ana Carolina TeixeiraDescrição original:
Título original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
66 Quim
Enviado por
Ana Carolina TeixeiraDireitos autorais:
Formatos disponíveis
66 PARTE 1 — QUÍMICA GERAL
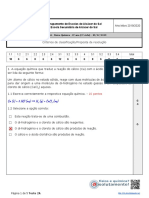
A criação de uma representação gráfica para
Corbis
os subníveis facilitou a visualização da sua ordem
crescente de energia. Essa representação é co-
nhecida como diagrama de Linus Pauling.
K n=1 1s
L n=2 2s 2p
M n=3 3s 3p 3d
N n=4 4s 4p 4d 4f
O n=5 5s 5p 5d 5f
Linus Pauling (1901-1994) rece-
P n=6 6s 6p 6d beu dois prêmios Nobel: de Química,
7s 7p em 1954, e da Paz, em 1962.
Q n=7
O preenchimento da eletrosfera pelos elétrons em subníveis obedece à ordem cres-
cente de energia definida pelo diagrama de Pauling:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s < 5f < 6d
Cada um desses subníveis pode acomodar um número máximo de elétrons:
Subnível s p d f
–
Nº máximo de e 2 6 10 14
Observação:
Os subníveis g, h, … são teóricos. Não são conhecidos átomos que apresentam número de elétrons
suficiente para ocupar esses subníveis.
DISTRIBUIÇÃO ELETRÔNICA POR SUBNÍVEL
Como num átomo o número de prótons (Z) é igual ao número de elétrons, conhe-
cendo o número atômico poderemos fazer a distribuição dos elétrons nos subníveis.
Vejamos alguns exemplos:
1 quantidade de e–
1 H: 1s
subnível s
Z nível 1
(camada K)
12Mg: 1s 2 2s 2 2p 6 3s 2
nível 1 nível 2 nível 3
camada K camada L camada M
nº de elétrons = 2 nº de elétrons = 8 nº de elétrons = 2
K=2 L=8 M=2
Você também pode gostar
- Aula 012 Distribuicao EletronicaDocumento17 páginasAula 012 Distribuicao EletronicaGabriel SimãoAinda não há avaliações
- Unidade 2 - Forças e Energias de Ligação InteratômicasDocumento68 páginasUnidade 2 - Forças e Energias de Ligação InteratômicasJoão Victor BertoldoAinda não há avaliações
- Aula 02Documento29 páginasAula 02Morais NazárioAinda não há avaliações
- Distribuição eletrônica em camadas e subníveisDocumento17 páginasDistribuição eletrônica em camadas e subníveisAna luAinda não há avaliações
- Rezumu Q3a 10 Ano Ct-1Documento30 páginasRezumu Q3a 10 Ano Ct-1RobertAinda não há avaliações
- Distribuição Eletrônica Atv e Folha TextoDocumento5 páginasDistribuição Eletrônica Atv e Folha TextoPatty CostaAinda não há avaliações
- A Tabela Periódica dos Elementos QuímicosDocumento117 páginasA Tabela Periódica dos Elementos QuímicosNelson MirandaAinda não há avaliações
- Diagrama de PaulingDocumento4 páginasDiagrama de PaulingJesse Pontifice RodriguesAinda não há avaliações
- A Origem Dos AtomosDocumento2 páginasA Origem Dos AtomosasfadasdasdasdasdAinda não há avaliações
- Distribuição EletrônicaDocumento5 páginasDistribuição EletrônicaÉrica Lima100% (3)
- Modelos atômicos de Rutherford e BöhrDocumento7 páginasModelos atômicos de Rutherford e BöhrvicfborgesAinda não há avaliações
- VOD Química Estudo Da Eletrosfera 2024Documento17 páginasVOD Química Estudo Da Eletrosfera 2024Ana Beatriz EliasAinda não há avaliações
- Configuração Eletrônica AtômicaDocumento4 páginasConfiguração Eletrônica AtômicaMarcelo NogueiraAinda não há avaliações
- Os AtomosDocumento3 páginasOs AtomosasfadasdasdasdasdAinda não há avaliações
- Distribuição eletrônicaDocumento10 páginasDistribuição eletrônicaNei Silva100% (1)
- Distribuição Eletrônica (PDF - Io)Documento13 páginasDistribuição Eletrônica (PDF - Io)Eduarda De Oliveira MorenoAinda não há avaliações
- Material de Apoio de Química 11 Classe 2023-24Documento92 páginasMaterial de Apoio de Química 11 Classe 2023-24luxdnlAinda não há avaliações
- Resumo 11 QGDocumento2 páginasResumo 11 QGlucas rosaAinda não há avaliações
- Apostila de Química 1° Ano CN - 2° Bi (12014)Documento12 páginasApostila de Química 1° Ano CN - 2° Bi (12014)Jacqueline AlexandrinoAinda não há avaliações
- Átomo: Partículas e EstruturaDocumento7 páginasÁtomo: Partículas e EstruturaZack WattersonAinda não há avaliações
- Resumo 07 QGDocumento3 páginasResumo 07 QGlucas rosaAinda não há avaliações
- Modelo atômico atual: orbitais e números quânticosDocumento23 páginasModelo atômico atual: orbitais e números quânticosBianca RodriguesAinda não há avaliações
- Estrutura atômica: níveis e subníveisDocumento12 páginasEstrutura atômica: níveis e subníveisCaio GuerattoAinda não há avaliações
- Cap. 2 - Ligações AtômicasDocumento21 páginasCap. 2 - Ligações AtômicasLucas RafaelAinda não há avaliações
- Aula03QumicaEstrutura AtmicaCMBPAManhCBMPA28112023Documento5 páginasAula03QumicaEstrutura AtmicaCMBPAManhCBMPA28112023investimentocursomppaAinda não há avaliações
- Curso Técnico em QuímicaDocumento37 páginasCurso Técnico em QuímicaMaycon ContildesAinda não há avaliações
- Distribuição Eletrônica: Níveis e Subníveis de EnergiaDocumento17 páginasDistribuição Eletrônica: Níveis e Subníveis de EnergiaMoises MoiaAinda não há avaliações
- EstudoDocumento13 páginasEstudoFrancisco Da Tiya AliceAinda não há avaliações
- Aulaaovivo Quimica Distribuicao Eletronica 07-03-2017Documento9 páginasAulaaovivo Quimica Distribuicao Eletronica 07-03-2017BRUNA BONAITA DE OLIVEIRAAinda não há avaliações
- Distribuição EletrônicaDocumento18 páginasDistribuição EletrônicaAnderson123Ainda não há avaliações
- Distribuição eletrônica - Brasil EscolaDocumento1 páginaDistribuição eletrônica - Brasil Escolavidalgaspar0205Ainda não há avaliações
- Diagrama de PaulingDocumento4 páginasDiagrama de PaulingRayner FreitasAinda não há avaliações
- Configuração Eletrônica em SubníveisDocumento24 páginasConfiguração Eletrônica em SubníveisDébora WeberAinda não há avaliações
- Átomo de HidrogÉnio e Estrutura AtÓmicaDocumento7 páginasÁtomo de HidrogÉnio e Estrutura AtÓmicaAnabelaLeitãoAinda não há avaliações
- Distribuição Eletrônica - Química - InfoEscolaDocumento1 páginaDistribuição Eletrônica - Química - InfoEscolaktw25bt4pqAinda não há avaliações
- Slide 1Documento44 páginasSlide 1G4M3M4XAinda não há avaliações
- Aula Nº. 11 e 12 Da 10 Classe - CópiaDocumento4 páginasAula Nº. 11 e 12 Da 10 Classe - CópiaJakendry 12100% (1)
- 1 Lista de Exercícios de Quimica GeralDocumento4 páginas1 Lista de Exercícios de Quimica Geralleandro silvaAinda não há avaliações
- Resolução Exercícios Primeiro Teste 2021Documento60 páginasResolução Exercícios Primeiro Teste 2021veronicaAinda não há avaliações
- Distribuição eletrônica em níveis e subníveis de energiaDocumento6 páginasDistribuição eletrônica em níveis e subníveis de energiaJosefumi Kujoh100% (1)
- Níveis e Subníveis Eletrônicos e A Distribuição EletrônicaDocumento6 páginasNíveis e Subníveis Eletrônicos e A Distribuição EletrônicaKelson AlvesAinda não há avaliações
- AULA 6 -ESTRUTURA ATOMICA ATUAL - CopyDocumento35 páginasAULA 6 -ESTRUTURA ATOMICA ATUAL - CopyRolleyn MachocoAinda não há avaliações
- Unidade 2 Numeros QuanticosDocumento34 páginasUnidade 2 Numeros QuanticosSARA JANE DE OLIVEIRAAinda não há avaliações
- Distribuição Eletrônica de Elétrons Tabela Periodica e Modelos Atomicos QuestõesDocumento56 páginasDistribuição Eletrônica de Elétrons Tabela Periodica e Modelos Atomicos QuestõesSonya Karla100% (1)
- Distribuição Eletrônica de ElétronsDocumento2 páginasDistribuição Eletrônica de ElétronsBrenda RaíssaAinda não há avaliações
- MG Tarefa Semanal 7 Ano 5e9df6a71b5f4Documento2 páginasMG Tarefa Semanal 7 Ano 5e9df6a71b5f4Mica MaiaAinda não há avaliações
- Distribuição EletrônicaDocumento36 páginasDistribuição EletrônicaKênya MoraesAinda não há avaliações
- Distribuição Eletrônica PaulingDocumento4 páginasDistribuição Eletrônica PaulingRenato SuarezAinda não há avaliações
- Modelo Atômico AtualDocumento36 páginasModelo Atômico Atualthiago_quimic@100% (1)
- Atividade de Química Revisão 9º Ano. Kaique QuartaDocumento12 páginasAtividade de Química Revisão 9º Ano. Kaique QuartafabiaAinda não há avaliações
- Química - 23, 26062023 - 230704 - 090750Documento7 páginasQuímica - 23, 26062023 - 230704 - 090750Sezo ArbutreAinda não há avaliações
- Teoria-2 Distribuição Eletrônica.Documento9 páginasTeoria-2 Distribuição Eletrônica.Luana TrevizanAinda não há avaliações
- Distribuição EletrônicaDocumento11 páginasDistribuição EletrônicaBarteloide Ricardo ErnestoAinda não há avaliações
- 18 - Distribuição Eletrônica Por DiagramaDocumento5 páginas18 - Distribuição Eletrônica Por Diagramasabrina martinsAinda não há avaliações
- Apostila - Mecanica Quantica IIDocumento51 páginasApostila - Mecanica Quantica IIIbilcemAinda não há avaliações
- Isótopos, isótonos e isóbarosDocumento6 páginasIsótopos, isótonos e isóbarosSilvio Roberto0% (1)
- Lista 1 - IC677 - Estrutura Ato770micaDocumento6 páginasLista 1 - IC677 - Estrutura Ato770micaIrene Vargas de CarvalhoAinda não há avaliações
- Correção Da Ficha Química 10ºDocumento3 páginasCorreção Da Ficha Química 10ºCarlaAinda não há avaliações
- Distribuição EletrônicaDocumento3 páginasDistribuição EletrônicaGustavo NunesAinda não há avaliações
- Reações Químicas de Precipitação: Sais Solubilidade Exceção Cloretos Sulfatos Nitratos Iodetos Carbonatos FosfatosDocumento5 páginasReações Químicas de Precipitação: Sais Solubilidade Exceção Cloretos Sulfatos Nitratos Iodetos Carbonatos FosfatosAna Carolina TeixeiraAinda não há avaliações
- História do Estado Novo em PortugalDocumento16 páginasHistória do Estado Novo em PortugalAna Carolina TeixeiraAinda não há avaliações
- Reações de precipitação e tipos de dureza da águaDocumento2 páginasReações de precipitação e tipos de dureza da águaAna Carolina TeixeiraAinda não há avaliações
- Teste de Físico-Química sobre Reações Químicas e pHDocumento5 páginasTeste de Físico-Química sobre Reações Químicas e pHAna Carolina TeixeiraAinda não há avaliações
- Agrupamento de Escolas de Alcácer Do Sal Escola Secundária de Alcácer Do SalDocumento4 páginasAgrupamento de Escolas de Alcácer Do Sal Escola Secundária de Alcácer Do SalAna Carolina TeixeiraAinda não há avaliações
- Prova de Física e Química analisa conceitos de isótopos, moléculas e reaçõesDocumento6 páginasProva de Física e Química analisa conceitos de isótopos, moléculas e reaçõesdorinamendoncaAinda não há avaliações
- 2o Teste Fqa10acDocumento6 páginas2o Teste Fqa10acAna Carolina TeixeiraAinda não há avaliações
- Ficha de Simulação EEDocumento8 páginasFicha de Simulação EEAna Carolina TeixeiraAinda não há avaliações
- Processos de separação de misturasDocumento15 páginasProcessos de separação de misturasJoão Victor LimaAinda não há avaliações
- 1 Série Química TRILHA Semana11Documento1 página1 Série Química TRILHA Semana11Juvenal S. PereiraAinda não há avaliações
- EnsFundII Geografia 6ºano Slides Aula11Documento28 páginasEnsFundII Geografia 6ºano Slides Aula11Isabelly Alves Santos AlberghiniAinda não há avaliações
- Teoria cinético-corpuscular na explicação da matériaDocumento4 páginasTeoria cinético-corpuscular na explicação da matériaMário MontesAinda não há avaliações
- Fispq MIBCDocumento10 páginasFispq MIBCAndré BragaAinda não há avaliações
- Faculdade Pio Décimo: Geração de Energia Elétrica Notas de AulaDocumento174 páginasFaculdade Pio Décimo: Geração de Energia Elétrica Notas de AulaRaphael MendonçaAinda não há avaliações
- Gestão Urbana: Programa Jardineiro Da Cidade. Sarandi. ParanáDocumento60 páginasGestão Urbana: Programa Jardineiro Da Cidade. Sarandi. ParanáJorge VillalobosAinda não há avaliações
- Calor e mudança de fase: temperatura, calor latente e específicoDocumento15 páginasCalor e mudança de fase: temperatura, calor latente e específicoJoão Batista PereiraAinda não há avaliações
- PolietilenoDocumento29 páginasPolietilenojonasbonfimxavier6485Ainda não há avaliações
- Camadas Atmosfera Divisões TemperaturaDocumento9 páginasCamadas Atmosfera Divisões TemperaturaCASSIA CRISTIANE NICOLAU DE SOUSAAinda não há avaliações
- Análise energética de compressores alternativosDocumento20 páginasAnálise energética de compressores alternativosDurao SebastiaoAinda não há avaliações
- G2 FIS1033 v5 GabaritoDocumento4 páginasG2 FIS1033 v5 GabaritoLuís Alberto NogueiraAinda não há avaliações
- Detecção de exsudações de HCs por geobotânica e sensoriamento remotoDocumento16 páginasDetecção de exsudações de HCs por geobotânica e sensoriamento remotodanzetrindadeAinda não há avaliações
- Revisao - Simulado (5) - fiscaIIDocumento3 páginasRevisao - Simulado (5) - fiscaIIGabriel LaranjoAinda não há avaliações
- Tarefa 03Documento9 páginasTarefa 03glaybson glaybsonAinda não há avaliações
- Bacia Do ParnaíbaDocumento91 páginasBacia Do ParnaíbaAna Cristina Meirelles Quintanilha Coelho AnaAinda não há avaliações
- Propriedades e processos de areias de fundiçãoDocumento41 páginasPropriedades e processos de areias de fundiçãoFelipe ConceiçãoAinda não há avaliações
- Exercícios Propostos Quimica Primeira Parte PDFDocumento27 páginasExercícios Propostos Quimica Primeira Parte PDFFlavioAinda não há avaliações
- Efeito Fotoelétrico - Ótica e Princípios de Física Moderna - UninterrDocumento6 páginasEfeito Fotoelétrico - Ótica e Princípios de Física Moderna - UninterrCavalini Assessoria AcadêmicaAinda não há avaliações
- Gresart 2020 1585618872Documento139 páginasGresart 2020 1585618872pinxexoAinda não há avaliações
- Cálculo de sapata em concretoDocumento2 páginasCálculo de sapata em concretoEng Rodrigo FelixAinda não há avaliações
- Bases Fisicas (1) Inovação 1Documento50 páginasBases Fisicas (1) Inovação 1Leide AquinoAinda não há avaliações
- Manual Extra o Solvende 1601338841Documento104 páginasManual Extra o Solvende 1601338841Donizeti OliveiraAinda não há avaliações
- Teste BioGeo10Documento9 páginasTeste BioGeo10Anonymous dPwFX8TIBMAinda não há avaliações
- Os Megacristais de Selenite da Serra de Naica no MéxicoDocumento5 páginasOs Megacristais de Selenite da Serra de Naica no MéxicosenahjsAinda não há avaliações
- Os 6 biomas brasileiros e suas característicasDocumento3 páginasOs 6 biomas brasileiros e suas característicasnhbhbgAinda não há avaliações
- Biomas 1Documento19 páginasBiomas 1KAREN ALVESAinda não há avaliações
- METODOLOGIA para EvangelizarDocumento6 páginasMETODOLOGIA para EvangelizarapmaguiarAinda não há avaliações
- Exercícios - Estudo Dos Gases - 2 SérieDocumento9 páginasExercícios - Estudo Dos Gases - 2 SérieMara MouraAinda não há avaliações
- Simulado Origem Da VidaDocumento10 páginasSimulado Origem Da VidadjspytfireAinda não há avaliações