Escolar Documentos
Profissional Documentos
Cultura Documentos
A dualidade onda-partícula da luz e da matéria
Enviado por
Silesia0 notas0% acharam este documento útil (0 voto)
18 visualizações10 páginasTítulo original
dualidade Alessandra
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
18 visualizações10 páginasA dualidade onda-partícula da luz e da matéria
Enviado por
SilesiaDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
Você está na página 1de 10
A natureza ondulatória das partículas
A luz tem uma longa história a respeito de sua natureza corpuscular
ou ondulatória, desde a teoria corpuscular de Newton, até os
experimentos de Young, Fresnel, Fermat e outros. Com o advento das
Equações de Maxwell, provou-se que a onda era de fato uma onda
eletromagnética o que, por alguns anos, deu o assunto por encerrado.
Porém, alguns fenômenos observados experimentalmente não
podiam ser explicados com as leis do Eletromagnetismo. Era o caso da
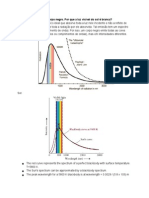
radiação de corpo negro: um metal, aquecido a temperaturas muito
elevadas que passava a emitir radiação em forma de luz. Quando a curva
da frequência da radiação emitida era levantada, tal dependência não
condizia com o previsto teoricamente. Foi Planck, um matemático, que
resolveu o problema assumindo que se a radiação fosse emitida
discretamente em forma de pacotes de energia (os quais ele chamou de
quanta), a curva teórica finalmente coincidia com a experimental, mesmo
admitindo não saber a razão. Outros experimentos, como o
espalhamento Compton, e o efeito fotoelétrico, também não podiam ser
explicados utilizando as leis do Eletromagnetismo. Foi então que
Einstein, brilhantemente, admitiu que Planck estava correto e que sim, a
luz possuía um aspecto corpuscular, que se sobressai durante a sua
interação com a matéria. Ele não só admitiu que Planck estava correto,
como utilizou seu argumento para resolver teoricamente o problema do
efeito fotoelétrico, trabalho este responsável por seu prêmio Nobel.
O que fato acontece com a luz é sua propagação é indiferente ao
tratamento que se faz enquanto onda ou partícula. Mesmo na interação
da luz com a matéria num nível macroscópico, a reflexão e a refração
pode ser obtida tratando-a como um campo eletromagnético e utilizando
condições de contorno na interface entre dois meios, e obter as
expressões para coeficientes de reflexão e refração. Mas é quando a luz
interage com a matéria num nível microscópico que seu aspecto
corpuscular é observado. Assim, a luz tem um comportamento duplo, se
revelando de maneira dual como onda e partícula. A relação de Planck
diz que um quantum de radiação luminosa (ou fóton) tem energia dada:
𝐸 = ℎ𝑓
Onde ℎ é a constante de Planck (ℎ = 6,63 ∙ 10−34 𝐽 ∙ 𝑠) e 𝑓 é a
frequência da radiação. A quantização da energia levou a resolver outras
questões, como as linhas espectrais do átomo de hidrogênio, mostrando
que energia de um átomo também se apresentava em níveis de energia
discretos, fato que levou ao modelo atômico de Bohr.
No modelo de Bohr, os elétrons da eletrosfera só podiam absorver
energia se esta energia fosse igual à diferença de energia entre dois
níveis permitidos. Se excitados por energia eletromagnética, então a
diferença de energia deveria ser igual ao do fóton incidente: ∆𝐸 = ℎ𝑓. De
forma semelhante, ao ir de um nível mais alto para um mais baixo, emitiria
radiação igual à do fóton absorvido. Os elétrons, por sua vez, por estarem
em movimento em torno do núcleo, Bohr assumiu que o momento angular
orbital os elétrons também deveriam ser quantizados. Em sua expressão:
𝑚𝑣𝑟 = 𝑛ℏ , onde ℏ = ℎ⁄2𝜋
A princípio, a dualidade onda-partícula estava relacionada apenas
à luz, mas um trabalho teórico feito por de Broglie deu início a outra
revolução, ao assumir que partículas também possuíam características
de onda. Os desdobramentos desse trabalho é o assunto deste texto.
Os Postulados de de Broglie: Em sua tese de doutorado, de
Broglie lançou uma ideia simples, porém extremamente importante, que
deu início à Mecânica Quântica. Como mencionado, a partir do conceito
do quantum de energia para a radiação eletromagnética, ficou claro que
as ondas poderiam, em certas ocasiões, se comportar como partícula.
Contudo, coube a de Broglie supor o contrário, que partículas sob certas
circunstâncias, poderiam apresentar um comportamento ondulatório.
Mesmo não havendo na época qualquer indício experimental de tal
comportamento, de Broglie supôs sua analogia diante do comportamento
dual da luz. Diante do seu argumento, as partículas poderiam sofrer, por
exemplo, difração e interferência, se os obstáculos fossem extremamente
pequenos, da ordem do comprimento de onda de matéria (chamadas por
ele de ondas piloto. O primeiro passo de sua teoria tratava de calcular o
comprimento de onda da matéria. Supondo que o comportamento dual
da matéria era de natureza quântica, assim como a luz, era natural supor
que este comprimento de onda fosse calculado da mesma maneira.
Lembrando que ara uma partícula relativística, a sua energia é dada por:
𝐸 2 = 𝑐 2 𝑝2 + (𝑚0 𝑐 2 )2
Para fóton (massa nula), tempos que 𝐸 = 𝑐𝑝, e como a energia
também é descrita por 𝐸 = ℎ𝑓, temos que:
𝑐
ℎ𝑓 = 𝑐𝑝 ⟹ ℎ = 𝑐𝑝
𝜆
ℎ
𝜆=
𝑝
Este comprimento de onda era muito pequeno para ser detectado
experimentalmente para uma partícula clássica. Por exemplo, ao calcular
o comprimento de onda de de Broglie para uma partícula de massa 10−6 𝑔
se movendo a uma velocidade de 10−6 𝑚/𝑠:
ℎ ℎ 6,63. 10−34 𝐽. 𝑠
𝜆= = = = 6,63. 10−19 𝑚
𝑝 𝑚𝑣 (10−9 𝑘𝑔)(10−6 𝑚/𝑠)
Em virtude de 𝜆 o ser muito menor que qualquer obstáculo possível
(cerca de 10 mil vezes menor que o núcleo de um átomo), seu caráter
ondulatório é impossível de ser detectado. Porém, para elétrons, é uma
realidade bastante possível. Imaginemos um elétron livre (carga 𝑒),
acelerado por uma diferença de potencial 𝑉 = 13,6 𝑉 (𝐸 = 13,6 𝑒𝑉). Sua
energia pode ser descrita como:
𝑝2
𝐸= = 𝑒𝑉 ⟹ 𝑝 = √2𝑚𝑒𝑉
2𝑚
ℎ ℎ 6,63 ∙ 10−34 𝐽 ∙ 𝑠
𝜆= = = ≈ 3,31 ∙ 10−10 𝑚
𝑝 √2𝑚𝑒𝑉 √(2 ∙ 9,1 ∙ 10−31 𝑘𝑔)(1,6 ∙ 10−19 𝐶 ∙ 13,6𝑉)
Um valor aproximadamente igual ao da primeira órbita de Bohr, ou
seja, aproximadamente do tamanho de um átomo. Ou seja, se fizermos
um feixe de elétrons, nesta voltagem, atravessar um cristal (onde as
posições são bem definidas), o espaçamento entre dois átomos vizinhos
funcionaria aproximadamente como uma fenda.
Verificação Experimental de Davisson e Germer: A descoberta
desses dois cientistas (e também de G.P. Thomson, filho de J.J. Thomson
do modelo atômico) se deu totalmente ao acaso, quando estudavam o
espalhamento de elétrons num alvo de níquel. Ao aquecer o alvo para
remover uma camada de oxidação, perceberam que o padrão dos
elétrons espalhados apresentava uma configuração de máximos e
mínimos dependente do ângulo 𝜃. Eles então descobriram que o alvo
tinha acidentalmente cristalizado e que estavam diante da difração de
elétrons. Eles então produziram um cristal de níquel e incidiram o feixe
no cristal novamente, e observaram o mesmo padrão. Na difração de
ondas, como por exemplo a luz de comprimento de onda 𝜆, a distância
entre mínimos consecutivos está ligada a abertura da fenda 𝑑 (no
experimento de fenda simples) através da expressão:
𝑛𝜆 = 𝑑 ∙ sen 𝜃
Assim, conhecendo a distância dos átomos de níquel no cristal, e
medindo os ângulos relacionados aos mínimos, chegaram ao valor de
𝜆 ≈ 1,65 ∙ 10−10 𝑚. No experimento original, Davisson e Germer usaram
um feixe com energia aproximada de 54 𝑒𝑉. De forma que:
ℎ ℎ 6,63 ∙ 10−34 𝐽 ∙ 𝑠
𝜆= = = ≈ 1,67 ∙ 10−10 𝑚
𝑝 √2𝑚𝑒𝑉 √(2 ∙ 9,1 ∙ 10−31 𝑘𝑔)(1,6 ∙ 10−19 𝐶 ∙ 54𝑉)
Concordando muito fortemente com os valores experimentais. Esse
experimento foi repetido diversas vezes, mudando a intensidade, o alvo,
e até mesmo outras partículas subatômicas (prótons e nêutrons), e em
todas as vezes, o comprimento de onda de de Broglie foi verificado com
precisão, validando sua teoria. Outra consequência da relação de Broglie
está relacionada à quantização do momento angular. Segundo o
postulado de Bohr, 𝑚𝑣𝑟 = 𝑛ℏ. Como 𝑝 = 𝑚𝑣, temos que:
ℎ ℎ
𝑟𝑝 = 𝑛ℏ ⟹ 𝑟=𝑛
𝜆 2𝜋
𝑛𝜆 = 2𝜋𝑟
A expressão anterior é equivalente à condição de uma onda
estacionária e 2𝜋𝑟 era a circunferência da órbita circular de Bohr. A
quantização das órbitas de Bohr, que levava aos níveis de energia,
estava ligada à existência de um número inteiro de ondas estacionárias
dos elétrons em torno do núcleo, que ao vibrar em frequências discretas,
geravam as energias vistas nos espectros de emissão e absorção de luz.
Dualidade Onda-Partícula: Imaginar que elétrons e outras
partículas apresentassem comportamento ondulatório era um tanto
contra-intuitivo, porém, essa estranheza surge do nosso entendimento
clássico do que são ondas e partículas. Neste caso, tanto a luz quanto os
elétrons e suas ondas são diferentes do clássico. Uma partícula clássica,
como uma bola de tênis, é localizada no tempo e no espaço com precisão
(especificando sua posição e velocidade), e troca energia com a matéria
aos pacotes, por meio de colisões. Uma onda clássica, no entanto,
transporta energia de forma contínua ao interagir com a matéria, uma vez
que sua energia está continuamente distribuída no tempo e no espaço.
Quando estudamos a luz, vemos que as ondas associadas não são
ondas clássicas, pois trocam energia aos pacotes, como uma partícula
clássica. Além disso, após de Broglie, elétrons e partículas subatômicas
não podem ser consideradas partículas clássicas, pois mesmo trocando
energia aos pacotes, não podem ser localizadas no tempo e no espaço
com precisão, pois não é possível determinar com precisão sua posição
e velocidade simultaneamente, como veremos a seguir. O fato de ondas
possuírem propriedades corpusculares e partículas terem propriedades
ondulatórias é chamado de dualidade onda-partícula.
Princípio da Incerteza: Vamos discutir uma consequência de
extrema importância dos postulados de de Broglie: o princípio da
incerteza de Heisenberg. Quando descrevemos o movimento de uma
partícula clássica, conseguimos determinar (considerando a precisão do
aparato) a velocidade e posição da partícula em qualquer instante. Por
exemplo, se iluminarmos a partícula enquanto ela se move, o padrão da
luz espalhada nos ajuda a determinar estas duas quantidades.
Obviamente, como vimos, a luz transfere momento para a partícula, mas
ele é tão pequeno em relação ao momento medido que podemos
considerar o momento da luz como uma perturbação desprezível.
Ao determinar a posição e momento de um elétron na órbita que
este faz em torno do núcleo, por exemplo, a situação é diferente. A
precisão da medida significa utilizar comprimentos de onda de radiação
muito pequenos (como raios-X). Como 𝑝 = ℎ⁄𝜆, essa radiação possui um
momento linear bastante elevado, que se transfere ao elétron mudando
a sua velocidade (às vezes até mesmo fazendo com que transitem para
orbitais mais elevados). Para diminuir este efeito, obviamente, teríamos
que reduzir 𝜆, ao custo de diminuir substancialmente a precisão na
medida da posição da partícula. Heisenberg formulou uma teoria
utilizando matrizes para classificar as quantidades observáveis e dela
extraiu que: é impossível determinar com precisão e de maneira
simultânea, a posição e o momento de uma partícula, de forma que, para
um movimento unidimensional na direção 𝑥, a incerteza nas medidas da
posição (∆𝑥) e do momento linear (∆𝑝𝑥 ) são inversamente proporcionais:
ℏ
∆𝑥 ∙ ∆𝑝𝑥 ≥
2
É possível ilustrar o princípio da incerteza utilizando como exemplo
um experimento de fenda simples que difrata um feixe de elétrons, todos
com mesma energia (e, portanto, 𝜆 = ℎ⁄𝑝). Esta configuração equivale a
de uma onda plana. A onda é difratada pela fenda (𝑎) e, num anteparo
distante, surgem o padrão de máximos e mínimos (interpretado como
uma incerteza completa na determinação da posição do elétron). O
primeiro mínimo de difração (defletido de 𝜃) é representado por sin 𝜃 =
𝜆⁄𝑎 . Classicamente, é esperado que a posição do elétron (se ele for uma
partícula clássica) que ele se encontre numa região determinada pela
abertura da fenda, ou seja, que ∆𝑦 = 𝑎. Obviamente, pela difração, o pico
central é mais largo que a abertura da fenda. Isso pode ser interpretado
como uma deflexão na velocidade do elétron, ou seja, gerando uma
imprecisão do seu momento na direção 𝑦 (paralela ao anteparo). Assim:
∆𝑝𝑦 = 𝑝 ∙ sin 𝜃
De forma que o produto destas incertezas é:
𝜆 ℎ
∆𝑦 ∙ ∆𝑝𝑦 = 𝑎 ∙ 𝑝 ∙ sin 𝜃 = ∙ ∙ sin 𝜃
sin 𝜃 𝜆
∆𝑦 ∙ ∆𝑝𝑦 = ℎ
Ou seja, como ℎ é uma constante, aumentar a precisão na medida
da posição (diminuir ∆𝑦) tem como consequência diminuir a precisão na
medida do momento (aumenta ∆𝑝𝑦 ), e tal consequência decorre apenas
quando consideramos que o elétron se comporta como uma onda, pelo
princípio de de Broglie. Percebemos então que, no mundo subatômico,
as leis da Mecânica Clássica não são mais suficientes para descrever os
movimentos das partículas, sendo então necessário outro formalismo.
Todas as evidências observadas experimentalmente, desde o efeito
fotoelétrico até os postulados de de Broglie culminaram na aceitação da
dualidade onda-partícula, que alimentaram os esforços de Heisenberg e
Schrödinger em estabelecer um conjunto de relações que descrevessem
o movimento destas partículas (ou ondas), assim como as Leis de
Newton levam às equações de movimento na Mecânica Clássica.
A versão de Schrödinger para a Mecânica Quântica: Outra
teoria para prever o movimento de uma partícula foi desenvolvida por
Schrödinger. Seu formalismo, que culminava na famosa equação de
Schrödinger, descreve a função de onda de probabilidade de encontrar
uma partícula numa certa posição e tempo. Curiosamente, o formalismo
de Schrödinger leva aos mesmos resultados do formalismo matricial de
Heisenberg, inclusive culminando no mesmo princípio da incerteza,
tornando-os totalmente equivalentes. A demonstração que leva a
equação de Schrödinger foge dos objetivos atuais, mas podemos
anuncia-la e mostrar que estão em perfeito acordo com as relações de
de Broglie, estados estacionários, e etc.
Por estarmos lidando com ondas ligadas a partículas, precisamos
de uma função de onda da qual possamos extrair as propriedades
mensuráveis de uma partícula (posição, momento, energia, etc.).
Schrödinger utilizou funções de onda de probabilidade como sendo
funções quadrado-integráveis do espaço de Hilbert, representadas por
Ψ(𝑥, 𝑦, 𝑧, 𝑡) = 𝜓(𝑥, 𝑦, 𝑧)𝜙(𝑡). A lógica é a mesma da difração, em que a
intensidade da luz num ponto, proporcional a 𝐸 2 (𝑥, 𝑦, 𝑧), é uma medida
da probabilidade de um fóton atingir aquele ponto. Assim, |Ψ(𝑥, 𝑦, 𝑧, 𝑡)|2
é a densidade de probabilidade uma partícula ter coordenadas (𝑥, 𝑦, 𝑧, 𝑡).
Esta função deve ter algumas propriedades, como a normalização:
∞
∫ |𝜓(𝑥, 𝑦, 𝑧)|2 𝑑𝑉 = 1
−∞
Isto por que a probabilidade de encontrar a partícula em qualquer
ponto do espaço deve ser igual a 1. Outra propriedade são os estados
estacionários. Da forma como está escrita, a probabilidade de encontrar
uma partícula num ponto (𝑥, 𝑦, 𝑧) varia no tempo. Porém, existe um
conjunto de funções que são chamados de estados estacionários, onde
a a probabilidade de encontrar uma partícula num ponto (𝑥, 𝑦, 𝑧) não varia
no tempo. Eles podem ser escritos como:
Ψ(𝑥, 𝑦, 𝑧, 𝑡) = 𝜓(𝑥, 𝑦, 𝑧)𝑒 −𝑖𝐸𝑡/ℏ
Desta forma, a densidade de probabilidade é:
2
|Ψ(𝑥, 𝑦, 𝑧, 𝑡)|2 = |𝜓(𝑥, 𝑦, 𝑧)𝑒 −𝑖𝐸𝑡/ℏ | = 𝜓(𝑥, 𝑦, 𝑧)𝑒 −𝑖𝐸𝑡/ℏ ∙ 𝜓 ∗ (𝑥, 𝑦, 𝑧)𝑒 𝑖𝐸𝑡/ℏ
|Ψ(𝑥, 𝑦, 𝑧, 𝑡)|2 = |𝜓(𝑥, 𝑦, 𝑧)|2
Onde 𝜓∗ (𝑥, 𝑦, 𝑧) é o complexo conjugado da função 𝜓. Esses
estados têm energia fixa (constante), como veremos mais adiante. O que
é importante saber é que, embora os estados estacionários pareçam
casos especiais, podemos combinar suas funções de onda para
encontrar qualquer estado possível, ou seja, elas formam uma base, da
mesma forma que as ondas estacionárias numa corda podem ser
combinadas para descrever qualquer função periódica. Assim, estados
estacionários são de extrema importância na Mecânica Quântica.
Estamos agora habilitados para estudar a equação de Schrödinger.
Tomemos uma partícula, com função de onda Ψ(𝑥, 𝑡), se movendo
apenas em uma dimensão. Digamos que, nesse espaço, ela esteja
sujeita a um potencial 𝑈(𝑥) ligado a uma força conservativa. A equação
de Schrödinger relaciona estas quantidades de tal forma que:
ℏ2 𝜕 2 𝜕
− Ψ(𝑥, 𝑡) + 𝑈(𝑥)Ψ(𝑥, 𝑡) = 𝑖ℏ Ψ(𝑥, 𝑡)
2𝑚 𝜕𝑥 2 𝜕𝑡
Percebemos que, para estados estacionários:
𝜕 𝜕
𝑖ℏ Ψ(𝑥, 𝑡) = 𝑖ℏ (𝑒 −𝑖𝐸𝑡/ℏ ) = 𝐸𝜓𝑒 −𝑖𝐸𝑡/ℏ
𝜕𝑡 𝜕𝑡
Assim:
ℏ2 𝜕 2 𝜓
− + 𝑈𝜓 = 𝐸𝜓
2𝑚 𝜕𝑥 2
Onde o próximo passo envolve encontrar a parte espacial da função
de onda. Para isto, precisamos especificar 𝑈(𝑥), que obviamente será
diferente para cada problema. Por exemplo, para uma partícula livre
(𝑈(𝑥) = 0), temos:
ℏ2 𝜕 2 𝜓
− = 𝐸𝜓
2𝑚 𝜕𝑥 2
Neste caso, uma possível solução é 𝜓(𝑥) = 𝐴𝑒 𝑖𝑘𝑥 , e assim:
ℏ2 𝜕 2
− 𝐴𝑒 𝑖𝑘𝑥 = 𝐸𝐴𝑒 𝑖𝑘𝑥
2𝑚 𝜕𝑥 2
ℏ2 𝑘 2 𝑖𝑘𝑥
𝐴𝑒 = 𝐸𝐴𝑒 𝑖𝑘𝑥
2𝑚
ℏ2 𝑘 2 (ℎ⁄2𝜋 ∙ 2𝜋⁄𝜆) (ℎ⁄𝜆)2
2
𝑝2
𝐸= = = =
2𝑚 2𝑚 2𝑚 2𝑚
Que nada mais é que a energia de uma partícula livre quando se
admite a relação de de Broglie. Ao desenvolver sua teoria, Schrödinger
aplicou-a para descrever uma série de problemas já conhecidos, como
obter os níveis de energia de um átomo de Hidrogênio e um oscilador
harmônico. Os resultados era extremamente próximos dos níveis de
energia obtidos por Bohr, e quase que os mesmos níveis de energia de
um oscilador harmônico admitidos por Planck e Einstein para explicar a
radiação de corpo negro. Assim, a equação de Schrödinger tem diversas
comprovações experimentais e aplicações, tornando a Mecânica
Quântica um campo de pesquisa extremamente ativo até os dias atuais.
Você também pode gostar
- Corpo negro, efeito fotoelétrico e quantização da energiaDocumento8 páginasCorpo negro, efeito fotoelétrico e quantização da energiaroger_meloAinda não há avaliações
- Física Moderna: Dualidade Onda-Partícula e Princípio de IncertezaDocumento10 páginasFísica Moderna: Dualidade Onda-Partícula e Princípio de IncertezaJoão Ricardo Quintal QuintalAinda não há avaliações
- Modelo Atômico de Bohr e Dualidade do ElétronDocumento3 páginasModelo Atômico de Bohr e Dualidade do ElétronJulia AquinoAinda não há avaliações
- Física PPT - Século XXDocumento30 páginasFísica PPT - Século XXFísica PPT100% (2)
- Modelo atómico de BohrDocumento23 páginasModelo atómico de BohrJerónimo LourençoAinda não há avaliações
- Química Geral e Inorgânica: Estrutura Atômica, Ligações e ReaçõesDocumento36 páginasQuímica Geral e Inorgânica: Estrutura Atômica, Ligações e ReaçõesGuilherme De Souza MoraisAinda não há avaliações
- Modelo atômico da mecânica quânticaDocumento18 páginasModelo atômico da mecânica quânticaRafael Tobias Canalobuana CanalobuanaAinda não há avaliações
- UntitledDocumento14 páginasUntitledVeve'h SantosAinda não há avaliações
- Dualidade Da Luz - LeituraDocumento2 páginasDualidade Da Luz - LeituraGuilherme ZidiottiAinda não há avaliações
- Quimica Geral - ResumoDocumento5 páginasQuimica Geral - ResumoAndrew GamaAinda não há avaliações
- Aula 4 Quimica Fundamental 2019 31Documento36 páginasAula 4 Quimica Fundamental 2019 31HADASSA MENDESAinda não há avaliações
- Capítulo 1 FANDocumento12 páginasCapítulo 1 FANmeujael28Ainda não há avaliações
- Física Quântica - 2021.3 - QS - Lista 4 - Tema: Uma Nova Interpretação Da Matéria (Dualidade Onda-Partícula) GabaritoDocumento6 páginasFísica Quântica - 2021.3 - QS - Lista 4 - Tema: Uma Nova Interpretação Da Matéria (Dualidade Onda-Partícula) GabaritoAndre Luiz CostaAinda não há avaliações
- Fisica Sec XXDocumento30 páginasFisica Sec XXLuiz Gabriel Brésio De LimaAinda não há avaliações
- A Física do século XX e as duas pequenas nuvensDocumento30 páginasA Física do século XX e as duas pequenas nuvenstjmigoto@hotmail.comAinda não há avaliações
- Teoria AtômicaDocumento38 páginasTeoria AtômicaMarcelle FelicianoAinda não há avaliações
- INTRODUÇÃO À FÍSICA MODERNADocumento36 páginasINTRODUÇÃO À FÍSICA MODERNAMarcos Vinicius Dos SantosAinda não há avaliações
- Modelos AtômicosDocumento76 páginasModelos AtômicosBreno Monteiro Dos Santos100% (1)
- Dualidade Da Natureza Do ElétronDocumento14 páginasDualidade Da Natureza Do ElétronPauloVidalAinda não há avaliações
- Eletromagnetismo No ÉterDocumento16 páginasEletromagnetismo No ÉterRodrigo VenturaAinda não há avaliações
- Teoria da Dualidade Onda-PartículaDocumento5 páginasTeoria da Dualidade Onda-PartículaGustavo LopesAinda não há avaliações
- A física moderna e a constante de PlanckDocumento5 páginasA física moderna e a constante de PlanckJason LorranAinda não há avaliações
- Modelos Atômicos e Estrutura Da MatériaDocumento53 páginasModelos Atômicos e Estrutura Da MatériaCamila Paiva100% (1)
- Lista de Física Moderna - Efeitos Fotoelétrico e Dualidade Onda-PartículaDocumento4 páginasLista de Física Moderna - Efeitos Fotoelétrico e Dualidade Onda-PartículaLUCIANO LUZ ANGELUCIAinda não há avaliações
- O Experimento de Franck-Hertz que comprovou a quantização de energia nos átomosDocumento24 páginasO Experimento de Franck-Hertz que comprovou a quantização de energia nos átomosThaisa UzanAinda não há avaliações
- Física Quântica e Espiritualidade - Aula 1Documento11 páginasFísica Quântica e Espiritualidade - Aula 1Roberto Brandão Vargas Júnior100% (1)
- Física Moderna I - Tema 2Documento37 páginasFísica Moderna I - Tema 2Francisco Rodrigo Oliveira de SousaAinda não há avaliações
- Aula 3Documento50 páginasAula 3Levi SantosAinda não há avaliações
- A Estrutura do Átomo: da descoberta aos modelos atuaisDocumento4 páginasA Estrutura do Átomo: da descoberta aos modelos atuaisMaria Gabriela CarraAinda não há avaliações
- Resumo de Química Geral IDocumento20 páginasResumo de Química Geral IAna Paula Do NascimentoAinda não há avaliações
- Aula 6 Quimica Geral I 2017 Ultima VersãoDocumento20 páginasAula 6 Quimica Geral I 2017 Ultima VersãoJessica CostaAinda não há avaliações
- O modelo atômico de Rutherford e a descoberta do núcleo atômicoDocumento4 páginasO modelo atômico de Rutherford e a descoberta do núcleo atômicofabianammbarbosaAinda não há avaliações
- Dualidade Onda-CorpúsculoDocumento4 páginasDualidade Onda-CorpúsculoRtyu IuytAinda não há avaliações
- Resumo de Química InorgânicaDocumento8 páginasResumo de Química InorgânicaMarcelle Lipman100% (1)
- Quantica Lista5Documento2 páginasQuantica Lista5Ana Luiza ValleAinda não há avaliações
- Evolução Dos Modelos AtômicosDocumento41 páginasEvolução Dos Modelos Atômicosthalescristiano756Ainda não há avaliações
- Anotações Capitulo 1 Introduction To Elementary Particles GriffithsDocumento3 páginasAnotações Capitulo 1 Introduction To Elementary Particles GriffithsangieAinda não há avaliações
- Estrutura Atômica e Evolução dos Modelos AtômicosDocumento30 páginasEstrutura Atômica e Evolução dos Modelos AtômicosRaiplayG10 []Ainda não há avaliações
- Aula Pratica 2 AlexDocumento11 páginasAula Pratica 2 AlexAlexandre GuilundoAinda não há avaliações
- Fundamentos Do Modelo Atômico AtualDocumento4 páginasFundamentos Do Modelo Atômico AtualClaudio BariquelloAinda não há avaliações
- Ap 1 2023 Evolução Dos Modelos Atômicos PDFDocumento7 páginasAp 1 2023 Evolução Dos Modelos Atômicos PDFbeatrizmenezes8756Ainda não há avaliações
- 1 Série Química TRILHA Semana14Documento1 página1 Série Química TRILHA Semana14Juvenal S. PereiraAinda não há avaliações
- Dualidade Onda-Partícula ElétronsDocumento8 páginasDualidade Onda-Partícula ElétronsMARCOS PESSOA PINTOAinda não há avaliações
- Dicas sobre a advento da fisica moderna e experimentos chaveDocumento1 páginaDicas sobre a advento da fisica moderna e experimentos chaveCaroline LisevskiAinda não há avaliações
- Seminário Mecânica QuânticaDocumento26 páginasSeminário Mecânica QuânticaAlvaro Rolim Guerra100% (1)
- FQ RevisaoDocumento23 páginasFQ RevisaoVanessa SoaresAinda não há avaliações
- Teoria das cordas: um modelo físico onde partículas são cordas vibrantesDocumento11 páginasTeoria das cordas: um modelo físico onde partículas são cordas vibrantesJowie Fatony marcos runeyAinda não há avaliações
- Trabalho Química Geral - Evolução Dos Modelos AtômicosDocumento11 páginasTrabalho Química Geral - Evolução Dos Modelos AtômicosCarlos FerreiraAinda não há avaliações
- Ver 2Documento28 páginasVer 2Jason Jerry Atoche MedranoAinda não há avaliações
- Estrutura Atomica e Propriedades PeriodicasDocumento28 páginasEstrutura Atomica e Propriedades Periodicasbeatriz cisterAinda não há avaliações
- Física ModernaDocumento8 páginasFísica Modernaadenilza silva100% (1)
- Resumo - Estrutura Da MatériaDocumento5 páginasResumo - Estrutura Da Matériadouglas0707Ainda não há avaliações
- QUIMICADocumento11 páginasQUIMICAThiago TavaresAinda não há avaliações
- Dualidade WilianDocumento8 páginasDualidade WilianSilesiaAinda não há avaliações
- VoltameriaDocumento177 páginasVoltameriaSilesiaAinda não há avaliações
- Transistores de CampoDocumento2 páginasTransistores de CampoSilesiaAinda não há avaliações
- MosfetDocumento204 páginasMosfetSilesiaAinda não há avaliações
- Materias FerroeletricosDocumento61 páginasMaterias FerroeletricosSilesiaAinda não há avaliações
- Ef12 Questao Aula 4Documento5 páginasEf12 Questao Aula 4gorete71Ainda não há avaliações
- Revisões Matemática 5o AnoDocumento10 páginasRevisões Matemática 5o AnoanamariasmAinda não há avaliações
- Radioatividade: Victor Hugo - GuzinDocumento72 páginasRadioatividade: Victor Hugo - GuzinYasminAinda não há avaliações
- Pratica ExperimentalDocumento9 páginasPratica ExperimentalNatalia RibeiroAinda não há avaliações
- Proj. Rec. 3ºano EM 2º Tri - FÍSICA PDFDocumento4 páginasProj. Rec. 3ºano EM 2º Tri - FÍSICA PDFHelio Duval de OliveiraAinda não há avaliações
- Sec Long Sec ItsDocumento4 páginasSec Long Sec ItsKaina PortoAinda não há avaliações
- Texto OndulatóriaDocumento3 páginasTexto OndulatóriaKátia Guimarães BenfícaAinda não há avaliações
- Campo Elétrico: Cargas Pontuais, Dipolos e DistribuiçõesDocumento2 páginasCampo Elétrico: Cargas Pontuais, Dipolos e DistribuiçõesJorge Manhepe50% (2)
- Lista III - Trigonometria No Triângulo RetânguloDocumento2 páginasLista III - Trigonometria No Triângulo RetânguloSuzy Vasconcelos Pereira Menezes0% (1)
- Fundamentos de Física ModernaDocumento1 páginaFundamentos de Física ModernaPereiraAinda não há avaliações
- Ficha N º3 - M4 e M5 - Aaaaaaaaaaaaaaaaaaaaaaa Ficha N º3 - M4 e M5 - AaaaaaaaaaaaaaaaaaaaaaaDocumento6 páginasFicha N º3 - M4 e M5 - Aaaaaaaaaaaaaaaaaaaaaaa Ficha N º3 - M4 e M5 - Aaaaaaaaaaaaaaaaaaaaaaatiagogp1024Ainda não há avaliações
- Eletromagnetismo OBCDocumento4 páginasEletromagnetismo OBCSophia MarquesAinda não há avaliações
- Estrutura Atômica e Distribuição EletrônicaDocumento22 páginasEstrutura Atômica e Distribuição EletrônicaClaiver CoelhoAinda não há avaliações
- Triângulos semelhantes: lados e razão de semelhançaDocumento41 páginasTriângulos semelhantes: lados e razão de semelhançaSoso MuitasAinda não há avaliações
- Revisão de Simulado com Questões sobre Partículas SubatômicasDocumento3 páginasRevisão de Simulado com Questões sobre Partículas SubatômicasMario Damião R. Domingos100% (1)
- Resumo P2 EDODocumento2 páginasResumo P2 EDONatanael MatiasAinda não há avaliações
- Química Geral I - Aula 14 - Décima Quarta Lista de Exercícios - GabaritoDocumento10 páginasQuímica Geral I - Aula 14 - Décima Quarta Lista de Exercícios - GabaritoJ O E LAinda não há avaliações
- Zatox FisicaDocumento57 páginasZatox FisicaJorge CambindaAinda não há avaliações
- 05-03 - M+V - Lista 2 - Campo ElétricoDocumento5 páginas05-03 - M+V - Lista 2 - Campo ElétricoArthur GarciaAinda não há avaliações
- Aula 3 - Espectroscopia de FRXDocumento55 páginasAula 3 - Espectroscopia de FRXJeferson Matias MartinsAinda não há avaliações
- Dosimetria de Raio X: Fundamentos e AplicaçõesDocumento5 páginasDosimetria de Raio X: Fundamentos e AplicaçõesVeve'h SantosAinda não há avaliações
- Lista Revisão P1 - Fen. Eletromagnéticos V2.0Documento5 páginasLista Revisão P1 - Fen. Eletromagnéticos V2.0Adriano DinizAinda não há avaliações
- Ava 7Documento120 páginasAva 7RodrigoAinda não há avaliações
- 2 Ee - Física 2 - 2020 1Documento3 páginas2 Ee - Física 2 - 2020 1Kássia RodriguesAinda não há avaliações
- Lista de Execicios Resolvidos Aula 1 PDFDocumento10 páginasLista de Execicios Resolvidos Aula 1 PDFpaulorjrAinda não há avaliações
- Ensaio de partículas magnéticas para relatório de inspeçãoDocumento1 páginaEnsaio de partículas magnéticas para relatório de inspeçãoWesley Marcos de PaulaAinda não há avaliações
- Avaliação de Química sobre Modelos AtômicosDocumento2 páginasAvaliação de Química sobre Modelos AtômicosThiagoMelloAinda não há avaliações