Escolar Documentos
Profissional Documentos
Cultura Documentos
QQD22 011 - Eletroquímica
Enviado por
cara de sapoDescrição original:
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
QQD22 011 - Eletroquímica
Enviado por
cara de sapoDireitos autorais:
Formatos disponíveis
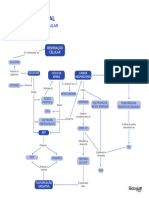
P IL H A
PROCESSO ESPONTÂNEO O QUE É
Ramo da Química que estuda o
fenômeno da transferência de elétrons
para transformar energia química em
ELETRÓLISE
energia elétrica ou energia elétrica
REDUÇÃO OXIDAÇÃO em energia química
Acontece no Cátodo Acontece no Ânodo REDUÇÃO OXIDAÇÃO
Polo negativo acontece no cátodo
Polo positivo acontece no ânodo
PILHA polo positivo
- 0 0 2+ 2e - ENERGIA polo negativo
2+
Cu(aq) + 2e Cu(s) Zn(s) + Zn(aq) ENERGIA
QUÍMICA
ELÉTRICA
ELETRÓLISE
ÍGNEA AQUOSA
acontece na presença de água
e - e -
acontece sem a presença de água
Exemplos:
Exemplos:
Dissolução
Fusão
2NaCl(aq) + -
2Na(aq) + 2Cl(aq)
ELETROQUÍMICA
Cu ponte Zn + -
2NaCl(s) 2Na(l) + 2Cl(l)
salina
Autoionização da água
Zn 2+ Semirreação de oxidação
2H20(l) + -
2H(aq) + 2OH(aq)
2Cl - -
2e + 2Cl2(l)
Cu 2+ (l)
Zn 2+
SO42+ Semirreação de redução
SO
2+ Zn 2+
4
Semirreação de redução +
2H(aq) + 2e- 2H2(s)
DIFER E N Ç A D E P O T E N C I A L METAL DE Metal que irá sofrer
oxidação no lugar de outro
+
2Na(l) + 2e- 2Na(s)
Semirreação de oxidação
SACRIFÍCIO
deverá apresentar um maior -
potencial de oxidação do que 2Cl -
2e + 2Cl2(g)
(aq)
o metal que você quer proteger
ou
DDP = Ered + Eoxi
0 0
ORDEM D E P R I O R I D A D E
Semirreação Potencial padrão
de redução de redução
) + ( E ) 0 CÁTION ÂNION
( E
0
DDP = red maior red menor Mg + 2e
2+ -
Mg - 2,37 V
Metais alcalinos Demais Oxigenados Demais
Zn + 2e
2+ -
Zn - 0,76 V H +
Cátions OH -
terrosos e Al 3+
eF -
Ânions
DDP = Eoxi + Ered =
0
+ 0 ,7
0
6 + 0 ,3 4 = + 1 ,1 0 V
Cu + 2e
2+ -
Cu + 0,34 V
Ponte Salina
Balancear as cargas K + e
+ -
K - 2,92 V
Você também pode gostar
- Flanges Conforme Normas ANSI DIN ISO e NBRDocumento23 páginasFlanges Conforme Normas ANSI DIN ISO e NBRKassioRodrigues75% (4)
- Ligações QuímicasDocumento21 páginasLigações QuímicasConsp100% (1)
- Estudo Dirigido - Sistemas de Informações GerenciaisDocumento19 páginasEstudo Dirigido - Sistemas de Informações GerenciaisJoão NicoliniAinda não há avaliações
- Planejamento Arca de NoéDocumento6 páginasPlanejamento Arca de NoéMárcia LirmanAinda não há avaliações
- Código de Conduta BayerDocumento10 páginasCódigo de Conduta BayerLuis ReisAinda não há avaliações
- RelatorioDocumento1 páginaRelatorioPedro LunaAinda não há avaliações
- ALENCASTRODocumento51 páginasALENCASTRONathi Feitosa100% (1)
- 9852 2728 06b Operator's Instructions FlexiROC T35, T40Documento144 páginas9852 2728 06b Operator's Instructions FlexiROC T35, T40Marcelo Farias100% (1)
- Guiao-Gigante Egoista Porto EditoraDocumento6 páginasGuiao-Gigante Egoista Porto EditoraDaniela BejaAinda não há avaliações
- Simulado de Pedagogia para Concursos 2023Documento4 páginasSimulado de Pedagogia para Concursos 2023José Gonçalves100% (2)
- Eletrodinamica E1642170838Documento89 páginasEletrodinamica E1642170838Geiziane GonçalvesAinda não há avaliações
- Apostila Eletrólise 2020 REVISADA PDFDocumento25 páginasApostila Eletrólise 2020 REVISADA PDFWillyan SouzaAinda não há avaliações
- Tabelas EquipamentosDocumento3 páginasTabelas EquipamentosmariAinda não há avaliações
- ELECTROQUÍMICA - Katia - GabrielDocumento46 páginasELECTROQUÍMICA - Katia - GabrielMarciaAinda não há avaliações
- Tabela de Reembolso Sulamerica Odonto PDFDocumento7 páginasTabela de Reembolso Sulamerica Odonto PDFRogério AraújoAinda não há avaliações
- 2023 - ELETRÓLISE - Apresentação 1Documento96 páginas2023 - ELETRÓLISE - Apresentação 1Arttoday ;bAinda não há avaliações
- Ligacrores Quirmicas Iornicas e Covalentes para Alunos 28052019Documento15 páginasLigacrores Quirmicas Iornicas e Covalentes para Alunos 28052019joao frotaAinda não há avaliações
- Eletronicos PDFDocumento16 páginasEletronicos PDFEricsson Dos SantosAinda não há avaliações
- Em Que Ocorre Pode Ser Que Produz: Polícia Militar de Minas GeraisDocumento3 páginasEm Que Ocorre Pode Ser Que Produz: Polícia Militar de Minas GeraisAdielson MonteiroAinda não há avaliações
- Atividade EAPDocumento1 páginaAtividade EAPJuliana SouzaAinda não há avaliações
- Material para Exaustor Moldara II.Documento1 páginaMaterial para Exaustor Moldara II.Arnaldo RosaAinda não há avaliações
- Ligações QuímicasDocumento29 páginasLigações QuímicasNathan SouzaAinda não há avaliações
- Roteiro de Estudos 28 Química 2QB Fís Quím PedroDocumento3 páginasRoteiro de Estudos 28 Química 2QB Fís Quím Pedroleticia.blanco2014Ainda não há avaliações
- 6 EletroquimicaDocumento43 páginas6 EletroquimicaGleison Paulino GonçalvesAinda não há avaliações
- 12 EletroquimicaDocumento2 páginas12 EletroquimicaPaulo BotêsAinda não há avaliações
- 1 - Eletroquimica Revisão 2008-2009Documento19 páginas1 - Eletroquimica Revisão 2008-2009Christianne G. RodriguesAinda não há avaliações
- Juntados Renan RibeiroDocumento11 páginasJuntados Renan RibeiroKarine Silva Sdrill do BrasilAinda não há avaliações
- Eletroquímica (Pilhas - Parte II) .PPTMDocumento16 páginasEletroquímica (Pilhas - Parte II) .PPTMWesley RodriguesAinda não há avaliações
- Serviços Pendentes Iluminação, Sistema de Incendio e Amonia.Documento13 páginasServiços Pendentes Iluminação, Sistema de Incendio e Amonia.Ezequiel MedeirosAinda não há avaliações
- Tabela de Cargas - ResidencialDocumento1 páginaTabela de Cargas - ResidencialtheresaAinda não há avaliações
- Cap Vi Electroquímica - Katia - GabrielDocumento71 páginasCap Vi Electroquímica - Katia - GabrielHelder SoaresAinda não há avaliações
- UntitledDocumento36 páginasUntitledCézarCavalcanteAinda não há avaliações
- Controle de Inspeção - Itens Içamento GeralDocumento24 páginasControle de Inspeção - Itens Içamento GeralCarol CastroAinda não há avaliações
- Orçamento ParamétricoDocumento1 páginaOrçamento Paramétricosabrina andradeAinda não há avaliações
- Eletrólise ÍgneaDocumento4 páginasEletrólise ÍgneaJulia DieringsAinda não há avaliações
- Manual CLAMPER Solar SB 1040V 2E - 2S P18Documento10 páginasManual CLAMPER Solar SB 1040V 2E - 2S P18DiogoAinda não há avaliações
- 2021 - EnsMédio - Química - 2 Série - Slides - Aula 26Documento30 páginas2021 - EnsMédio - Química - 2 Série - Slides - Aula 26Francisco FlorencioAinda não há avaliações
- Revisão Enem 2020 - Sílvio RomeroDocumento50 páginasRevisão Enem 2020 - Sílvio RomeroTHIAGO DE CARVALHO MENEZESAinda não há avaliações
- Potencial Das PilhasDocumento35 páginasPotencial Das PilhasPablo Sergio Dos SantosAinda não há avaliações
- Fundamentos Da EletrodeposicaoDocumento28 páginasFundamentos Da Eletrodeposicaorafaelmiguez0% (1)
- Ecologia - EcossistemaDocumento1 páginaEcologia - EcossistemaThiago FiladelfoAinda não há avaliações
- Célula Galvânica IIDocumento32 páginasCélula Galvânica IIsae1973Ainda não há avaliações
- Manuel Gomes LourencoDocumento16 páginasManuel Gomes LourencoMiguel LourençoAinda não há avaliações
- Catálogo Kauai 2020Documento6 páginasCatálogo Kauai 2020Goyaz AcessoriosAinda não há avaliações
- EletroquimicaDocumento20 páginasEletroquimicanicoleAinda não há avaliações
- Apostila Eletrólise 2020 REVISADA PDFDocumento25 páginasApostila Eletrólise 2020 REVISADA PDFWillyan SouzaAinda não há avaliações
- 3346-Mapa - Respiração CelularDocumento1 página3346-Mapa - Respiração CelularRênisson KalinoAinda não há avaliações
- Eletroquímica - Profº Agamenon RobertoDocumento17 páginasEletroquímica - Profº Agamenon Robertocb_penatrujilloAinda não há avaliações
- Material Prominp Tratamento de SuperficiesDocumento166 páginasMaterial Prominp Tratamento de SuperficiesPriscilla Kelly Freitas dos SantosAinda não há avaliações
- Apostila de PecDocumento120 páginasApostila de PecRoger SaléAinda não há avaliações
- Catálogo EmicolDocumento16 páginasCatálogo EmicolBreno Sousa100% (3)
- Nuos 200 - 250 - 250 SysDocumento1 páginaNuos 200 - 250 - 250 SysCristina MarquesAinda não há avaliações
- Resultado Final - MCSD EN A4+ Geradores - 1 - 1Documento4 páginasResultado Final - MCSD EN A4+ Geradores - 1 - 1Anonymous f3ksmNzAinda não há avaliações
- Turmadeagosto Química Eletroquímica Eletrólise 14-10-2022Documento15 páginasTurmadeagosto Química Eletroquímica Eletrólise 14-10-2022lucasgoudardAinda não há avaliações
- 9 PDFDocumento1 página9 PDFjoao domingosAinda não há avaliações
- ELetronicaDocumento57 páginasELetronicaJaqueline BeserraAinda não há avaliações
- Trabalho de Física e QuímicaDocumento5 páginasTrabalho de Física e QuímicaMatheus TarginoAinda não há avaliações
- ELETROLISEDocumento12 páginasELETROLISENei SilvaAinda não há avaliações
- Química - Pré-Vestibular7 - Ligações QuímicasDocumento3 páginasQuímica - Pré-Vestibular7 - Ligações QuímicasCiencias PPT100% (3)
- Tabela de Serviços FotovoltaicosDocumento1 páginaTabela de Serviços FotovoltaicosArnnor RochaAinda não há avaliações
- PIRATA11Documento6 páginasPIRATA11rejane silva100% (1)
- Tabelão Outubro 2022Documento1 páginaTabelão Outubro 2022Jose Aldo Campos AlvesAinda não há avaliações
- Último Relatorio fqx2Documento7 páginasÚltimo Relatorio fqx2mariaclaraasantiago1Ainda não há avaliações
- Cx220b Escavadeira Hidráulica (09!01!2008) (Brasil)Documento3 páginasCx220b Escavadeira Hidráulica (09!01!2008) (Brasil)carlosAinda não há avaliações
- Trabalho InglêsDocumento7 páginasTrabalho Inglêscara de sapoAinda não há avaliações
- A WOMAN's PlaceDocumento2 páginasA WOMAN's Placecara de sapoAinda não há avaliações
- Sisu2022 Notas de Corte 2021Documento1 páginaSisu2022 Notas de Corte 2021cara de sapoAinda não há avaliações
- Revista de Cabelo - 2023Documento1 páginaRevista de Cabelo - 2023cara de sapoAinda não há avaliações
- O Continente AmericanoDocumento29 páginasO Continente Americanocara de sapoAinda não há avaliações
- Mais Exercícios Sobre Análise CombinatóriaDocumento2 páginasMais Exercícios Sobre Análise Combinatóriacara de sapoAinda não há avaliações
- Palestra 22Documento68 páginasPalestra 22Ryan SantosAinda não há avaliações
- Lista de Preço RFDocumento65 páginasLista de Preço RFadamofdias8464Ainda não há avaliações
- Tr0201 Fis3 HPDocumento4 páginasTr0201 Fis3 HPDá PreiAinda não há avaliações
- Georg Simmel e Max Weber - Vida e Obra Dos SociólogosDocumento7 páginasGeorg Simmel e Max Weber - Vida e Obra Dos SociólogosGian Cornachini0% (1)
- IntertextualidadeDocumento26 páginasIntertextualidadeAmanda GuethiAinda não há avaliações
- Gdc2 - Plano Analítico 2023Documento5 páginasGdc2 - Plano Analítico 2023Rutherfordia PedroAinda não há avaliações
- Conceito de Manas em Sankhya DarshanaDocumento6 páginasConceito de Manas em Sankhya DarshanaBarbara LitoAinda não há avaliações
- Ficha AnamneseDocumento1 páginaFicha AnamneseIza ChanAinda não há avaliações
- Sedenions de Cayley-Dickson e Dilatação de Funções K-QuaseconformesDocumento124 páginasSedenions de Cayley-Dickson e Dilatação de Funções K-QuaseconformesEzequielAinda não há avaliações
- Curso de Avaliação Imobiliário Certificado Pela CMC 10 EdiçãoDocumento16 páginasCurso de Avaliação Imobiliário Certificado Pela CMC 10 EdiçãoAlex De AlmeidaAinda não há avaliações
- Gestão Estratégica de Compras e FornecedoresDocumento4 páginasGestão Estratégica de Compras e FornecedoresLucaspro gamerAinda não há avaliações
- Apresentação CampanelliDocumento8 páginasApresentação CampanelliWildson DantasAinda não há avaliações
- 600 Frases em FrancesDocumento66 páginas600 Frases em FrancesariosvaldusAinda não há avaliações
- Atributos Dos Cosmos14Documento4 páginasAtributos Dos Cosmos14Vinicius CardealAinda não há avaliações
- Boas Práticas em Unidades de Alimentação e Nutrição EscolaresDocumento8 páginasBoas Práticas em Unidades de Alimentação e Nutrição EscolaresGeilson FidelisAinda não há avaliações
- Fundep Gestao de Concursos 2019 Prefeitura de Uberlandia MG Contador ProvaDocumento16 páginasFundep Gestao de Concursos 2019 Prefeitura de Uberlandia MG Contador ProvaDiegoAinda não há avaliações
- A Xenofobia É Um Tipo de Preconceito Caracterizado Pela AversãoDocumento13 páginasA Xenofobia É Um Tipo de Preconceito Caracterizado Pela Aversãohortencio ivan mussaAinda não há avaliações
- Desenvolvimento e Implantação de Produtos DigitaisDocumento18 páginasDesenvolvimento e Implantação de Produtos DigitaisThiago Raulino Dal PontAinda não há avaliações
- Treinamento de Força em Portadores de Acidente Vascular CerebralDocumento21 páginasTreinamento de Força em Portadores de Acidente Vascular CerebralmiriswindAinda não há avaliações
- Fispq Startgrill StarDocumento1 páginaFispq Startgrill Starpaula.jegrupoAinda não há avaliações
- Apostila Curso Terceirização e Contratação Do Motorista AutônomoDocumento13 páginasApostila Curso Terceirização e Contratação Do Motorista AutônomoRubia BalestriAinda não há avaliações