Escolar Documentos
Profissional Documentos
Cultura Documentos
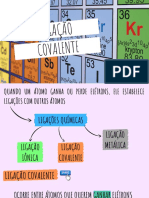
Ligações Químicas - Iônica e Covalente
Enviado por
Jerusa FreitasTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Ligações Químicas - Iônica e Covalente
Enviado por
Jerusa FreitasDireitos autorais:
Formatos disponíveis
Química 1
LIGAÇÕES QUÍMICAS Ligação Iônica ou Eletrovalente
Introdução
É aquela que ocorre pela atração elétrica entre íons
Muitas vezes questionamos porque alguns materiais positivos e negativos (ou quando a diferença de eletro-
são sólidos, outros são líquidos, alguns são duros e ou- negatividade entre os elementos ligantes seja superior a
tros são moles; alguns quebram facilmente e outros não. 1,7). De modo geral, esta ligação ocorre:
Sabe-se, hoje em dia, que essas grandes diferenças de
propriedades entre os materiais se devem em grande
METAIS NÃO - METAIS
parte, às ligações existentes entre os átomos e à forma
como esses átomos se dispõem.
- 1 a 3 elétrons na - 5 a 7 elétrons na
Camada de Valência Camada de Valência
Ligação química é a força de atração, suficiente-
- IA, IIA, IIIA e B - VA, VIA, VIIA
mente forte entre dois átomos, mantendo-os unidos
- Eletropositivo - Eletronegativo
e formando diferentes substâncias químicas.
- Ceder elétrons - Ganhar elétrons
- Cátions - Ânions
Denomina-se valência, a capacidade de combinação
dos átomos. Esta valência, em geral, corresponde ao
número de elétrons que um átomo necessita ganhar ou
perder, para adquirir estabilidade. TRANSFERÊNCIA DE
Um elemento que tem 1 valência é classificado como ELÉTRONS
monovalente; o de 2 valências é divalente, o de 3 valên-
cias trivalente e o de 4, tetravalente, e assim por diante. Por exemplo:
Ligação entre o átomo de sódio (1A) com o átomo de
Regra do Octeto cloro (7A):
Em 1916, o alemão Walter Kössel, observou que um
átomo é mais estável quando sua camada de valência
apresentar 8 elétrons. No mesmo ano, o americano Gilbert
N. Lewis, verificando as estruturas eletrônicas de átomos
quaisquer combinados, observou uma semelhança des-
ses átomos com a estrutura eletrônica dos gases nobres.
01) Estrutura de Lewis
Provou-se experimentalmente que os gases nobres, Consiste em representar os elétrons da última
em geral, não participam das combinações químicas, por camada(elétrons de vlência) por sinais e . Esta repre-
isso, podem ser considerados elementos quimicamente sentação é chamada notação de Lewis
inertes. Em 1919, o americano Irving Langmuir, basean-
do-se neste dado experimental e nas ideias de Lewis e Exemplos:
Kössel, criou a teoria (ou regra) do Octeto.
“Um átomo adquire a estabilidade quando
apresentar 8 elétrons na última camada (camada
de valência), ou 2, caso a última camada seja a k,
apresentando configuração eletrônica semelhante Ligação entre o átomo de magnésio (2A) com o átomo
a dos gases nobres.” de flúor (7A):
Os demais elementos que possuem 1 a 7 elétrons na
camada de valência, para adquirirem a estabilidade rea-
lizam as chamadas ligações químicas. Para isso, doam,
recebem ou ainda compartilham seus elétrons de valência,
até adquirirem estrutura de um gás nobre.
De acordo com a transferência ou compartilhamento de Ligação entre o átomo de alumínio (IIA) com o átomo
elétrons as ligações químicas entre átomos (interatômicas) de oxigênio (VIA):
são classificadas em:
iônicas;
covalentes e
metálicas.
Química 1
02) Através da eletrovalência
Consiste em construir a fórmula através das eletro- LIGAÇÃO COVALENTE
-valências.O número de íons que se unem é inversamente
proporcional às suas cargas. As ligações covalentes, também denominadas mo-
-leculares, ocorrem somente entre átomos que têm
Esquema Geral
tendências em receber elétrons. Isso quer dizer que as
ligações covalentes ocorrem entre átomos de não metais
ou ametais. Nas ligações entre o hidrogênio (que também
é não-metal) com outros não-metais, esse tende a receber
um elétron e adquirir a configuração estável do hélio.
Assim a ligação covalente ocorre com o com-
partilhamento de pares eletrônicos pertencentes
a átomos distintos.
onde:
- AyBx Representamos, agora, com o auxílio do modelo de
- A é o cátion de eletrovalência + x Lewis algumas substâncias covalente mais comuns.
- B é o ânion de eletrovalência - y
Exemplo:
Ligação entre o átomo de alumínio (IIIA) com átomo Através da distribuição eletrônica observa-se que cada
de oxigênio (VIA): átomo de cloro falta um elétron para completar o octeto e
adquirir estabilidade como os gases nobres. Então, dois
átomos de cloro se unem através de um compartilhamento
de par eletrônico esquematizado segundo Lewis.
Grupos
1A ou I A
2A ou II A
3A ou III A
5A ou V A
6A ou VI A
7A ou VII A
Observações:
• todo cátion é menor que o respectivo átomo neutr
• todo ânion é maior que o respectivo átomo neutr
• entre os íons isoeletrônicos, quanto maior o número
atômico, menor o raio. Ligação Covalente e Tabela Periódica
Quando um átomo perde elétreons, o núcleo passa a
atrair fortemente os elétrons restantes diminuindo o raio.
Quando um átomo recebe elétrons a carga nuclear fica
menor que o número de elétrons , por consequência a
atração diminui aumentando o raio atômico.
Propriedades dos compostos iônicos
a) Sólidos e cristalinos com elevados pontos de fusão
e ebulição.
b) Duros e quebradiços.
c) São maus condutores de eletricidade, exceto em
solução aquosa ou fundidos. Sofrem a dissociação iônica
formando uma solução eletrolítica.
Química 1
Ligação Covalente Dativa ou Coordenada Exceções ao Octeto
Existem compostos moleculares em que o número de Atualmente, os químicos têm conhecimento da exis-
átomos presentes não podem ser explicados, considera- tência de muitas moléculas que não obedecem a regra
dos apenas as ligações covalentes comuns, admite-se, do octeto. Berílio (Be) e boro (B) aparecem em algumas
então, que alguns elementos podem formar outras liga- moléculas com octeto incompleto. Apesar de pertencerem
ções; ligação covalente dativa ou coordenada. a famílias que tendem a formar cátion em ligação iônica
A ligação covalente dativa ocorre quando um dos eles fazem ligações covalentes. O Be é encontrado com
átomos já possui estrutura estável (configuração dos ga- 4 elétrons na camada de valência e B com 6.
ses nobres) e o outro necessita de um ou de mais pares
de elétrons. Ocorre assim, um compartilhamento, de tal
maneira que o par de elétrons ligantes sejam proveniente
de apenas um dos átomos da ligação.
Duas outras exceções ao octeto são alguns compos-
tos de enxofre e fósforo nos quais aparecem com mais
de 8 elétrons na camada de valência.
Exemplos: O oxigênio e o enxofre (família VI A) apre-
sentam 6 elétrons no último nível, faltando dois elétrons
para a estabilidade:
Três exceções mais interessantes à regra do octeto
são os compostos NO, NO2 e ClO2 com número ímpar de
O átomo estável de enxofre apresenta 2 pares de elé-
é na camada de valência.
trons que não participam de ligações (pares de elétrons
disponíveis), estes poderão ser “doados” através de liga-
ção a outros átomos que necessitem de elétrons. A isto Propriedades dos Compostos Covalentes
chamamos de ligação dativa ou coordenada.
As substâncias covalentes podem ser sólidas (I2, S8,
P4), líquidas (Br2, H2O, H2SO4) ou gasosas (Cl2, O2, N2, H2).
Em relação a dureza são considerados moles.
Apresentam baixos pontos de fusão e ebulição. Em
geral são solúveis em solventes polares e insolúveis
em solvente apolares. Não conduzem corrente elétrica,
mesmo liquefeitos e alguns conduzem em solução aquosa
devido a ionização, ou seja, formação de íons.
2 lig. Covalente dativas
Alguns compostos covalentes que apresentam liga-
ções dativas:
Você também pode gostar
- Tópico 10 - Listas e Provas - RevDocumento6 páginasTópico 10 - Listas e Provas - RevGuilherme CauãAinda não há avaliações
- Química Conceitual - Vol 4Documento31 páginasQuímica Conceitual - Vol 4Rtyu IuytAinda não há avaliações
- Metasil Jato Plus: 1. Identificação Do ProdutoDocumento12 páginasMetasil Jato Plus: 1. Identificação Do ProdutoNathalia FernandaAinda não há avaliações
- Ligação CovalenteDocumento3 páginasLigação CovalentetrigemeasAinda não há avaliações
- Ligacoes QuimicasDocumento23 páginasLigacoes Quimicasailtongospel8167Ainda não há avaliações
- Ligação Química HidrocarbonetosDocumento12 páginasLigação Química HidrocarbonetosceciliaguiseAinda não há avaliações
- Lista de AtomísticaDocumento5 páginasLista de AtomísticajaspersamuAinda não há avaliações
- Aula 06 Classificacao PeriodicaDocumento10 páginasAula 06 Classificacao PeriodicaresolvidosAinda não há avaliações
- Ligações Químicas: Estabilidade dos Gases NobresDocumento7 páginasLigações Químicas: Estabilidade dos Gases NobresVanessa VieiraAinda não há avaliações
- Ligacoes QuimicasDocumento4 páginasLigacoes QuimicasGiovanne BritoAinda não há avaliações
- Avaliação de Química 1º AnoDocumento2 páginasAvaliação de Química 1º AnoJosé Irlandio Sales AlvesAinda não há avaliações
- Modelos atômicos: evolução históricaDocumento7 páginasModelos atômicos: evolução históricaHenrique Gabriel Barbosa Guida RodriguesAinda não há avaliações
- Teorias de Ligação QuímicaDocumento30 páginasTeorias de Ligação QuímicaJullyAinda não há avaliações
- Conteúdos 9o e 8o ano Química e FísicaDocumento6 páginasConteúdos 9o e 8o ano Química e FísicaNathaniel RossiAinda não há avaliações
- Tecidos Do Corpo Humano 8 AnoDocumento24 páginasTecidos Do Corpo Humano 8 AnoIrlaRodriguesdeOliveira50% (2)
- Modelos atômicosDocumento1 páginaModelos atômicosPedro RibeiroAinda não há avaliações
- Biologia Desequilibrios Ambientais FacilDocumento9 páginasBiologia Desequilibrios Ambientais FacilAlvaro NevesAinda não há avaliações
- Propriedades da matéria e classificação de substâncias e misturasDocumento5 páginasPropriedades da matéria e classificação de substâncias e misturasSidney Christ100% (1)
- Evolução do conceito de átomoDocumento39 páginasEvolução do conceito de átomoAmy AdamsAinda não há avaliações
- 9º Ano - Atividade - Átomos - Elementos Químicos - Tabela Periódica - FCLDocumento1 página9º Ano - Atividade - Átomos - Elementos Químicos - Tabela Periódica - FCLNatanaelAinda não há avaliações
- Modelos AtômicosDocumento32 páginasModelos AtômicosDaianne MadureiraAinda não há avaliações
- Estrutura AtomicaDocumento11 páginasEstrutura AtomicaBruno Matassoli BragaAinda não há avaliações
- Propriedades periódicas e exercíciosDocumento12 páginasPropriedades periódicas e exercíciosAdry SantosAinda não há avaliações
- O que explica as cores dos sóisDocumento38 páginasO que explica as cores dos sóisAnna Paulap PereiraAinda não há avaliações
- Evolução dos Modelos AtômicosDocumento6 páginasEvolução dos Modelos Atômicosjulia BeatrizAinda não há avaliações
- Ligações IntermolecularesDocumento39 páginasLigações IntermolecularesDangley CoserAinda não há avaliações
- Modelos atômicos e ligações químicasDocumento4 páginasModelos atômicos e ligações químicasJéssica LayneAinda não há avaliações
- Ligação iônica e covalente: modelos, classes e propriedadesDocumento3 páginasLigação iônica e covalente: modelos, classes e propriedadesjufontana7Ainda não há avaliações
- Aula Geometria Molecular e PolaridadeDocumento31 páginasAula Geometria Molecular e PolaridadeGabriela ParroAinda não há avaliações
- Ligações Químicas: Tipos e CaracterísticasDocumento3 páginasLigações Químicas: Tipos e CaracterísticasRayssaAnndradeAinda não há avaliações
- Ligações QuímicasDocumento45 páginasLigações QuímicasLarissa Santos100% (1)
- Propriedades coligativasDocumento7 páginasPropriedades coligativasNicele PaixãoAinda não há avaliações
- Modelos AtômicosDocumento76 páginasModelos AtômicosBreno Monteiro Dos Santos100% (1)
- Quím OrgânicaDocumento9 páginasQuím OrgânicaVanessa SchenegoskiAinda não há avaliações
- Química OrgânicaDocumento16 páginasQuímica OrgânicaJoão PauloAinda não há avaliações
- A classificação periódica dos elementos químicosDocumento53 páginasA classificação periódica dos elementos químicositalo jimenez100% (1)
- Numeros QuanticosDocumento11 páginasNumeros QuanticosJosemar de SouzaAinda não há avaliações
- GEOMETRIA MOLECULAR E POLARIDADEDocumento32 páginasGEOMETRIA MOLECULAR E POLARIDADECliciane PeixotoAinda não há avaliações
- Ligação CovalenteDocumento14 páginasLigação CovalenteDiana MirandaAinda não há avaliações
- Atomistica EXERCICIOSDocumento18 páginasAtomistica EXERCICIOSMario LuizAinda não há avaliações
- Modelos AtômicosDocumento119 páginasModelos AtômicosPaulo Vitor PinheiroAinda não há avaliações
- c6 Curso A Prof QuimicaDocumento20 páginasc6 Curso A Prof QuimicaTiago RodriguesAinda não há avaliações
- A evolução da teoria atômicaDocumento15 páginasA evolução da teoria atômicaJanaína MatosAinda não há avaliações
- Modelo AtomicoDocumento19 páginasModelo AtomicoAdriano AlvesAinda não há avaliações
- Ligações químicas covalentesDocumento12 páginasLigações químicas covalenteslfdmrAinda não há avaliações
- Biologia - Pré-Vestibular Vetor - Bio1 Fisiologia - Sistema ReprodutorDocumento3 páginasBiologia - Pré-Vestibular Vetor - Bio1 Fisiologia - Sistema ReprodutorBiologia Concurso Vestibular100% (10)
- Aula 1 - Modelos AtômicosDocumento30 páginasAula 1 - Modelos Atômicosaugusto cesar januarioAinda não há avaliações
- Filo Porifera PDFDocumento50 páginasFilo Porifera PDFjoseAinda não há avaliações
- Trabalho de QuímicaDocumento8 páginasTrabalho de QuímicaMário Gabriel fausto100% (1)
- Química - Pré-Vestibular Impacto - Radioatividade - Leis IDocumento2 páginasQuímica - Pré-Vestibular Impacto - Radioatividade - Leis IQuímica Qui100% (1)
- Roteiro de Aulas Práticas - Ciências Morfofuncionais II - UNIMEDocumento21 páginasRoteiro de Aulas Práticas - Ciências Morfofuncionais II - UNIMEEtcy Tal100% (1)
- O Modelo Atômico de RutherfordDocumento4 páginasO Modelo Atômico de Rutherfordisabella100% (1)
- Plano de Curso Física 2015Documento6 páginasPlano de Curso Física 2015Edjan CastroAinda não há avaliações
- Radioatividade 33Documento5 páginasRadioatividade 33Leonel MiguelAinda não há avaliações
- Avaliação Química ÓrgânicaDocumento2 páginasAvaliação Química ÓrgânicaBirina DamasioAinda não há avaliações
- Propriedades periódicas e tabela periódicaDocumento5 páginasPropriedades periódicas e tabela periódicaLeandro CoqueiroAinda não há avaliações
- Lista de Exercícios - Tabela PeriódicaDocumento17 páginasLista de Exercícios - Tabela PeriódicaAlielson Botelho100% (1)
- Eletiva - Laboratório de Química - Aula 1 - 2022Documento51 páginasEletiva - Laboratório de Química - Aula 1 - 2022Jerusa FreitasAinda não há avaliações
- A Historia Do PetróleoDocumento4 páginasA Historia Do PetróleoJerusa FreitasAinda não há avaliações
- Energias Renováveis Apresentação JáderDocumento12 páginasEnergias Renováveis Apresentação JáderJerusa FreitasAinda não há avaliações
- 002 Funções Da Química OrgânicaDocumento3 páginas002 Funções Da Química OrgânicaJerusa FreitasAinda não há avaliações
- Cinética QuímicaDocumento11 páginasCinética QuímicaJerusa FreitasAinda não há avaliações
- Tranformaçôes Gasosas.Documento22 páginasTranformaçôes Gasosas.Jerusa FreitasAinda não há avaliações
- TERMOQUÍMICADocumento15 páginasTERMOQUÍMICAJerusa FreitasAinda não há avaliações
- Resumo Sobre Nomenclatura OrgânicaDocumento4 páginasResumo Sobre Nomenclatura OrgânicaJerusa FreitasAinda não há avaliações
- Lista de exercícios de termoquímica com cálculos de entalpia, entropia e energia de reações químicasDocumento3 páginasLista de exercícios de termoquímica com cálculos de entalpia, entropia e energia de reações químicasGabriel Vinícius0% (1)
- Resumão 2ºano 2ºbimDocumento10 páginasResumão 2ºano 2ºbimJerusa FreitasAinda não há avaliações
- Desinfetnate TallDocumento6 páginasDesinfetnate TallRicardoAinda não há avaliações
- SanarFlix - Introdução À GenéticaDocumento31 páginasSanarFlix - Introdução À GenéticaGabriel Elias100% (1)
- 32 Logaritmo Propriedades e ExercíciosDocumento6 páginas32 Logaritmo Propriedades e ExercíciosPaulo César M. Campos100% (1)
- A Composição Da Atmosfera e Suas AlteraçõesDocumento20 páginasA Composição Da Atmosfera e Suas AlteraçõesJohn JonAinda não há avaliações
- CR BR PT Coralit Total Balance BR VermelhoDocumento12 páginasCR BR PT Coralit Total Balance BR VermelhodaianeAinda não há avaliações
- Isótopos e iõesDocumento24 páginasIsótopos e iõesMatilde SilvaAinda não há avaliações
- Normas e materiais laboratório químicaDocumento28 páginasNormas e materiais laboratório químicaDiego Carvalho100% (1)
- Processos de Cementação e CarbonitretaçãoDocumento6 páginasProcessos de Cementação e CarbonitretaçãoPaulaAinda não há avaliações
- Módulo 04Documento21 páginasMódulo 04Everson MaroliAinda não há avaliações
- Guia Prático de Alquimia - PDFDocumento63 páginasGuia Prático de Alquimia - PDFEduavison Pacheco CardosoAinda não há avaliações
- Revista Concreto IBRACON 94 - Pesquisa e Desenvolvimento 1Documento7 páginasRevista Concreto IBRACON 94 - Pesquisa e Desenvolvimento 1Alexandre Ribeiro de SouzaAinda não há avaliações
- Laca Azul PK 560Documento11 páginasLaca Azul PK 560Yuri SouzaAinda não há avaliações
- FISPQ Pisos e Cimentados PretoDocumento9 páginasFISPQ Pisos e Cimentados PretoJhennif CostaAinda não há avaliações
- Fotossíntese em discos de folhasDocumento2 páginasFotossíntese em discos de folhaselisabete marinhoAinda não há avaliações
- Ciclo Carbono Nitrogênio e EnxofreDocumento23 páginasCiclo Carbono Nitrogênio e EnxofreJean Cesar BenassiAinda não há avaliações
- 822 Petrobras 23 007 01Documento5 páginas822 Petrobras 23 007 01diegonorksAinda não há avaliações
- Final 2. QuímicaDocumento3 páginasFinal 2. QuímicaJaires FreitasAinda não há avaliações
- FISPQ do Cloro LíquidoDocumento12 páginasFISPQ do Cloro Líquidoricardo_potascheffAinda não há avaliações
- Química 1 - Lista de exercícios de equações de redoxDocumento1 páginaQuímica 1 - Lista de exercícios de equações de redoxEros Furtado JúniorAinda não há avaliações
- Mensagens secretas com sal e águaDocumento4 páginasMensagens secretas com sal e águaCarlaAinda não há avaliações
- Exercicios de Aplicação 3Documento3 páginasExercicios de Aplicação 3Martinõ MarcellAinda não há avaliações
- Curso de Onduladeira-ONDUNORTE - APOSTILA-FUNDO BRANCODocumento62 páginasCurso de Onduladeira-ONDUNORTE - APOSTILA-FUNDO BRANCOAndre L B100% (1)
- Conteúdo Programático - SsaDocumento3 páginasConteúdo Programático - SsaLeywison Arthur EvaristoAinda não há avaliações
- Excesso X LimitanteDocumento4 páginasExcesso X Limitantemaria eduardaAinda não há avaliações
- Desnaturação de proteínasDocumento11 páginasDesnaturação de proteínasEssumaila AliAinda não há avaliações
- BepanthenePlus FI Newpack100gDocumento4 páginasBepanthenePlus FI Newpack100gbrenojoaquim WilkerAinda não há avaliações
- Avaliação de biomarcadores de estresse oxidativoDocumento35 páginasAvaliação de biomarcadores de estresse oxidativoManoela Leticia Oliveira CarolinoAinda não há avaliações
- Sistema DigestórioDocumento59 páginasSistema DigestórioLollaAinda não há avaliações