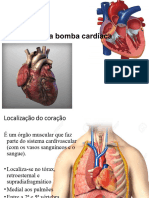
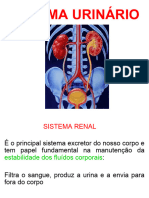
Escolar Documentos
Profissional Documentos
Cultura Documentos
Ficha 9B. Equilíbrio Químico 1
Enviado por
delfioanalia77Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Ficha 9B. Equilíbrio Químico 1
Enviado por
delfioanalia77Direitos autorais:
Formatos disponíveis
2021 Preparação para Exames de Admissão
Ficha 9B. Equilíbrio Químico 1
1. Escreva a expressão da constante de equilíbrio em função da concentração e da pressão das
seguintes reacções:
a) H2(g) + I2(g) ⇄ 2HI(g)
b) 3C2 H2(g) ⇄ C6 H6(g)
c) N2(g) + 3H2(g) ⇄ 2NH3(g)
2. Escreva as expressões da relação entre Kc e Kp para cada reacção da questão 1.
3. A uma dada temperatura, a reacção 𝟐𝐇𝐈(𝐠) ⇄ 𝐇𝟐(𝐠) + 𝐈𝟐(𝐠) apresenta as seguintes concentrações no
equilíbrio: [HI] = 2,2x10-2 M; [H2] = 1,0x10-3 M; [I2] = 2,5x10-2 M. Calcular a constante de equilíbrio, Kc,
dessa reacção.
4. A uma dada temperatura, 2 mol de H2 e 1,5 mol de I2 foram colocados em um balão de 10 litros.
Estabelecido o equilíbrio 𝐇𝟐(𝐠) + 𝐈𝟐(𝐠) ⇄ 𝟐𝐇𝐈(𝐠), encontra-se no balão 1 mol de HI. Calcular a constante
de equilíbrio Kc do sistema.
5. Na precipitação de chuva ácida, um dos ácidos responsáveis pela acidez é o sulfúrico. Um equilíbrio
envolvido na formação desse ácido na água da chuva está representado pela equação:
𝟐𝐒𝐎𝟐(𝐠) + 𝐎𝟐(𝐠) ⇄ 𝟐𝐒𝐎𝟑(𝐠).
Calcular o valor da constante de equilíbrio Kc nas condições em que reagindo-se 6 mol/L de SO2 com 5
mol/L de O2, obtém-se 4 mol/L de SO3 quando o sistema atinge o equilíbrio.
6. Para a dissociação do trióxido de enxofre 𝟐𝐒𝐎𝟑(𝐠) ⇄ 𝟐𝐒𝐎𝟐(𝐠) + 𝐎𝟐(𝐠) o valor de Kc é igual a 5, a uma
certa temperatura. Num recipiente de 10 L, a essa mesma temperatura, verifica-se que estão presentes no
equilíbrio 4 mol de SO2 e 5 mol de O2. Calcule a concentração do SO3 no equilíbrio.
7. Para a reacção 𝟐𝐂𝐎(𝐠) + 𝐎𝟐(𝐠) ⇄ 𝟐𝐂𝐎𝟐(𝐠), as pressões parciais de CO e O2 são, respectivamente, 0.2 atm
e 0.4 atm. A pressão total do sistema é de 1.4 atm. Calcule a constante de equilíbrio em função das pressões
parciais para esta reacção.
November 11, 2021 1
Paulo Mugaduia & Eugênio Tembe
2021 Preparação para Exames de Admissão
8. Considere o equilíbrio, em fase gasosa: 𝐂𝐎(𝐠) + 𝐇𝟐 𝐎(𝐠) ⇄ 𝐂𝐎𝟐(𝐠) + 𝐇𝟐(𝐠) cuja constante Kc, à
temperatura de 430oC, é igual a 4. Em um frasco de de 1,0 L, mantido a 430oC, foram misturados 1 mol de
CO, 1 mol de H2O, 3 mol de CO2 e 3 mol de H2. Esperou-se até o equilíbrio ser atingido.
a) Em qual sentido, no de formar mais CO ou de consumi-lo, a rapidez da reacção é maior, até se igualar
no equilíbrio? Justifique!
b) Calcule as concentrações de equilíbrio de cada uma das especiais envolvidas.
9. Num recipiente de volume constante igual a 1 L, inicialmente evacuado, foi introduzido 1 mol de PCl 5
gasoso puro. O recipiente foi mantido a 250 oC e no equilíbrio final foi verificada a existência de 0,47 mol
de gás cloro. Das opções abaixo, identifique a que contém o valor aproximado da constante (Kc) do
equilíbrio estabelecido dentro do cilindro e representado pela seguinte equação química:
𝐏𝐂𝐥𝟓(𝐠) ⇄ 𝐏𝐂𝐥𝟑(𝐠) + 𝐂𝐥𝟐(𝐠)
A. 0,179 B. 0,22 C. 0,42 D. 2,38 E. 4,52
10. N2O4 e NO2, gases poluentes do ar, encontram-se em equilíbrio, como indicado
𝐍𝟐 𝐎𝟒(𝐠) ⇄ 𝟐𝐍𝐎𝟐(𝐠)
Em uma experiência, nas condições ambientais, introduziu-se 1,50 mol de N2O4 em um reactor de 2 L.
Estabelecido o equilíbrio, a concentração de NO2 foi de 0,060 mol/L. Qual o valor da constante Kc, em
termos de concentração, desse equilíbrio?
A. 2,4x10-3 B. 4,8x10-3 C. 5,0x10-3 D. 5,2x10-3 E. 8,3x10-2
11. Na reacção 𝐏𝐂𝐥𝟓(𝐠) ⇄ 𝐏𝐂𝐥𝟑(𝐠) + 𝐂𝐥𝟐(𝐠), a constante Kc vale 32,8 a 727 oC. Em um recipiente estão em
equilíbrio 1,5x10-3 M de PCl5 e 2,0x10-1 M de Cl2. Calcular:
a) A concentração molar do PCl3 nesse equilíbrio.
b) O valor da constante de equilíbrio Kp ( R = 8,2x10 -2 atm.L.K-1.mol-1)
12. No sistema em equilíbrio 𝐍𝟐(𝐠) + 𝟑𝐇𝟐(𝐠) ⇄ 𝟐𝐍𝐇𝟑(𝐠), a 27oC, as pressões parciais de cada gás são: pN2 =
0,4 atm; pH2 = 1,0 atm e pNH3 = 0,2 atm. Calcular as constantes de equilíbrio Kp e Kc desse equilíbrio,
na temperatura dada. (R = 8,2x10-2 atm.L.K-1.mol-1).
13. A reacção para a formação do NOCl: 𝟐𝐍𝐎(𝐠) + 𝐂𝐥𝟐(𝐠) ⇄ 𝟐𝐍𝐎𝐂𝐥(𝐠) foi estudada a 25oC. Nesta
temperatura, e a partir de determinadas condições iniciais, as pressões encontradas no equilíbrio foram:
pNOCl = 1,2 atm; pNO = 5,0x10-2 atm; pCl2 = 3,0x10-1 atm.
a) Calcule o valor de Kp para essa reacção a 25 oC.
b) Utilizando o valor do item “a”, calcule o Kc para essa reacção (R = 0,082 atm.L.K -1.mol-1).
November 11, 2021 2
Paulo Mugaduia & Eugênio Tembe
2021 Preparação para Exames de Admissão
14. Em um recipiente de 1 L, colocou-se 1 mol de PCl5. Supondo o equilíbrio:
𝐏𝐂𝐥𝟓(𝐠) ⇄ 𝐏𝐂𝐥𝟑(𝐠) + 𝐂𝐥𝟐(𝐠)
Em temperatura tal que o PCl5 esteja 80% dissociado, calcular a constante de equilíbrio Kc.
15. Sob determinadas condições, 1 mol de HI gasoso encontra-se 20% dissociado em H2 e I2 segundo a
equação da reacção: 𝟐𝐇𝐈(𝐠) ⇄ 𝐇𝟐(𝐠) + 𝐈𝟐(𝐠). Calcule a constante de equilíbrio Kc da reacção.
16. Considere a reacção: 2 Cl2(g) + 2H2 O(g) ⇄ 4HCl(g) + O2(g) ∆H = +113 kJ. Admita que o sistema
está em equilíbrio. O que ocorrerá ao número de moles de H2O no recipiente se:
a) For adicionado O2.
b) For adicionado Cl2
c) For retirado HCl
d) O volume do recipiente for diminuído
e) A temperatura for diminuída.
17. Dada a reacção em equilíbrio: N2(g) + O2(g) ⇄ 2NO(g) ∆H = −43, 2 kcal. Determine o que ocorre
com esse equilíbrio se:
a) For adicionado N2.
b) For retirado NO.
c) For aumentada a temperatura.
d) For aumentada a pressão.
Chemistry states: the more energy
you put into a bond, the harder it is to break.
LOVE INTENSELY
November 11, 2021 3
Paulo Mugaduia & Eugênio Tembe
Você também pode gostar
- Lista Exercicios 5 - Equilibrio Quimico - ComplementaresDocumento3 páginasLista Exercicios 5 - Equilibrio Quimico - ComplementaresFlávia CastroAinda não há avaliações
- Lista Exercicios 01 KC KP DeslocDocumento3 páginasLista Exercicios 01 KC KP DeslocLetícia Rossi0% (1)
- Lista Equilibrio QuimicoDocumento3 páginasLista Equilibrio QuimicoAline MirandaAinda não há avaliações
- 1 Lista de Atividades de Equilíbrio QuímicoDocumento4 páginas1 Lista de Atividades de Equilíbrio QuímicoDavid RonaldAinda não há avaliações
- Lista de Equilíbrio QuímicoDocumento5 páginasLista de Equilíbrio QuímicoMÁRIO LIMAAinda não há avaliações
- Calculos Das Constantes IntermediarioDocumento2 páginasCalculos Das Constantes Intermediariovmosconta4Ainda não há avaliações
- Exerc EquilibrioDocumento4 páginasExerc EquilibrioJr FantinellAinda não há avaliações
- 135Documento4 páginas135mailas33Ainda não há avaliações
- Go Tarefa Semanal Curso 5e8b7a80d74e8Documento22 páginasGo Tarefa Semanal Curso 5e8b7a80d74e8rafinhagebrinAinda não há avaliações
- Ficha 2 - Extensão Das ReaçõesDocumento3 páginasFicha 2 - Extensão Das ReaçõesRafael TeixeiraAinda não há avaliações
- 3-Equilibrio QuimicoDocumento3 páginas3-Equilibrio QuimicoFranck PereiraAinda não há avaliações
- Lista Equilibrio Quimico 2012Documento12 páginasLista Equilibrio Quimico 2012Luelc SouzaAinda não há avaliações
- Estudo Dirigido - KC e KPDocumento1 páginaEstudo Dirigido - KC e KPRoberval Siqueira LisboaAinda não há avaliações
- 3-Equilibrio QuimicoDocumento3 páginas3-Equilibrio Quimicojuliana dinizAinda não há avaliações
- Exercícios CAp-COLUNIDocumento3 páginasExercícios CAp-COLUNImaiaAinda não há avaliações
- Equilíbrio QuímicoDocumento2 páginasEquilíbrio QuímicoGerson SilvaAinda não há avaliações
- Exercicios de Equilibrio QuimicoDocumento2 páginasExercicios de Equilibrio QuimicoDaniloAinda não há avaliações
- Extensivoenem Química Equilíbrio Químico - KC e KP 12-07-2019Documento9 páginasExtensivoenem Química Equilíbrio Químico - KC e KP 12-07-2019Pedro ManoelAinda não há avaliações
- Equilíbrio QuímicoDocumento8 páginasEquilíbrio Químicoprofmarkao0% (1)
- A No 3Documento2 páginasA No 3Gabriel ZemunerAinda não há avaliações
- Lista Fisico QuimicaDocumento3 páginasLista Fisico QuimicaGui AurelioAinda não há avaliações
- Alfa - Módulo 42Documento22 páginasAlfa - Módulo 42Deborah LGAinda não há avaliações
- 1a FichaDocumento4 páginas1a FichaAlexandre DiazAinda não há avaliações
- FichaprinchatDocumento4 páginasFichaprinchatAndrei GalanAinda não há avaliações
- Pcasd - Uploads - Rogerio - Arquivos - Lista 12 - Equilbrio Qumico - Constante de Equlibrio KCDocumento9 páginasPcasd - Uploads - Rogerio - Arquivos - Lista 12 - Equilbrio Qumico - Constante de Equlibrio KCRaisson HolandaAinda não há avaliações
- EQUILIBRIO QUIMICO ExerciciosDocumento7 páginasEQUILIBRIO QUIMICO ExerciciosVagner EbreAinda não há avaliações
- ListaDocumento2 páginasListaMari MouraAinda não há avaliações
- Lista de Exercicios Equilíbrio Químico FFQ - 2019-1Documento3 páginasLista de Exercicios Equilíbrio Químico FFQ - 2019-1Guilherme SchmalzAinda não há avaliações
- Analitica ListaDocumento2 páginasAnalitica Listaedu_araujo_18Ainda não há avaliações
- Aula 14 - Questões Química IIDocumento3 páginasAula 14 - Questões Química IIestudanteboamorteAinda não há avaliações
- Lista de Equilíbrio Químico - 2023Documento4 páginasLista de Equilíbrio Químico - 2023Lukas-n1nja Gomes MarquesAinda não há avaliações
- Exer Equilíbrio QuímicoDocumento3 páginasExer Equilíbrio QuímicosamiraAinda não há avaliações
- Exercícios Constante de EquilíbrioDocumento13 páginasExercícios Constante de EquilíbrioPietra LemosAinda não há avaliações
- Equi Lib Rio Qui MicoDocumento5 páginasEqui Lib Rio Qui MicoRogerio AndradeAinda não há avaliações
- Prof. Rafa - Química - Equilíbrio QuímicoDocumento9 páginasProf. Rafa - Química - Equilíbrio QuímicoRafael VaristeloAinda não há avaliações
- QFL0605 - Lista de Exercicios - Equilíbrio Químico 26-03-2020Documento3 páginasQFL0605 - Lista de Exercicios - Equilíbrio Químico 26-03-2020Esperança FLORENTINOAinda não há avaliações
- Cálculo Da ConstanteDocumento2 páginasCálculo Da ConstanteArthur FiaminiAinda não há avaliações
- 40-Cálculos de EquilíbrioDocumento4 páginas40-Cálculos de Equilíbrionv77vnmAinda não há avaliações
- Equilibrio Quimico - Parte 1Documento28 páginasEquilibrio Quimico - Parte 1Maria Luísa M. LiraAinda não há avaliações
- Lista 1 - Equilíbrio QuímicoDocumento2 páginasLista 1 - Equilíbrio Químicoqeduardo.ferreiraAinda não há avaliações
- Exercícios de Equilíbrio - Módulo 43Documento31 páginasExercícios de Equilíbrio - Módulo 43frechesAinda não há avaliações
- Teste 4 v1Documento5 páginasTeste 4 v1André MatosAinda não há avaliações
- Lista de Exercício - Equilíbrio QuímicoDocumento2 páginasLista de Exercício - Equilíbrio QuímicoEudes Santos50% (2)
- Alfa - Módulo 43 PDFDocumento31 páginasAlfa - Módulo 43 PDFjparatyAinda não há avaliações
- Lista Equilíbrio 2021Documento1 páginaLista Equilíbrio 2021Lara Silva Feitosa 474038Ainda não há avaliações
- Go Tarefa Semanal 3 Serie e Curso 5e961d9f0ad5fDocumento15 páginasGo Tarefa Semanal 3 Serie e Curso 5e961d9f0ad5fBaptistaAinda não há avaliações
- Lista de Exercícios Equilíbrio QuímicoDocumento4 páginasLista de Exercícios Equilíbrio QuímicoSamara CristinyAinda não há avaliações
- Equil Brio Qu MicoDocumento3 páginasEquil Brio Qu Micodaniel_nrnAinda não há avaliações
- LEQuímica EquilíbrioDocumento5 páginasLEQuímica EquilíbrioLussandra MarquezAinda não há avaliações
- 1º Lista de Exercícios - Equilibrio 2021-2Documento8 páginas1º Lista de Exercícios - Equilibrio 2021-2bernardo garciaAinda não há avaliações
- Lista QualitativaDocumento3 páginasLista Qualitativabolota4Ainda não há avaliações
- C S Lewis Cristianismo Puro e Simples CompletoDocumento2 páginasC S Lewis Cristianismo Puro e Simples CompletoIngrid OliveiraAinda não há avaliações
- Lista de Exercícios II - Equilíbrio QuímicoDocumento6 páginasLista de Exercícios II - Equilíbrio QuímicoErenilson SantosAinda não há avaliações
- Equilíbrio QuímicoDocumento7 páginasEquilíbrio QuímicoVânia Maria SantosAinda não há avaliações
- Lista Conjunta de Equilibrio Quimico 05102010Documento5 páginasLista Conjunta de Equilibrio Quimico 05102010Anderson_NizAinda não há avaliações
- Apostila Química Orgânica: Carbono, Dienos E AromáticosNo EverandApostila Química Orgânica: Carbono, Dienos E AromáticosAinda não há avaliações
- Sinais e Sintomas Avaliados Com o AidiDocumento27 páginasSinais e Sintomas Avaliados Com o Aididelfioanalia77Ainda não há avaliações
- SEMIOLOGIA (Anamnese) Power Point-2Documento10 páginasSEMIOLOGIA (Anamnese) Power Point-2delfioanalia77Ainda não há avaliações
- 2.nefrologia Sinais e SintomasDocumento42 páginas2.nefrologia Sinais e Sintomasdelfioanalia77Ainda não há avaliações
- A Anamnese em Caso de EmergênciasDocumento3 páginasA Anamnese em Caso de Emergênciasdelfioanalia77Ainda não há avaliações
- Revisão e Definições de Sintomas e Sinais Da Cabeça e PescoçoDocumento7 páginasRevisão e Definições de Sintomas e Sinais Da Cabeça e Pescoçodelfioanalia77Ainda não há avaliações
- Sinais e Sintomas Avaliados Com o AidiDocumento27 páginasSinais e Sintomas Avaliados Com o Aididelfioanalia77Ainda não há avaliações
- Aula 5.1 Coracao (Fisiologia)Documento28 páginasAula 5.1 Coracao (Fisiologia)delfioanalia77Ainda não há avaliações
- Febre Reumatica 1-1Documento48 páginasFebre Reumatica 1-1delfioanalia77Ainda não há avaliações
- Aula 8 (Sistema Urinário)Documento21 páginasAula 8 (Sistema Urinário)delfioanalia77Ainda não há avaliações
- Microbiologia-Virologia - Esmi 11Documento29 páginasMicrobiologia-Virologia - Esmi 11delfioanalia77Ainda não há avaliações
- AULA 12 ANATOMIA (Sistema Reprodutor Feminino)Documento40 páginasAULA 12 ANATOMIA (Sistema Reprodutor Feminino)delfioanalia77Ainda não há avaliações
- Meningite 2020 2 SEMESTREDocumento62 páginasMeningite 2020 2 SEMESTREdelfioanalia77Ainda não há avaliações
- AvaManejoHIV PA25 ProfilaxiaIOsCTZ FINAL 2013Documento9 páginasAvaManejoHIV PA25 ProfilaxiaIOsCTZ FINAL 2013delfioanalia77Ainda não há avaliações
- Introdução A Microbiologia ESMI-XIIIDocumento42 páginasIntrodução A Microbiologia ESMI-XIIIdelfioanalia77Ainda não há avaliações
- AvaManejoHIV PA24 NeuropatiaPeriferica FINAL 2013Documento9 páginasAvaManejoHIV PA24 NeuropatiaPeriferica FINAL 2013delfioanalia77Ainda não há avaliações
- Ficha de Exercícios - Função Homógrafa e Paridade - 125611Documento1 páginaFicha de Exercícios - Função Homógrafa e Paridade - 125611delfioanalia77Ainda não há avaliações
- Medidas de DispersãoDocumento3 páginasMedidas de Dispersãodelfioanalia77Ainda não há avaliações
- AvaManejoHIV PA21 Diarreia FINAL 2013Documento12 páginasAvaManejoHIV PA21 Diarreia FINAL 2013delfioanalia77Ainda não há avaliações
- Tuberculose - PPTX Tratamento, Monitoria e PrevencaoDocumento25 páginasTuberculose - PPTX Tratamento, Monitoria e Prevencaodelfioanalia77Ainda não há avaliações
- Sistema ReprodutorDocumento35 páginasSistema Reprodutordelfioanalia77Ainda não há avaliações
- Ancora Catalogo 2015Documento116 páginasAncora Catalogo 2015pedlopesAinda não há avaliações
- Aula 22 - Ensino Híbrido-01 - 2 Ano - Química Diogo LopesDocumento5 páginasAula 22 - Ensino Híbrido-01 - 2 Ano - Química Diogo LopesMárcio VitorAinda não há avaliações
- Aula 1 - TLB - Introdução e Aparelhagem de LaboratórioDocumento7 páginasAula 1 - TLB - Introdução e Aparelhagem de LaboratórioSilvânia Regina M. MoreschiAinda não há avaliações
- #Apostila Química Zero-1Documento35 páginas#Apostila Química Zero-1cristina100% (1)
- MSFZ0005 - Cvu26b Vcu30bDocumento7 páginasMSFZ0005 - Cvu26b Vcu30bValdir BerkembrockAinda não há avaliações
- TermodinâmicaDocumento7 páginasTermodinâmicacb_penatrujilloAinda não há avaliações
- Mancais de RolamentoDocumento25 páginasMancais de Rolamentorereluta100% (1)
- WEG Manual de Instalacao Operacao Manutencao Disjuntor A Vacuo VBW Manual Portugues BRDocumento128 páginasWEG Manual de Instalacao Operacao Manutencao Disjuntor A Vacuo VBW Manual Portugues BRJosé Adalberto JuniorAinda não há avaliações
- Síntese Da Teoria de Transporte de Sedimentos de Van Rijn (1984)Documento27 páginasSíntese Da Teoria de Transporte de Sedimentos de Van Rijn (1984)samuel_barsanelliAinda não há avaliações
- Bioprocessos - EnzimologiaDocumento70 páginasBioprocessos - EnzimologiaAndreTomazTerraJuniorAinda não há avaliações
- Installation & Service Manual For Use With Remote Single Condensing Unit (RLE) - SPANISHDocumento55 páginasInstallation & Service Manual For Use With Remote Single Condensing Unit (RLE) - SPANISHleonel uribeAinda não há avaliações
- Cessna 172 Skyhawk (Fórmulas)Documento6 páginasCessna 172 Skyhawk (Fórmulas)ChefiaAinda não há avaliações
- Relatorio - Síntese Do Ácido Acetilsalicílico (Aas) - Passei DiretoDocumento10 páginasRelatorio - Síntese Do Ácido Acetilsalicílico (Aas) - Passei DiretoJOANA SCAPINIAinda não há avaliações
- MI YT18-22 BROCHURA Correto para Impressão YANMARDocumento20 páginasMI YT18-22 BROCHURA Correto para Impressão YANMARAlberto0% (2)
- Aula 3 - Corte e Serragem e Lista de ExercíciosDocumento10 páginasAula 3 - Corte e Serragem e Lista de ExercíciosGiuseppe Ferrari100% (1)
- Funções QuímicasDocumento4 páginasFunções QuímicasElen FernandoAinda não há avaliações
- Creatin in ADocumento2 páginasCreatin in APaulo MattosAinda não há avaliações
- Descrição Técnica Fertilizantes - AtualizadaDocumento18 páginasDescrição Técnica Fertilizantes - AtualizadaMatheus CostaAinda não há avaliações
- Alcalinidade PDFDocumento10 páginasAlcalinidade PDFCamila Bortolatto RodriguesAinda não há avaliações
- Aquecimento Enem FisicaDocumento5 páginasAquecimento Enem FisicaCarvalho DuarteAinda não há avaliações
- NBR 14936 - Abr2003 - Plugues e Tomadas para Uso Doméstico e Análogo - Adaptadores - Requisitos EspecíficosDocumento11 páginasNBR 14936 - Abr2003 - Plugues e Tomadas para Uso Doméstico e Análogo - Adaptadores - Requisitos EspecíficosmullerafAinda não há avaliações
- Catalogo InsizeDocumento280 páginasCatalogo InsizeANTOHAKI100% (1)
- ManualSecador100a200Litros PDFDocumento8 páginasManualSecador100a200Litros PDFtonnytoonsAinda não há avaliações
- Desempeno de Chapas PDFDocumento22 páginasDesempeno de Chapas PDFRamonMelgaço100% (2)
- Reparo, Recuperação Ou Reforço em Lajes - RabeloDocumento68 páginasReparo, Recuperação Ou Reforço em Lajes - RabeloTatiane Rabelo100% (1)
- Manobra AssepticaDocumento3 páginasManobra AssepticaIvana RiiAinda não há avaliações
- Fluence - Laser Led PDFDocumento103 páginasFluence - Laser Led PDFLaura KmilaAinda não há avaliações
- André Vieira - Como Testar Meus HormniosDocumento32 páginasAndré Vieira - Como Testar Meus HormniosJoão SantanaAinda não há avaliações
- Eologia Geral e UrbanaDocumento20 páginasEologia Geral e UrbanaThiago Almeida de Carvalho100% (1)
- FAU MACKENZIE Conforto Dos Ambientes I (2015)Documento5 páginasFAU MACKENZIE Conforto Dos Ambientes I (2015)Philip BraunsteinAinda não há avaliações