Escolar Documentos
Profissional Documentos
Cultura Documentos
Ficha - 14 - Estado de Equilíbrio e Extensão Das Reações Químicas - Aluno
Enviado por
João MoreiraTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Ficha - 14 - Estado de Equilíbrio e Extensão Das Reações Químicas - Aluno
Enviado por
João MoreiraDireitos autorais:
Formatos disponíveis
ESCOLA BÁSICA E SECUNDÁRIA DRA.
JUDITE ANDRADE
Ano Letivo 2023/2024
Ficha de Trabalho nº 14 - Física e Química A - 11º Ano
(___ de março de 2024)
Nome: __________________________________________________ Nº: _____ Turma: ____
Aprendizagens Essenciais…
Resolver problemas envolvendo a estequiometria de uma reação, incluindo o cálculo do rendimento, explicando as estratégias de resolução e os
raciocínios demonstrativos que fundamentam uma conclusão.
Comparar reações químicas do ponto de vista da química verde, avaliando as implicações na sustentabilidade económica e ambiental.
Aplicar, na resolução de problemas, o conceito de equilíbrio químico em sistemas homogéneos, incluindo a análise de gráficos, a escrita de
expressões matemáticas que traduzam a constante de equilíbrio e a relação entre a constante de equilíbrio e a extensão de uma reação,
explicando as estratégias de resolução.
Prever o sentido da evolução de um sistema químico homogéneo quando o estado de equilíbrio é perturbado (variações de pressão em sistemas
gasosos, de temperatura e de concentração), com base no Princípio de Le Châtelier.
Prever o sentido da evolução de um sistema químico homogéneo por comparação entre o quociente da reação e a constante de equilíbrio.
1. A reação de síntese do amoníaco pode ser traduzida por
N2 (g) + 3 H2 (g) ⇌ 2 NH3 (g)
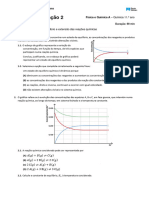
A figura apresenta um gráfico que traduz a evolução, ao longo do tempo, das concentrações das espécies envolvidas na
reação de síntese do amoníaco, à temperatura de 350 °C. A
figura não está à escala.
1.1 O sistema químico considerado ____ inicialmente em
equilíbrio, evoluindo no sentido da reação ____ após lhe
ter sido aplicada, no instante t1, uma perturbação.
(A) encontrava-se … direta
(B) não se encontrava … direta
(C) não se encontrava … inversa
(D) encontrava-se … inversa
1.2 A expressão numérica que pode traduzir o valor
aproximado do quociente da reação, no instante
imediatamente após ter sido aplicada a perturbação é …
(A) (C)
(B) (D)
2. A reação de síntese do amoníaco pode ser traduzida por
N2 (g) + 3 H2 (g) ⇌ 2 NH3 (g)
2.1 Na tabela seguinte estão registadas, além das concentrações iniciais de N 2 (g) e de H2 (g), as concentrações de equilíbrio
das substâncias envolvidas na reação considerada
relativas a um mesmo estado de equilíbrio do sistema, à
temperatura T. Admita que a reação ocorreu num reator
com a capacidade de 1,00 L e que as substâncias
envolvidas não participaram em nenhum outro processo.
2.1.1 Verifique se inicialmente existia, ou não, NH 3
no reator. Apresente todos os cálculos efetuados.
Ficha nº 14 – Estado de equilíbrio e extensão das reações químicas Página 1 de 3
2.1.2 Admita que, num determinado instante, se adicionou H 2 (g) ao sistema no estado de equilíbrio considerado e que a
concentração deste gás aumentou, nesse instante, para o dobro.
O valor aproximado do quociente da reação, imediatamente após aquela adição, pode ser calculado pela
expressão …
(A) (C)
(B) (D)
2.2 Num reator com a capacidade de 0,50 L, foram introduzidas 6,00 mol de NH 3 (g). Quando o sistema químico atingiu o
estado de equilíbrio, à temperatura T, verificou-se que existia no reator 86,6% da quantidade daquele gás.
Calcule a constante de equilíbrio, Kc, da reação de decomposição do amoníaco, à temperatura T. Apresente todos os
cálculos efetuados.
3. A reação de síntese do amoníaco pode ser traduzida por
N2 (g) + 3 H2 (g) ⇌ 2 NH3 (g) ΔH < 0
Considere que se introduziu, num reator com a capacidade de 1,00 L, uma mistura
de dinitrogénio, di-hidrogénio e amoníaco, em fase gasosa, em diferentes
concentrações.
O gráfico da figura representa a evolução, ao longo do tempo, t, das concentrações,
c, dessas substâncias, à temperatura T.
3.1 Calcule a variação da concentração de H2 (g) no intervalo de tempo [0, t1].
3.2 Calcule o rendimento da reação de síntese do NH3 (g), nas condições
consideradas. Apresente todos os cálculos efetuados.
3.3 Preveja, justificando, como variará a composição da mistura reacional se
ocorrer um aumento da temperatura do sistema em equilíbrio.
4. O dinitrogénio, N2 (g), e o di-hidrogénio, H2 (g), são utilizados na síntese do amoníaco, NH 3 (g), traduzida por
N2 (g) + 3 H2 (g) ⇌ 2 NH3 (g)
Considere um sistema químico de volume variável que contém apenas estas três
substâncias.
Na figura apresenta-se o gráfico da quantidade, n, de cada uma das substâncias
em função do tempo, t, a uma temperatura constante, T.
O sistema químico foi perturbado num instante entre t1 e t2, tendo-se alterado a
quantidade de uma das substâncias, a pressão constante. O sistema químico foi
novamente perturbado num instante entre t 3 e t4.
4.1 Identifique a perturbação aplicada ao sistema químico considerado, no
intervalo de tempo [t1, t2], indicando a substância cuja quantidade foi
alterada e se essa substância foi introduzida ou removida do sistema.
4.2 Conclua, fundamentando, se o quociente da reação no intervalo de tempo [t2, t3] é superior, inferior ou igual ao
quociente da reação no intervalo de tempo [t4, t5]. Escreva um texto estruturado, utilizando linguagem científica
adequada.
5. As curvas representadas no gráfico da figura traduzem a concentração, c, ao
longo do tempo, t, das espécies A, B e C que intervêm numa reação química
em fase gasosa. O sistema químico atinge um estado de equilíbrio a uma
temperatura T.
5.1 A proporção em que reagem entre si as espécies A e B é …
(A) 2 mol A : 1 mol B (C) 1 mol A : 2 mol B
(B) 3 mol A : 2 mol B (D) 2 mol A : 3 mol B
Ficha nº 14 – Estado de equilíbrio e extensão das reações químicas Página 2 de 3
5.2 Considere que num determinado instante, depois de atingido o estado de equilíbrio à temperatura T, se aumenta a
concentração da espécie A.
Conclua, justificando, como variará o quociente da reação, após o aumento da concentração da espécie A, até ser
atingido um novo estado de equilíbrio, à mesma temperatura.
6. O di-iodo, I2 (g), reage com o di-hidrogénio, H2 (g), em fase gasosa, formando-se iodeto de hidrogénio, HI (g). A reação pode ser
traduzida por
H2 (g) + I2 (g) ⇌ 2 HI (g) H < 0
6.1 Considere que, à temperatura T, se introduziu, num reator com a capacidade de 1,00 L, uma mistura de H2 (g) e de I2 (g),
em diferentes concentrações, não existindo
inicialmente HI (g) no reator.
O gráfico da figura mostra a evolução, ao longo do
tempo, t, das concentrações, c, dos reagentes.
Determine a constante de equilíbrio, Kc, da reação
considerada, à temperatura T.
6.2 Conclua como variará a composição do sistema se a
temperatura diminuir, a volume constante. Apresente
num texto a fundamentação da conclusão solicitada.
A Professora,
Helena Bernardino
Ficha nº 14 – Estado de equilíbrio e extensão das reações químicas Página 3 de 3
Você também pode gostar
- Equilíbrio químico e extensão de reaçõesDocumento4 páginasEquilíbrio químico e extensão de reaçõesINES DE LEMOS SARGENTO E ALMEIDAAinda não há avaliações
- 11FQA Ficha Formativa Q1.2Documento3 páginas11FQA Ficha Formativa Q1.2Andrei GalanAinda não há avaliações
- [4.2.1] 11Q_CAP_[Fichas 1.2]Documento25 páginas[4.2.1] 11Q_CAP_[Fichas 1.2]Catarina FerreiraAinda não há avaliações
- Ficha 2 - QuímicaDocumento6 páginasFicha 2 - QuímicaBeatriz VenâncioAinda não há avaliações
- Equilíbrio químico exercíciosDocumento11 páginasEquilíbrio químico exercíciosERIK CESARAinda não há avaliações
- Equilíbrio QuímicoDocumento17 páginasEquilíbrio QuímicojulioAinda não há avaliações
- Q2-Ficha Trabalho Nº2Documento3 páginasQ2-Ficha Trabalho Nº2Ana SilvaAinda não há avaliações
- Exercícios de Aplicação - Equilíbrio Químico 3Documento4 páginasExercícios de Aplicação - Equilíbrio Químico 3sevinchrajabova027Ainda não há avaliações
- FichatrabeqquímicoDocumento3 páginasFichatrabeqquímicoAndrei GalanAinda não há avaliações
- Exercícios de Equilíbrio Químico - Profº Agamenon RobertoDocumento46 páginasExercícios de Equilíbrio Químico - Profº Agamenon Robertocb_penatrujillo92% (26)
- Ficha de trabalho sobre equilíbrio químicoDocumento2 páginasFicha de trabalho sobre equilíbrio químicoDiogo NunesAinda não há avaliações
- 2T.EQUILIBRIO MOLECULAR - Apostilaconteúdo.exercícios.2023Documento10 páginas2T.EQUILIBRIO MOLECULAR - Apostilaconteúdo.exercícios.2023Iara DaherAinda não há avaliações
- FT - Princípio de Le ChâtelierDocumento2 páginasFT - Princípio de Le ChâtelierAndré MatosAinda não há avaliações
- Equilibrio QuímicoDocumento44 páginasEquilibrio QuímicoJúlia XavierAinda não há avaliações
- Equilibrio_introducaoDocumento3 páginasEquilibrio_introducaovmosconta4Ainda não há avaliações
- ExercíciosDocumento6 páginasExercíciosCaroline Paglia NadalAinda não há avaliações
- FIcha - Equlibrio QuimicoDocumento4 páginasFIcha - Equlibrio QuimicoAlda Maria Dinis GinjaAinda não há avaliações
- Ae q11 Fich Form 1Documento5 páginasAe q11 Fich Form 1Mariana Coelho100% (4)
- Ficha de Trabalho 7 - Aspetos Quantitativos Das RQ e Equilíbrio Químico e Extensão Das RQDocumento4 páginasFicha de Trabalho 7 - Aspetos Quantitativos Das RQ e Equilíbrio Químico e Extensão Das RQFranciscaAinda não há avaliações
- Ae q11 Fich Form 1Documento5 páginasAe q11 Fich Form 1Ana Raquel PintoAinda não há avaliações
- Formação Profissional Reações QuímicasDocumento2 páginasFormação Profissional Reações QuímicasRaquel_DanielaAinda não há avaliações
- 3-Equilíbrio Químico (Apostila)Documento14 páginas3-Equilíbrio Químico (Apostila)Vaniely SiqueiraAinda não há avaliações
- CAPITULO VII - Equilibrio QuimicDocumento9 páginasCAPITULO VII - Equilibrio QuimicHélder ViegasAinda não há avaliações
- Equilíbrio Químico e Cálculo de Constante de Equilíbrio KcDocumento3 páginasEquilíbrio Químico e Cálculo de Constante de Equilíbrio KcAlda Maria Dinis Ginja100% (1)
- Exe EquilibrioDocumento48 páginasExe Equilibrioruannamsb4596100% (2)
- Equilíbrio Químico e Cálculos em Reações QuímicasDocumento17 páginasEquilíbrio Químico e Cálculos em Reações QuímicasjotaAinda não há avaliações
- Ae q11 Fich Form 1Documento6 páginasAe q11 Fich Form 1sandraimartins0% (1)
- Cálculos Estequiométricos e Equilíbrio QuímicoDocumento12 páginasCálculos Estequiométricos e Equilíbrio QuímicoanamdAinda não há avaliações
- Lista Exercicios - Equilibrio Quimico - Parte 1Documento2 páginasLista Exercicios - Equilibrio Quimico - Parte 1aaAinda não há avaliações
- FT - FQA11 - Equilíbrio QuímicoDocumento5 páginasFT - FQA11 - Equilíbrio QuímicoRui RodriguesAinda não há avaliações
- Equilíbrio QuímicoDocumento94 páginasEquilíbrio QuímicoMicheleAinda não há avaliações
- Ficha Formativa - UFCD 6708Documento5 páginasFicha Formativa - UFCD 6708cristinajlopesAinda não há avaliações
- Eq. QuímicoDocumento82 páginasEq. QuímicoFábio Luiz SeribeliAinda não há avaliações
- Ae q11 Fich Form 1Documento5 páginasAe q11 Fich Form 1carla50% (2)
- Lista de Equilíbrio Químico PDFDocumento3 páginasLista de Equilíbrio Químico PDFMarcelo SatorresAinda não há avaliações
- Teste - 2 - PORTO EDITORA 2023 - Enunciado - sd2 - Estado - Equilibrio - Extensao - Reacoes - QuimicasDocumento6 páginasTeste - 2 - PORTO EDITORA 2023 - Enunciado - sd2 - Estado - Equilibrio - Extensao - Reacoes - QuimicasLuis VarelaAinda não há avaliações
- Ficha - Avaliacao - Equilibrio Químico2Documento6 páginasFicha - Avaliacao - Equilibrio Químico2Carla CruzAinda não há avaliações
- Ficha 2 - Equilíbrio QuímicoDocumento5 páginasFicha 2 - Equilíbrio QuímicoBeatriz AmorimAinda não há avaliações
- 11FQA Ficha Trab Ini Q1.2 - N.º 2Documento4 páginas11FQA Ficha Trab Ini Q1.2 - N.º 2Andrei GalanAinda não há avaliações
- Atividades Globais SD2Documento4 páginasAtividades Globais SD2milenerato2240Ainda não há avaliações
- Equilíbrio QuímicoDocumento13 páginasEquilíbrio QuímicoSilvio RobertoAinda não há avaliações
- Equilíbrio químico e cálculos estequiométricosDocumento3 páginasEquilíbrio químico e cálculos estequiométricosnelson_honorioAinda não há avaliações
- 11FQA Ficha Trab Ini Q1.2 - N.º 2Documento4 páginas11FQA Ficha Trab Ini Q1.2 - N.º 2carlosAinda não há avaliações
- Equilíbrio Químico ListaDocumento8 páginasEquilíbrio Químico ListamateusAinda não há avaliações
- Cinética QuímicaDocumento5 páginasCinética QuímicaXavier EliúdeAinda não há avaliações
- Ficha de Apoio - Quimica - 12 Classe PDFDocumento8 páginasFicha de Apoio - Quimica - 12 Classe PDFPaulo Lewis100% (5)
- Resolução de exercícios de equilíbrio químicoDocumento3 páginasResolução de exercícios de equilíbrio químicoLorran Alves ViannaAinda não há avaliações
- Equilibrio Quimico iDocumento5 páginasEquilibrio Quimico iauriaesmeniauamusseAinda não há avaliações
- Ficha NR 3 PerguntasDocumento5 páginasFicha NR 3 PerguntasernildoernestomalajissaAinda não há avaliações
- Equilíbrio QuímicoDocumento7 páginasEquilíbrio QuímicoVânia Maria SantosAinda não há avaliações
- MM - FQ - KC IntroDocumento6 páginasMM - FQ - KC IntroPetrus NegreiroAinda não há avaliações
- Química 1Documento14 páginasQuímica 1Maria Vitoria Moreira DantasAinda não há avaliações
- Apostila Química Orgânica: Carbono, Dienos E AromáticosNo EverandApostila Química Orgânica: Carbono, Dienos E AromáticosAinda não há avaliações
- Ácidos e Bases de Brönsted e Lowry: Uma visão aplicada ao meio ambienteNo EverandÁcidos e Bases de Brönsted e Lowry: Uma visão aplicada ao meio ambienteAinda não há avaliações
- Análise das tensões em estruturas de concreto devido a variações de temperatura entre os anos de 2009 e 2018No EverandAnálise das tensões em estruturas de concreto devido a variações de temperatura entre os anos de 2009 e 2018Ainda não há avaliações
- Aprendendo a mecânica quântica: equação de Schrödinger em 1DNo EverandAprendendo a mecânica quântica: equação de Schrödinger em 1DAinda não há avaliações
- Ficha_8_Forças e movimento_GPE_AlunoDocumento2 páginasFicha_8_Forças e movimento_GPE_AlunoJoão MoreiraAinda não há avaliações
- EX EconA712 F2 2023 V1 - NetDocumento16 páginasEX EconA712 F2 2023 V1 - NetJoão MoreiraAinda não há avaliações
- EX EconA712 F2 2023 V1 - NetDocumento16 páginasEX EconA712 F2 2023 V1 - NetJoão MoreiraAinda não há avaliações
- EX EconA712 F2 2023 V1 - NetDocumento16 páginasEX EconA712 F2 2023 V1 - NetJoão MoreiraAinda não há avaliações
- Microbiologia - Resumo II - Classificação de MicrorganismosDocumento3 páginasMicrobiologia - Resumo II - Classificação de MicrorganismosJhonatan Maraschin50% (2)
- SRD 1903 Engine PT-BRDocumento290 páginasSRD 1903 Engine PT-BRjose breno vieira silva100% (4)
- Corr GoodYearDocumento28 páginasCorr GoodYearRicardoRachelAinda não há avaliações
- Volumetria de Complexação - Análise de CA em Leite em PóDocumento13 páginasVolumetria de Complexação - Análise de CA em Leite em PóEvandro Serafim Morais100% (1)
- Apresentação MergulhoDocumento57 páginasApresentação MergulhoLuiz HardmanAinda não há avaliações
- Manual de Serviço Pulverizador Case Patriot 250Documento1.162 páginasManual de Serviço Pulverizador Case Patriot 250VDF83% (18)
- Administração de Medicação IMDocumento72 páginasAdministração de Medicação IMSandra Regina100% (1)
- Ensaios Ultrassom MateriaisDocumento10 páginasEnsaios Ultrassom MateriaisDiego TochettoAinda não há avaliações
- Apostila Ceja.Documento21 páginasApostila Ceja.arilsonprata333Ainda não há avaliações
- Eletronica AnalogicaDocumento127 páginasEletronica AnalogicaRogerio AlvesAinda não há avaliações
- Metabolismo Vitaminas e MineraisDocumento20 páginasMetabolismo Vitaminas e MineraisKelson AssunçãoAinda não há avaliações
- Classificação de EletrodosDocumento30 páginasClassificação de Eletrodosvaldilanenunes10Ainda não há avaliações
- Material para Isolamento TérmicoDocumento34 páginasMaterial para Isolamento TérmicoJosuel SantosAinda não há avaliações
- Química Ambiental: Noções de ToxicologiaDocumento44 páginasQuímica Ambiental: Noções de ToxicologiaDierley MoraisAinda não há avaliações
- Cartilha - Segurança DomiciliarDocumento9 páginasCartilha - Segurança DomiciliarNeilton JuniorAinda não há avaliações
- Fenômenos Elétricos nas CélulasDocumento4 páginasFenômenos Elétricos nas CélulasCindy MatsumotoAinda não há avaliações
- Lista Publico Crouse Hinds Web PDFDocumento35 páginasLista Publico Crouse Hinds Web PDFAnonymous IXswcnWAinda não há avaliações
- Lixo ameaça vida marinha segundo história de latinhasDocumento56 páginasLixo ameaça vida marinha segundo história de latinhasAssíria BatistaAinda não há avaliações
- Metalizacao A Alto Vacuo Brochure PDFDocumento12 páginasMetalizacao A Alto Vacuo Brochure PDFAnildo Eldivar De Oliveira SarmentoAinda não há avaliações
- Avaliação Diagnostica 1 Ano QuimicaDocumento3 páginasAvaliação Diagnostica 1 Ano QuimicaMarcela Souza de JesusAinda não há avaliações
- Uerj - Coletânea de Questões Anteriores (2011-2007) - Folha 2Documento7 páginasUerj - Coletânea de Questões Anteriores (2011-2007) - Folha 2Michael A. Rocha - Pesquise algo --)100% (1)
- Fabricação por FuraçãoDocumento101 páginasFabricação por FuraçãoWanderley XavierAinda não há avaliações
- Ligas Ferrosas: Aços e seus Elementos de LigaDocumento86 páginasLigas Ferrosas: Aços e seus Elementos de LigaEltonAinda não há avaliações
- Elevador Naftalina Violeta DesapareceDocumento2 páginasElevador Naftalina Violeta DesapareceHoutarouAinda não há avaliações
- Manual Misoprostol PortuguesDocumento106 páginasManual Misoprostol PortuguesnbrancaglioneAinda não há avaliações
- Bioquímica 2Documento9 páginasBioquímica 2HansMikuAinda não há avaliações
- Questionario Das Atividades PraticasDocumento5 páginasQuestionario Das Atividades PraticasJonesigley da Silva DurãesAinda não há avaliações
- Peças e especificações de mangueiras e cilindros para plataformas elevadoras JLGDocumento39 páginasPeças e especificações de mangueiras e cilindros para plataformas elevadoras JLGronaldosilva2Ainda não há avaliações
- Introdução ao alumínio, sua extração e usosDocumento2 páginasIntrodução ao alumínio, sua extração e usosRobert AnjosAinda não há avaliações
- Apostila Estria PDFDocumento19 páginasApostila Estria PDFJanini De Oliveira FreitasAinda não há avaliações


![[4.2.1] 11Q_CAP_[Fichas 1.2]](https://imgv2-2-f.scribdassets.com/img/document/723264083/149x198/12b9004dbd/1713197773?v=1)