Escolar Documentos
Profissional Documentos
Cultura Documentos
LISTA EXERCÍCIOS 3 - Termodinâmica Das Soluçoes Não-Eletrolíticas Reais
Enviado por
Angenor Geovani Auler0 notas0% acharam este documento útil (0 voto)
157 visualizações5 páginas1. O documento discute as propriedades termodinâmicas de soluções não-eletrolíticas reais, incluindo os diagramas de pressão de vapor-composição e coeficientes de atividade.
2. Problemas específicos incluem calcular frações molares, pressões de vapor, volumes e atividades em sistemas como clorofórmio-éter propílico, acetona-éter, amônia-água e água-metanol.
3. As soluções podem apresentar desvios positivos ou
Descrição original:
Termodinâmica Das Soluçoes Não-Eletrolíticas Reais. Uma lista de exercícios
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documento1. O documento discute as propriedades termodinâmicas de soluções não-eletrolíticas reais, incluindo os diagramas de pressão de vapor-composição e coeficientes de atividade.
2. Problemas específicos incluem calcular frações molares, pressões de vapor, volumes e atividades em sistemas como clorofórmio-éter propílico, acetona-éter, amônia-água e água-metanol.
3. As soluções podem apresentar desvios positivos ou
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
157 visualizações5 páginasLISTA EXERCÍCIOS 3 - Termodinâmica Das Soluçoes Não-Eletrolíticas Reais
Enviado por
Angenor Geovani Auler1. O documento discute as propriedades termodinâmicas de soluções não-eletrolíticas reais, incluindo os diagramas de pressão de vapor-composição e coeficientes de atividade.
2. Problemas específicos incluem calcular frações molares, pressões de vapor, volumes e atividades em sistemas como clorofórmio-éter propílico, acetona-éter, amônia-água e água-metanol.
3. As soluções podem apresentar desvios positivos ou
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
Você está na página 1de 5
Universidade Estadual do Rio Grande do Sul
Novo Hamburgo
Engenharia de Bioprocessos e Biotecnologia
Termodinâmica Aplicada a Biotecnologia
Profa. Lúcia A.S. Ries
LISTA 3 –
TERMODINÂMICA DAS SOLUÇÕES NÃO-ELETROLÍTICAS REAIS
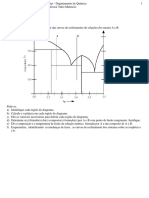
1. O diagrama pressão de vapor-composição do sistema clorofórmio-éter
propílico, a 60oC, sugere a tendência à formação de um composto entre
os componentes da solução. Trace, de forma qualitativa, as curvas que
dão a variação da pressão de vapor de cada componente, assim como da
pressão total da solução com a composição, nessa temperatura. As
pressões de vapor dos componentes quando puros são,
respectivamente, 700 e 800 torr. Apesar de que as curvas traçadas
sejam apenas qualitativas, cuide que sua forma geral obedeça às Leis de
Raoult e de Henry nos intervalos de composição correspondentes. Para
esse sistema, a constante de Henry (k2) vale 500 torr para o éter e 300
torr para o clorofórmio.
2. Acetona e éter formam soluções não ideais. A 30oC, as pressões de
vapor dos líquidos puros são respectivamente, 280 e 650 torr. A pressão
total de vapor de uma solução destes componentes de fração molar 0,5
é 600 torr, naquela temperatura, e o coeficiente de atividade do éter na
solução é de 1,30.
a) Calcule γ para a acetona no sistema em estudo;
b) Trace, de maneira qualitativa, as curvas de pressão de vapor e de
pressão total da solução em função da composição, a 30oC.
R.: γA = 1,27
3. Uma dada solução real de componentes A e B tem seu ponto normal
de ebulição a 60oC. Os coeficientes γA e γB valem 1,3 e 1,6
respectivamente. A atividade de A é igual a 0,6 e a pressão de vapor de
A quando puro vale 400 torr. Calcule:
a) A fração molar de A, no vapor, em equilíbrio com a solução líquida.
b) O valor da pressão de vapor de A quando puro.
R.: x’A = 0,316 P□B = 604 mmHg
4. Líquidos A e B formam soluções reais. Os coeficientes de atividade do
componente A, a várias concentrações, são dados abaixo:
XA 1,0 0,9 0,8 0,7 0,5 0,3 0,2 0,1
γA 1,00 0,99 0,91 0,85 0,64 0,54 0,44 0,43
Dados: P□A = 700 torr; P□B = 400 torr
a) Calcule kA, a constante de Henry, para o componente A. (PA = xA.kA)
b) As soluções de A e B apresentam desvio negativo ou positivo em
relação à Lei de Raoult? Justifique.
c) Qual a atividade do componente A numa solução de composição xA =
0,3?
R.: kA = 300 torr; b).....; c) aA = 0,162
5. Os volumes molares parciais da água e do etanol a 20oC são
respectivamente, 17 e 57 cm3.mol-1, numa solução de ambos os
componentes em que xEt = 0,4. Calcule o volume total de uma solução
obtida por mistura de dois móis de água com suficiente etanol para dar
xEt = 0,4.
R.: V = 109,8 cm3.
6. Numa dada solução de amônia (NH3) e de água, a 22,1oC, a pressão
parcial de vapor d’água em equilíbrio com a solução é de 0,34 psi,
sendo a fração molar de água igual a 0,95. Calcule:
a) O coeficiente de atividade e a atividade da água, nesse sistema.
b) A pressão parcial de vapor da amônia, a 22,1oC.
Dados: kNH3 = 725 torr; P□H2O = 18,77 torr (a 22,1oC) 1 psi = 0,068 atm
R.: γH2O = 0,985; aH2O = 0,936; PNH3 = 36,25 torr
7. A 39,9oC, as pressões parciais de vapor d’água e do vapor de metanol
em equilíbrio com a solução líquida dos dois componentes são dadas na
tabela abaixo. Deseja-se preparar uma solução de metanol em água
com concentração tal que as atividades de ambos os componentes
sejam iguais.
a) Determine graficamente a composição de tal solução.
b) A seguir, calcule o coeficiente de atividade de cada componente na
solução mencionada no item “a”.
Percentagem Pressão parcial Pressão parcial da
molar de Me- do Me-OH/torr água/torr
OH/%molar
0,0 0,0 54,7
27,3 100,6 39,8
47,0 141,6 31,5
68,9 186,6 20,7
86,0 225,2 10,1
100,0 260,7 0,0
R.: xMe-OH = 0,49; b) γMe-OH = 1,14; c) γH2O = 1,10
8. A 75oC, tem-se PHNO3 = 35,0 torr e PH2O = 86,0 torr sobre uma solução
aquosa de HNO3 a 65% em fração ponderal. Sabe-se que, nessa
temperatura, P□H2O = 289,1 torr. Calcule a pressão total sobre a solução
e a fração molar do ácido nítrico no vapor, considerando dois casos: a)
Solução líquida ideal e b) Solução líquida real. Qual o tipo de desvio
apresentado pelo sistema?
Pideal = 376 torr; Preal = 121 torr; x’HNO3 = 0,50 (ideal) x’HNO3 = 029 (real);
γHNO3 = 0,19; γH2O = 0,45; Desvio ......
9. A 300K, o líquido A tem uma pressão de vapor de 280,0 torr e o
líquido B, de 170,0 torr. Uma solução contendo 2 móis de cada um dos
líquidos, tem pressão de vapor de 380,0 torr e o vapor com ela em
equilíbrio contém 60,0 mol% de A, na mesma temperatura. Admitindo
que o vapor é ideal, calcule para o sistema:
a) As atividades de A e B na solução;
b) Os coeficientes de atividade de cada componente na solução;
c) A energia livre de mistura da solução;
d) A energia livre de mistura se a solução fosse ideal;
e) A energia livre de excesso.
R.: aA = 0,814; aB = 0,894 b) γA = 1,628; γB = 1,788; c) Gmist = -378 cal;
d) Gid = -1653 cal; e) GE = 1275 cal
Você também pode gostar
- Soluções não ideais e coeficientes de atividadeDocumento1 páginaSoluções não ideais e coeficientes de atividadeTuane da Silva Cunha AlvesAinda não há avaliações
- Diagramas de Fases e Equilíbrio QuímicoDocumento4 páginasDiagramas de Fases e Equilíbrio QuímicoJanaina LeitinhoAinda não há avaliações
- Físico-química II APS 2 - Problemas de soluções ideais e não ideaisDocumento2 páginasFísico-química II APS 2 - Problemas de soluções ideais e não ideaisIzabele RamosAinda não há avaliações
- Soluções e equilíbrios entre fases condensadasDocumento5 páginasSoluções e equilíbrios entre fases condensadasCândido RamosAinda não há avaliações
- Diagramas de fase - Lista de exercíciosDocumento4 páginasDiagramas de fase - Lista de exercíciosRodrigo VieiraAinda não há avaliações
- Lista Exercicios 2 Equilibrio Liq Liq PDFDocumento8 páginasLista Exercicios 2 Equilibrio Liq Liq PDFJanaina LeitinhoAinda não há avaliações
- Lista de Exercícios 2 (PLE)Documento3 páginasLista de Exercícios 2 (PLE)Ana Carolina QuaresmaAinda não há avaliações
- Equilíbrio de Misturas Líquidas BináriasDocumento6 páginasEquilíbrio de Misturas Líquidas BináriasPaulinha PereiraAinda não há avaliações
- Soluções ideais e reais: exercícios de físico-químicaDocumento4 páginasSoluções ideais e reais: exercícios de físico-químicaAmanda Araujo RamosAinda não há avaliações
- Lista de Exercicios - Producao OrganicaDocumento4 páginasLista de Exercicios - Producao OrganicaThamiles AmaralAinda não há avaliações
- Eng. Químico - EletrobrásDocumento4 páginasEng. Químico - EletrobrásprincipiaAinda não há avaliações
- Lista - Exercicios - Diagram de FasesDocumento11 páginasLista - Exercicios - Diagram de FasesElaineAinda não há avaliações
- Fundamentos da Teoria Moderna da Dissociação EletrolíticaDocumento11 páginasFundamentos da Teoria Moderna da Dissociação EletrolíticaLara ReisAinda não há avaliações
- CRQ - 1 Lista QuestõesDocumento7 páginasCRQ - 1 Lista QuestõesDeolinda ReisAinda não há avaliações
- Livro D QuímicaDocumento11 páginasLivro D QuímicaKaua Moraes vieiraAinda não há avaliações
- Operações Unitárias 2Documento9 páginasOperações Unitárias 2Laysa LimaAinda não há avaliações
- Exercícios - ELVDocumento4 páginasExercícios - ELVTayla LuizaAinda não há avaliações
- Lista Exerc - Cios - Cap 14 e 15Documento3 páginasLista Exerc - Cios - Cap 14 e 15Nathalia SiqueiraAinda não há avaliações
- TDQDocumento7 páginasTDQNey JuniorAinda não há avaliações
- Calcular efeitos de pressão no ponto de fusão da águaDocumento23 páginasCalcular efeitos de pressão no ponto de fusão da águaPetroleo PlanaltoAinda não há avaliações
- Lista 2 - Físico-Química - AntoninoDocumento1 páginaLista 2 - Físico-Química - AntoninoElizeu FelixAinda não há avaliações
- Transformações físicas das substâncias puras e misturasDocumento4 páginasTransformações físicas das substâncias puras e misturasMaria Das Graças SantosAinda não há avaliações
- Lista de exercícios 5 - Operações Unitárias IIIDocumento7 páginasLista de exercícios 5 - Operações Unitárias IIInandasduarte15Ainda não há avaliações
- P2 FQDocumento1 páginaP2 FQceciliaAinda não há avaliações
- Exercícios de AplicaçãoDocumento1 páginaExercícios de AplicaçãoFernando CollAinda não há avaliações
- 2a Lista de ExerciciosDocumento2 páginas2a Lista de ExerciciosMarina PiresAinda não há avaliações
- Exercícios de Termodinâmica IIDocumento2 páginasExercícios de Termodinâmica IICesar SavioliAinda não há avaliações
- 2013 Exercícios de LíquidosDocumento1 página2013 Exercícios de LíquidosYara CunhaAinda não há avaliações
- Perguntas TermodinamicaDocumento7 páginasPerguntas TermodinamicaMarisa CardosoAinda não há avaliações
- Lista 3Documento3 páginasLista 3Marcello SeveroAinda não há avaliações
- Diagrama de fases Cd-Zn e Pb-SbDocumento3 páginasDiagrama de fases Cd-Zn e Pb-SbDanielAinda não há avaliações
- Lista de ExercíciosDocumento6 páginasLista de ExercíciosMikele ViannaAinda não há avaliações
- Gabarito Comentado Engenharia Química (Qui) - Versão ADocumento16 páginasGabarito Comentado Engenharia Química (Qui) - Versão AMaisa Paraguassu100% (1)
- Relatório 8 - Diagrama de Fases Líquido-VaporDocumento10 páginasRelatório 8 - Diagrama de Fases Líquido-VaporRenato Alexandre Polins JuniorAinda não há avaliações
- TD - Reta Final - Ime 2023Documento9 páginasTD - Reta Final - Ime 2023Vip DesignerAinda não há avaliações
- Seminario Diagrama Ternario 2Documento74 páginasSeminario Diagrama Ternario 2Roberta Lopes de PaulaAinda não há avaliações
- Diagrama de fases de sistema aquoso com sais A e BDocumento4 páginasDiagrama de fases de sistema aquoso com sais A e BJefferson Ferreira da Silva0% (1)
- Introdução BioquímicaDocumento17 páginasIntrodução BioquímicaNu Film CriticsAinda não há avaliações
- Binários e TernáriosDocumento8 páginasBinários e TernáriosKarina RodriguesAinda não há avaliações
- QUÍMICADocumento9 páginasQUÍMICAstefaniebuarqueAinda não há avaliações
- Exercícios DestilaçãoDocumento12 páginasExercícios DestilaçãoVITORIA DE OLIVEIRA SOARESAinda não há avaliações
- Constante de equilíbrio e exercícios de equilíbrio químicoSO2(g) + NO2(g) ⇌ SO3(g) + NO(gDocumento5 páginasConstante de equilíbrio e exercícios de equilíbrio químicoSO2(g) + NO2(g) ⇌ SO3(g) + NO(gAndryo CardosoAinda não há avaliações
- Propriedades ColigativasDocumento2 páginasPropriedades ColigativasMayanderson Rodrigues100% (1)
- Volume 01 - Capitulo 1Documento3 páginasVolume 01 - Capitulo 1fabianodeavizAinda não há avaliações
- Modelo de Prova - P2Documento11 páginasModelo de Prova - P2Kamily SoaresAinda não há avaliações
- Coligativas TExercíciosDocumento18 páginasColigativas TExercíciosalexbreisAinda não há avaliações
- Lista 03 - McCabe-ThieleDocumento6 páginasLista 03 - McCabe-ThieleGenilson E Neliane SilvaAinda não há avaliações
- Propriedades coligativas exercíciosDocumento2 páginasPropriedades coligativas exercíciosEverton SilvaAinda não há avaliações
- Provas especiais de Química e Biologia para maiores de 23 anosDocumento14 páginasProvas especiais de Química e Biologia para maiores de 23 anosSara e JorgeAinda não há avaliações
- Lista 1Documento3 páginasLista 1flaviagoncalvesAinda não há avaliações
- Aula 3 - Diagrama de Fases TernárioDocumento15 páginasAula 3 - Diagrama de Fases TernárioLiciani Inae PuttiAinda não há avaliações
- Quimica - Misturas SimplesDocumento35 páginasQuimica - Misturas SimplesMarcio100% (1)
- Fundamentos de Química - Propriedades dos Gases e Cinética QuímicaDocumento6 páginasFundamentos de Química - Propriedades dos Gases e Cinética QuímicaLaysa BebezinhaAinda não há avaliações
- Engenharia Química Operações Unitárias C Primeira Avaliação Teórica (10,0)Documento2 páginasEngenharia Química Operações Unitárias C Primeira Avaliação Teórica (10,0)Vinícius HigutiAinda não há avaliações
- Lista 2 Reatores A 2019Documento3 páginasLista 2 Reatores A 2019ClaudiaWincklerAinda não há avaliações
- Termodinâmica II: Equilíbrio Líquido-VaporDocumento3 páginasTermodinâmica II: Equilíbrio Líquido-VaporShirlei QueirozAinda não há avaliações
- Questionário sobre Química geral experimental (2021/1Documento5 páginasQuestionário sobre Química geral experimental (2021/1Abraao SantanaAinda não há avaliações
- 11 Q - Equilibrio QuimicoDocumento27 páginas11 Q - Equilibrio QuimicoJoana PereiraAinda não há avaliações
- Exercícios - ExtraDocumento5 páginasExercícios - ExtraThiago BarrettoAinda não há avaliações
- Apostila Química Orgânica: Carbono, Dienos E AromáticosNo EverandApostila Química Orgânica: Carbono, Dienos E AromáticosAinda não há avaliações
- Avaliação Do Potencial Dos Resíduos Gerados No Setor Vinícola Do Rio Grande Do Sul para Processos de BiorrefinariaDocumento1 páginaAvaliação Do Potencial Dos Resíduos Gerados No Setor Vinícola Do Rio Grande Do Sul para Processos de BiorrefinariaAngenor Geovani AulerAinda não há avaliações
- E Book AgroplasticDocumento21 páginasE Book AgroplasticAngenor Geovani AulerAinda não há avaliações
- Potenciais-Padrão QuímicaDocumento1 páginaPotenciais-Padrão QuímicalucasmanjosAinda não há avaliações
- Formulario 1 para ProvaDocumento4 páginasFormulario 1 para ProvaAngenor Geovani AulerAinda não há avaliações
- Termodinâmica de soluções não-idealDocumento4 páginasTermodinâmica de soluções não-idealHenrique BritoAinda não há avaliações
- Formulario 3 TermodinamicaDocumento2 páginasFormulario 3 TermodinamicaAngenor Geovani AulerAinda não há avaliações
- As Propriedades Coligativas São As Propriedades Do Solvente Que Se Modificam Na Presença de Um Soluto Não Volátil e Que Dependem Apenas Do Número de Partículas Do SolutoDocumento1 páginaAs Propriedades Coligativas São As Propriedades Do Solvente Que Se Modificam Na Presença de Um Soluto Não Volátil e Que Dependem Apenas Do Número de Partículas Do SolutoAngenor Geovani AulerAinda não há avaliações
- Apostila Química Dos Polímeros 2011Documento84 páginasApostila Química Dos Polímeros 2011Eva SilvaAinda não há avaliações
- Regimento Geral UniversidadeDocumento154 páginasRegimento Geral UniversidadeAngenor Geovani AulerAinda não há avaliações
- Formulario 3Documento2 páginasFormulario 3Angenor Geovani AulerAinda não há avaliações
- Formulario 1Documento3 páginasFormulario 1Angenor Geovani AulerAinda não há avaliações
- Bacia Hidrografica Do Rio Magdalena (Colombia)Documento9 páginasBacia Hidrografica Do Rio Magdalena (Colombia)Angenor Geovani AulerAinda não há avaliações
- Constante de Equilíbrio QuímicoDocumento2 páginasConstante de Equilíbrio QuímicoAngenor Geovani AulerAinda não há avaliações
- Formulario Final TermodinamicaDocumento1 páginaFormulario Final TermodinamicaAngenor Geovani AulerAinda não há avaliações
- Resultado Empírico: Fatores de FormaDocumento4 páginasResultado Empírico: Fatores de FormaAngenor Geovani AulerAinda não há avaliações
- Med. Do Tamanho Das Part. Pela Análise Das PeneirasDocumento7 páginasMed. Do Tamanho Das Part. Pela Análise Das PeneirasAngenor Geovani AulerAinda não há avaliações
- Relatório 2Documento16 páginasRelatório 2Angenor Geovani AulerAinda não há avaliações
- Conversao de UnidadesDocumento26 páginasConversao de UnidadesAngenor Geovani AulerAinda não há avaliações
- Relatório 1Documento18 páginasRelatório 1Angenor Geovani AulerAinda não há avaliações
- Relatório 1Documento18 páginasRelatório 1Angenor Geovani AulerAinda não há avaliações
- CTC troca íons em solos e águasDocumento1 páginaCTC troca íons em solos e águasAngenor Geovani AulerAinda não há avaliações
- Relatorio Extraçao DnaDocumento4 páginasRelatorio Extraçao DnaAngenor Geovani AulerAinda não há avaliações
- Sistema ABO e ImunoglobulinasDocumento6 páginasSistema ABO e ImunoglobulinasAngenor Geovani AulerAinda não há avaliações
- Cultura Tec Bas2Documento36 páginasCultura Tec Bas2Angenor Geovani AulerAinda não há avaliações
- IMUNOLOGIADocumento17 páginasIMUNOLOGIAAngenor Geovani AulerAinda não há avaliações
- Relatorio 2Documento8 páginasRelatorio 2Angenor Geovani AulerAinda não há avaliações
- TabelasDocumento3 páginasTabelasAngenor Geovani AulerAinda não há avaliações
- Exercicios Quimica Gases RbdquimicaDocumento9 páginasExercicios Quimica Gases RbdquimicaLila SantosAinda não há avaliações
- Tema 1 - A Higiene Do Trabalho e Os Agentes Físicos - Pressões AnormaisDocumento48 páginasTema 1 - A Higiene Do Trabalho e Os Agentes Físicos - Pressões AnormaisOlidio ReifeAinda não há avaliações
- ExerciciosDocumento2 páginasExerciciosNathália MendonçaAinda não há avaliações
- Apostila Capitulo 7 Umidade ArDocumento27 páginasApostila Capitulo 7 Umidade ArSabrina FernandesAinda não há avaliações
- CAPÍTULO 4 - PrecipitaçaoDocumento60 páginasCAPÍTULO 4 - PrecipitaçaoTelma Nsai Messias Gomes DiasAinda não há avaliações
- Massa Molar e Frações de Gases em MisturaDocumento3 páginasMassa Molar e Frações de Gases em MisturaRenato Vieira de SáAinda não há avaliações
- Modelo de Programa de Proteção Respiratóra - PPRDocumento32 páginasModelo de Programa de Proteção Respiratóra - PPRcelcemara92% (25)
- EF - qg28. Mistura de GasesDocumento8 páginasEF - qg28. Mistura de GasesAline OliveiraAinda não há avaliações
- Torre de arrefecimento: componentes e funçãoDocumento22 páginasTorre de arrefecimento: componentes e funçãomarcos_lopes71Ainda não há avaliações
- Prova IME 2020 Química 1Documento19 páginasProva IME 2020 Química 1lucas bernardinoAinda não há avaliações
- CompletaDocumento13 páginasCompletapaulazelindroAinda não há avaliações
- Fisioterapia e terapia ocupacional: o sono e as profissõesDocumento44 páginasFisioterapia e terapia ocupacional: o sono e as profissõesGabriela Joana67% (3)
- Refrigeração e Ar Condicionado: Guia CompletoDocumento162 páginasRefrigeração e Ar Condicionado: Guia CompletoNathan PompermayerAinda não há avaliações
- Seleção e uso correto de respiradores para proteção respiratóriaDocumento64 páginasSeleção e uso correto de respiradores para proteção respiratóriaAdma MoraisAinda não há avaliações
- Quimica 12a Classe Ficha de ApoioDocumento8 páginasQuimica 12a Classe Ficha de ApoioDilva Nota100% (1)
- Toxicologia dos Solventes OrgânicosDocumento7 páginasToxicologia dos Solventes OrgânicosJéssica CarvalhoAinda não há avaliações
- A Lei de Raoult e a formação de azeótroposDocumento17 páginasA Lei de Raoult e a formação de azeótroposMariana GonçalvesAinda não há avaliações
- Lista de Exercícios sobre Gases e suas PropriedadesDocumento4 páginasLista de Exercícios sobre Gases e suas PropriedadesNayara SaldanhaAinda não há avaliações
- Castellan - Cap 11 Exercícios 12-30Documento10 páginasCastellan - Cap 11 Exercícios 12-30Fabiana MarquesAinda não há avaliações
- C. Bombardelli - Apostila de Química Geral e Inorgânica (1a Ed.)Documento159 páginasC. Bombardelli - Apostila de Química Geral e Inorgânica (1a Ed.)Clovis Bombardelli50% (2)
- Fenômenos de Transporte - Aula 9Documento23 páginasFenômenos de Transporte - Aula 9Claudio DiogoAinda não há avaliações
- Transferência de MassaDocumento25 páginasTransferência de MassaMichelle SalgueiroAinda não há avaliações
- Estrutura da Matéria e Exercícios de Cálculos EstequiométricosDocumento25 páginasEstrutura da Matéria e Exercícios de Cálculos EstequiométricosGuilherme SaltarelliAinda não há avaliações
- Aula5 Gases PDFDocumento10 páginasAula5 Gases PDFJüvinal Pasiensia Simu DeitAinda não há avaliações
- Lista 1 - Gases IdeaisDocumento4 páginasLista 1 - Gases IdeaisDavid WellsAinda não há avaliações
- Livro Cinética e Reatores SchmalDocumento108 páginasLivro Cinética e Reatores Schmalalinecristina150550% (6)
- Gases - ExercíciosDocumento6 páginasGases - ExercíciosBruna BarbozaAinda não há avaliações
- UNEB20141 Cad2 Modelo1 PDFDocumento22 páginasUNEB20141 Cad2 Modelo1 PDFManuela Marcio Avelar da HoraAinda não há avaliações
- Propriedades dos Gases IdeaisDocumento51 páginasPropriedades dos Gases IdeaisGabriela Tivo da SilvaAinda não há avaliações
- Exercicio Transferência de MassaDocumento3 páginasExercicio Transferência de MassaPaulo HenriqueAinda não há avaliações