Escolar Documentos
Profissional Documentos
Cultura Documentos
Quimica Atividade 1B
Enviado por
mistermachado0Descrição original:
Título original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Quimica Atividade 1B
Enviado por
mistermachado0Direitos autorais:
Formatos disponíveis
Nome: Mateus Machado n°24 1°A
Exercícios pagina 53-questões :55,56,57,58 e 59
Questão 55
Solução: são misturas homogêneas de duas ou mais substâncias, ou seja podemos citar as
soluções líquidas, como a água, vinagre , sólidas, que é o caso do ouro e cobre, e gasosa, que
resultam em mistura gasosa, como as que predominam o ar , N2 e O2. Questão 56
um exemplo de solução sólida poderíamos citar o Ouro, e também liga de Níquel
e cobre
Questão 57
A-) O solvente nesse caso seria apenas a água.
B-) O soluto em maior quantidade seria o sal
Questão 58
Não, o sal não dissolve, pois as polaridades dos dois são diferentes,
enquanto o sal é polar o óleo é apolar.
3.8
Questão 59
Isso ocorre pelo fato de o óleo ter uma menor densidade que a água. E como se sabe os
líquidos de menor densidade tendem a ficar acima dos de maior densidade. Além de uma
substância ser polar(água) e a outra apolar(óleo).
PÁGINA 56-questões 61 e 62
Questão 61
Solubilidade é a quantidade do que é solúvel (que pode se dissolver) em outra substância.
Questão 62
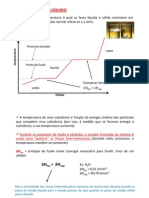
Coeficiente de solubilidade ( CS ) pode aumentar ou diminuir
a) dissolução de sólido em líquido:
- com o aumento da temperatura o CS aumenta
- a pressão não altera o CS
b) dissolução de gases em líquidos:
- com o aumento da temperatura o CS diminui
- com o aumento da pressão o CS aumenta (Lei de Henry)
Quando se trata de misturas de soluções o KPS se altera em relação à temperatura:
- Reação endotérmica: o KPS aumenta com o aumento da temperatura (solubilidade aumenta).
- Reação exotérmica: o KPS diminui com o aumento da temperatura (solubilidade diminui).
OBS:
Coeficiente de solubilidade (CS): massa de soluto que pode ser dissolvida em 100g de água
(solvente) à uma dada temperatura [m(g)/100g(água)]
Produto de solubilidade (KPS): relaciona a molaridade (concentração molar) (mol/L) com a
solubilidade do soluto (mol/L)
Você também pode gostar
- Apostila 1 de Química X - Prof Zila - UERJ PDFDocumento58 páginasApostila 1 de Química X - Prof Zila - UERJ PDFIsabelle ChristineAinda não há avaliações
- ESTUDO DAS SOLUÇÕES - Slide 2º AnoDocumento19 páginasESTUDO DAS SOLUÇÕES - Slide 2º AnoAlberio Rocha100% (1)
- Soluções e Equilíbrio de SolubilidadeDocumento17 páginasSoluções e Equilíbrio de SolubilidademariaAinda não há avaliações
- Soluções - Módulo 1Documento24 páginasSoluções - Módulo 1neyzanata5043Ainda não há avaliações
- Aula de Química Básica-SoluçõesDocumento11 páginasAula de Química Básica-SoluçõesHellen PatriciaAinda não há avaliações
- Aula04 QA SoluçõesDocumento27 páginasAula04 QA SoluçõesIzabelli de Castro BaptistaAinda não há avaliações
- Relatório - SolubilidadeDocumento7 páginasRelatório - SolubilidadeDiego E. MaylaAinda não há avaliações
- 11ano Q 2 3 2 SolubilidadedesaisemaguaDocumento8 páginas11ano Q 2 3 2 SolubilidadedesaisemaguaFrancisca FonsecaAinda não há avaliações
- Princípios de SolubilidadeDocumento3 páginasPrincípios de SolubilidadePedro Henrique Abrantes MousinhoAinda não há avaliações
- VOD Química SolubilidadeDocumento13 páginasVOD Química SolubilidadeSr. Van Hastra do CarmoAinda não há avaliações
- 378870-Módulo 01 - Soluções 1 PDFDocumento8 páginas378870-Módulo 01 - Soluções 1 PDFÍtalo SantosAinda não há avaliações
- INTRODUÇÃO AquosaDocumento8 páginasINTRODUÇÃO AquosaMauro ErnestoAinda não há avaliações
- Fisicoquimica II ApostilaDocumento36 páginasFisicoquimica II ApostilaMario SantanaAinda não há avaliações
- Analítica - Solubilidade e Precipitação 1Documento9 páginasAnalítica - Solubilidade e Precipitação 1Rayanne FrotaAinda não há avaliações
- Quc3admica Parte 62Documento5 páginasQuc3admica Parte 62Maria OliveiraAinda não há avaliações
- Resumo 02 FQDocumento3 páginasResumo 02 FQAlexandre MagnoAinda não há avaliações
- Soluções Químicas - 201Documento4 páginasSoluções Químicas - 201jucquevAinda não há avaliações
- Propriedades Coligativas 2 AnoDocumento31 páginasPropriedades Coligativas 2 AnoJúnior FerreiraAinda não há avaliações
- Quimica 18Documento29 páginasQuimica 18ascatanho100% (1)
- Química 11 e 12 SoluçõesDocumento7 páginasQuímica 11 e 12 SoluçõesJonathan AraujoAinda não há avaliações
- Composição Qualitativa de SoluçõesDocumento18 páginasComposição Qualitativa de SoluçõesCátia GomesAinda não há avaliações
- Semana 6 A 10 Soluções Solubilidade Concentrações e MisturasDocumento70 páginasSemana 6 A 10 Soluções Solubilidade Concentrações e Misturasnogueirax7Ainda não há avaliações
- Alteração Solubilidade SaisDocumento21 páginasAlteração Solubilidade SaisPetro KashevkoAinda não há avaliações
- Adolf Quimica 1Documento11 páginasAdolf Quimica 1MustaquimAinda não há avaliações
- Soluções - Parte 1 - Classificação de SoluçõesDocumento2 páginasSoluções - Parte 1 - Classificação de SoluçõesLyeniferAinda não há avaliações
- Estados Físico Da Materia e AtividadeDocumento2 páginasEstados Físico Da Materia e Atividadeantonio.junior14Ainda não há avaliações
- Alunos Material Complementar de Química - 2 A - Solubilidade - 4° BIMESTREDocumento13 páginasAlunos Material Complementar de Química - 2 A - Solubilidade - 4° BIMESTREMagnólia Viana SalgadoAinda não há avaliações
- Apostila - Eq em Reações de PrecipitaçãoDocumento11 páginasApostila - Eq em Reações de PrecipitaçãoAna Carolina LageAinda não há avaliações
- Misturas e Soluções-Texto ComplementarDocumento6 páginasMisturas e Soluções-Texto ComplementarcaoAinda não há avaliações
- SoluçõesDocumento20 páginasSoluçõesEugenio ManuelAinda não há avaliações
- Atividades Quimica ColigaçoesDocumento4 páginasAtividades Quimica Coligaçoes1011004012Ainda não há avaliações
- SOLUÇÕESDocumento98 páginasSOLUÇÕESSidney JesusAinda não há avaliações
- Aula Sobre Soluções - Parte 2Documento9 páginasAula Sobre Soluções - Parte 2Paula CaldasAinda não há avaliações
- Resumo Sobre SoluçõesDocumento19 páginasResumo Sobre SoluçõesFabíola FelixAinda não há avaliações
- Equilibrios Heterogéneos - ResumoDocumento7 páginasEquilibrios Heterogéneos - ResumoLaura MonteiroAinda não há avaliações
- Memorex Quimica - Solucoes IDocumento1 páginaMemorex Quimica - Solucoes Icon_seguirAinda não há avaliações
- Relatorio MarcoDocumento5 páginasRelatorio MarcogustavoAinda não há avaliações
- SolubilidadeDocumento4 páginasSolubilidadeDmingos JúniorAinda não há avaliações
- Estudo Das Solucoes Coeficiente de SolubilidadeDocumento13 páginasEstudo Das Solucoes Coeficiente de SolubilidadeGildo Silva100% (1)
- Introdução SoluçõesDocumento13 páginasIntrodução SoluçõesNiko Bellic50% (2)
- QuimicaDocumento4 páginasQuimicaAntonio EduardoAinda não há avaliações
- Science Subject For High School 9th Grade ChemistryDocumento9 páginasScience Subject For High School 9th Grade ChemistryEdgar PantojaAinda não há avaliações
- Quimica - 002 SolucoesDocumento5 páginasQuimica - 002 Solucoescon_seguir100% (1)
- 11ano Q 2 3 2 Solubilidade de Sais em AguaDocumento10 páginas11ano Q 2 3 2 Solubilidade de Sais em AguaRafael TeixeiraAinda não há avaliações
- Química 2° Ano EM 2Documento26 páginasQuímica 2° Ano EM 2vivianegobi0Ainda não há avaliações
- Aula 1 - SoluçõesDocumento38 páginasAula 1 - SoluçõesPEMapperAinda não há avaliações
- SOLUÇÕES CompletaDocumento70 páginasSOLUÇÕES CompletaprofmarconiAinda não há avaliações
- Equilíbrio de Solubilidade (KPS)Documento13 páginasEquilíbrio de Solubilidade (KPS)E aí? Sacô? Prof. Gabriel100% (1)
- Ficha 7 - QGDocumento7 páginasFicha 7 - QGOrenço JumaAinda não há avaliações
- Wa0046.Documento5 páginasWa0046.Miranda Graciela Ramos RezendeAinda não há avaliações
- Equilibrio de Solubilidade-SlidesDocumento40 páginasEquilibrio de Solubilidade-SlidesisraeluefsAinda não há avaliações
- Coeficiente de Solubilidadeaula 12 04 12blogDocumento7 páginasCoeficiente de Solubilidadeaula 12 04 12blogThania ArrudaAinda não há avaliações
- Instituto Federal de Pernambuco-Ifpe Campus Vitória de Santo AntãoDocumento14 páginasInstituto Federal de Pernambuco-Ifpe Campus Vitória de Santo AntãoGabriella SilvaAinda não há avaliações
- Aula03-BasesAnalíticas AlunosDocumento27 páginasAula03-BasesAnalíticas AlunosbernardoAinda não há avaliações
- Erick Leal Dos Santos Souza - NOTAS de AULA 1 Soluções 5 UnidadeDocumento6 páginasErick Leal Dos Santos Souza - NOTAS de AULA 1 Soluções 5 UnidadeNyxAinda não há avaliações
- Equilibrio de SolubilidadeDocumento39 páginasEquilibrio de SolubilidadeOdilon LeiteAinda não há avaliações
- Aula 6 - SoluesDocumento40 páginasAula 6 - Soluesryan ferreiraAinda não há avaliações
- Coeficiente de SolubilidadeDocumento1 páginaCoeficiente de SolubilidadeIara DaherAinda não há avaliações