Escolar Documentos
Profissional Documentos
Cultura Documentos
Cinética Química
Enviado por
Isah- Chanʕ ́•ᴥ•ʔ0 notas0% acharam este documento útil (0 voto)
3 visualizações6 páginasDireitos autorais
© © All Rights Reserved
Formatos disponíveis
PPTX, PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PPTX, PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
3 visualizações6 páginasCinética Química
Enviado por
Isah- Chanʕ ́•ᴥ•ʔDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PPTX, PDF, TXT ou leia online no Scribd
Você está na página 1de 6
Lembrando:
• Lei da velocidade: Determina a velocidade, a constante ou a ordem de
uma determinada reação.
• Fórmula: V= K. [
Onde:
V= velocidade da reação
K= constante de velocidade, depende da temperatura
[A= concentração do reagente A
[B= concentração do reagente B
x e y= expoente determinados experimentalmente
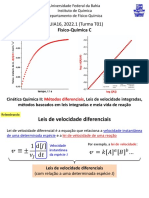
Cinética Química: Lei das velocidades integradas
• Frequentemente precisamos saber como a concentração de um
regente ou produto varia com o tempo.
Quanto de uma certa
Quanto tempo um
substância pode ser
determinado poluente
produzida em uma
leva para se decompor?
hora?
Essas questões podem
ser respondidas, usando
fórmulas derivadas de
leis de velocidade das
reações.
Leis das Velocidades integradas.
Determina a concentração de reagentes ou de produtos em função
do tempo da reação;
Dependem da ordem da reação;
Elas podem ser:
De ordem zero
De primeira ordem
De segunda ordem
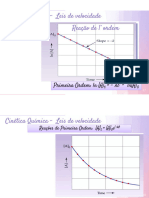
Ordem zero
Deduzida através da integração da lei de velocidade:
y = a – b.x
• Tempo meia vida:
Tempo de meia vida (t½) é o tempo necessário para que a
concentração de um reagente alcance a metade de sua
concentração inicial.
Para reações de ordem zero: [A]t = [A]0 -k.t
Substituindo [A]t por ½[A]0
½[A]0 = [A]0 -k.t ½
½[A]0 - [A]0 =-k.t½
O tempo de meia vida de ordem
-½[A]0 =-k.t½
zero, vai depender da
concentração inicial e da
½[A]0 =k.t½
constante cinética.
[A]0 = t½
2k
• Exemplo:
Um sistema de ordem zero tem constante cinética 1,56x10-5 mol/L -1.s. Quanto tempo será
necessário
para que a concentração do reagente atinja 50% do valor inicial de cada concentração?
a)1,20x10-3 mol/L
b)1,8x10-3 mol/L
Você também pode gostar
- Cinetica ResolucaoDocumento51 páginasCinetica ResolucaoCarlos Henrique0% (1)
- Relatório - Velocidade de Uma Reação QuímicaDocumento11 páginasRelatório - Velocidade de Uma Reação QuímicaRaimunda Branco100% (1)
- Cinética QuímicaDocumento51 páginasCinética QuímicaJamilly Vitoria HaperAinda não há avaliações
- Relatório Cinética Parâmetros de ArrheniusDocumento11 páginasRelatório Cinética Parâmetros de ArrheniusRafael CarvalhoAinda não há avaliações
- 1 - Testes de Estabilidade e Fundamentos de Cinetica QuimicaDocumento26 páginas1 - Testes de Estabilidade e Fundamentos de Cinetica QuimicasaullodmoAinda não há avaliações
- Cinetica Aula 01Documento54 páginasCinetica Aula 01Plinio SouzaAinda não há avaliações
- 1 - Influência Da Temperatura Na Constante de Velocidade de Reação. A Equação de ArrheniusDocumento9 páginas1 - Influência Da Temperatura Na Constante de Velocidade de Reação. A Equação de Arrheniusluizrgama0% (1)
- Relatório 9 - CONSTANTE DE VELOCIDADE DE UMA REAÇÃO DE SAPONIFICAÇÃODocumento13 páginasRelatório 9 - CONSTANTE DE VELOCIDADE DE UMA REAÇÃO DE SAPONIFICAÇÃOMatson EdwardsAinda não há avaliações
- Cinética QuímicaDocumento25 páginasCinética QuímicaJaqueline Santos BastosAinda não há avaliações
- Módulo III - Cinética Química - Parte IIDocumento13 páginasMódulo III - Cinética Química - Parte IIELMAR JUNIORAinda não há avaliações
- CQ243 - 1S2023 - Parte IDocumento21 páginasCQ243 - 1S2023 - Parte IGeisieli RodriguesAinda não há avaliações
- Cinética Química e Equilíbrio QuímicoDocumento95 páginasCinética Química e Equilíbrio QuímicoMarcos AntonioAinda não há avaliações
- Aula 15 - Cinética Parte II Química UFCDocumento21 páginasAula 15 - Cinética Parte II Química UFCアッシジエホバAinda não há avaliações
- Aula Capitulo 14 Cinetica QuimicaDocumento77 páginasAula Capitulo 14 Cinetica QuimicaMarina Sartori100% (1)
- Cinética Química Professor SubstitutoDocumento44 páginasCinética Química Professor SubstitutoLarissa ArrudaAinda não há avaliações
- Cinetica Helton Aula 1 Jan 2013Documento42 páginasCinetica Helton Aula 1 Jan 2013Robert BarbosaAinda não há avaliações
- 06 Cinética QuímicaDocumento10 páginas06 Cinética QuímicaMARIO ALBERTO LOPEZ MENDOZAAinda não há avaliações
- Quia16 (2022.1-T01) Cin-2Documento36 páginasQuia16 (2022.1-T01) Cin-2E GAinda não há avaliações
- 1.velocidade de ReaçãoDocumento16 páginas1.velocidade de ReaçãoleslyAinda não há avaliações
- Cinética Química - UFCGDocumento66 páginasCinética Química - UFCGAldenilo VieiraAinda não há avaliações
- Aula 9 - Cinética QuímicaDocumento41 páginasAula 9 - Cinética QuímicaRodrigo Figueiredo AssisAinda não há avaliações
- Apostila de CinéticaDocumento64 páginasApostila de CinéticarobinhossAinda não há avaliações
- Aula 03Documento36 páginasAula 03Naailma MartinsAinda não há avaliações
- Pré-Relatório Sobre Cinética QuímicaDocumento4 páginasPré-Relatório Sobre Cinética QuímicaAlanna CostaAinda não há avaliações
- CinéticaDocumento27 páginasCinéticaIgor Ferreira da SilvaAinda não há avaliações
- Material-Da-Aula-Curso de Química para CN 2024 (P-Aula 09 - Cinétic-Livro-DigitalDocumento79 páginasMaterial-Da-Aula-Curso de Química para CN 2024 (P-Aula 09 - Cinétic-Livro-Digitalconcursosl.m07Ainda não há avaliações
- Cinetica QuimicaDocumento54 páginasCinetica QuimicaVioleta ValèryAinda não há avaliações
- 3 Concentração e Tempo (I) CINÉTICADocumento11 páginas3 Concentração e Tempo (I) CINÉTICAclauber_dalmas0% (1)
- Aula 02 - Cinética Química - Lei de Cinética e DesintegraçãoDocumento21 páginasAula 02 - Cinética Química - Lei de Cinética e DesintegraçãoKeila de FreitasAinda não há avaliações
- Aula I Cinética QuimicaDocumento14 páginasAula I Cinética QuimicaFoxert100% (1)
- Relatório 3 - Hidrólise Do Acetato de Etila (Monyque Rosa e Monique Trindade)Documento24 páginasRelatório 3 - Hidrólise Do Acetato de Etila (Monyque Rosa e Monique Trindade)Cesar AmaralAinda não há avaliações
- Reações Irreverssíveia A Vol ConstDocumento6 páginasReações Irreverssíveia A Vol ConstMarcos SilvaAinda não há avaliações
- Cinética Química e EletroquímicaDocumento25 páginasCinética Química e EletroquímicaAmanda Eiriz FeuAinda não há avaliações
- 2º Relatório de Físico-Química Experimental - Cinética QuímicaDocumento27 páginas2º Relatório de Físico-Química Experimental - Cinética QuímicaAnonymous xauweRn4w100% (1)
- Aula 7 Cinetica QuimicaDocumento72 páginasAula 7 Cinetica QuimicaLeonardo Maciel50% (2)
- Grupo 3 Reatores HomogeneosDocumento18 páginasGrupo 3 Reatores HomogeneosLarisse SalvadorAinda não há avaliações
- Aula 1 QUI57 Reação de Primeira OrdemDocumento6 páginasAula 1 QUI57 Reação de Primeira OrdemJúlio FalcoAinda não há avaliações
- Apontamentos de Cinetica QuimicaDocumento7 páginasApontamentos de Cinetica QuimicaJoaquim BandeiraAinda não há avaliações
- Capítulo 1 - Introdução A Cinetica QuimicaDocumento9 páginasCapítulo 1 - Introdução A Cinetica QuimicaDébora Muniz de SouzaAinda não há avaliações
- 10 Apostila Quimica - CineticaDocumento3 páginas10 Apostila Quimica - CineticaAlanaAinda não há avaliações
- Cinetica e EquilibrioDocumento54 páginasCinetica e Equilibriocav2009Ainda não há avaliações
- Aula CinéticaDocumento49 páginasAula CinéticaThales Rossi SpartalisAinda não há avaliações
- Cinetica Quimica - Fisico-QuimicaDocumento40 páginasCinetica Quimica - Fisico-QuimicaGremio jovensAinda não há avaliações
- Cinética QuímicaDocumento9 páginasCinética QuímicaAnanda LimaAinda não há avaliações
- Conf#12 ACTUALIZADA Biocatalizadores. Cinética Enzimática.2018 - CópiaDocumento41 páginasConf#12 ACTUALIZADA Biocatalizadores. Cinética Enzimática.2018 - CópiaAntónio OsórioAinda não há avaliações
- Cinética de Desinfecção 1Documento21 páginasCinética de Desinfecção 1Ilca António de Oliveira NhandamoAinda não há avaliações
- Apostila Leis de VelocidadeDocumento33 páginasApostila Leis de Velocidadeisaaaasss0% (1)
- Cinetica QuimicaDocumento8 páginasCinetica QuimicaJacinto FaustinoAinda não há avaliações
- 02-Cinetica de Reacoes HomogeneasDocumento34 páginas02-Cinetica de Reacoes HomogeneasLeticia MendesAinda não há avaliações
- Cinetica Quimica EJDocumento50 páginasCinetica Quimica EJElizael De Jesus GonçalvesAinda não há avaliações
- Cinética Exp. (Relatório) - Método Das Concentrações em ExcessoDocumento15 páginasCinética Exp. (Relatório) - Método Das Concentrações em ExcessoVinicius PimentelAinda não há avaliações
- Aula 06 CineticaDocumento76 páginasAula 06 CineticaAnonymous UYDJtUnAinda não há avaliações
- Aprendendo a mecânica quântica: equação de Schrödinger em 1DNo EverandAprendendo a mecânica quântica: equação de Schrödinger em 1DAinda não há avaliações
- Ácidos e Bases de Brönsted e Lowry: Uma visão aplicada ao meio ambienteNo EverandÁcidos e Bases de Brönsted e Lowry: Uma visão aplicada ao meio ambienteAinda não há avaliações