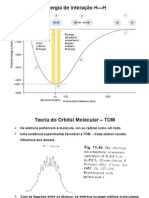
Escolar Documentos
Profissional Documentos
Cultura Documentos
Exercícios Da Teoria Do Orbital
Enviado por
Paulo Henrique Barcellos FrançaDescrição original:
Título original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Exercícios Da Teoria Do Orbital
Enviado por
Paulo Henrique Barcellos FrançaDireitos autorais:
Formatos disponíveis
Glossrio
Orbital antiligante: Uma orbital molecular maior em energia do que qualquer um dos orbitais atmicos a partir do qual derivado, quando preenchido com eltrons, empresta a instabilidade de uma molcula ou on. Energia de ligao: A quantidade de energia necessria para quebrar um mol de ligaes de um determinado tipo (na fase gasosa). Ordem de ligao: Metade do nmero de eltrons em orbitais de ligao menos metade do nmero de eltrons em orbitais antiligantes. Orbital de ligao: Uma orbital molecular mais baixo em energia do que qualquer um dos orbitais atmicos a partir do qual derivado, quando preenchida com eltrons, d estabilidade a uma molcula ou on. Orbitais degenerados: orbitais de mesma energia. Deslocalizao: A formao de um conjunto de orbitais moleculares que se estendem por mais de dois tomos; importante em espcies que a teoria da ligao de valncia descreve, em termos de ressonncia. Heteronucleares: constitudo por elementos diferentes Homonucleares: constitudo por um nico elemento. Orbitais moleculares (MO): Um orbital resultante da sobreposio e mistura de orbitais atmicos sobre tomos diferentes. Uma MO pertence molcula como um todo. Teoria do orbital molecular: A teoria da ligao qumica baseada na existncia de postulados de orbitais moleculares. Plano nodal (n): A regio em que a probabilidade de encontrar um eltron zero. Orbital no-ligante: Uma orbital molecular derivados somente a partir de um orbital atmico de um tomo; empresta nem estabilidade, nem a instabilidade de uma molcula ou on, quando preenchido com eltrons. Ligao Pi (): A ligao resultante da ocupao de eltrons de um orbital molecular pi. Orbital Pi (): Uma orbital molecular resultante da sobreposio de orbitais atmicos. Ligao Sigma (): A ligao resultante da ocupao de eltrons de um orbital molecular sigma. Orbital Sigma (): Um orbital molecular resultante da sobreposio de duas orbitais atmicos.
Exerccios
01. Descreva as principais diferenas entre a teoria da ligao de valncia e a teoria dos orbitais moleculares. 02. Na teoria de orbital molecular, que um orbital molecular? Quais os dois tipos de informaes podem ser obtidas a partir de Clculos de orbitais moleculares? Como podemos utilizar essa informao para descrever a ligao dentro de uma molcula? 03. Qual a relao entre o nmero mximo de eltrons que pode ser acomodado por um conjunto de orbitais moleculares e do nmero mximo que pode ser acomodada pela orbitais atmicas do que a MOs so formados? Qual o nmero mximo de eltrons que um MO pode conter? 04. Resposta do exerccio 3, aps a substituio de "orbitais moleculares", com "hybridized orbitais atmicas." 05. Que diferenas e semelhanas existem entre (a orbitais) atmica, (b) localizadas hybridized orbitais atmicos de acordo com a teoria da ligao de valncia, e (c) orbitais moleculares? 06. Qual a relao entre a energia de um orbital bonding molecular e as energias dos orbitais atmicos original? Qual a relao entre a energia de um orbital molecular antibonding e as energias dos orbitais atmicos original? 07. Comparar e contrastar os trs (a) Orbitais ligantes (b) orbitais antiligantes (c) orbitais no-ligantes. seguintes conceitos:
08. Descrever as formas, incluindo a localizao dos ncleos, dos orbitais e *.
09. Descrever as formas, incluindo a localizao dos ncleos, dos orbitais e *. 10. Estado as trs regras para a colocao de eltrons em orbitais moleculares. 11. O que se entende pelo termo ordem de ligao"? Qual o valor da ordem de ligao calculada? 12. Compare e ilustre as diferenas entre: (a) orbitais atmicos e orbitais moleculares, (b) Orbitais moleculares ligantes e antiligantes (c) ligaes e ligaes (d) orbitais moleculares localizados e deslocalizados. 13. possvel que uma molcula ou on poliatmicos em seu estado fundamental ter uma ordem de ligao negativa? Por qu?
Espcie homonucleares diatmicas
14. O que queremos dizer quando dizemos que uma molcula ou on : (a) homonuclear (b) heteronuclear (c) diatmica? 15. Use o diagrama de energia dos orbitais moleculares apropriadas para escrever a configurao eletrnica para cada um dos seguintes: calcular a ordem de ligao de cada um, e prever que existe. (a) H2+; (b) H2; (c) H2-; (d) H2216. Repita o Exerccio 15 para: (a) He2+; (b) He2; (c) He22+ 17. Repita o Exerccio 15 para: (a) N2; (b) Ne2; (c) C2218. Repita o Exerccio 15 para: (a) Li2; (b) Li2+; (c) O2219. Use o diagrama de energia dos orbitais moleculares apropriadas para gravar as configuraes eletrnicas das molculas e ons a seguir: (a) Be2; Be2+; Be2- (b) B2; B2+; B220. Qual a ordem de ligao de cada uma das espcies no Exerccio 19? 21. Qual das espcies no Exerccio 19 so diamagnticos e paramagnticos? 22. Usar a teoria MO para prever estabilidade relativa das espcies no Exerccio 19. Comente sobre a validade dessas previses. O que mais deve ser considerado, alm de ocupao eletrnica de MOs? 23. Que molculas diatmicas homonucleares ou ons do segundo perodo tem a seguinte distribuio eletrnica em MOs? Em outras palavras, identificar X em cada um.
24. Qual a ordem de ligao de cada uma das espcies no Exerccio 23? 25. (a) D as denominaes MO para: O2, O2-, O22-, O2+ (b) D a ordem de ligao em cada caso.(c) Match destas espcies com os seguintes comprimentos de ligao observados: 1,04 ; 1,12 ; 1,21 ; 1,33 e 1,49 . 26. (a) D as denominaes MO para: N2, N2-, N2+ (b) D a ordem de ligao em cada caso. (c) Das trs espcies, prever qual delas tem maior comprimento de ligao. 27. Supondo que o MO 2p menor em energia do que o MOS 2py e 2pz para as seguintes espcies, Descrever as configuraes eletrnicas para: (a) F2; F2+; F2- e (b) C2; C2+; C2-
28. (a) Qual a ordem de ligao de cada espcie no Exerccio 27? (b) So diamagntico ou paramagntico? (c) O que prev a teoria MO sobre a estabilidade destas espcies?
Espcies diatmicas heteronucleares
O seguinte um diagrama de nvel molecular orbital de energia para uma molcula diatmica heteronuclear, XY, em que X e Y so do perodo 2 e Y um pouco mais eletronegativo. Este diagrama pode ser usado para responder perguntas nesta seo. 29. Use o esquema anterior para preencher um diagrama de MO para NO-. Qual a ordem de ligao da NO-? paramagntico? Como voc avalia a sua estabilidade? 30. Repita o Exerccio 29 para NO+. 31. Repita o Exerccio 29 para a CN+. Consulte o diagrama anterior, mas assume que os MOs 2py e 2pz so mais baixos na energia do que a MO 2p. 32. Compare as descries MO para CN, CN- e CN2-. Consulte o diagrama anterior, mas assume que o MOs 2py e 2pz so mais baixos na energia do que a MO 2p. Qual seria mais estvel? Por qu? 33. Para cada uma das duas espcies de OF e OF-: (a) Desenhar os diagramas de energia do MO. (b) Descrever as configuraes eletrnicas. (c) Determinar as ordens de ligao e prever estabilidade relativa. (d) prever se diamagnetismo ou paramagnetismo. 34. Para cada uma das duas espcies de NF e NF+: (a) Desenhar os diagramas de energia do MO. (b) Descrever as configuraes eletrnicas. (c) Determinar as ordens de ligao e prever estabilidade relativa. (d) prever se diamagnetismo ou paramagnetismo. 35. Considerando as formas de diagramas de energia MO para molculas apolares covalentes e covalentes polares, o que voc diria sobre diagramas de MO e, portanto, sobre a sobreposio de orbitais atmicos, para os compostos inicos? 36. Para aumentar a fora da ligao no hipottico composto BC, voc adicionaria ou subtraia um eltron? Explique sua resposta com o auxlio de uma estrutura eletrnica de MO.
Deslocalizao
37. Utilize as frmulas de Lewis para representar as estruturas de ressonncia das seguintes espcies do ponto de vista da ligao de valncia e, em seguida esboar MOs para os sistemas deslocalizados: (a) NO3-, on nitrato (b) HCO3- on bicarbonato (H ligado ao O) (c) NO2-, on nitrito 38. Utilize as frmulas de Lewis para representar as estruturas de ressonncia das seguintes espcies do ponto de vista da ligao de valncia e, em seguida esboar MOs para os sistemas deslocalizados: (a) SO2, dixido de enxofre (b) O3, oznio (c) HCO2-, on formado (H ligado ao C)
Mixed Exerccios
39. Desenhar e classificar os diagramas de energia do MO para as seguintes espcies. Para cada um delas, determinar a ordem de ligao, prever a estabilidade das espcies, e prever se a espcie paramagntica ou diamagntica: (a) He2+ (b) CN (c) HeH+
40. Desenhar e classificar o diagramas de energia do MO para as seguintes espcies. Para cada um delas, determinar a ordem de ligao, prever a estabilidade das espcies, e prever se a espcie paramagntica ou diamagntica: (a) O22+ (b) HO- (c) HF 41. Qual destas espcies que voc esperaria ser paramagnticos ou diamagnticos? (a) He 2- (b) N2 (c) NO+ (d) N22+ (e) F2+
Exerccios Conceituais
42. Consulte o diagrama na Figura 9-5, se necessrio. Pode a ordem de ligao de uma espcie diatmica com 20 ou menos eltrons pode ser superior a trs? Ordem de ligao pode ser um valor que no divisvel por 0.5? Por qu? 43. Como NO ioniza para formar NO+? Faz a ligao de nitrognio e oxignio se tornar mais forte ou mais fraca? 44. Qual das molculas diatmicas homonuclear da segunda linha da tabela peridica (Li 2 para Ne2) so previstos pela teoria de MO a ser paramagntico? Quais so previstas para ter uma ordem de ligao de um? Quais so previstas para ter uma ordem de ligao de dois? Qual prevista para ter uma ordem de ligao mais elevada?
Construindo seu conhecimento
45. Quando carbono vaporiza em temperaturas extremamente altas, dentre as espcies presentes no vapor o C2 molcula diatmica. Escreva uma frmula de Lewis para C2. A sua frmula de Lewis C2 obedece regra do octeto? (C2 no contm uma ligao qudrupla.) C2 contm uma ligao simples, dupla ou tripla? paramagntico ou diamagntico? Mostrar como a teoria do orbital molecular pode ser usada para prever as respostas s perguntas deixadas sem resposta pela teoria da ligao de valncia. 46. Racionalizar as seguintes observaes em termos de estabilidade das ligaos de e : (a) A forma mais comum de nitrognio N2, enquanto que a forma mais comum de fsforo P4 (ver estrutura na Figura 2-3), (b) As formas mais comuns de oxignio O2 e O3 (menos comum), enquanto que a forma mais comum de enxofre S8.
Você também pode gostar
- QAI, COV, Poluição e Nano TiO2: estudo de fotodegradação de benzeno por nano TiO2 em revestimento cerâmico comercial e assistida por radiação ultravioletaNo EverandQAI, COV, Poluição e Nano TiO2: estudo de fotodegradação de benzeno por nano TiO2 em revestimento cerâmico comercial e assistida por radiação ultravioletaAinda não há avaliações
- Lista 1 - Ligações e TomDocumento4 páginasLista 1 - Ligações e TomEdson Miranda Marques0% (1)
- 1 - Processos Industriais Organicos PDFDocumento15 páginas1 - Processos Industriais Organicos PDFDiego TeixeiraAinda não há avaliações
- Fisico Quimica ADocumento51 páginasFisico Quimica AGisa Jacques100% (2)
- Lista 1 - NomenclaturaDocumento1 páginaLista 1 - NomenclaturaRenan OliveiraAinda não há avaliações
- Cinética QuímicaDocumento29 páginasCinética QuímicaProfessoraGianiAinda não há avaliações
- Termos EspectroscópicosDocumento14 páginasTermos EspectroscópicosLiah SkylaAinda não há avaliações
- 3 Exercicicos 2 Gases Reais PDFDocumento2 páginas3 Exercicicos 2 Gases Reais PDFVanilson SertãoAinda não há avaliações
- Aula 1 - Estudo de Gases PDFDocumento19 páginasAula 1 - Estudo de Gases PDFGuilhermeAinda não há avaliações
- Cinética Química - Expressão e Cálculo Da Velocidade - 130 QuestõesDocumento72 páginasCinética Química - Expressão e Cálculo Da Velocidade - 130 QuestõesrafelAinda não há avaliações
- Lista de Exercícios CinéticaDocumento3 páginasLista de Exercícios CinéticaLucas Morais0% (1)
- Lista Cap07 20231o - GabaritoDocumento7 páginasLista Cap07 20231o - GabaritoPedro Henrique100% (1)
- Propriedades Coligativas ResumoDocumento18 páginasPropriedades Coligativas ResumomarsjommAinda não há avaliações
- Molaridade e Normalidade - Exercícios e TeoriaDocumento3 páginasMolaridade e Normalidade - Exercícios e TeoriaAlbertoAlecioAinda não há avaliações
- Relatório de Físico Química - Calor de VaporizaçãoDocumento8 páginasRelatório de Físico Química - Calor de VaporizaçãoKarine SilvaAinda não há avaliações
- Roteiro Experimental 1 - Equilibrio QuímicoDocumento3 páginasRoteiro Experimental 1 - Equilibrio QuímicoBira VieiraAinda não há avaliações
- Relatório de Aula Prática - Determinação de Parâmetros Cinéticos de Reações HomogêneasDocumento32 páginasRelatório de Aula Prática - Determinação de Parâmetros Cinéticos de Reações HomogêneasRicardo Engenharia Ribeirão100% (1)
- Exerc. Difíceis CinéticaDocumento9 páginasExerc. Difíceis CinéticaIANAELAinda não há avaliações
- Teoria Da Ligação de Valência (RPECV)Documento16 páginasTeoria Da Ligação de Valência (RPECV)TatianyAinda não há avaliações
- Manual de Q. Inorg. ExperimentalDocumento19 páginasManual de Q. Inorg. ExperimentalDafne CavalcanteAinda não há avaliações
- 1 Lista de Química Analítica 2021Documento6 páginas1 Lista de Química Analítica 2021Acisseid SaidAinda não há avaliações
- Exercicios IIDocumento5 páginasExercicios IImax_patricioAinda não há avaliações
- Cálculo Estequiométrico - Massa - 118 QuestõesDocumento46 páginasCálculo Estequiométrico - Massa - 118 QuestõesItarralyss HericoAinda não há avaliações
- Coletania Livro IME QuímicaDocumento40 páginasColetania Livro IME QuímicaFelipe MonteAinda não há avaliações
- Química - Estudo Dos GasesDocumento31 páginasQuímica - Estudo Dos GasesKaaueAinda não há avaliações
- Lista IntrodutóriaDocumento1 páginaLista IntrodutóriaJean GalloAinda não há avaliações
- Lista Equilibrio Quimico 2012Documento12 páginasLista Equilibrio Quimico 2012Luelc SouzaAinda não há avaliações
- Elaboracao Aula 5 - Regra Da Alavanca PDFDocumento50 páginasElaboracao Aula 5 - Regra Da Alavanca PDFFelix Ferreira100% (2)
- Resolução ATIVIDADE 3 ANÁLISE INSTRUMENTALDocumento3 páginasResolução ATIVIDADE 3 ANÁLISE INSTRUMENTALLuiz BorgesAinda não há avaliações
- Estudo DirigidoDocumento25 páginasEstudo DirigidoCarlos SilvaAinda não há avaliações
- Lista de Exercícios - Cinética QuímicaDocumento2 páginasLista de Exercícios - Cinética QuímicaJoão Valdir Miranda100% (2)
- Determinação Da Entalpia de Vaporização de LíquidosDocumento7 páginasDeterminação Da Entalpia de Vaporização de LíquidosPedro Kortstee SimõesAinda não há avaliações
- Quimica Organica Exercicios Classificacao Nomenclatura GabaritoDocumento26 páginasQuimica Organica Exercicios Classificacao Nomenclatura GabaritoRones DiasAinda não há avaliações
- Aulas 4 e 5 - Porcentagem em Massa PPM e PPBDocumento3 páginasAulas 4 e 5 - Porcentagem em Massa PPM e PPBMikaylan SousaAinda não há avaliações
- Aula 1 QO II - Sistemas Insaturados ConjugadosDocumento69 páginasAula 1 QO II - Sistemas Insaturados ConjugadosPedro Morais100% (1)
- 2 Lei de Velocidade e Ordem de Reação CINÉTICADocumento13 páginas2 Lei de Velocidade e Ordem de Reação CINÉTICAclauber_dalmas100% (1)
- 25 20mol 20e 20massa 20molarDocumento28 páginas25 20mol 20e 20massa 20molarGustavoAinda não há avaliações
- Cinética Química - Expressão e Cálculo Da Velocidade - 130 QuestõesDocumento72 páginasCinética Química - Expressão e Cálculo Da Velocidade - 130 Questõesani_matrixx4733100% (1)
- Determinação de Cobre Na CachaçaDocumento3 páginasDeterminação de Cobre Na Cachaçaelainer2pAinda não há avaliações
- Slides Uv-Vis - EQ PDFDocumento49 páginasSlides Uv-Vis - EQ PDFSilvio Marinho100% (1)
- Lei de Hess - Exercícios de Revisão PDFDocumento7 páginasLei de Hess - Exercícios de Revisão PDFGeliane RochaAinda não há avaliações
- Lista de Cinética QuímicaDocumento7 páginasLista de Cinética QuímicaLeonardo Alves de OliveiraAinda não há avaliações
- Relatório 1 - VersãoDocumento7 páginasRelatório 1 - VersãoNatalia NevesAinda não há avaliações
- Exercícios de MIA I 01Documento3 páginasExercícios de MIA I 01Samuel JosexAinda não há avaliações
- Aldeídos e Cetonas - Características e Reações de Adição NucleofílicaDocumento87 páginasAldeídos e Cetonas - Características e Reações de Adição NucleofílicaTatiane Barcellos SilvaAinda não há avaliações
- TOM e ExerciciosDocumento3 páginasTOM e ExerciciosAndrade29Ainda não há avaliações
- Exercícios - Aula 9 e 10 PDFDocumento2 páginasExercícios - Aula 9 e 10 PDFmarcelo brasilAinda não há avaliações
- Exercicios P2 - Com Algumas RespostasDocumento10 páginasExercicios P2 - Com Algumas RespostasCaroline CarvalhoAinda não há avaliações
- Lista TOMDocumento2 páginasLista TOMBreno RamosAinda não há avaliações
- Lista Qfl0137 2Documento3 páginasLista Qfl0137 2nofaaonfqAinda não há avaliações
- Exercícios Orbitais MolecularesDocumento2 páginasExercícios Orbitais MolecularesRafa_ibcAinda não há avaliações
- AtividadeDocumento4 páginasAtividadelucas ronieryAinda não há avaliações
- Aula - Ligações Covalentes - Profº - Diego RobsonDocumento4 páginasAula - Ligações Covalentes - Profº - Diego RobsonDiego RobsonAinda não há avaliações
- Lista de Exercicios - Ligacao QuimicaDocumento4 páginasLista de Exercicios - Ligacao QuimicaGabriel Cristofoletti DiorioAinda não há avaliações
- Ficha # 1 - Estrutura AtomicaDocumento2 páginasFicha # 1 - Estrutura AtomicaFáusia Paulo ChirindzaAinda não há avaliações
- Lista de Química Parte 1Documento3 páginasLista de Química Parte 1Futuros OficiaisAinda não há avaliações
- Ligações Covalentes - TomDocumento64 páginasLigações Covalentes - TomMarcus Vinicius100% (1)
- Segunda Lista QG2Documento5 páginasSegunda Lista QG2JACIANNY MARIELLY DOS SANTOS BEZERRAAinda não há avaliações
- Resumo Geral Sobre Tom e TLVDocumento6 páginasResumo Geral Sobre Tom e TLVLEE MARXAinda não há avaliações
- Líquidos Iônicos À Temperatura AmbienteDocumento7 páginasLíquidos Iônicos À Temperatura AmbientePaulo Henrique Barcellos FrançaAinda não há avaliações
- Apresentação Defesa Paulo FinalDocumento52 páginasApresentação Defesa Paulo FinalPaulo Henrique Barcellos FrançaAinda não há avaliações
- Líquidos Iônicos À Temperatura AmbienteDocumento7 páginasLíquidos Iônicos À Temperatura AmbientePaulo Henrique Barcellos FrançaAinda não há avaliações
- Formulario Aproveitamento de Credito - Cursado No PPGQBDocumento1 páginaFormulario Aproveitamento de Credito - Cursado No PPGQBPaulo Henrique Barcellos FrançaAinda não há avaliações
- Indicadores Naturais de PHDocumento5 páginasIndicadores Naturais de PHalexandrefpiresAinda não há avaliações
- 1 Lista Org AvancDocumento7 páginas1 Lista Org AvancPaulo Henrique Barcellos FrançaAinda não há avaliações
- QuestligquimicaDocumento2 páginasQuestligquimicaKilça Tanaka BotelhoAinda não há avaliações
- Lista de Exerícios 5 - Análise InstrumentalDocumento3 páginasLista de Exerícios 5 - Análise InstrumentalGabriela MoragasAinda não há avaliações
- Niveis de EnergiaDocumento4 páginasNiveis de EnergiaFidel ManuelAinda não há avaliações
- Acido Base Química OrgânicaDocumento41 páginasAcido Base Química OrgânicaRodrigo Mendes PereiraAinda não há avaliações
- Lista QuimicaDocumento13 páginasLista QuimicaLohana Rodrigues PereiraAinda não há avaliações
- Relacoes Entre Eecc em Sistemas Oh e TDDocumento17 páginasRelacoes Entre Eecc em Sistemas Oh e TDSilvia CristinaAinda não há avaliações
- Arranjo GeometriaDocumento16 páginasArranjo GeometriaeiqzieqsAinda não há avaliações
- Lista de Exercícios 1 - Modelo Atômico e Números Quânticos - Prof Aline JoanaDocumento2 páginasLista de Exercícios 1 - Modelo Atômico e Números Quânticos - Prof Aline JoanaJúlia Blank HolzAinda não há avaliações
- Equilibrio Envolvendo Ions ComplexosDocumento22 páginasEquilibrio Envolvendo Ions ComplexosGilberto T. de Carvalho0% (1)
- Seminário Inorgânica - Ácidos e BasesDocumento28 páginasSeminário Inorgânica - Ácidos e BasesGabriel MarquesAinda não há avaliações
- Discussão Dos Resultados - UV - VisDocumento5 páginasDiscussão Dos Resultados - UV - VisPatrick Rodrigues BatistaAinda não há avaliações
- FluorimetriaDocumento6 páginasFluorimetriaZairaAinda não há avaliações
- Aula 03 de 05 (Espectroscopia UV, IV, AA, Flourescencia, Fosforescencia) - ProfDocumento114 páginasAula 03 de 05 (Espectroscopia UV, IV, AA, Flourescencia, Fosforescencia) - ProfNelson VirgilioAinda não há avaliações
- 11ano Q 2 1 1 Acidos e BasesDocumento8 páginas11ano Q 2 1 1 Acidos e BasesInês JuliãoAinda não há avaliações
- Estudo Comparativo Entre As Teorias Acido-BaseDocumento36 páginasEstudo Comparativo Entre As Teorias Acido-BaseZoordiAinda não há avaliações
- Seminário Espectroscopia Massas 1Documento24 páginasSeminário Espectroscopia Massas 1kauevergaraAinda não há avaliações
- Complexos Com Ligantes Pi ReceptoresDocumento33 páginasComplexos Com Ligantes Pi ReceptoresYzabelli Ribeiro100% (2)
- Lentes EletromagnéticasDocumento35 páginasLentes EletromagnéticasPaulo ToninAinda não há avaliações
- Ácido BaseDocumento3 páginasÁcido BaseLuciara MafraAinda não há avaliações
- Teorias Da Ligação Química - Química Geral - 2018 PDFDocumento80 páginasTeorias Da Ligação Química - Química Geral - 2018 PDFSérgio Daniel AndréAinda não há avaliações
- Camada de ValênciaDocumento3 páginasCamada de ValênciaRtyu IuytAinda não há avaliações
- Classificação de Carbonos e GeometriaDocumento3 páginasClassificação de Carbonos e GeometriaMarcela NascimentoAinda não há avaliações
- Aula 5 - Geometria MolecularDocumento18 páginasAula 5 - Geometria MolecularGuilherme DiaconiucAinda não há avaliações
- Ficha Adaptada 4 - Substâncias IónicasDocumento2 páginasFicha Adaptada 4 - Substâncias IónicasFilipaOliveiraAinda não há avaliações
- 1.1.5energia de Remoção EletrónicaDocumento19 páginas1.1.5energia de Remoção EletrónicaMarta AguiarAinda não há avaliações
- Espectrometria de Absorção Atômica e em ChamaDocumento19 páginasEspectrometria de Absorção Atômica e em ChamaVirgulino CamposAinda não há avaliações
- Rlatório 3 - Extração Ácido e BaseDocumento6 páginasRlatório 3 - Extração Ácido e BaseCBA CREDAinda não há avaliações
- Equilibrio de ComplexacaoDocumento37 páginasEquilibrio de ComplexacaoAlexsander LopesAinda não há avaliações
- Ligações Intermoleculares: Trabalho Realizado Por: Rafael Sousa Gonçalo AguiarDocumento10 páginasLigações Intermoleculares: Trabalho Realizado Por: Rafael Sousa Gonçalo AguiarRafael SousaAinda não há avaliações
- Relatorio Espectrofotometria Uv-VisDocumento9 páginasRelatorio Espectrofotometria Uv-VisNelio Bento JuniorAinda não há avaliações