Escolar Documentos
Profissional Documentos
Cultura Documentos
02 Quimica Aula 22 04
Enviado por
juliocezarfranciscomartinsinfaTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
02 Quimica Aula 22 04
Enviado por
juliocezarfranciscomartinsinfaDireitos autorais:
Formatos disponíveis
___________________, ____ de Abril de 2.
022
Aluno(a):_______________________________________________________________________________
Disciplina: • Química Professor: • Glauco Conteúdo• Soluções
QUIMICA II 1- SOLUÇÕES b) Misturas Homogêneas visualiza-se uma única fase
sem distinção alguma de nenhum componente, são
1. Introdução sistemas contínuos e de fácil estudo. As soluções
verdadeiras ou apenas SOLUÇÕES serão sempre
Este tópico que iremos estudar é o alicerce de toda a Físico-Química misturas homogêneas.
Os conceitos de solução, soluto, solvente e tipos de solução são
importantíssimos e por isso devem ser muito bem explicados pelos
professores e compreendidos pelos alunos. Apesar de sua Cuidado: Leite e sangue são exemplos de misturas heterogêneas.
importância, é uma matéria simples e gostosa de estudar, sendo
assim vamos ao que nos interessa. 2. SOLUÇÕES
Dispersões Partes de uma solução
São todas as misturas de duas ou mais substâncias. a) Solvente substância que dissemina a outra(s),
As dispersões podem ser classificados de acordo com o tamanho das que SOLVATA, a que está em maior quantidade.
partículas disseminadas no dispersante; por meio desse critério b) Soluto substância disseminada, solvatada, em
temos: menor quantidade.
a) Suspensão: partículas disseminadas com diâmetro Convenções nas notações
maior que 1000 nm.
ex: água e areia. a) Índice 1: refere-se ao soluto m1, M1, V1, ...
b) Colóide: partículas disseminadas com diâmetro b) Índice 2: refere-se ao solvente m2, V2, M2, ...
entre 1 e 1000 nm. c) Sem índice: refere-se à solução m, V, M
ex: água e pó de gelatina.
c) Solução (também dita solução verdadeira):
partículas disseminadas com diâmetro menor do obviamente m = m1 + m2 ; V= V1 + V2
que 1nm.
ex: água e sal.
Coeficiente de solubilidade (Cs)
nm = nanômetro 1nm = 10–9m
Definição: indica qual a máxima quantidade de soluto (m1) que pode
Dispersante x Disperso ser DISSOLVIDA em uma quantidade padrão de solvente (100g de
H2O) para formar uma SOLUÇÃO SATURADA a uma determinada
• Disperso é a substância que será disseminada. TEMPERATURA.
Nos casos acima são a areia, pó de gelatina e o sal.
• Dispersante é a substância que dissemina. Nos Unidade: [Cs] = g de soluto / 100g de H2O a θºC
casos acima é a água.
ex: Csx = 10g / 100g H2O a 25ºC, entende-se: para saturar 100g de
Nos concursos de nível médio (UnB, EsPCEx, ITA, IME) são H2O a 25ºC são necessários 10g do soluto x.
raros os casos nos quais a água não é o dispersante, uma
vez que a água é chamada de solvente universal e se Classificação das soluções em relação a m1 versus Cs
constitui, assim, como um grande transportador de outras
substâncias. a) INSATURADA Se m1 < cs ou seja, a quantidade de
soluto DISSOLVIDA é menor do que o Cs.
Nas soluções o dispersante será chamado de SOLVENTE e b) SATURADA se m1 = Cs ou seja, a quantidade de
geralmente estará em maior quantidade e o disperso será o soluto DISSOLVIDA é igual ao Cs.
SOLUTO e estará em menor quantidade. c) SUPERSATURADA se m1 > Cs ou seja, a
quantidade de soluto dissolvida é maior do que o
Misturas Homogêneas x Misturas Heterogêneas Cs.
a) Misturas Heterogêneas consegue-se distinguir
mais de uma fase da mistura. No caso de uma
SUSPENSÃO o DISPERSO, que é visível a olho nu,
poderá ser separado do dispersante por processos
mecânicos simples como a filtração, decantação,
sifonação e a centrifugação. Já no sistema COLOIDAL a
separação ao disperso se dará por processos
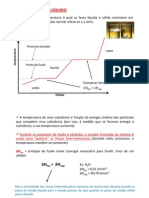
mecânicos mais elaborados como ultra-filtração, 3. Curvas de solubilidade
ultra-centrifugação etc...
Definição: Mostram o comportamento do Cs em função da
temperatura (t) ou seja Cs=f(t)
“DISCIPLINA, ISSO SEPARA OS BONS DOS MELHORES !!!”
http://www.cursosglaucoleyser.com.br
-1-
Seja uma curva de solubilidade de uma dada substância x, como
mostrado a seguir:
Conclusões a respeito da análise das curvas de solubilidade.
As conclusões abaixo geralmente não se encontram em livros pois
são cobradas em concursos e são IMPLICITAS à análise das curvas,
principalmente quando estão representados mais de um soluto no
mesmo gráfico.
Assim de acordo com o gráfico abaixo:
Tomando curvas de solubilidade, como a do KNO3, NaCℓ e NaOH
em água, podemos concluir:
Tipos: existem 02 tipos de curvas de solubilidade de acordo com o
comportamento do Cs em função da temperatura assim:
1ª Conclusão: qual a soluto mais sensível à variação da temperatura?
Observe que, dentre a substância mais sensível à variação de
temperatura quanto à solubilidade é o KNO3. Para uma variação de
temperatura (z – x), as variações de solubilidade das substâncias são:
KNO3 : z1 – x1; NaCℓ : z2 – x2 ; NaOH : x3 – z3
Como (z1 – x1) > (x3 – z3) > ( z2 – x2), a maior variação de solubilidade é
a do KNO3, enquanto a menor é a do NaCℓ. Portanto, o NaCℓ é o
menos sensível à variação de temperatura. Com isso, podemos
concluir que quanto mais próxima da vertical for a curva de
solubilidade, mais sensível é a substância à variação de temperatura.
2ª Conclusão: Qual substância é mais solúvel a uma determinada
temperatura?
Outra pergunta freqüente é: qual das três substâncias é a mais
solúvel em água? Depende da temperatura. Na temperatura x, o
maior Cs é o do NaOH, que neste caso é a substância mais solúvel. Na
temperatura y, a mais solúvel é o NaCℓ e na temperatura z, é o KNO3.
3ª Conclusão: Quais substâncias têm dissoluções endotérmicas ou
exotérmicas?
Basta ver quais curvas são crescentes e estas serão endotérmicas e
as que são decrescentes serão as exotérmicas.
4ª Conclusão:Situações hipotéticas do gráfico: quando serão
saturadas, insaturadas ou supersaturadas?
Ao analisarmos as curvas de solubilidade é muito simples
identificarmos se a situação representa uma saturadas, insaturação
ou supersaturação vejamos.
“DISCIPLINA, ISSO SEPARA OS BONS DOS MELHORES !!!”
http://www.cursosglaucoleyser.com.br
-2-
Situação Inicial A: A Dissolução completa de 40g do soluto x a 20ºC
em 100g de H2O será uma solução SATURADA.
Situação B: Por meio de um lento e controlado resfriamento da
solução A atingimos a temperatura de 18ºC (Cs= 36g) com 40g de
soluto dissolvido. Isso configura uma SUPERSATURADA. Excesso de
4g dissolvido.
Situação C: Por uma perturbação (agitação) no sistema, precipitam
os 4g do excesso formando assim uma solução sobrenadante
saturada e uma parte sólida chamado de precipitado, corpo de fundo
ou corpo de chão
Assim sendo, de acordo com o gráfico acima e a uma temperatura “t” Se adicionarmos cristais do sal em uma solução supersaturada desse
temos: sal, esses cristais ocasionarão a precipitação de todo o excesso de sal
Cs=ye dissolvido. Esses cristais chamam-se de GERMENS DE
assim CRISTALIZAÇÃO.
Ponto D → quantidade x e x < y → INSATURADA
Ponto A → quantidade y e y = y → SATURADA 3.1. Unidades de Concentração de Soluções
Ponto E → quantidade z e z > y → SUPERSATURADA
Servem apenas para que tenhamos uma melhor compreensão da
Vimos que alterando a quantidade do soluto dissolvido, a uma noção de solução concentrada e diluída. Sendo assim as principais
mesma temperatura (t), atingiremos todas as classificações de são:
soluções.
Concentração Comum (C)
m1 m =
Para uma mesma quantidade de soluto e com uma variação da C= (g / ) 1
temperatura podemos ter também todas as classificações de V V=
soluções. Vejamos:
Densidade (d)
m m=
Para uma massa de soluto (m1) igual a y podemos ter: d= (g / m )
V V =
m1=ye
Titulo ou Porcentagem em massa (τ)
assim m =
m1
Ponto B → temp = t 1 → Cs = x ; y > x → SUPERSATURADA τ= (%) 1
Ponto A → temp = t → Cs = y ; y = y → SATURADA
m m=
Ponto C → temp = t → Cs = z ; y > z → INSATURADA
2 Molaridade ou concentração molar ()
n 1 n 1 =
Conclui-se com as 2 simulações acima, mesma temperatura 1º ou =
mesma massa de soluto 2º que: V V =
Unidade m (mol/, molar, M)
Pontos acima da curva são SUPERSATURADOS E e B
Pontos sobre a curva são SATURADOS A
Pontos abaixo da curva são INSATURADADOS C e D
• EQUIVALENTE GRAMA (eq – g) DE UMA SUBSTÂNCIA – E
5ª Conclusão – Obtenção de soluções SUPERSATURADAS
Se massas diferentes, de substâncias diferentes, são capazes de
Uma solução SUPERSATURADA é obtida pelo resfriamento lento de reagir com uma mesma massa de determinada substância, então
uma solução saturada, de um soluto cuja dissolução seja essas massas se equivalem quimicamente, ou seja, são
ENDOTÉRMICA. No gráfico abaixo da situação “A” para a “B”. A equivalentes químicos. – (definição retirada do livro de química
solução supersaturada é muito instável e qualquer perturbação fará da Martha Reis)
com o que a quantidade acima do Cs (excesso de soluto) precipite
tornando-se SATURADA COM CORPO DE FUNDO OU PRECIPITADO, Regras para a determinação do equivalente grama de:
no gráfico representado pela passagem da situação “B” para a “C”.
a) Substâncias simples E =
M→ M = massa molar
K → K = valência do elemento
Ex: Do cálcio E = 40 = 20g
2
Do sódio E = 23 = 23g
1
Do alumínio E = 27 = 9g
3
b) Substâncias compostas E = M K = carga total do cátion ou
K
ânion
“DISCIPLINA, ISSO SEPARA OS BONS DOS MELHORES !!!”
http://www.cursosglaucoleyser.com.br
-3-
Ex: CaC2 → E = M
2 entre ex = ey → NxVx = Ny . Vy
Ex: A2 (so4)3 → E = 342
6 Onde: Nx = Normalidade a ser determinada
c) De ácidos ou bases Vx = Volume utilizado de X
Ny = Normalidade da subst.y
Vy = Volume utilizado de y.
E = M ; K = nº de H+ ou OH–
K
Exemplo 1
Ex H2SO4 → E = 48 = 49g
2
Um volume de 20 ml de NaOH de molaridade desconhecida foi
Mg(OH)2 → E = 58 = 29g neutralizada por 30 ml de H2SO4 de molaridade 2 molar. Qual a
2
molaridade de NaOH?
Ca(OH)2 → E = 74 = 37g
2
Solução: Apesar de tratar de molaridade, usa-se o principio da
• Número de equivalentes grama (e) equivalência:
ebase = eácido → Nb . Vb = Na . Va → Nb . 20 = Na . 30
e = m m = massa de substância
E E = eq − g da substância
→ lembrar que N = m . K, então: mb . Kb . 2 = ma . Ka 3
• Normalidade (N)
→ mb . 1 . 2 = 2 . 2 . 3 → mb = 6 molar
N = e1 (eq – g/l) Exemplo 2
V
– Relações entre normalidade e molaridade e com Uma amostra de 40 ml de solução aquosa de ácido clorídico de
concentração comum. concentração comum 15g/l, foi totalmente neutralizada por 500 ml
de uma solução aquosa de hidróxido de alumínio. Qual a
m1 normalidade dessa solução? (Cl = 35,5; H = 1)
N = e1 → N = E → N = m1 ①
Solução: eácido = ebase → Na . Va = Nb . Vb → Na . 40 = Nb 500
V V E.V
m1
m1 então N = C → C = N . E ②
4 . Na = 50 . Nb ① → Lembre que Na = ma . Ka → Na = . Ka→
C = 1 M1. V
V E
De ① C .K a ② 4 . C .K a
Na = , assim: ② em ① → = 50 . Nb →
n1 m1. k n .k M1 M
= então N = m1 →N= →N= 1 ↝
v M1 M1 .V V 4 .15 .1
.V = 50 . NB → NB = 0,33 eq – g/
K 36,5
N= .K③
A expressão ② mostra a relação entre normalidade e
concentração comum é a expressão ③ demonstra a
relação entre normalidade e molaridade de uma solução
EXERCICIOS DE FIXAÇÃO
1) Calcule o número de equivalentes-grama (e) contido nas
massas dos ácidos, das bases e dos sais relacionados abaixo.
a) 217 g de H2CO3
b) 35,6 g de H4P2O7
c) 100 g de NaOH
d) 825 g de Pb(OH)4
e) 154 g de FeS
f) 257,85 g de Ca3(PO4)2
2) Uma indústria comprou hidróxido de sódio como matéria-
prima, sabendo que o material apresentava impurezas
inertes ao HC.
Certa amostra com massa igual a 3,0 g daquele álcali foi
completamente neutralizada por 20 mL de HC 3,0 eq/L.
4. TITULOMETRIA OU TITULAÇÃO
Pedem-se:
a) a porcentagem de pureza do NaOH;
b) a massa do material necessário para a preparação de 1 L
de solução 1,0 eq/L.
A titulometria é um procedimento
utilizado para determinar a 3) Um acidente numa indústria química fez com que 60 L de
concentração de uma solução uma mistura de volumes iguais de ácido sulfúrico e ácido
problema (x) por meio de uma clorídrico, ambos 0,1 eq/L, fossem liberados diretamente
reação química entre volumes para um condutor que se dirige a um lago das proximidades.
conhecidos desta solução e de uma Sem tempo de impedir que o vazamento atingisse o lago,
outra de concentração conhecida.(y) um químico da industria resolve neutralizá-lo com a
Basea-se no principio da igualdade quantidade adequada de hidróxido de cálcio. Embora essa
“DISCIPLINA, ISSO SEPARA OS BONS DOS MELHORES !!!”
http://www.cursosglaucoleyser.com.br
-4-
medida seja justificável por evitar que as águas do lago
tenham seu índice de acidez (pH) sensivelmente alterado
pela dissolução da mistura ácida, ela serve apenas como
paliativo, uma vez que um aumento da concentração de sais
na água compromete a sobrevivência de espécies animais e
vegetais adaptadas para a água doce.
a) Equacione as reações de neutralização envolvidas.
b) Qual o sal que formado nessa reação será dissolvido pela
água do meio e arrastado para o lago?
c) Qual o sal que poderá ser arrastado mecanicamente como
resíduo sólido para o lago?
d) Calcule a massa de hidróxido do vazamento.
Relações entre as unidades-A serem feitas pelo aluno em
sala de aula!
________________________________________________________
________________________________________________________
________________________________________________________
3.2. Diluição de Soluções
Diluir uma solução nada mais do que diminuir sua concentração, e
isso ocorrerá por uma retirada de soluto (muito difícil) ou pelo De solutos diferentes que reagem entre si
acréscimo de solvente o que é muito simples. Para fins matemáticos veremos como último tópico do nosso conteúdo de química, após
básicos trabalharemos com o acréscimo de solvente mantendo a estequiometria.
quantidade de soluto sempre constante.
Exercícios
1. Em diabéticos, a ingestão de 80 g de açúcar comum (sacarose)
Esquematicamente. eleva a quantidade de glicose (C6H12O6) no sangue em 1,0 g de
glicose para cada litro de sangue. Considerando-se que a taxa de
glicose no sangue dos diabéticos, em condições normais, é de
aproximadamente 1,4 g/L, a concentração de glicose no sangue
de uma pessoa diabética após o consumo de 100 g de açúcar
será de aproximadamente:
a) 7,8x10–3 mol/L
b) 6,9x10–3 mol/L
c) 6,9x10–2 mol/L
Se retirarmos solvente (por evaporação, por exemplo) o raciocínio é d) 1,5x10–2 mol/L
o mesmo porém haverá um aumento nas concentrações das e) 1,5x10–1 mol/L
soluções.
2. O grande volume de esgotos clandestinos lançados nos
3.3. Mistura de Soluções mananciais da grande São Paulo é uma das causas da
proliferação de algas microscópicas nocivas. Essas algas
De solutos iguais Esquematicamente comprometem a qualidade da água. Concentrações de CO2
acima do limite de 2,5 x 10–3 mol/L aceleram o crescimento de
alguns tipos de algas. Numa represa de 5000 litros, assinale a
alternativa correspondente à massa limite (em Kg) de CO2 citada
acima.
a) 0,55
b) 1,10
c) 2,20
d) 4,40
e) 5,50
3. Uma solução de ácido sulfúrico, para ser utilizada em baterias de
chumbo de veículos automotivos, deve apresentar concentração
igual a 4 mol/L. O volume total de uma solução adequada para
se utilizar nestas baterias que pode ser obtido a partir de 500 mL
de solução de H2SO4 de concentração 18 mol/L, é igual a:
a) 0,50 L
b) 2,00 L
c) 2,25 L
d) 4,50 L
e) 9,00 L
De solutos diferentes que não reagem entre si.
4. O tratamento de água não elimina alguns poluentes
Esquema potencialmente tóxicos, como os metais pesados. Por isso, é
importante que indústrias instaladas ao longo de rios que sejam
fontes de água para a população tenham seus rejeitos
controlados. Considere uma indústria que lançou, em um curso
de água, 20 000 litros de um rejeito contendo 1 g/L de CdCl2. Se
metade desse rejeito encontrar o seu destino em um tanque de
“DISCIPLINA, ISSO SEPARA OS BONS DOS MELHORES !!!”
http://www.cursosglaucoleyser.com.br
-5-
uma estação de tratamento de volume 50 x 106 litros, a 10. Misturando-se 20 mL de solução de NaC, de concentração 6,0
concentração de cádmio aí será de aproximadamente
(Cd=112,4g/mol; Cl=35,5g/mol): mol/L, com 80mL de solução de NaC, de concentração 2,0
a) 1 x 10–6 mol/L mol/L, são obtidos 100mL de solução de NaC, de concentração,
b) 1 x 10–5 mol/L em mol/L igual a:
c) 5 x 10–4 mol/L a) 1,4
d) 1 x 10–4 mol/L b) 2,8
e) 5 x 10–3 mol/L c) 4,2
d) 5,6
5. Evapora-se completamente a água de 40 g de solução saturada e) 4,0
de nitrato de prata, sem corpo de fundo, e obtêm-se 15 g de
resíduo sólido. O coeficiente de solubilidade do nitrato de prata
para 100 g de água na temperatura inicial é:
a) 25g
b) 30g
c) 60g
d) 15g
e) 45g
6. Uma dona de casa, ao preparar um refresco adicionou um
envelope de suco de refresco e 4 colheres de açúcar em 1,5 litro
de água fria e homogeneizou.
Considere:
1 colher de açúcar: 18 g
1 envelope de refresco: 50 g
Densidade da água: 1,00 g/mL.
Qual é a porcentagem dos sólidos dissolvidos na solução
preparada?
a) 6,0%
b) 12,0%
c) 7,5%
d) 3,0%
e) 4,5%
7. A dosagem de etanol no sangue de um indivíduo mostrou o valor
de 0,080 g por 100 mL de sangue. Supondo que o volume total
de sangue desse indivíduo seja 6,0 L e admitindo que 12% do
álcool ingerido se encontra no sangue, quantas doses de bebida
alcoólica ele deve ter tomado?
Considere: 1 dose de bebida alcoólica = 20 mL
Porcentagem aproximada, em volume, de etanol na bebida =
50%
Densidade do etanol = 1,0 g/mL.
a) 2
b) 4
c) 5
d) 6
e) 7
8. A 30°C a solubilidade do nitrato de prata em água é de 3.000 g
por quilograma de água. Adicionam-se, a 30°C, 2.000 g desse sal
a 500 g de água, agita-se vigorosamente e depois filtra-se. Qual
a massa da solução saturada obtida?
a) 1.000 g
b) 1.500 g
c) 2.000 g
d) 2.500 g
e) 3.000 g
9. Na preparação de 500mL de uma solução aquosa de H2SO4 de
concentração 3 mol/L, a partir de uma solução de concentração
15 mol/L do ácido, deve-se diluir o seguinte volume da solução
concentrada:
a) 10mL
b) 100mL
c) 150mL
d) 300mL
e) 450mL
“DISCIPLINA, ISSO SEPARA OS BONS DOS MELHORES !!!”
http://www.cursosglaucoleyser.com.br
-6-
Você também pode gostar
- Soluções e propriedades coligativasDocumento12 páginasSoluções e propriedades coligativasMartinõ MarcellAinda não há avaliações
- Mod 12 Quimica 2014Documento13 páginasMod 12 Quimica 2014Aline F da CostaAinda não há avaliações
- Biofísica para ciências biomédicas – 4ª ediçãoNo EverandBiofísica para ciências biomédicas – 4ª ediçãoAinda não há avaliações
- Apostila Quimica2Documento33 páginasApostila Quimica2resolvidos0% (1)
- Tratamento de Lodos de Estações de Tratamento de ÁguaNo EverandTratamento de Lodos de Estações de Tratamento de ÁguaAinda não há avaliações
- SoluçõesDocumento5 páginasSoluçõesThiago DiosAinda não há avaliações
- Aula 02 - 2ºano - SOLUÇÕES - 01 - 2023Documento34 páginasAula 02 - 2ºano - SOLUÇÕES - 01 - 2023Ágata LohanaAinda não há avaliações
- SoluesDocumento12 páginasSoluesMarceloCardosoAinda não há avaliações
- Soluções químicas éDocumento3 páginasSoluções químicas éSAMIR SANTOSAinda não há avaliações
- Apostila Físico-Química1Documento29 páginasApostila Físico-Química1Diego E MarinaAinda não há avaliações
- AAula 01 - SoluçõesDocumento15 páginasAAula 01 - Soluçõeskilvia LAinda não há avaliações
- Adolf Quimica 1Documento11 páginasAdolf Quimica 1MustaquimAinda não há avaliações
- BALC - Aula 5 - Soluções e DisperssõesDocumento16 páginasBALC - Aula 5 - Soluções e DisperssõesBruna CostaAinda não há avaliações
- Cursinho Química SoluçõesDocumento7 páginasCursinho Química SoluçõesJonathan AraujoAinda não há avaliações
- 4 Solucoes TeoriaDocumento9 páginas4 Solucoes TeoriaIsabela MarcelinoAinda não há avaliações
- Dispersões: É Um Processo de Mistura de Substâncias, No Qual Classificamos Como: Homogêneas Ou HeterogêneasDocumento12 páginasDispersões: É Um Processo de Mistura de Substâncias, No Qual Classificamos Como: Homogêneas Ou HeterogêneasbarbypratesAinda não há avaliações
- Aula1 SoluçõesDocumento41 páginasAula1 SoluçõesLuana Silva FerreiraAinda não há avaliações
- Quimica Livro2 Parte2 Capitulo1Documento54 páginasQuimica Livro2 Parte2 Capitulo1pedrohps10Ainda não há avaliações
- Aula Sobre Soluções - Parte 1Documento41 páginasAula Sobre Soluções - Parte 1Paula CaldasAinda não há avaliações
- Soluções AquosasDocumento63 páginasSoluções AquosasGesiane Cabral de FreitasAinda não há avaliações
- 01 - SoluçõesDocumento5 páginas01 - SoluçõesJaque SoaresAinda não há avaliações
- Dispersões, Soluções e Coeficiente de SolubilidadeDocumento6 páginasDispersões, Soluções e Coeficiente de SolubilidadeSidney ChristAinda não há avaliações
- Requisitos químicos da água potável e concentrações em soluçõesDocumento3 páginasRequisitos químicos da água potável e concentrações em soluçõesKarina MagnoAinda não há avaliações
- Agua e Solucoes 2Documento27 páginasAgua e Solucoes 2Crelio LangaAinda não há avaliações
- Soluções químicas: tipos, componentes e unidades de concentraçãoDocumento3 páginasSoluções químicas: tipos, componentes e unidades de concentraçãohichuana gallina100% (1)
- 2 AnoDocumento32 páginas2 Anoestrela_black_02Ainda não há avaliações
- DISPERSOES Prof. CleberDocumento62 páginasDISPERSOES Prof. CleberceliogardeonAinda não há avaliações
- Poligrafo T8 QuimicaDocumento15 páginasPoligrafo T8 QuimicaGabriel silvaAinda não há avaliações
- Teoria SoluçõesDocumento18 páginasTeoria SoluçõesGiorgio AntoniolliAinda não há avaliações
- Quimica 18Documento29 páginasQuimica 18ascatanho100% (1)
- Química - Pré-Vestibular Impacto - SolubilidadeDocumento2 páginasQuímica - Pré-Vestibular Impacto - SolubilidadeQuímica Qui80% (5)
- Química - Pré-Vestibular Impacto - Misturas Do Dia-DiaDocumento2 páginasQuímica - Pré-Vestibular Impacto - Misturas Do Dia-DiaQuímica Qui100% (3)
- SoluçõesDocumento39 páginasSoluçõesanacostacampos2001Ainda não há avaliações
- 3 - Solucoes AlunoDocumento100 páginas3 - Solucoes AlunoQuimica Mais FrancisAinda não há avaliações
- Soluções e concentraçãoDocumento19 páginasSoluções e concentraçãoFernando BanzeAinda não há avaliações
- Resumo Sobre SoluçõesDocumento19 páginasResumo Sobre SoluçõesFabíola FelixAinda não há avaliações
- Soluções químicasDocumento18 páginasSoluções químicasRayfson OliveiraAinda não há avaliações
- Soluções Aquosas - Dent - 2022-2022 - Aula 3Documento29 páginasSoluções Aquosas - Dent - 2022-2022 - Aula 3Dorivaldo GomesAinda não há avaliações
- 03 - SoluçõesDocumento5 páginas03 - Soluçõescleyton_775918781Ainda não há avaliações
- Curso 11186 Aula 11 v1Documento29 páginasCurso 11186 Aula 11 v1Moises CorsiAinda não há avaliações
- Matriz - SolubilidadeDocumento3 páginasMatriz - SolubilidadeEtiene Pereira de AndradeAinda não há avaliações
- SOLUÇÕESDocumento20 páginasSOLUÇÕESmarcellebrunamartelliAinda não há avaliações
- Soluções Químicas: Tipos e ClassificaçãoDocumento7 páginasSoluções Químicas: Tipos e ClassificaçãoAdilson SousaAinda não há avaliações
- Química 2° Ano EM 2Documento26 páginasQuímica 2° Ano EM 2vivianegobi0Ainda não há avaliações
- Estudo das SoluçõesDocumento5 páginasEstudo das SoluçõesKyuraKingAinda não há avaliações
- Estudo das dispersões: soluções, colóides e suspensõesDocumento47 páginasEstudo das dispersões: soluções, colóides e suspensõesFelipe MoraesAinda não há avaliações
- Soluções verdadeiras ou falsasDocumento70 páginasSoluções verdadeiras ou falsasprofmarconiAinda não há avaliações
- Soluções QuímicasDocumento16 páginasSoluções QuímicasAlanis RochaAinda não há avaliações
- Cap V SoluçõesDocumento6 páginasCap V SoluçõesHélder ViegasAinda não há avaliações
- Soluções PDFDocumento14 páginasSoluções PDFMario SantanaAinda não há avaliações
- Alunos Material Complementar de Química - 2 A - Solubilidade - 4° BIMESTREDocumento13 páginasAlunos Material Complementar de Química - 2 A - Solubilidade - 4° BIMESTREMagnólia Viana SalgadoAinda não há avaliações
- Roteiro 1 - Soluções Densidade ConcentraçãoDocumento2 páginasRoteiro 1 - Soluções Densidade ConcentraçãoThiago AcciolyAinda não há avaliações
- Tematica A Apostila SolucoesDocumento17 páginasTematica A Apostila SolucoesRiani WeberAinda não há avaliações
- Trabalho de QuimicaDocumento5 páginasTrabalho de Quimicamaycon riosAinda não há avaliações
- 3 Apostila de Fisico Química PDFDocumento101 páginas3 Apostila de Fisico Química PDFVágner José MartinsAinda não há avaliações
- QUiMICA TECNOLoGICA SOLUcoESDocumento7 páginasQUiMICA TECNOLoGICA SOLUcoESHugo PerrettAinda não há avaliações
- Momento de Avaliação Q2Documento3 páginasMomento de Avaliação Q2Magda FerreiraAinda não há avaliações
- Medicina-Química-Exercícios Sobre Propriedades Coligativas Exercícios de Aprofundamento-09-07-2019Documento10 páginasMedicina-Química-Exercícios Sobre Propriedades Coligativas Exercícios de Aprofundamento-09-07-2019Cíntya LiraAinda não há avaliações
- Gases e Dispersões - Ficha de Trabalho 10º Ano QuímicaDocumento2 páginasGases e Dispersões - Ficha de Trabalho 10º Ano QuímicaTeresa CaldeiraAinda não há avaliações
- Versão 1: Exame Final Nacional de Física e Química A Prova 715 - 1. Fase - Ensino Secundário - 2021Documento16 páginasVersão 1: Exame Final Nacional de Física e Química A Prova 715 - 1. Fase - Ensino Secundário - 2021Filipe PiresAinda não há avaliações
- Método Instrumental de AnáliseDocumento13 páginasMétodo Instrumental de AnáliseDaniela PascoalAinda não há avaliações
- Resolução de exercícios de QuímicaDocumento3 páginasResolução de exercícios de QuímicaWalber PereiraAinda não há avaliações
- Determinação do teor em açúcar em sumo (método densimétricoDocumento2 páginasDeterminação do teor em açúcar em sumo (método densimétricoMauro SerafimAinda não há avaliações
- Azdoc - Tips Teste de Quimica 2005 2014Documento36 páginasAzdoc - Tips Teste de Quimica 2005 2014Lino MakiesseAinda não há avaliações
- 76.operações Com Soluções 2Documento20 páginas76.operações Com Soluções 2Paulo VictorAinda não há avaliações
- Apostila - Fertirrigacao PDFDocumento51 páginasApostila - Fertirrigacao PDFClaudio Luiz de SouzaAinda não há avaliações
- Solução de sulfato de cobre preparação laboratorialDocumento2 páginasSolução de sulfato de cobre preparação laboratorialAna Celia MendesAinda não há avaliações
- Lista 2 - Concentração DassoluçõesDocumento4 páginasLista 2 - Concentração Dassoluçõesbrigida.lucinAinda não há avaliações
- Aulas Práticas - Laboratório de Físico-QuímicaDocumento64 páginasAulas Práticas - Laboratório de Físico-QuímicaAlexandre AlmeidaAinda não há avaliações
- A cidadania na Grécia AntigaDocumento19 páginasA cidadania na Grécia AntigaMayara BritoAinda não há avaliações
- Administração de Medicamentos em EnfermagemDocumento54 páginasAdministração de Medicamentos em EnfermagemLindair Raider50% (2)
- Composição de soluções quantitativasDocumento5 páginasComposição de soluções quantitativasiolaAinda não há avaliações
- Pop Praticas Unifsa Quimica Geral VeterinariaDocumento27 páginasPop Praticas Unifsa Quimica Geral VeterinariaDaiane NascimentoAinda não há avaliações
- Apostila - Cálculos Farmacêuticos (1) - 1606746705Documento108 páginasApostila - Cálculos Farmacêuticos (1) - 1606746705João Marcos50% (4)
- Tratamento de água na escolaDocumento10 páginasTratamento de água na escolaLuiz JuniorAinda não há avaliações
- Aula 5 - Cálculo de DosagemDocumento47 páginasAula 5 - Cálculo de DosagemHORUS_KHANAinda não há avaliações
- Absorção de gases em contracorrenteDocumento63 páginasAbsorção de gases em contracorrenteFernanda PeixotoAinda não há avaliações
- Lista de Exercicio - Radiação EletromagnéticaDocumento2 páginasLista de Exercicio - Radiação EletromagnéticaRafaella da Costa BonalumeAinda não há avaliações
- Determinação do coeficiente de partição óleo/águaDocumento4 páginasDeterminação do coeficiente de partição óleo/águaJoice AmorimAinda não há avaliações
- D17 1058 - CorrosãoDocumento20 páginasD17 1058 - Corrosãoclaudio5475100% (1)
- Ae 3ceb Faq7 Solucoes Mat EnergiaDocumento16 páginasAe 3ceb Faq7 Solucoes Mat EnergiatajomilpAinda não há avaliações
- Cinética Enzimática: Estudo dos FatoresDocumento7 páginasCinética Enzimática: Estudo dos FatoresANA FLAVIA FEUSERAinda não há avaliações
- DILUICAODocumento1 páginaDILUICAOAdemario JuniorAinda não há avaliações
- Lista - Analise Gravimetrica - Vol Precipitação - Vol RedoxDocumento4 páginasLista - Analise Gravimetrica - Vol Precipitação - Vol RedoxJoão Paulo SousaAinda não há avaliações
- Gabarito Simulinho 10-06Documento4 páginasGabarito Simulinho 10-06Kim TaehyungAinda não há avaliações
- Exercícios sobre pH e equilíbrio químicoDocumento5 páginasExercícios sobre pH e equilíbrio químicoFolashade Airam OluwatuyiAinda não há avaliações
- Coeficiente de transferência de massa na cristalização de sacaroseDocumento8 páginasCoeficiente de transferência de massa na cristalização de sacaroseHelcio GomesAinda não há avaliações
- Treinamento cerebral: Compreendendo inteligência emocional, atenção e muito maisNo EverandTreinamento cerebral: Compreendendo inteligência emocional, atenção e muito maisNota: 4.5 de 5 estrelas4.5/5 (169)
- Inteligência artificial: Como aprendizado de máquina, robótica e automação moldaram nossa sociedadeNo EverandInteligência artificial: Como aprendizado de máquina, robótica e automação moldaram nossa sociedadeNota: 5 de 5 estrelas5/5 (3)
- Biomecânica Básica dos Exercícios: Membros InferioresNo EverandBiomecânica Básica dos Exercícios: Membros InferioresNota: 3.5 de 5 estrelas3.5/5 (8)
- Instalações elétricas e o projeto de arquiteturaNo EverandInstalações elétricas e o projeto de arquiteturaAinda não há avaliações
- Inteligência artificial: O guia completo para iniciantes sobre o futuro da IANo EverandInteligência artificial: O guia completo para iniciantes sobre o futuro da IANota: 5 de 5 estrelas5/5 (6)
- Eletricista Residencial E PredialNo EverandEletricista Residencial E PredialNota: 3 de 5 estrelas3/5 (1)
- Exclusão e abraço: Uma reflexão teológica sobre identidade, alteridade e reconciliaçãoNo EverandExclusão e abraço: Uma reflexão teológica sobre identidade, alteridade e reconciliaçãoAinda não há avaliações
- Motores automotivos: evolução, manutenção e tendênciasNo EverandMotores automotivos: evolução, manutenção e tendênciasNota: 5 de 5 estrelas5/5 (1)
- O Que Todo Atirador Precisa Saber Sobre BalísticaNo EverandO Que Todo Atirador Precisa Saber Sobre BalísticaNota: 5 de 5 estrelas5/5 (1)
- Estratégias E Macetes Matemáticos Para ConcurseirosNo EverandEstratégias E Macetes Matemáticos Para ConcurseirosAinda não há avaliações
- Dimensionamento e Planejamento de Máquinas e Implementos AgrícolasNo EverandDimensionamento e Planejamento de Máquinas e Implementos AgrícolasNota: 1 de 5 estrelas1/5 (2)
- Educação ambiental: A formação do sujeito ecológicoNo EverandEducação ambiental: A formação do sujeito ecológicoAinda não há avaliações
- Uma viagem pelo cérebro: A via rápida para entender neurociência: 1ª edição revisada e atualizadaNo EverandUma viagem pelo cérebro: A via rápida para entender neurociência: 1ª edição revisada e atualizadaNota: 4 de 5 estrelas4/5 (13)