Escolar Documentos
Profissional Documentos
Cultura Documentos
Introdução Petala
Enviado por
OS N3RDS0 notas0% acharam este documento útil (0 voto)
5 visualizações3 páginasTítulo original
Introdução-Petala
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
5 visualizações3 páginasIntrodução Petala
Enviado por
OS N3RDSDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
Você está na página 1de 3
Introdução 1
Esse relatório tem o objetivo de relatar a aula prática que aconteceu no laboratório de
química do Instituto Federal do Campus Zona Rural de Petrolina, no dia 23 de setembro de
2022, na qual realizamos um experimento com o objetivo de determinar a quantidade de
ácido acético no vinagre. Para esse procedimento utilizamos 3 testes.
Para começarmos precisamos compreender o que é esse ácido . O ácido etanoico ou
ácido acético tendo sua fórmula (CH3COOH) ele é um importante ácido carboxílico capaz
de conduzir eletricidade em soluções aquosas e agir como indicador ácido-base ao mudar a
cor de algumas substâncias.Trata-se de um líquido incolor, de sabor azedo e um forte cheiro
característico.
A principal e mais conhecida aplicação do ácido acético é para
fabricação de vinagre, muito utilizado na culinária e na limpeza em
geral. A composição química do vinagre corresponde a uma solução de
4 a 10% do ácido.
Fonte: Toda matéria
https://www.todamateria.com.br/acido-acetico/amp/
Introdução 2
Somos estudantes de agronomia do Instituto Federal do Campus Zona Rural de Petrolina,
esse relatório tem como objetivo desenvolver a aula prática que aconteceu no laboratório de
química, e o intuito da aula foi encontrar o ponto de neutralização da solução de hidróxido
de sódio(NaOH) após adicionar aos poucos a solução de biftalato de potássio, até o ácido
reagir com toda base. Esse experimento foi realizado no dia 30 de setembro de 2022, onde
fizemos 3 testes.
O hidróxido de sódio (NaOH), também conhecido como soda cáustica, é um hidróxido
cáustico usado na indústria principalmente como uma base química, A produção da soda
cáustica é feita através da reação de eletrólise, onde grande quantidade de calor é liberada
(reação exotérmica) junto dos íons Na+ e OH-.
A fórmula molecular da soda cáustica é NaOH, sendo composta
por um átomo de sódio (Na), um de hidrogênio (H) e outro de
oxigênio (O).
Fonte: Toda Matéria
https://www.todamateria.com.br/hidroxido-de-sodio/amp/
Introdução 3
O seguinte relatório foi realizado no laboratório de química do Instituto federal do Campus
zona rural de Petrolina, na qual aconteceu no dia 14 de outubro de 2022. Onde nós alunos
de agronomia, produzimos o experimento com o intuito de achar a determinação da
concentração de H2SO4, fizemos dois procedimentos, 2 teste utilizado a solução ácida com
a água e a outra foram 3 teste com apenas com o ácido, totalizando 5 teste.
O ácido sulfúrico é composto por dois átomos de hidrogênio, um de enxofre e quatro de
oxigênio, resultando na fórmula molecular H2SO4, e sua fórmula estrutural é tetraédrica.
O ácido sulfúrico é um líquido incolor e altamente corrosivo
oxigênio que possui vasta aplicação em indústrias e em
laboratórios, sendo uma das substâncias mais utilizadas. O
ácido sulfúrico possui um grau de ionização alto (α = 61%), ou
seja, é um ácido forte. Além disso, possui um elevado poder
oxidante e desidratante, e por essa razão, é tão perigoso, pois
pode chegar a carbonizar compostos orgânicos, como tecidos
de organismos vivos.
(Fonte: Brasi Escola UOL)
https://brasilescola.uol.com.br/quimica/acido-sulfurico.htm
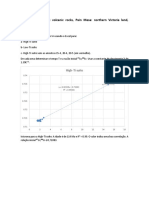
Introdução 4
Esse relatório onde a prática aconteceu no dia 18 de outubro de 2022 no laboratório de
química, localizado no IF Sertão campus zona rural em Petrolina, o objetivo da aula prática
foi encontrar a concentração da massa molar do ácido que é de uma concentração
desconhecida.
Concentração molar ou molaridade é a quantidade de soluto, em mol, dissolvidos num
volume de solução em litros. O mol concentração nada mais é que a quantidade de
substâncias de um sistema que contém tantas unidades elementares quantas existem em
átomos de carbono.
A quantidade de matéria é a relação entre a quantidade
de matéria do soluto, medida em mol (n1), e o volume da
solução em litros (V). Essa concentração é medida em mol por
litro (mol/L).
Fonte: Brasil escola UOL (foto)
https://www.infoescola.com/fisico-quimica/molaridade/amp/
Você também pode gostar
- O Seu Portal de Cursos-35Documento9 páginasO Seu Portal de Cursos-35Jaque MartinsAinda não há avaliações
- Teu PaiDocumento5 páginasTeu PaiPedro NonakaAinda não há avaliações
- volumetria-OXI AnaliticaDocumento9 páginasvolumetria-OXI AnaliticaLoren AgataAinda não há avaliações
- Revisao Turma Enem e Bahiana. Caderno Do Aluno. Por Prof Uelder SantosDocumento3 páginasRevisao Turma Enem e Bahiana. Caderno Do Aluno. Por Prof Uelder SantosUELDER SANTOSAinda não há avaliações
- Atividade Ácido-BaseDocumento2 páginasAtividade Ácido-BaseALINE ROBERTA SANTOS CARDOSO SILVAAinda não há avaliações
- Relatório de Química IIIDocumento10 páginasRelatório de Química IIINatanael vitorAinda não há avaliações
- Relatório de Aulas Práticas QuimicaDocumento10 páginasRelatório de Aulas Práticas QuimicaAline de Sena AlvesAinda não há avaliações
- Relatório - Prática 6 (Determinação Da Concentração de Ácido Acético em Vinagre Por Volumetria de Neutralização)Documento6 páginasRelatório - Prática 6 (Determinação Da Concentração de Ácido Acético em Vinagre Por Volumetria de Neutralização)stephanieclcordovaAinda não há avaliações
- Relatório de QuímicaDocumento5 páginasRelatório de QuímicaÊnio CidrãoAinda não há avaliações
- Titulação de Óxido Redução - Teor de Cloro Ativo - RELATÓRIODocumento14 páginasTitulação de Óxido Redução - Teor de Cloro Ativo - RELATÓRIOLailaFerreiraAinda não há avaliações
- Determinação de Cloro em Alvejantes Por Oxirredução: Uma Prática Didática para o Ensino de Química AnalíticaDocumento1 páginaDeterminação de Cloro em Alvejantes Por Oxirredução: Uma Prática Didática para o Ensino de Química AnalíticaLucas Ferreira de PaulaAinda não há avaliações
- Relatorio Quimica Organica 4Documento8 páginasRelatorio Quimica Organica 4Giovanna martinsAinda não há avaliações
- Fisico Quimica PH e POHDocumento45 páginasFisico Quimica PH e POHjoao victorAinda não há avaliações
- Disciplina: Química Professora: Renata Paim: Exercícios Complementares: Funções InorgânicasDocumento6 páginasDisciplina: Química Professora: Renata Paim: Exercícios Complementares: Funções Inorgânicasmariana neryAinda não há avaliações
- Lista Funcoes InorganicasDocumento7 páginasLista Funcoes InorganicasAmanda LouresAinda não há avaliações
- 1 IntroduçãoDocumento12 páginas1 IntroduçãoAntonio samuel Nhatsave100% (1)
- Apostila de Química de Coordenação (Eunice-Midori) - 2013Documento34 páginasApostila de Química de Coordenação (Eunice-Midori) - 2013shakarotto100% (1)
- Lista de Exercícios PH e pOHDocumento4 páginasLista de Exercícios PH e pOHCamila VitoriaAinda não há avaliações
- Exercício - Química Analítica Qualitativa - Prof. Fernanda Gomes - 20200416042838Documento5 páginasExercício - Química Analítica Qualitativa - Prof. Fernanda Gomes - 20200416042838PROF. ALANO PITOMBEIRAAinda não há avaliações
- Relatório Titulação de NeutralizaçãoDocumento7 páginasRelatório Titulação de NeutralizaçãoLuiz Carlos SantanaAinda não há avaliações
- Ácido AdípicoDocumento6 páginasÁcido AdípicoBárbara Azevedo TamburiAinda não há avaliações
- Relatório - Oxigênio DissolvidoDocumento10 páginasRelatório - Oxigênio DissolvidoRIAN CAMPOS ALMEIDAAinda não há avaliações
- Relatório 03 INORGDocumento12 páginasRelatório 03 INORGAlexsandro SantiagoAinda não há avaliações
- Aula 4Documento4 páginasAula 4Giovanna Galvão ScheideggerAinda não há avaliações
- Conceitos e Metodos V1 - Fundamentos em Quimica Experimental PDFDocumento64 páginasConceitos e Metodos V1 - Fundamentos em Quimica Experimental PDFDarlan SantilAinda não há avaliações
- Relatório Sobre Aula Prática Do Dia 05.04-2Documento8 páginasRelatório Sobre Aula Prática Do Dia 05.04-2Leandro De JesusAinda não há avaliações
- Grupo 16Documento8 páginasGrupo 16Joyce NascimentoAinda não há avaliações
- Relatorio Quimica Organica KalineDocumento10 páginasRelatorio Quimica Organica Kalinekalinearaujoteles318Ainda não há avaliações
- AlcoóisDocumento12 páginasAlcoóisJosé Teófilo Moreira FilhoAinda não há avaliações
- IQUIMICA Simulado 04 Dezembro v2Documento10 páginasIQUIMICA Simulado 04 Dezembro v2Vinícius Borges Dos AnjosAinda não há avaliações
- Ficha 14 - Hidrólise A Nova GeraçãoDocumento5 páginasFicha 14 - Hidrólise A Nova GeraçãoThayseAinda não há avaliações
- Relatorio Farmacognosia 4Documento11 páginasRelatorio Farmacognosia 4Sara PollastreliAinda não há avaliações
- Relatorio Quimica OrganicaDocumento10 páginasRelatorio Quimica Organicakalinearaujoteles318Ainda não há avaliações
- Eurisvanio Relatorio de QuimicaDocumento16 páginasEurisvanio Relatorio de QuimicaVander EurisAinda não há avaliações
- 4 PH e PohDocumento103 páginas4 PH e PohJuniorAinda não há avaliações
- O Seu Portal de Cursos-17Documento9 páginasO Seu Portal de Cursos-17Jaque MartinsAinda não há avaliações
- 100 Questões de Conc de SoluçõesDocumento42 páginas100 Questões de Conc de SoluçõesEraclitoSL100% (5)
- Enade OrganicaDocumento5 páginasEnade OrganicaGiulliano Thomaz DiasAinda não há avaliações
- Relatório Aula Prática 01Documento6 páginasRelatório Aula Prática 01Thales Barbalho100% (1)
- Relatorio DQO DBODocumento8 páginasRelatorio DQO DBOEloh AzevedoAinda não há avaliações
- Determinação de PH e de Alcalinidade TotalDocumento7 páginasDeterminação de PH e de Alcalinidade Totalcassita2Ainda não há avaliações
- Química 2016Documento7 páginasQuímica 2016Vivi LeeAinda não há avaliações
- Analise Qualitativa de Aldeidos e CetonasDocumento11 páginasAnalise Qualitativa de Aldeidos e CetonasLucas CruzAinda não há avaliações
- Roteíro de Práticas de Química Farmacêutica - JoubertDocumento13 páginasRoteíro de Práticas de Química Farmacêutica - JoubertLauuh OliveiraAinda não há avaliações
- O Seu Portal de Cursos-18Documento10 páginasO Seu Portal de Cursos-18Jaque MartinsAinda não há avaliações
- O Seu Portal de Cursos-19Documento10 páginasO Seu Portal de Cursos-19Jaque MartinsAinda não há avaliações
- Ácidos e Bases PDFDocumento34 páginasÁcidos e Bases PDFSjsmsmsAinda não há avaliações
- Relatório 3 - QGDocumento6 páginasRelatório 3 - QGElias SousaAinda não há avaliações
- Relatorio Quimica OrganicaDocumento10 páginasRelatorio Quimica Organicakalinearaujoteles318Ainda não há avaliações
- Relatorio Aula 21.determinaçao Do Teor de Hidroxido de Sodio Na Soda Caustica.Documento7 páginasRelatorio Aula 21.determinaçao Do Teor de Hidroxido de Sodio Na Soda Caustica.Cristina Freitas100% (2)
- Curso 11186 Aula 10 v1Documento35 páginasCurso 11186 Aula 10 v1Moises CorsiAinda não há avaliações
- Análise de HipocloritoDocumento5 páginasAnálise de HipocloritocrssierraAinda não há avaliações
- Rot 4 Quim Inorganica ExpDocumento3 páginasRot 4 Quim Inorganica ExpTomas Petesse BasiliciAinda não há avaliações
- RELATÓRIO - Bioquímica Humana - AULA 2 FabriciaDocumento7 páginasRELATÓRIO - Bioquímica Humana - AULA 2 FabriciaFabricia Silva Andrade LeiteAinda não há avaliações
- Relatório de Prática ExperimentalDocumento8 páginasRelatório de Prática ExperimentalPaula TejanoAinda não há avaliações
- UCS - SoluçõesDocumento12 páginasUCS - SoluçõesJoel AldaveAinda não há avaliações
- Processos Tecnológicos e Modelagens Matemáticas de Oxidação de Percolados de Aterros SanitáriosNo EverandProcessos Tecnológicos e Modelagens Matemáticas de Oxidação de Percolados de Aterros SanitáriosAinda não há avaliações
- Biofísica para ciências biomédicas – 4ª ediçãoNo EverandBiofísica para ciências biomédicas – 4ª ediçãoAinda não há avaliações
- Princípios de química analítica: Abordagem teórica qualitativa e quantitativaNo EverandPrincípios de química analítica: Abordagem teórica qualitativa e quantitativaNota: 5 de 5 estrelas5/5 (1)
- Dna RnaDocumento211 páginasDna RnaJefferson Guedes Oliveira100% (1)
- QUÍMICA 1º Ano Roteiro de Estudos 01Documento2 páginasQUÍMICA 1º Ano Roteiro de Estudos 01Karla Rodrigues MotaAinda não há avaliações
- Biogeografia 1Documento14 páginasBiogeografia 1Ariadne Cristina De AntonioAinda não há avaliações
- Exercícios RB-SRDocumento8 páginasExercícios RB-SRNati FerroAinda não há avaliações
- Escola Estadual João Kopke EfDocumento28 páginasEscola Estadual João Kopke EfAlex LourençoAinda não há avaliações
- Dane Rudhyar - Uma Mandala AstrologicaDocumento192 páginasDane Rudhyar - Uma Mandala Astrologicahanah91% (11)
- 2011-2 Aula 1 Introdução Ao Estudo Dos EcossistemasDocumento48 páginas2011-2 Aula 1 Introdução Ao Estudo Dos EcossistemasAlessandro de PaulaAinda não há avaliações
- Lista 4 FB2 Virtual OndasDocumento3 páginasLista 4 FB2 Virtual OndasFelipe AugustoAinda não há avaliações
- Lista de Exercicios 7 - Lic. Quimica IIDocumento3 páginasLista de Exercicios 7 - Lic. Quimica IIAbebeAinda não há avaliações
- Memorial Calculo - Trocador de Calor Casco e TuboDocumento4 páginasMemorial Calculo - Trocador de Calor Casco e TuboVictor OliveiraAinda não há avaliações
- PTRF Fazenda Ilha Grande 01 PDFDocumento29 páginasPTRF Fazenda Ilha Grande 01 PDFTauany RodriguesAinda não há avaliações
- FISPQ Cobau Atualizada 2022Documento3 páginasFISPQ Cobau Atualizada 2022Rechane NovaisAinda não há avaliações
- Manejo de Nematóides Na Cana-De-AçúcarDocumento29 páginasManejo de Nematóides Na Cana-De-AçúcarJV Mídia visualAinda não há avaliações
- Quimica 2Documento4 páginasQuimica 2Gabriela PereiraAinda não há avaliações
- Polímero Reticulado - Bórax+PVADocumento20 páginasPolímero Reticulado - Bórax+PVADenis LimaAinda não há avaliações
- A Improbabilidade de Deus PDFDocumento5 páginasA Improbabilidade de Deus PDFIsrael DantasAinda não há avaliações
- V de Gowin Nº1Documento1 páginaV de Gowin Nº1Angélica RyzhakAinda não há avaliações
- 2 Aula Ecossistema Luciano LeiteDocumento52 páginas2 Aula Ecossistema Luciano LeitealanaAinda não há avaliações
- Bombas Op1 - Mais Sobre CavitaçãoDocumento55 páginasBombas Op1 - Mais Sobre CavitaçãoCarlos Alexandre SilvaAinda não há avaliações
- Quadros 2.1 e 2.2Documento3 páginasQuadros 2.1 e 2.2Daniel FonsecaAinda não há avaliações
- TRANE Catalogo-Comercial-Piso-Teto-InverterDocumento2 páginasTRANE Catalogo-Comercial-Piso-Teto-InverterPaulo Damaceno100% (1)
- Maria Lúcia WiltshireDocumento15 páginasMaria Lúcia WiltshiregeisyydiasAinda não há avaliações
- Manual de Geologia GeralDocumento184 páginasManual de Geologia GeralHelio Armazia50% (2)
- Máquinas de Fluxos - 1º AulaDocumento43 páginasMáquinas de Fluxos - 1º AulaChristian Moreira0% (1)
- 07 PDFDocumento19 páginas07 PDFJoão EstevanAinda não há avaliações
- A Questão Social: O Anarquismo em Face Da CiênciaDocumento155 páginasA Questão Social: O Anarquismo em Face Da CiênciaRafael Morato ZanattoAinda não há avaliações
- Aula 04 - SedimentaçãoDocumento28 páginasAula 04 - SedimentaçãoProfa Vanessa Monteiro0% (1)
- Revisão (Prova Final de Física) - EM1Documento2 páginasRevisão (Prova Final de Física) - EM1Adriano GomesAinda não há avaliações
- Meditação Sobre o Mundo Interior - Alceu Amoroso LimaDocumento89 páginasMeditação Sobre o Mundo Interior - Alceu Amoroso LimaRicardo Maddalena100% (1)