Escolar Documentos
Profissional Documentos
Cultura Documentos
Ligações Químicas (Ionica, Covalente e Metalica)
Ligações Químicas (Ionica, Covalente e Metalica)
Enviado por
Cid FilhoDireitos autorais:
Formatos disponíveis
Você também pode gostar
- ExerciciosDocumento18 páginasExerciciosNicole Dos Santos TillwitzAinda não há avaliações
- Colheitadeira S430 Edicao Sul Americana Introdu oDocumento3 páginasColheitadeira S430 Edicao Sul Americana Introdu oRogerio Silva50% (2)
- OGC007Documento19 páginasOGC007Sandro CardosoAinda não há avaliações
- Upload Produto 15 Manual Fazerys250 - 2007 - (1s4 f8199 w1)Documento140 páginasUpload Produto 15 Manual Fazerys250 - 2007 - (1s4 f8199 w1)Roney CetnarowskiAinda não há avaliações
- Treinamento Operador Empilhadeira NR-11Documento57 páginasTreinamento Operador Empilhadeira NR-11Técnico em Segurança do Trabalho TST50% (2)
- Ligações Químicas (Ionica, Covalente e Metalica)Documento5 páginasLigações Químicas (Ionica, Covalente e Metalica)Cid FilhoAinda não há avaliações
- Apostila de Ligações QuímicasDocumento15 páginasApostila de Ligações QuímicasÍngrede Ferreira0% (1)
- Aula Ligação QuímicaDocumento18 páginasAula Ligação QuímicaJoel SáAinda não há avaliações
- Ligações QuímicasDocumento3 páginasLigações Químicasaugustorodrigo995Ainda não há avaliações
- Ligacoes QuimicasDocumento7 páginasLigacoes QuimicasLúbio LuisAinda não há avaliações
- #Aula 07 Ligação QuímicaDocumento2 páginas#Aula 07 Ligação Químicaice.jd.vl.solAinda não há avaliações
- Aula - Ligaçoes QuimicasDocumento22 páginasAula - Ligaçoes QuimicasWellen Barbosa100% (1)
- Ligações Iônicas Ou EletrovalentesDocumento4 páginasLigações Iônicas Ou EletrovalentesThais CerqueiraAinda não há avaliações
- Trabalho de QuímicaDocumento10 páginasTrabalho de QuímicaPaulo António JúniorAinda não há avaliações
- Ligações Químicas - Iônica e CovalenteDocumento3 páginasLigações Químicas - Iônica e CovalenteJerusa FreitasAinda não há avaliações
- 06 - Liga Es Qu Micas e Resson NciaDocumento30 páginas06 - Liga Es Qu Micas e Resson NciaRaiplayG10 []Ainda não há avaliações
- Ligações QuímicasDocumento7 páginasLigações QuímicasDomingos MbanaAinda não há avaliações
- Ligações QuimicasDocumento2 páginasLigações Quimicasrosimeri.batistaAinda não há avaliações
- Ligações QuímicasDocumento6 páginasLigações QuímicasWuazoAinda não há avaliações
- Ligações Químicas 02-1Documento53 páginasLigações Químicas 02-1Rauan BrendonAinda não há avaliações
- Aula 6 - QuímicaDocumento30 páginasAula 6 - QuímicaBeatriz MenezesAinda não há avaliações
- Ligações Químicas - Teoria Do Octeto, Ligação Iônica, Ligação Metálica e CovalenteDocumento15 páginasLigações Químicas - Teoria Do Octeto, Ligação Iônica, Ligação Metálica e CovalentePedro100% (1)
- Ligações Químicas QG 2016Documento86 páginasLigações Químicas QG 2016Marco Túlio Pimenta100% (1)
- 15324916022012fundamentos de Quimica Aula 6Documento18 páginas15324916022012fundamentos de Quimica Aula 6Jefferson RibeiroAinda não há avaliações
- Aulas de Química Geral 1 - Ligações Quimicas - PitagorasDocumento27 páginasAulas de Química Geral 1 - Ligações Quimicas - Pitagorasjohn heberAinda não há avaliações
- Ligações QuímicasDocumento4 páginasLigações QuímicasWellington PimentelAinda não há avaliações
- Apostila Ligações Ionicas e CovalentesDocumento3 páginasApostila Ligações Ionicas e Covalentesjufontana7Ainda não há avaliações
- Aula+6+-+Ligações+Quimicas Fabiana+AlmeidaDocumento49 páginasAula+6+-+Ligações+Quimicas Fabiana+AlmeidaBené JúniorAinda não há avaliações
- Clara Anotações Escola PDFDocumento3 páginasClara Anotações Escola PDFmaria clara melo moreiraAinda não há avaliações
- LigaCao Quimica 9a ClasseDocumento9 páginasLigaCao Quimica 9a ClasseNélio MachadoAinda não há avaliações
- 4 - Ativ. Ciencias 9o AnoDocumento13 páginas4 - Ativ. Ciencias 9o AnoAdriana JesusAinda não há avaliações
- Ligacoes Quimicas para EJADocumento11 páginasLigacoes Quimicas para EJAAlda ErnestinaAinda não há avaliações
- Íons e Ligações QuímicasDocumento8 páginasÍons e Ligações Químicaserika.poa.rsAinda não há avaliações
- 4 Ligacoes Quimicas - Simbolos de Lewis e ADocumento26 páginas4 Ligacoes Quimicas - Simbolos de Lewis e AhitcarAinda não há avaliações
- Ligações QuímicasDocumento16 páginasLigações QuímicasAmandaAinda não há avaliações
- Ligações QuímicasDocumento66 páginasLigações QuímicasBenites PatrickAinda não há avaliações
- Ligacoes QuimicasDocumento121 páginasLigacoes QuimicasmanudaoAinda não há avaliações
- Material Teorico e Exercicios 2021.2Documento78 páginasMaterial Teorico e Exercicios 2021.2Felipe BitencourtAinda não há avaliações
- Plano de Aula Ligações QuimicasDocumento10 páginasPlano de Aula Ligações QuimicasHelena Brites RodriguesAinda não há avaliações
- Ligaes QumicasDocumento3 páginasLigaes QumicasBrendaAinda não há avaliações
- ATIVIDADeDocumento4 páginasATIVIDADePablo ViniciusAinda não há avaliações
- Aula para Upload Aula7Documento11 páginasAula para Upload Aula7Pércio De JesusAinda não há avaliações
- Ligações Quimica AlannaDocumento44 páginasLigações Quimica AlannaAlanna Costa100% (2)
- Ligaçoes QuimicasDocumento26 páginasLigaçoes QuimicasCAROLINE NEVES COSTAAinda não há avaliações
- Quimica OrganicaDocumento257 páginasQuimica Organicaacgsoares14100% (2)
- Ligação IônicaDocumento8 páginasLigação Iônicagabriele gomesAinda não há avaliações
- Aula 09 - Ligações Químicas e Determinação de Fórmulas de Compostos IônicosDocumento8 páginasAula 09 - Ligações Químicas e Determinação de Fórmulas de Compostos IônicosvicfborgesAinda não há avaliações
- Aula 05 - Ligações QuímicasDocumento11 páginasAula 05 - Ligações QuímicasMarcelo NogueiraAinda não há avaliações
- Ligações AtômicasDocumento20 páginasLigações AtômicasRubens SantosAinda não há avaliações
- Trabalho de Química PDFDocumento18 páginasTrabalho de Química PDFLetício FranciscoAinda não há avaliações
- Eletrosfera e Ligações QuímicasDocumento5 páginasEletrosfera e Ligações QuímicaslarissacanellaAinda não há avaliações
- Lista 2Documento8 páginasLista 2ThallesAlmeidaAinda não há avaliações
- Material de Química 2Documento7 páginasMaterial de Química 2Camila MouraAinda não há avaliações
- Esc Est Técnica José CanellasDocumento4 páginasEsc Est Técnica José CanellasguilhermekwacheleskiAinda não há avaliações
- Slides Ligações QuímicasDocumento24 páginasSlides Ligações Químicasluamaria9wjoaquinaAinda não há avaliações
- Aula 7 e 8 Ligações QuímicasDocumento61 páginasAula 7 e 8 Ligações QuímicasVinicius GamaAinda não há avaliações
- Ligacao Covalente e MetalicaDocumento11 páginasLigacao Covalente e MetalicaRobbin StroschOneAinda não há avaliações
- Aula 2Documento56 páginasAula 2jailson suquitodoceAinda não há avaliações
- Química 1A: Aula 3 - Ligações QuímicasDocumento26 páginasQuímica 1A: Aula 3 - Ligações QuímicasLavinia FagundesAinda não há avaliações
- Quim - Ligações QuímicasDocumento34 páginasQuim - Ligações Químicas1belnAinda não há avaliações
- Ligações InteratômicasDocumento12 páginasLigações InteratômicasCarina SiqueiraAinda não há avaliações
- Ligações Químicas - Química GeralDocumento29 páginasLigações Químicas - Química GeralJean Carlos CarlosAinda não há avaliações
- Modelo AtômicoDocumento2 páginasModelo AtômicoCid FilhoAinda não há avaliações
- Emilie Durkheim Fatos SociaisDocumento1 páginaEmilie Durkheim Fatos SociaisCid FilhoAinda não há avaliações
- Émilie Durkheim e A Divisão Social Do TrabalhoDocumento3 páginasÉmilie Durkheim e A Divisão Social Do TrabalhoCid FilhoAinda não há avaliações
- AgronegócioDocumento3 páginasAgronegócioCid FilhoAinda não há avaliações
- 2 Revolução IndustrialDocumento2 páginas2 Revolução IndustrialCid FilhoAinda não há avaliações
- Polarização Política e Seus Efeitos Na SociedadeDocumento1 páginaPolarização Política e Seus Efeitos Na SociedadeCid FilhoAinda não há avaliações
- Beamer ModeloDocumento49 páginasBeamer Modeloleandro1281Ainda não há avaliações
- Programacao Linear Aula 3 - 2020Documento9 páginasProgramacao Linear Aula 3 - 2020bentoAinda não há avaliações
- As MônadasDocumento7 páginasAs MônadasOVERBURNAinda não há avaliações
- Lista1 - Econometria IIDocumento4 páginasLista1 - Econometria IIAlice VasconcelosAinda não há avaliações
- Acentuação GráficaDocumento4 páginasAcentuação GráficaLeandroAinda não há avaliações
- Apostila USP PDFDocumento24 páginasApostila USP PDFPatricia AlmeidaAinda não há avaliações
- 3 Lei de NewtonDocumento1 página3 Lei de NewtonAnnalyce AbelhaAinda não há avaliações
- Lista de Exercícios LEIS DE NEWTONDocumento2 páginasLista de Exercícios LEIS DE NEWTONCícero FeitosaAinda não há avaliações
- Variação de TemperaturaDocumento3 páginasVariação de TemperaturaEduarda GabrielaAinda não há avaliações
- Reforço Prova 2Documento42 páginasReforço Prova 2John Lopes Jr.Ainda não há avaliações
- Apostila Dominando Python2Documento72 páginasApostila Dominando Python2Camila Ferreira DiasAinda não há avaliações
- 135-Abs - Sae 01Documento9 páginas135-Abs - Sae 01Egydio Tahira FilhoAinda não há avaliações
- Scimitar ManualDocumento18 páginasScimitar ManualHamer FélixAinda não há avaliações
- Codigos de Falha PethaDocumento26 páginasCodigos de Falha PethaCarlos EduardoAinda não há avaliações
- Segunda Avaliação - Bruno BalotinDocumento8 páginasSegunda Avaliação - Bruno BalotinBruno BalotinAinda não há avaliações
- Matheus Rodrigues - Procedimentos de EnfermagemDocumento231 páginasMatheus Rodrigues - Procedimentos de EnfermagemSara MartinezAinda não há avaliações
- 618 Introduçao Conduçao 03082017Documento80 páginas618 Introduçao Conduçao 03082017Jean Patrick Freitas NobreAinda não há avaliações
- Manual GdoorDocumento6 páginasManual GdoorNaiara BonifacioAinda não há avaliações
- DOQ-Cgcre-36 - 02 - Orientações Sobre Verificações Das Balanças PDFDocumento7 páginasDOQ-Cgcre-36 - 02 - Orientações Sobre Verificações Das Balanças PDFJoão Vitor Apolinário FerreiraAinda não há avaliações
- Destravando Seu ImprovisoDocumento37 páginasDestravando Seu ImprovisoJeferson DiasAinda não há avaliações
- Relatório Físico-Químico - Aplicação Da Lei de Dalton para Determinar o Volume Molar de Um GásDocumento4 páginasRelatório Físico-Químico - Aplicação Da Lei de Dalton para Determinar o Volume Molar de Um GásOliveira Salezio GabrielAinda não há avaliações
- Jardim Botânico - CompletoDocumento4 páginasJardim Botânico - CompletoGustavo 61Ainda não há avaliações
- Lista 04 7º Ano Números InteirosDocumento1 páginaLista 04 7º Ano Números InteirosDiego SouzaAinda não há avaliações
- Aspecto Grafico Do Trabalho AcademicoDocumento33 páginasAspecto Grafico Do Trabalho AcademicoFrancisco PontesAinda não há avaliações
- Racionalismo Descartes 11o Ano - CompletoDocumento36 páginasRacionalismo Descartes 11o Ano - CompletoDiogo SilvaAinda não há avaliações
Ligações Químicas (Ionica, Covalente e Metalica)
Ligações Químicas (Ionica, Covalente e Metalica)
Enviado por
Cid FilhoTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Ligações Químicas (Ionica, Covalente e Metalica)
Ligações Químicas (Ionica, Covalente e Metalica)
Enviado por
Cid FilhoDireitos autorais:
Formatos disponíveis
Ligações químicas
1. Regra do octeto
Kossel e Lewis lançaram a hipótese de que os átomos, ao se unirem,
procuram perder, ganhar ou compartilhar seus elétrons da camada de
valência até adquirirem a configuração eletrônica de um gás nobre, ou seja,
oito elétrons.
2. Ligação iônica ou eletrovalente
É a ligação entre átomos mais favoráveis a perder elétrons e átomos mais
favoráveis a ganhar elétrons.
o Ao ganhar ou perder elétrons formam-se os íons.
o Cátion: Perde elétrons;
IA – Monovalentes (1+);
Ex.: Na11 → 1s²2s²2p63s¹
1 elétron na camada de valência
Na+→1s²2s²2p6
8 elétrons na camada de
IIA –valência
Bivalentes (2+);
IIIA – Trivalentes (3+).
o Ânion: Recebe elétrons.
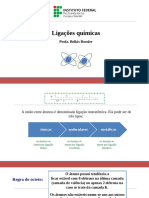
Esses íons sofrem atração eletrostática, formando assim as ligações iônicas.
Figura 01: Formação da ligação iônica do NaCl.
Ligações químicas
Símbolo de Lewis: As ligações químicas poderiam ser explicadas se os
elétrons da camada de valência envolvidos fossem representados.
o Os pontos representam os elétrons. Eles são dispostos de maneira que
fiquem o mais afastado possível uns dos outros ao redor do elemento.
Em seguida, os demais elétrons são distribuídos formando pares.
o Representação da reação de formação do NaCl seguindo a o símbolo
de Lewis:
o Permite encontrar a fórmula mínima:
Formação do hidreto de cálcio:
3. Fórmula mínima de um composto iônico
Deve mostrar a menor proporção inteira de cátions e ânions.
A quantidade total de elétrons perdidos deve ser igual a quantidade total de
elétrons recebidos, assim, a substancia será eletricamente neutra.
Inversão dos valores das cargas:
o Ex.: Formação do sulfeto de Alumínio:
4. Propriedades dos compostos iônicos
Elevadas temperaturas de fusão e de ebulição;
Ligações químicas
o São sólidos em temperatura e pressão ambientes (25º C e 1 atm);
o Devido a atração das cargas opostos, é necessária muita energia para
separar os íons que formam uma estrutura iônica.
Duros e quebradiços (baixa tenacidade)
o Ao ser aplicada uma força sobre o cristal, as camadas de íons da
estrutura cristalina podem deslizar, fazendo que íons de mesma carga
fiquem próximos uns dos outros, repelindo-se e fraturando o cristal.
Conduzem corrente elétrica no estado líquido ou solução aquosa
o Para uma substancia conduzir eletricidade, ela deve apresentar
partículas carregadas que possam se movimentar.
5. Ligação Covalente
A medida que dois átomos se aproximam, aparecem duas forças:
o Força de atração: Entre o núcleo e os elétrons do outro átomo;
o Força de repulsão: Entre os núcleos.
O equilíbrio dessas forças ocorre a uma determinada distância entre os
átomos.
A força de atração faz com que os átomos de hidrogênio permaneçam juntos,
constituindo a ligação covalente.
Compartilhamento de elétrons, para ambos adquirirem a configuração
eletrônica de um gás nobre.
o Elétrons não compartilhados: São os elétrons que não participaram da
ligação covalente.
Tipos de fórmulas
o Fórmula eletrônica ou Estrutura de Lewis: Deve-se determinar o
número total de elétrons na camada de valência, o número de
compartilhamentos que cada átomo realizará para completar o octeto
e distribuir os pares eletrônicos na estrutura.
Ligações químicas
Comprimento da ligação e energia da ligação
o A distância média entre os átomos varia de acordo com os pares de
elétrons compartilhados.
o Distancia (d) e elétrons compartilhados (EC)
↑ EC ↓ d
o Energia de ligação (EL) elétrons compartilhados (EC)
↑ EL↑ EC
Ligações covalentes dativas: O elétron compartilhado vem de um só átomo.
Atualmente é chamada de ligação coordenada.
6. Propriedades dos compostos moleculares
Ligações químicas
Na temperatura e pressão ambientes (25º C e 1 atm) podem ser: Sólidos,
líquidos ou gasosos;
Quando puros, NÃO conduzem corrente elétrica em nenhum estado físico;
Em solução aquosa, ácidos e amônia sofrem ionização e formam soluções
aquosas condutoras de corrente elétrica.
7. Exceções à regra do octeto
Be (berílio) – Se torna estável com 4 elétrons;
B (boro) – Se torna estável com 6 elétrons;
SF6 , PCl5 , XeF4, BrF5
Radicais livres: São moléculas com número ímpar de elétrons. Apresentam
um elétron livre no átomo central Ex.: NO, NO2.
8. Ligação metálica
Formado exclusivamente por átomos de metais (tendência a perder elétrons);
Teoria do mar de elétrons ou da nuvem eletrônica: Os átomos dos metais
perdem seus elétrons mais externos, formando cátions. Estes, ocupariam os
pontos de um retículo cristalino e os elétrons não seriam atraídos por
nenhum núcleo em particular. Ficariam deslocados, formando uma nuvem
eletrônica gigante, espalhada por todo o retículo;
A nuvem eletrônica mantém os íons positivos atraídos e os elétrons ficam
confinados na estrutura metálica;
9. Propriedades dos metais
Elevada condutibilidade térmica e elétrica;
Maleabilidade (podem ser transformados em lâminas);
Ductibilidade (podem ser transformados em fios);
Brilho metálico;
Resistência à tração;
Elevadas temperaturas de fusão e ebulição;
o Exceção: Hg
Você também pode gostar
- ExerciciosDocumento18 páginasExerciciosNicole Dos Santos TillwitzAinda não há avaliações
- Colheitadeira S430 Edicao Sul Americana Introdu oDocumento3 páginasColheitadeira S430 Edicao Sul Americana Introdu oRogerio Silva50% (2)
- OGC007Documento19 páginasOGC007Sandro CardosoAinda não há avaliações
- Upload Produto 15 Manual Fazerys250 - 2007 - (1s4 f8199 w1)Documento140 páginasUpload Produto 15 Manual Fazerys250 - 2007 - (1s4 f8199 w1)Roney CetnarowskiAinda não há avaliações
- Treinamento Operador Empilhadeira NR-11Documento57 páginasTreinamento Operador Empilhadeira NR-11Técnico em Segurança do Trabalho TST50% (2)
- Ligações Químicas (Ionica, Covalente e Metalica)Documento5 páginasLigações Químicas (Ionica, Covalente e Metalica)Cid FilhoAinda não há avaliações
- Apostila de Ligações QuímicasDocumento15 páginasApostila de Ligações QuímicasÍngrede Ferreira0% (1)
- Aula Ligação QuímicaDocumento18 páginasAula Ligação QuímicaJoel SáAinda não há avaliações
- Ligações QuímicasDocumento3 páginasLigações Químicasaugustorodrigo995Ainda não há avaliações
- Ligacoes QuimicasDocumento7 páginasLigacoes QuimicasLúbio LuisAinda não há avaliações
- #Aula 07 Ligação QuímicaDocumento2 páginas#Aula 07 Ligação Químicaice.jd.vl.solAinda não há avaliações
- Aula - Ligaçoes QuimicasDocumento22 páginasAula - Ligaçoes QuimicasWellen Barbosa100% (1)
- Ligações Iônicas Ou EletrovalentesDocumento4 páginasLigações Iônicas Ou EletrovalentesThais CerqueiraAinda não há avaliações
- Trabalho de QuímicaDocumento10 páginasTrabalho de QuímicaPaulo António JúniorAinda não há avaliações
- Ligações Químicas - Iônica e CovalenteDocumento3 páginasLigações Químicas - Iônica e CovalenteJerusa FreitasAinda não há avaliações
- 06 - Liga Es Qu Micas e Resson NciaDocumento30 páginas06 - Liga Es Qu Micas e Resson NciaRaiplayG10 []Ainda não há avaliações
- Ligações QuímicasDocumento7 páginasLigações QuímicasDomingos MbanaAinda não há avaliações
- Ligações QuimicasDocumento2 páginasLigações Quimicasrosimeri.batistaAinda não há avaliações
- Ligações QuímicasDocumento6 páginasLigações QuímicasWuazoAinda não há avaliações
- Ligações Químicas 02-1Documento53 páginasLigações Químicas 02-1Rauan BrendonAinda não há avaliações
- Aula 6 - QuímicaDocumento30 páginasAula 6 - QuímicaBeatriz MenezesAinda não há avaliações
- Ligações Químicas - Teoria Do Octeto, Ligação Iônica, Ligação Metálica e CovalenteDocumento15 páginasLigações Químicas - Teoria Do Octeto, Ligação Iônica, Ligação Metálica e CovalentePedro100% (1)
- Ligações Químicas QG 2016Documento86 páginasLigações Químicas QG 2016Marco Túlio Pimenta100% (1)
- 15324916022012fundamentos de Quimica Aula 6Documento18 páginas15324916022012fundamentos de Quimica Aula 6Jefferson RibeiroAinda não há avaliações
- Aulas de Química Geral 1 - Ligações Quimicas - PitagorasDocumento27 páginasAulas de Química Geral 1 - Ligações Quimicas - Pitagorasjohn heberAinda não há avaliações
- Ligações QuímicasDocumento4 páginasLigações QuímicasWellington PimentelAinda não há avaliações
- Apostila Ligações Ionicas e CovalentesDocumento3 páginasApostila Ligações Ionicas e Covalentesjufontana7Ainda não há avaliações
- Aula+6+-+Ligações+Quimicas Fabiana+AlmeidaDocumento49 páginasAula+6+-+Ligações+Quimicas Fabiana+AlmeidaBené JúniorAinda não há avaliações
- Clara Anotações Escola PDFDocumento3 páginasClara Anotações Escola PDFmaria clara melo moreiraAinda não há avaliações
- LigaCao Quimica 9a ClasseDocumento9 páginasLigaCao Quimica 9a ClasseNélio MachadoAinda não há avaliações
- 4 - Ativ. Ciencias 9o AnoDocumento13 páginas4 - Ativ. Ciencias 9o AnoAdriana JesusAinda não há avaliações
- Ligacoes Quimicas para EJADocumento11 páginasLigacoes Quimicas para EJAAlda ErnestinaAinda não há avaliações
- Íons e Ligações QuímicasDocumento8 páginasÍons e Ligações Químicaserika.poa.rsAinda não há avaliações
- 4 Ligacoes Quimicas - Simbolos de Lewis e ADocumento26 páginas4 Ligacoes Quimicas - Simbolos de Lewis e AhitcarAinda não há avaliações
- Ligações QuímicasDocumento16 páginasLigações QuímicasAmandaAinda não há avaliações
- Ligações QuímicasDocumento66 páginasLigações QuímicasBenites PatrickAinda não há avaliações
- Ligacoes QuimicasDocumento121 páginasLigacoes QuimicasmanudaoAinda não há avaliações
- Material Teorico e Exercicios 2021.2Documento78 páginasMaterial Teorico e Exercicios 2021.2Felipe BitencourtAinda não há avaliações
- Plano de Aula Ligações QuimicasDocumento10 páginasPlano de Aula Ligações QuimicasHelena Brites RodriguesAinda não há avaliações
- Ligaes QumicasDocumento3 páginasLigaes QumicasBrendaAinda não há avaliações
- ATIVIDADeDocumento4 páginasATIVIDADePablo ViniciusAinda não há avaliações
- Aula para Upload Aula7Documento11 páginasAula para Upload Aula7Pércio De JesusAinda não há avaliações
- Ligações Quimica AlannaDocumento44 páginasLigações Quimica AlannaAlanna Costa100% (2)
- Ligaçoes QuimicasDocumento26 páginasLigaçoes QuimicasCAROLINE NEVES COSTAAinda não há avaliações
- Quimica OrganicaDocumento257 páginasQuimica Organicaacgsoares14100% (2)
- Ligação IônicaDocumento8 páginasLigação Iônicagabriele gomesAinda não há avaliações
- Aula 09 - Ligações Químicas e Determinação de Fórmulas de Compostos IônicosDocumento8 páginasAula 09 - Ligações Químicas e Determinação de Fórmulas de Compostos IônicosvicfborgesAinda não há avaliações
- Aula 05 - Ligações QuímicasDocumento11 páginasAula 05 - Ligações QuímicasMarcelo NogueiraAinda não há avaliações
- Ligações AtômicasDocumento20 páginasLigações AtômicasRubens SantosAinda não há avaliações
- Trabalho de Química PDFDocumento18 páginasTrabalho de Química PDFLetício FranciscoAinda não há avaliações
- Eletrosfera e Ligações QuímicasDocumento5 páginasEletrosfera e Ligações QuímicaslarissacanellaAinda não há avaliações
- Lista 2Documento8 páginasLista 2ThallesAlmeidaAinda não há avaliações
- Material de Química 2Documento7 páginasMaterial de Química 2Camila MouraAinda não há avaliações
- Esc Est Técnica José CanellasDocumento4 páginasEsc Est Técnica José CanellasguilhermekwacheleskiAinda não há avaliações
- Slides Ligações QuímicasDocumento24 páginasSlides Ligações Químicasluamaria9wjoaquinaAinda não há avaliações
- Aula 7 e 8 Ligações QuímicasDocumento61 páginasAula 7 e 8 Ligações QuímicasVinicius GamaAinda não há avaliações
- Ligacao Covalente e MetalicaDocumento11 páginasLigacao Covalente e MetalicaRobbin StroschOneAinda não há avaliações
- Aula 2Documento56 páginasAula 2jailson suquitodoceAinda não há avaliações
- Química 1A: Aula 3 - Ligações QuímicasDocumento26 páginasQuímica 1A: Aula 3 - Ligações QuímicasLavinia FagundesAinda não há avaliações
- Quim - Ligações QuímicasDocumento34 páginasQuim - Ligações Químicas1belnAinda não há avaliações
- Ligações InteratômicasDocumento12 páginasLigações InteratômicasCarina SiqueiraAinda não há avaliações
- Ligações Químicas - Química GeralDocumento29 páginasLigações Químicas - Química GeralJean Carlos CarlosAinda não há avaliações
- Modelo AtômicoDocumento2 páginasModelo AtômicoCid FilhoAinda não há avaliações
- Emilie Durkheim Fatos SociaisDocumento1 páginaEmilie Durkheim Fatos SociaisCid FilhoAinda não há avaliações
- Émilie Durkheim e A Divisão Social Do TrabalhoDocumento3 páginasÉmilie Durkheim e A Divisão Social Do TrabalhoCid FilhoAinda não há avaliações
- AgronegócioDocumento3 páginasAgronegócioCid FilhoAinda não há avaliações
- 2 Revolução IndustrialDocumento2 páginas2 Revolução IndustrialCid FilhoAinda não há avaliações
- Polarização Política e Seus Efeitos Na SociedadeDocumento1 páginaPolarização Política e Seus Efeitos Na SociedadeCid FilhoAinda não há avaliações
- Beamer ModeloDocumento49 páginasBeamer Modeloleandro1281Ainda não há avaliações
- Programacao Linear Aula 3 - 2020Documento9 páginasProgramacao Linear Aula 3 - 2020bentoAinda não há avaliações
- As MônadasDocumento7 páginasAs MônadasOVERBURNAinda não há avaliações
- Lista1 - Econometria IIDocumento4 páginasLista1 - Econometria IIAlice VasconcelosAinda não há avaliações
- Acentuação GráficaDocumento4 páginasAcentuação GráficaLeandroAinda não há avaliações
- Apostila USP PDFDocumento24 páginasApostila USP PDFPatricia AlmeidaAinda não há avaliações
- 3 Lei de NewtonDocumento1 página3 Lei de NewtonAnnalyce AbelhaAinda não há avaliações
- Lista de Exercícios LEIS DE NEWTONDocumento2 páginasLista de Exercícios LEIS DE NEWTONCícero FeitosaAinda não há avaliações
- Variação de TemperaturaDocumento3 páginasVariação de TemperaturaEduarda GabrielaAinda não há avaliações
- Reforço Prova 2Documento42 páginasReforço Prova 2John Lopes Jr.Ainda não há avaliações
- Apostila Dominando Python2Documento72 páginasApostila Dominando Python2Camila Ferreira DiasAinda não há avaliações
- 135-Abs - Sae 01Documento9 páginas135-Abs - Sae 01Egydio Tahira FilhoAinda não há avaliações
- Scimitar ManualDocumento18 páginasScimitar ManualHamer FélixAinda não há avaliações
- Codigos de Falha PethaDocumento26 páginasCodigos de Falha PethaCarlos EduardoAinda não há avaliações
- Segunda Avaliação - Bruno BalotinDocumento8 páginasSegunda Avaliação - Bruno BalotinBruno BalotinAinda não há avaliações
- Matheus Rodrigues - Procedimentos de EnfermagemDocumento231 páginasMatheus Rodrigues - Procedimentos de EnfermagemSara MartinezAinda não há avaliações
- 618 Introduçao Conduçao 03082017Documento80 páginas618 Introduçao Conduçao 03082017Jean Patrick Freitas NobreAinda não há avaliações
- Manual GdoorDocumento6 páginasManual GdoorNaiara BonifacioAinda não há avaliações
- DOQ-Cgcre-36 - 02 - Orientações Sobre Verificações Das Balanças PDFDocumento7 páginasDOQ-Cgcre-36 - 02 - Orientações Sobre Verificações Das Balanças PDFJoão Vitor Apolinário FerreiraAinda não há avaliações
- Destravando Seu ImprovisoDocumento37 páginasDestravando Seu ImprovisoJeferson DiasAinda não há avaliações
- Relatório Físico-Químico - Aplicação Da Lei de Dalton para Determinar o Volume Molar de Um GásDocumento4 páginasRelatório Físico-Químico - Aplicação Da Lei de Dalton para Determinar o Volume Molar de Um GásOliveira Salezio GabrielAinda não há avaliações
- Jardim Botânico - CompletoDocumento4 páginasJardim Botânico - CompletoGustavo 61Ainda não há avaliações
- Lista 04 7º Ano Números InteirosDocumento1 páginaLista 04 7º Ano Números InteirosDiego SouzaAinda não há avaliações
- Aspecto Grafico Do Trabalho AcademicoDocumento33 páginasAspecto Grafico Do Trabalho AcademicoFrancisco PontesAinda não há avaliações
- Racionalismo Descartes 11o Ano - CompletoDocumento36 páginasRacionalismo Descartes 11o Ano - CompletoDiogo SilvaAinda não há avaliações