Escolar Documentos
Profissional Documentos
Cultura Documentos
Apostila de Fisica 2o Ano 1o Sem
Apostila de Fisica 2o Ano 1o Sem
Enviado por
oluapfonsecaDireitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Apostila de Fisica 2o Ano 1o Sem
Apostila de Fisica 2o Ano 1o Sem
Enviado por
oluapfonsecaDireitos autorais:
Formatos disponíveis
APOSTILA DE FSICA 2 SRIE EM
CALOR, ENERGIA TRMICA E TEMPERATURA:
Calor: um tipo de energia (como a eltrica, a nuclear, a qumica) que tem como caracterstica importante o fato de estar sempre em trnsito, bastando que haja uma diferena de temperatura entre dois pontos. Energia trmica: a energia trmica de um corpo a energia cintica total de suas molculas. Ela depende da velocidade das molculas, das massas moleculares e do nmero total de molculas que constituem o corpo. Temperatura: uma medida da agitao das molculas de um corpo. Quanto maior essa agitao, maior a temperatura desse corpo.
Ento, um corpo ao receber calor (energia trmica) de outro, tem um aumento de sua temperatura pois suas molculas passam a ter maior agitao, ou seja, a energia trmica recebida convertida em energia cintica das molculas. LEMBRE-SE: CALOR E TEMPERATURA no so a mesma coisa. As sensaes de quente e frio tem relao com as trocas de calor e no com a temperatura propriamente dita. Algo que em um momento nos d a sensao de frio, no momento seguinte pode nos dar a sensao de quente. Escreva no caderno um exemplo dessa situao. Fontes de Calor: naturais, Sol; fsicas, o atrito, a corrente eltrica; qumicas, as combustes em geral. termmetro um instrumento utilizado para avaliar a temperatura de
TERMOMETRIA:
um corpo. Existem vrios tipos de termmetros, mas os mais comuns utilizam uma escala e uma substncia termomtrica que se dilata uniformemente ao entrar em contato com um corpo e ao atingir o equilbrio trmico nos d uma medida da temperatura desse corpo. O mercrio a substncia mais utilizada pois sendo metal, um bom condutor de calor e possui pontos de vaporizao e solidificao bem distanciados. Pesquisar os vrios tipos de termmetros e medidores de temperatura utilizados. Pesquisar os pontos de fuso e ebulio do mercrio e do lcool utilizado em termmetros e comentar suas aplicaes utilizando essa informao como justificativa. Grupo de 3 pessoas. Escalas termomtricas: ao se construir um termmetro devemos associ-lo a uma escala. Podemos escolher um ponto para representar o incio da escala, por exemplo, o ponto de fuso da gua e outro ponto para representar a evoluo da escala, por exemplo, o ponto de ebulio da gua. Essa uma escala relativa. As escalas relativas mais utilizadas so a Celsius e a Fahrenheit.
Para converter a temperatura de uma escala para outra fazemos comparao utilizando propores. No desenho observamos que:
Tc 0 TF 32 100 180
Exerccio: A) Qual a temperatura na qual as escalas Celsius e Fahrenheit marcam o mesmo valor? B) Uma menina vai para o Chile e lhe informam que, nesse pais, em janeiro, a temperatura mdia 64,4F. Qual o valor correspondente na escala Celsius? Escala Kelvin: uma escala absoluta, ou seja, o zero dessa escala corresponde menor temperatura possvel na natureza, mas que no foi atingida na prtica, embora se tenha chegado perto da mesma e nessas condies foram descobertos dois novos estados da matria (Pesquisar quais os estados da matria. Escrever no seu caderno). a escala padro no Sistema Internacional de Medidas. O 0K corresponde a -273,156C, mas para efeitos de correspondncia de escalas usamos o valor 273. Ou seja, para converter de C para K, somamos 273 e de K para C subtramos 273. Exerccio: a temperatura de ebulio do nitrognio, sob presso normal, 77K. Na escala Celsius qual a temperatura correspondente?
DILATAO TRMICA: quando um corpo submetido a uma variao de temperatura,
suas dimenses se alteram. Nos slidos, so trs tipos de dilatao: linear, superficial e volumtrica. Linear: considera a dilatao de um corpo em uma dimenso apenas. Exemplo, um fio, uma barra. A variao (L) que o corpo vai sofrer depende do comprimento inicial (Li), da variao de temperatura (T) e do coeficiente de dilatao linear () do material. Esse coeficiente indica qual o aumento que o material sofre a cada grau de variao de temperatura. um valor especfico para cada material. Por exemplo, o do ferro 1,2.10-5C-1, ou seja, para 1 grau de aumento da temperatura, o comprimento aumenta 0,000012 da unidade de comprimento do material. Ento L=Li..T e o comprimento final da pea Lf=Li+L. Superficial: estuda a dilatao de um corpo em duas dimenses. o caso de uma chapa plana. Por exemplo, ao aquecermos ou resfriamos essa chapa ela varia o tamanho na largura e no comprimento. Chamando a dilatao trmica superficial de S, Si=rea 2
inicial da superfcie, T=variao de temperatura e o coeficiente de dilatao superficial (=2.), ento: S=Si..T e a rea final Sf=Si+S. Volumtrica: considera a dilatao do corpo em trs dimenses: comprimento, largura e profundidade. V=Vi..T, onde: V a variao de volume, Vi o volume inicial, o coeficiente de dilatao volumtrica onde =3., T a variao de temperatura. O volume final dado por Vf=Vi+V. Dilatao de Lquidos: como os lquidos no possuem forma prpria, assumimos o volume do recipiente em que se encontram nos estudos de dilatao e, portanto vamos trat-la como volumtrica. Entretanto, os lquidos possuem coeficientes de dilatao diferentes dos recipientes em que se encontram e isso faz com que se dilatem de modo diferente dos recipientes. comum o lquido dilatar mais e transbordar surgindo o que chamamos de dilatao aparente. Entretanto, a dilatao sofrida pelo lquido a do recipiente somada aparente. A essa chamamos de dilatao real.
Exerccios: A) A uma dada temperatura um pino ajusta-se perfeitamente a um orifcio de uma chapa metlica. Se somente a chapa for aquecida, o que acontecer ao pino? B) Um tubo de lato dilatou 13mm, quando sua temperatura passou de 20C para 70C. Qual o comprimento do tubo a 20C, sabendo que o coeficiente de dilatao linear do lato 2.10-5C-1? C) Uma placa de ao tem um furo circular de 2 cm2 de rea a 10C. Determinar a rea do orifcio se a placa for aquecida a 1010C, sabendo-se que o coeficiente de dilatao linear do ao 11.10-6C-1 D) Um vasilhame de alumnio com capacidade inicial de 1l, contendo glicerina, levado ao fogo. Quando o sistema sofre uma variao de 40C, a glicerina passa a ocupar todo o volume disponvel. Sabendo-se que o coeficiente de dilatao volumtrico do alumnio 50.10-6C-1 e o da glicerina 500.10-6C-1, calcule o volume inicial da glicerina.
PROPAGAO DE CALOR:
a propagao ou transmisso de calor a passagem de
energia trmica de um corpo para outro. Ela se d por trs processos: conduo, conveco e irradiao.
Conduo: a transmisso de calor partcula a partcula. As molculas em contato com a fonte de calor tm sua energia cintica aumentada e com isso causando o choque com as molculas vizinhas e isso se propaga por todo o material. Existem materiais que so bons condutores de calor, como os metais e materiais que so bons isolantes trmicos como o isopor, a borracha, a cortia, a porcelana. Conveco: acontece pelo movimento de matria. Ocorre geralmente nos fluidos, tais como lquidos e gases. Por exemplo, uma vasilha com gua. A gua no fundo da vasilha comea a se aquecer devido o contato com a panela. Mas ao se aquecer torna-se menos denso que a camada de liquido em contato com a atmosfera e assim sobe e a camada superior desce, vindo a se tornar mais fria que a inferior e assim ocorre a movimentao das camadas de gua dentro da vasilha pelo processo de conveco. Esse processo no pode ocorrer no vcuo, pois depende da movimentao da matria. A origem dos ventos explicada por correntes de conveco. A brisa martima resultado da diferena de comportamento trmico entre a terra e a gua. Durante o dia a Terra se aquece mais que a gua e assim ocorre movimentao do ar do mar para a terra (brisa martima). noite a gua mais quente que a terra e a a massa de ar da terra para o mar (brisa terrestre). Irradiao: o processo de transmisso de calor atravs de ondas eletromagnticas. No existe necessidade de um meio material para tal propagao. Logo, a nica maneira de transmitir calor no vcuo por irradiao. Exemplo: a transmisso da luz infravermelha do Sol at a Terra.
Pesquisa: faa uma pesquisa do funcionamento de uma garrafa trmica destacando a forma como ela impede a propagao de calor. Mencione isso para cada um dos trs processos mencionados acima.
CALORIMETRIA:
a parte da fsica que estuda as trocas de energia entre corpos ou
sistemas quando essas trocas se do na forma de calor. CALOR: a energia trmica em trnsito de um corpo com temperatura mais alta para um corpo com temperatura mais baixa. A unidade mais usual do calor caloria (cal), mas no S.I., considerando que o calor nada mais que uma forma de energia, sua unidade o joule (j). 1cal=4,18j. Calor Latente: o calor fornecido ou retirado de um corpo durante a mudana de fase da matria por unidade de massa. Em outras palavras, a quantidade de calor que 1g da matria necessita para mudar de fase. Note que durante a mudana de fase o corpo absorve ou fornece calor, entretanto sua temperatura no varia. Exemplo: o calor latente do gelo 80cal/g. Isto significa que para 1g de gelo virar gua ser necessrio fornecer 80 calorias. Seja Q a quantidade de calor que uma substncia precisa perder ou receber para mudar de fase, ento Q=m.L, onde m a massa em gramas e L o calor latente da sustncia em cal/g.
Calor especfico: uma grandeza fsica que define a Substncia Calor Especfico (cal/g.C) variao trmica em 1C de 1 grama de determinada gua 1,0 lcool 0,6 substncia ao receber ou ceder determinada quantidade 0,22 de calor. A tabela ao lado mostra o calor especfico de alumnio ar 0,24 algumas substncia. Observe que a gua a substncia carbono 0,12 com maior calor especfico 1 cal/gC. O ferro tem calor chumbo 0,031 especfico de 0,11 calor cal/gC. Isto significa que se cobre 0,094 ferro 0,11 quisermos elevar a temperatura em 1C de 1g de gua e gelo 0,5 1 g de ferro precisamos fornecer 1 caloria para a gua e hlio 1,25 0,11 caloria para o ferro, ou seja, necessrio hidrognio 3,4 praticamente 10 vezes mais calor para esquentar a gua lato 0,092 do que o ferro. madeira 0,42 0,033 Calor Sensvel: o calor recebido ou fornecido por um mercrio 0,25 corpo que provoca variao de temperatura. Por nitrognio ouro 0,032 exemplo, ao colocarmos uma panela no fogo ela, ao oxignio 0,22 receber o calor da chama, tem sua temperatura elevada. prata 0,056 rochas 0,21 Ento dizemos que o calor recebido pela panela calor vidro 0,16 sensvel. Para calcular a quantidade de calor sensvel Q, zinco 0,093 utilizamos a seguinte equao: Q=m.c.T onde m a massa em g; c o calor especfico da substncia e T a variao de temperatura. Capacidade Trmica: a quantidade de calor que um corpo necessita para que sua temperatura aumente 1C. Por exemplo, a capacidade trmica de 1 litro de gua 1000 cal/C, ou seja para aumentar a temperatura de 1 litro de gua em 1C so necessrias 1000 calorias. A capacidade trmica C=m.c (onde m=massa e c=calor especfico). Trocas de calor: num sistema termicamente isolado, a QB QA soma das quantidades de calor trocadas entre os B A calor corpos nula. O calor recebido pelo corpo B igual ao cedido pelo corpo A, ento QB=-QA ou QB+QA=0. Os recipientes usados para trocas de calor isoladas so denominados calormetros.
Mudana de Fase: dependendo do estado de agregao da matria, uma substncia pode se apresentar em trs fases: slida, lquida e gasosa (Alm desses
3 conhecidos estados existem mais 3 estados cientificamente comprovados: Plasma, Condensado Bose-Einstein e o Gs Ferminico, mas no trataremos desses estados neste momento). No estado slido as molculas esto fortemente ligadas entre si e apenas vibram. Na fase lquida as molculas possuem certa movimentao mas as foras de coeso entre as molculas ainda so suficientes para as manterem prximas. Na fase gasosa essas foras so extremamente fracas e as molculas movimentam-se desordenadamente ocupando todo o volume disponvel. Quando uma substncia recebe ou perde calor podem ocorrer as seguintes mudanas de estado: o Fuso: a passagem do estado slido para o estado lquido o Solidificao: a passagem do estado lquido para o estado slido o Vaporizao: a passagem do estado lquido para o gasoso o Condensao ou liquefao: a passagem do estado gasoso para o estado lquido
Sublimao: a passagem direta do estado gasoso para o slido ou vice e versa
Exerccio: A) Um bloco de gelo de 20g com temperatura de -20C presso normal recebe calor de uma fonte externa aquecendo-se at se transformar em vapor de gua a 100C. Calcular a quantidade de calor total fornecida ao bloco para que esse processo ocorra e fazer o grfico de TxQ (temperatura x quantidade de calor). Dado: cgelo=0,5cal/gC; cagua=1cal/gC; Lfagua=80cal/gC ; Lvagua=540cal/g/C). B) O grfico representa a variao de temperatura T(C) de um corpo slido, em funo do tempo ao ser aquecido por uma fonte que libera energia 40 a uma potncia constante de 150 cal/min. Como a massa do corpo de 100g, qual o seu 20 calor especfico em cal/gC? 10 t(min.)
GASES: os gases representam o estado da matria no qual as partculas que o constituem
movimentam-se com total liberdade. Possuem propriedades de expansibilidade e compressibilidade. A primeira diz que o gs ocupa todo o volume do recipiente onde est depositado. A compressibilidade garante a sensvel reduo do volume do gs. O estado de certa massa gasosa caracterizado por suas variveis de estado, a saber: o Volume (V), a temperatura (T) e a presso (p). Uma transformao gasosa ocorre quando pelo menos duas dessas variveis se alteram. A equao de Clapeyron relaciona essas variveis para um m determinado gs: p.V=n.R.T, onde p=presso; V= volume; n=numero de mols do gs (n= ),
R=constante universal dos gases perfeitos e T= temperatura. Considerando-se que os gases em estudo so ideais, pode-se aplicar a equao dos gases perfeitos: p i Vi p o Vo
Ti
To
importante lembrar-se que a unidade de temperatura utilizada na definio dessas equaes o Kelvin (K). p Transformao Isotrmica: nessa transformao o volume e a presso variam e a temperatura permanece constante. O grfico pxV tem o aspecto de uma hiprbole que chamada de isoterma. (piVi=poVo) Transformao Isobrica: a temperatura e o volume p variam enquanto a presso do sistema permanece constante. O grfico pxV tem o aspecto da figura e a equao da transformao gasosa se reduz a
Vi Vo Ti To
6 V
Transformao isomtrica: a que ocorre com volume constante, enquanto a presso p e a temperatura T variam. Tambm conhecida como transformao isocrica ou isso volumtrica. O grfico p x V tem o aspecto da figura e a equao de transformao se reduz a: p pi po
Ti
To
V Exerccios: A) Num recipiente fechado h um gs a uma presso de 3.105Pa(N/m2) e a uma temperatura de 27C. Qual ser a presso do gs quando a temperatura for elevada para 327C? B) Um gs ideal ocupa um volume de 4 litros a uma presso de 6 atm, num recipiente em que um mbolo mvel permite a variao de volume entre 2 e 10 litros. Considerando-se que no h variao de temperatura, qual a presso para um volume de 2 litros? C) Identifique os tipos de transformaes gasosas representadas no grfico: 1. _________________ 2. ___________________ 3.__________________
Trabalho de pesquisa: grupos de 4. Fazer pesquisa e preparar apresentao para a classe: Relacione os conhecimentos de Fsica aprendidos sobre Temperatura e Calor com os seguintes fenmenos da natureza: efeito estufa, frente fria, massa de ar polar, inverso trmica. Primeiro conceitue cada um desses fenmenos e depois os relacione com as Leis Fsicas aprendidas. TERMODINMICA:
a parte da Termologia que estuda as relaes entre calor e
trabalho, num gs ideal. Existem processos que transformam energia cintica em calor, por exemplo, um corpo que desliza sobre uma superfcie com atrito at parar. A superfcie aquece porque a energia cintica transformada em calor. Pode ocorrer tambm o inverso, a transformao do calor em trabalho, por exemplo, uma tampa de uma panela levantando-se devido o vapor dos lquidos aquecidos na panela. Ciclos: a denominao dos processos termodinmicos. Podem ser abertos ou fechados. No primeiro caso, os estados iniciais e finais so diferentes (ou seja, as variveis de estado do gs so alteradas). Nos ciclos fechados, os estados iniciais e finais no se alteram, ou seja, P, V e T do incio do processo so iguais a P,V e T do fim do processo. Sistema: o sistema termodinmico o gs que sofrer transformaes de modo a realizar ou receber trabalho. 7
Trabalho: um gs realiza trabalho (ou seja, transfere energia ao meio externo) quando ocorre expanso no seu volume. Por exemplo, um gs comprimido num cilindro com um mbolo. Ao se soltar o mbolo ocorre a expanso do gs. Como essa transformao isobrica, o trabalho calculado pela expresso: =p(Vo-Vi). Se o gs for comprimido presso constante, o meio externo que est realizando o trabalho sobre o gs e o trabalho negativo, pois o volume final menor que o inicial. Energia Interna: a energia de um gs perfeito monoatmico (tomos no ligados) a soma das energias cinticas mdias de todas as suas molculas. A energia interna est relacionada temperatura do gs. Se um gs tem sua energia interna aumentada, sua temperatura tambm aumenta. Se a energia interna de um gs no alterada, sua temperatura permanece a mesma. Primeiro princpio da Termodinmica: A variao da energia interna de um gs representada por U=Q-, onde Q a quantidade de calor trocada entre o gs e o meio externo e o trabalho realizado sobre o gs ou pelo gs. A figura a seguir resume os sinais das grandezas envolvidas. Nas transformaes cclicas, o estado final do gs igual ao inicial e assim U=0 e Q=. O trabalho dado pela rea delimitada pelas curvas do ciclo. Se o sentido do ciclo for horrio, o trabalho positivo. Se o sentido for anti-horrio o trabalho negativo.
Exerccios: A) A figura mostra a variao do volume de um gs ideal, presso constante de 4N/m2, em funo da temperatura. Sabe-se que, durante a transformao de estado de A a B, o gs recebeu uma quantidade de calor igual a 20j. Qual a variao da energia interna do gs entre os estados A e B? B) Certa quantidade de gs sofre um ciclo de transformaes, representado no diagrama. Calcule o trabalho realizado pelo gs ao descrever o ciclo ABCA, em joules, e o calor trocado entre o gs e o meio, em calorias. Considere 1cal=4,2j.
Transformaes adiabticas: so transformaes onde no ocorrem trocas de calor com o meio externo, pois elas ocorrem muito rapidamente. Numa expanso adiabtica, o gs realiza trabalho mas no h trocas de calor, ou seja, Q=0. A variao da energia interna U=-, ou seja, na expanso adiabtica o gs utiliza sua energia interna para realizar o trabalho e por isso o gs tende a se resfriar. Numa compresso adiabtica, o trabalho realizado sobre o gs transformado em energia interna e assim a temperatura do gs aumenta. Segundo Princpio da Termodinmica: estabelece que o calor flui espontaneamente de um corpo mais quente para outro mais frio e que impossvel construir uma mquina que transforme totalmente o calor recebido em trabalho. Rendimento das Mquinas Trmicas: o O trabalho realizado por uma mquina trmica a diferena entre a energia recebida da fonte quente e a energia dispensada na fonte fria. Q1=calor recebido Q2=calor rejeitado =trabalho realizado
=Q1-Q2 e o rendimento () dessa mquina indica o aproveitamento da energia que est sendo fornecida, ou seja, qual a porcentagem da energia fornecida transformada em trabalho. calculada por: = Q1 Ciclo de Carnot: constitudo por uma expanso isotrmica (AB) seguida de uma adiabtica (BC) e por uma compresso isotrmica (CD) seguida de uma adiabtica (DA). O calor provoca a expanso do gs aquecido e pode ser transformado em trabalho. Observe que: o na expanso isotrmica AB o gs retira calor da fonte quente o na expanso adiabtica BC o gs no troca calor o na compresso isotrmica CD o gs rejeita calor para a fonte fria o na compresso adiabtica DA o gs no troca calor. A mquina de Carnot a que apresenta o maior rendimento possvel. uma mquina terica que no pode ser produzida. Nenhuma mquina pode ter rendimento melhor que a mquina de Carnot. Mesmo uma mquina operando no ciclo de Carnot no consegue rendimento de 100%. Para calcular o rendimento de uma mquina de Carnot basta conhecer a temperatura das fontes quente e fria. =1- T2 T1 9
Exerccios: A) Determine o trabalho realizado por um gs que comprimido isobaricamente por uma presso de 200N/m2, sabendo que o seu volume passou de 12 m3 para 8m3. B) Um gs sofre uma transformao isobrica como mostra o grfico. Qual o trabalho realizado por esse gs? C) Qual a variao da energia interna de um gs ideal sobre o qual realizado um trabalho de 80j, durante uma compresso adiabtica. D) A figura ao lado representa um cilindro com mbolo mvel, de massa 200 Kg e rea A= 100 cm2,que contm inicialmente 2,4 litros de um gs ideal temperatura de 27C. Aquece-se o sistema at a temperatura estabilizar-se em 127C; a presso atmosfrica igual a 105N/m2. Adotar g=10m/s2. Qual o volume final do gs? Qual o trabalho mecnico realizado? E) Uma mquina trmica funciona realizando o ciclo de Carnot entre as temperaturas de 800K e 400K. Em cada ciclo a mquina recebe 1000j de calor da fonte quente. a. Qual o calor rejeitado em cada ciclo? b. Qual o trabalho realizado pela mquina em cada ciclo? c. Calcule o rendimento da mquina PESQUISA SOBRE ENTROPIA: grupo de 3 alunos. Descrever o que entropia, qual a relao com as leis da termodinmica. De acordo com essa teoria, o que se espera para o futuro? Qual a opinio do grupo a respeito do assunto? Essa ltima pergunta deve ser respondida na concluso do trabalho.
10
Você também pode gostar
- Relatório de Química Analítica: PotenciometriaDocumento14 páginasRelatório de Química Analítica: PotenciometriaGabi Bitto100% (10)
- História Da MatemáticaDocumento15 páginasHistória Da MatemáticaPaulo César da SilvaAinda não há avaliações
- Introdução A TermologiaDocumento10 páginasIntrodução A Termologiapaulamelo641313Ainda não há avaliações
- ALFA Livro de FichasDocumento64 páginasALFA Livro de FichasCarla Luciana Pereira72% (18)
- Faca o DOWNLOAD Do GUIA DO CONCURSEIRO e Aprenda A Estudar de GRACA PDFDocumento133 páginasFaca o DOWNLOAD Do GUIA DO CONCURSEIRO e Aprenda A Estudar de GRACA PDFDiemis Rochumback100% (2)
- 20152-2302 EPD004 TA 133 N-1440105346-Aula 02 Previsao de Demanda PDFDocumento31 páginas20152-2302 EPD004 TA 133 N-1440105346-Aula 02 Previsao de Demanda PDFFranciele BorgesAinda não há avaliações
- Física II - Aula 2Documento9 páginasFísica II - Aula 2Ocino JúniorAinda não há avaliações
- 1° e 2° LISTA 2° A e B - Trilhas de Aprendizagem. ANO 2023Documento17 páginas1° e 2° LISTA 2° A e B - Trilhas de Aprendizagem. ANO 2023Zeca Vieira AlencarAinda não há avaliações
- Termologia-Dilatação Térmica - RevDocumento36 páginasTermologia-Dilatação Térmica - RevRaquel AcacioAinda não há avaliações
- Curso Fisica TermicaDocumento38 páginasCurso Fisica TermicamarcoabqsAinda não há avaliações
- Apostila-Lélio-2012 41 108 PDFDocumento68 páginasApostila-Lélio-2012 41 108 PDFAlineLimaChicoTinocoAinda não há avaliações
- Termologia-Dilatação Térmica - RevDocumento36 páginasTermologia-Dilatação Térmica - RevGildásio JúniorAinda não há avaliações
- 55d3bd130d582 PDFDocumento12 páginas55d3bd130d582 PDFEBookexcel100% (1)
- SAU BAFICI 21 E 3 ValidaçãoDocumento39 páginasSAU BAFICI 21 E 3 ValidaçãoAlexandre XavierAinda não há avaliações
- Pet Física Eja 2 3 BimestreDocumento12 páginasPet Física Eja 2 3 BimestreRodrigo RamosAinda não há avaliações
- Trabalho de FisicaDocumento5 páginasTrabalho de FisicafranciscoAinda não há avaliações
- Barbie 2.0Documento13 páginasBarbie 2.0Ana Beatriz Fernandes CondeAinda não há avaliações
- Propagação de CalorDocumento10 páginasPropagação de CalorCelorsAinda não há avaliações
- Apostila - CalorDocumento74 páginasApostila - CalorDenisCoutinhoAinda não há avaliações
- Pet Complementar Física 2º Ano Volume Ii - CompletoDocumento15 páginasPet Complementar Física 2º Ano Volume Ii - CompletoCaticilene JesusAinda não há avaliações
- Apostila de Física 2Documento11 páginasApostila de Física 2moraes_matAinda não há avaliações
- Propagacao Do CalorDocumento27 páginasPropagacao Do CalorLudymilla Raika Valentim Costa100% (1)
- Termologia Aluno PDFDocumento11 páginasTermologia Aluno PDFThayse MartinsAinda não há avaliações
- Roteiro de Estudos Unidade II-1Documento7 páginasRoteiro de Estudos Unidade II-1RaquellsabinoAinda não há avaliações
- Trabalho FísicaDocumento19 páginasTrabalho Físicaemilybsantosdea07Ainda não há avaliações
- Relatório Coeficiente de DilataçãoDocumento5 páginasRelatório Coeficiente de DilataçãoThalita PradoAinda não há avaliações
- TERMOMETRIADocumento51 páginasTERMOMETRIAdinavan712Ainda não há avaliações
- Ficha 1 - 9 ClasseDocumento4 páginasFicha 1 - 9 ClassekmissasAinda não há avaliações
- TERMOLOGIADocumento19 páginasTERMOLOGIAHellen Garcia GomesAinda não há avaliações
- Termodinâmica AtualDocumento164 páginasTermodinâmica AtualVinícius MenezesAinda não há avaliações
- 12 - Termologia - 1°parteDocumento66 páginas12 - Termologia - 1°parteGabriela AvelarAinda não há avaliações
- 1 09 COC TermometriaDocumento15 páginas1 09 COC TermometriaThiago AndradeAinda não há avaliações
- 7º ANO - Temperatura - FÍSICADocumento27 páginas7º ANO - Temperatura - FÍSICAcaio.pinheiro6681658851Ainda não há avaliações
- ArquivoDocumento4 páginasArquivoJúlia CardosoAinda não há avaliações
- Pet 2 Física 2° AnoDocumento7 páginasPet 2 Física 2° Anolucilene carneiroAinda não há avaliações
- TermologiaDocumento45 páginasTermologiaAntonio RibeiroAinda não há avaliações
- Calor e TemperaturaDocumento22 páginasCalor e TemperaturaGeovanna MatosAinda não há avaliações
- Física TérmicaDocumento11 páginasFísica TérmicaAelsonMelloAinda não há avaliações
- Calorimetria e Dilatometria - Trabalho 2º BimestreDocumento9 páginasCalorimetria e Dilatometria - Trabalho 2º BimestreClaude BrechtAinda não há avaliações
- Ativ. Remo 2º Ano 3 Ativ. Emaús 2021Documento5 páginasAtiv. Remo 2º Ano 3 Ativ. Emaús 2021João TavaresAinda não há avaliações
- Fisica CalorDocumento11 páginasFisica CalorVANESSA CRISTINA BORTOLOSSI VIERAAinda não há avaliações
- CALORIMETRIADocumento17 páginasCALORIMETRIAWanderson MendesAinda não há avaliações
- Movimento Térmico: Número:38 Nome: Maíra VigáriDocumento8 páginasMovimento Térmico: Número:38 Nome: Maíra VigáriKellson BSAinda não há avaliações
- Calor e TemperaturaDocumento13 páginasCalor e TemperaturaTatiana KoroivaAinda não há avaliações
- Apostila FísicaDocumento19 páginasApostila FísicaFrancisco Adriano Oliveira da RosaAinda não há avaliações
- Unidade 4 - Termologia IIDocumento14 páginasUnidade 4 - Termologia IILair MacedoAinda não há avaliações
- Exercıcios ConceituaisDocumento4 páginasExercıcios ConceituaisFABIO DE OLIVEIRA SOUSAAinda não há avaliações
- Atividade Das Unidades 1 e 2Documento12 páginasAtividade Das Unidades 1 e 2Leticia KaremAinda não há avaliações
- Atividade Das Unidades 1 e 2..Documento12 páginasAtividade Das Unidades 1 e 2..Leticia KaremAinda não há avaliações
- Fisica 2 - TermometriaDocumento3 páginasFisica 2 - TermometriaThéo OliveiraAinda não há avaliações
- 2 Ano FisicaDocumento60 páginas2 Ano FisicaApollo SilvaAinda não há avaliações
- Condução TérmicaDocumento13 páginasCondução TérmicaEduardo SouzaAinda não há avaliações
- Aula - Introdução A Termologia PDFDocumento2 páginasAula - Introdução A Termologia PDFdiegorobsonAinda não há avaliações
- 34 Propagação de CalorDocumento5 páginas34 Propagação de CalorpaulorochadigitalAinda não há avaliações
- Transporte de Calor e MassaDocumento8 páginasTransporte de Calor e MassaLyandra RafaelaAinda não há avaliações
- 701 Temperatura, Calor e Sensação TérmicaDocumento6 páginas701 Temperatura, Calor e Sensação TérmicaLourdes JesusAinda não há avaliações
- Calor e Sua PropagaçãoDocumento27 páginasCalor e Sua PropagaçãoMarcos MacedoAinda não há avaliações
- 2° Lista Trilhas de AprendizadoDocumento7 páginas2° Lista Trilhas de AprendizadoZeca Vieira AlencarAinda não há avaliações
- Aula 1Documento3 páginasAula 1osvaldoAinda não há avaliações
- TERMOMETRIADocumento12 páginasTERMOMETRIALuine CerqueiraAinda não há avaliações
- BernoliDocumento10 páginasBernoliMarcos AndreAinda não há avaliações
- 2N1 - Escalas TermométricasDocumento4 páginas2N1 - Escalas TermométricasJuliana Da Costa CastiglioniAinda não há avaliações
- Atoração de Expressões AlgébricasDocumento13 páginasAtoração de Expressões AlgébricasLUCELINO DA COSTA LARANJEIRAAinda não há avaliações
- LpII-Atividade 3Documento4 páginasLpII-Atividade 3Math HonAinda não há avaliações
- OPT Aula-29Documento47 páginasOPT Aula-29Hélio Julião NgoveAinda não há avaliações
- Indutor ToriodalDocumento7 páginasIndutor ToriodalPriscila LimaAinda não há avaliações
- Relatorio Bioquimica EspectrofotometriaDocumento13 páginasRelatorio Bioquimica EspectrofotometriaanacarolwAinda não há avaliações
- PROVA DE RACIOCÍNIO QUANTITATIVO ANPAD Jun 2008Documento12 páginasPROVA DE RACIOCÍNIO QUANTITATIVO ANPAD Jun 2008ricardoalfenasAinda não há avaliações
- Exercicios PythonDocumento3 páginasExercicios PythonPaulo RijoAinda não há avaliações
- Lista Exercicios Gases 3Documento5 páginasLista Exercicios Gases 3Jacinete LimaAinda não há avaliações
- Relatório de Associação de Molas em Série e em ParaleloDocumento6 páginasRelatório de Associação de Molas em Série e em ParaleloMariana Aboud100% (1)
- Holo Cine 1 CompactoDocumento23 páginasHolo Cine 1 CompactoAline RodriguesAinda não há avaliações
- Processo de Otimização Multidisciplinar de Aeronaves Por Evolução DiferencialDocumento9 páginasProcesso de Otimização Multidisciplinar de Aeronaves Por Evolução DiferencialMatheus MonteiroAinda não há avaliações
- Manual de Subrotinas Apalpador Ling Fanuc Portugues H 2000 6338 0C A PDFDocumento191 páginasManual de Subrotinas Apalpador Ling Fanuc Portugues H 2000 6338 0C A PDFBruno TeixeiraAinda não há avaliações
- 33 Prof MatematicaDocumento11 páginas33 Prof MatematicaPaulo HenriqueAinda não há avaliações
- Figuras de LissajousDocumento6 páginasFiguras de Lissajouspedro juniorAinda não há avaliações
- Conjuntos Numéricos - ExercíciosDocumento2 páginasConjuntos Numéricos - ExercíciosTalita SofiaAinda não há avaliações
- 08 - Distribuição Normal de Probabilidade - Parte 2Documento12 páginas08 - Distribuição Normal de Probabilidade - Parte 2Cristian PelizzaAinda não há avaliações
- Exercicio Heranca Interface PolimorfirsmoDocumento4 páginasExercicio Heranca Interface PolimorfirsmoNash JuniorAinda não há avaliações
- Logica Computacional 1Documento177 páginasLogica Computacional 1jonatasAinda não há avaliações
- Diagrama Ortodontico Individualizado Trevisi+405Documento8 páginasDiagrama Ortodontico Individualizado Trevisi+405Arnaldo HayashiAinda não há avaliações
- Lista 1 Revisão 2Documento5 páginasLista 1 Revisão 2AndersonOliveiraAinda não há avaliações
- Provisões - PPNGDocumento4 páginasProvisões - PPNGFilipe FariasAinda não há avaliações
- Logica - LISTA DE EXERCICIOSDocumento7 páginasLogica - LISTA DE EXERCICIOSKárcio RicardoAinda não há avaliações
- Apostila Microsoft Excel Avançado Com VbaDocumento68 páginasApostila Microsoft Excel Avançado Com VbaRodrigo MagalhãesAinda não há avaliações
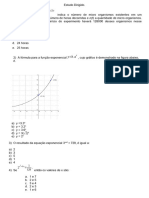
- Exercícios. Eq ExpDocumento2 páginasExercícios. Eq ExpGUTTEMBERG MARTINS DE ABREUAinda não há avaliações
- Lista 03 - Frações, Razão, ProporçãoDocumento9 páginasLista 03 - Frações, Razão, ProporçãoMoisés FélixAinda não há avaliações