Escolar Documentos
Profissional Documentos
Cultura Documentos
10Q - (Teste 3) - 01 - 2020
10Q - (Teste 3) - 01 - 2020
Enviado por
Ana MartinsTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
10Q - (Teste 3) - 01 - 2020
10Q - (Teste 3) - 01 - 2020
Enviado por
Ana MartinsDireitos autorais:
Formatos disponíveis
Teste 3
Duração: 90 a 100 min
NOME ______________________________________________ Turma _______ Número _______
Consulte a Tabela Periódica, a tabela de constantes e o formulário sempre que necessário.
Nos itens de escolha múltipla escreva a letra da única opção que permite obter uma afirmação correta ou que
responda corretamente à questão.
Nos itens de construção que envolvam cálculos é obrigatório apresentar todas as etapas de resolução.
Junto de cada item, entre parênteses, apresenta-se a respetiva cotação.
GRUPO I
O teor alcoólico e a taxa de alcoolemia são grandezas relacionadas com a quantidade de etanol. No
primeiro caso, o teor alcoólico de uma bebida refere-se à percentagem em volume de etanol que
existe numa bebida, enquanto a taxa de alcoolemia se refere à massa, em gramas, de etanol por
litro de sangue num indivíduo.
Considere uma garrafa de 50 cL de vinho do Porto com teor alcoólico de 20% e uma garrafa de
750 mL de um espumante com teor alcoólico de 13%.
1. (8p) Para um mesmo indivíduo, podemos afirmar que…
(A) as taxas de alcoolemia resultantes da ingestão de iguais volumes de vinho do Porto e de
espumante são iguais.
(B) a taxa de alcoolemia resultante da ingestão de iguais volumes de vinho do Porto e de
espumante é maior para o espumante.
(C) a taxa de alcoolemia resultante da ingestão de iguais volumes de vinho do Porto e de
espumante é maior para o vinho do Porto.
(D) as taxas de alcoolemia resultantes da ingestão do vinho do Porto são sempre superiores às
resultantes da ingestão de espumante.
2. (12p) Determine a razão entre o volume de etanol existente na garrafa de espumante e o volume
de etanol existente na garrafa de vinho do Porto.
3. (12p) Calcule qual seria o teor alcoólico da bebida resultante da mistura dos 50 cL de vinho do
Porto com os 750 mL de espumante. Admita que os volumes são aditivos
4. (8p) Indique a expressão que permite calcular o teor alcoólico do espumante expresso em partes
por milhão em volume.
13
(A) ppm𝑉
106
13 × 106
(B) ppm𝑉
100
13 × 100
(C) ppm𝑉
106
13
(D) ppm𝑉
100 × 106
Editável e fotocopiável © Texto | Novo 10Q 1
GRUPO II
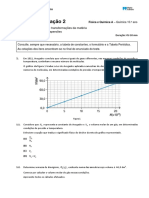
A utilização de combustíveis fósseis é o principal fator responsável pela libertação de dióxido de
carbono para a atmosfera. O gráfico e a tabela seguintes mostram a evolução da massa de dióxido
de carbono libertado para a atmosfera, em Portugal, proveniente da utilização de combustíveis
fósseis.
CO2 de origem fóssil CO2 de origem fóssil CO2 de origem fóssil
Anos Anos Anos
(milhares de toneladas) (milhares de toneladas) (milhares de toneladas)
1995 56 675,0 2003 66 964,3 2011 53 141,4
1996 54 233,9 2004 70 085,0 2012 51 437,4
1997 57 159,2 2005 72 474,8 2013 49 408,2
1998 61 710,0 2006 67 711,9 2014 49 397,6
1999 69 092,1 2007 64 663,4 2015 53 426,8
2000 68 027,6 2008 62 448,9 2016 51 501,7
2001 68 152,5 2009 58 769,9 2017 55 818,3
2002 71 952,7 2010 54 269,8
Fonte: PORDATA
1. (8p) Indique o período em que se verificou, em Portugal, um maior crescimento contínuo da
emissão de dióxido de carbono de origem fóssil para a atmosfera.
2. (8p) Selecione a opção que completa corretamente a afirmação:
As principais fontes emissoras para a atmosfera de dióxido de carbono de origem fóssil são…
(A) a respiração, a produção de energia elétrica, os transportes e a indústria transformadora.
(B) a produção de energia elétrica, o aquecimento, os transportes e a indústria transformadora.
(C) a digestão dos ruminantes, o aquecimento e os transportes e a indústria transformadora.
(D) as erupções vulcânicas, a respiração, o aquecimento e os transportes.
3. (12p) Os cientistas estimam que, anualmente, sejam emitidas para a atmosfera cerca de 10
gigatoneladas de dióxido de carbono. Calcule qual a percentagem de dióxido de carbono emitido
para a atmosfera em Portugal relativamente à massa total desse gás emitido durante o ano 2017.
2 Editável e fotocopiável © Texto | Novo 10Q
4. (16p) O dióxido de carbono é um gás muito solúvel em água e, por esse motivo, os oceanos
possuem um grande papel no controlo do efeito de estufa, pois aproximadamente um quarto do
dióxido de carbono emitido para a atmosfera dissolve-se nos oceanos. Considere uma amostra
de 2,0 litros de água do mar (ρ = 1024 kg/m3 ) que contém 0,60% em massa de dióxido de
carbono dissolvido. Determine a concentração de dióxido de carbono na água considerada.
Apresente todas as etapas de resolução.
GRUPO III
Os óxidos de nitrogénio podem estar na base da decomposição do ozono. A partir de dióxido de
nitrogénio, por ação de luz ultravioleta, podem formar-se radicais livres NO• . Este radical reage com
ozono, originando dióxido de nitrogénio e oxigénio. A reação de destruição do ozono pelo radical
NO• está representada através de modelos moleculares no esquema seguinte.
∆𝐻 = −200 kJ/mol
1. (12p) Explique o que é um radical livre e justifique que a espécie NO• é um radical livre.
2. (8p) O ozono, na estratosfera, atua como um filtro de radiação…
(A) UV-B e UV-C. (C) visível e UV-A.
(B) UV-A e UV-B. (D) infravermelha e visível.
3. (8p) Classifique, do ponto de vista termoquímico, a destruição do ozono por ação do radical NO• .
4. (8p) Dos diagramas de energia seguintes, indique aquele que traduz corretamente a reação
representada pelos modelos moleculares.
Editável e fotocopiável © Texto | Novo 10Q 3
5. (12p) Sabendo que a energia de ligação OO em O2 é 496 kJ mol−1 , a energia de ligação NO em
NO2 é 469 kJ mol−1 e em NO é 632 kJ mol−1 , determine a energia média de ligação OO em O3 .
Apresente todas as etapas de resolução.
6. (8p) De acordo as informações dadas na questão anterior, pode concluir-se que o comprimento
médio da ligação NO em NO2 é…
(A) menor que em NO e a molécula de NO2 é mais estável que a de NO.
(B) menor que em NO e a molécula de NO2 é menos estável que a de NO.
(C) maior que em NO e a molécula de NO2 é mais estável que a de NO.
(D) maior que em NO e a molécula de NO2 é menos estável que a de NO.
GRUPO IV
Em odontologia, na restauração estética e/ou funcional dos dentes, utilizam-se materiais sintéticos
para modelar a forma dos dentes, restaurar dentes fraturados ou preencher cavidades provocadas
por cáries. Estes materiais depois de moldados são endurecidos por ação de radiação ultravioleta
(UV).
1. (8p) A afirmação destacada a negrito descreve uma reação…
(A) termoquímica.
(B) eletroquímica.
(C) de precipitação.
(D) fotoquímica.
2. Considere 3 amostras iguais de um material sintético usado em odontologia (amostras A, B e C).
Cada amostra foi sujeita à ação de uma radiação (1, 2 e 3). A tabela seguinte mostra os resultados
obtidos após 30 e 60 segundos de incidência das radiações sobre as amostras.
Amostra A Amostra B Amostra C
[Radiação 1] [Radiação 2] [Radiação 3]
30 segundos Não endurecida Endurecida Não endurecida
60 segundos Não endurecida Endurecida Endurecida
2.1 (8p) Ordene, por ordem crescente de frequência, as três radiações.
2.2 (8p) Refira porque é que os materiais referidos não são endurecidos por ação da luz
infravermelha.
4 Editável e fotocopiável © Texto | Novo 10Q
GRUPO V
Leia a seguinte informação retirada de um rótulo de uma solução comercial de ácido clorídrico.
Ácido clorídrico, HCl (aq) 32% (m/m)
ρ = 1,16 g/cm3 M = 36,46 g/mol
1. (16p) Mostre que a concentração desta solução de ácido clorídrico é 10,2 mol dm−3.
Apresente todas as etapas de resolução.
2. (12p) Determine o volume de solução 6,00 mol dm−3 de ácido clorídrico que é necessário medir
para preparar 25,00 cm3 de solução diluída de ácido clorídrico de concentração 0,480 mol dm−3 .
Apresente todas as etapas de resolução.
3. (8p) Para medir com o maior rigor possível o volume de solução determinado em 2, deve usar-se:
(A) um balão volumétrico.
(B) uma proveta graduada.
(C) uma pipeta volumétrica.
(D) um copo graduado.
FIM
Editável e fotocopiável © Texto | Novo 10Q 5
Você também pode gostar
- Teste 3 - 2023 - TextoDocumento4 páginasTeste 3 - 2023 - TextoLuísa CarmoAinda não há avaliações
- Fu2.3 - U2-Propriedades e Transformações Da Matéria - CCDocumento7 páginasFu2.3 - U2-Propriedades e Transformações Da Matéria - CCiolaAinda não há avaliações
- 02 Teste 1 Massa Tamanho AtomosDocumento6 páginas02 Teste 1 Massa Tamanho AtomosPaula FernandesAinda não há avaliações
- Teste 1 (2017)Documento5 páginasTeste 1 (2017)Maria João LoureiroAinda não há avaliações
- Fa10 - Testes - Avaliacao - 2 - ResolucaoDocumento13 páginasFa10 - Testes - Avaliacao - 2 - Resolucaodiario.de.uma.gordAinda não há avaliações
- Teste Final de Química de 10ºano (2015-2016)Documento7 páginasTeste Final de Química de 10ºano (2015-2016)Rúben SilvaAinda não há avaliações
- 03 Teste 2 Gases Dispersoes CriteriosDocumento4 páginas03 Teste 2 Gases Dispersoes Criteriosmariana barbeiroAinda não há avaliações
- Criterios Teste2 NovDocumento3 páginasCriterios Teste2 NovTomás SilveiraAinda não há avaliações
- rq10 Teste1 Out2023Documento6 páginasrq10 Teste1 Out2023c6md6xpn98Ainda não há avaliações
- Ef10 Dossie Prof Teste Avaliacao 3Documento3 páginasEf10 Dossie Prof Teste Avaliacao 3Elsa Viana BaptistaAinda não há avaliações
- BioGeo10 Teste D5 6 2019 CORRECDocumento1 páginaBioGeo10 Teste D5 6 2019 CORRECAna 2005Ainda não há avaliações
- Re82133 Fa11 Teste GlobalDocumento9 páginasRe82133 Fa11 Teste GlobalDuarte AraujoAinda não há avaliações
- 10Q NL (Teste2 CC) Out.2020Documento3 páginas10Q NL (Teste2 CC) Out.2020Luísa Fernandes de Melo0% (1)
- 03 Criterios de Correcao - Teste de Avaliacao d2 - sd3Documento3 páginas03 Criterios de Correcao - Teste de Avaliacao d2 - sd3maria claraAinda não há avaliações
- Odis10 Nl1 Teste Avaliacao CCDocumento2 páginasOdis10 Nl1 Teste Avaliacao CCRaiz Centro de EstudoAinda não há avaliações
- 03 Criterios de Correcao - Teste de Avaliacao d2 - sd3Documento3 páginas03 Criterios de Correcao - Teste de Avaliacao d2 - sd3maria claraAinda não há avaliações
- Qr10 Teste GlobalDocumento9 páginasQr10 Teste GlobalAna MartinsAinda não há avaliações
- Fa10 Ficha1 Sd1 ResolucaoDocumento2 páginasFa10 Ficha1 Sd1 ResolucaoElsa Viana BaptistaAinda não há avaliações
- Odis11 eNL Teste3 CorrecaoDocumento2 páginasOdis11 eNL Teste3 CorrecaoCelina ReixaAinda não há avaliações
- Fa10 Ficha0 sd3Documento3 páginasFa10 Ficha0 sd3João CCAinda não há avaliações
- Mensagens10 Teste1 Unidades 1 e 2 2020CCDocumento2 páginasMensagens10 Teste1 Unidades 1 e 2 2020CCAfonso LucasAinda não há avaliações
- Q Teste Ava 2Documento11 páginasQ Teste Ava 2filipaAinda não há avaliações
- Cartoon Exemplo de RespostaDocumento3 páginasCartoon Exemplo de RespostaPaula FontesAinda não há avaliações
- 02 Teste 1 Massa Tamanho AtomosDocumento5 páginas02 Teste 1 Massa Tamanho Atomosgorete71Ainda não há avaliações
- Ficha - Formativa - 10Q - N.º2Documento3 páginasFicha - Formativa - 10Q - N.º2Filipa BaptistaAinda não há avaliações
- Fa10 Ficha5 sd3 ResolucaoDocumento4 páginasFa10 Ficha5 sd3 ResolucaoLucilia PereiraAinda não há avaliações
- Fa11 Aval Ondas Eletrom Teste Aval 1Documento7 páginasFa11 Aval Ondas Eletrom Teste Aval 1rodrigoAinda não há avaliações
- FilDocumento6 páginasFilKika AmorimAinda não há avaliações
- 10Q - (Teste 3CC) - 01 - 2020Documento3 páginas10Q - (Teste 3CC) - 01 - 2020Tomás SilveiraAinda não há avaliações
- qr10 03 Teste Aval 5 sd3 Crit CorrecaoDocumento2 páginasqr10 03 Teste Aval 5 sd3 Crit CorrecaoLeonor VieiraAinda não há avaliações
- qr10 02 Teste Aval 1 sd1 EnunciadoDocumento5 páginasqr10 02 Teste Aval 1 sd1 EnunciadoBeatriz RodriguesAinda não há avaliações
- qr10 03 Teste Aval 14 d2 Crit CorrecaoDocumento4 páginasqr10 03 Teste Aval 14 d2 Crit CorrecaoMariaAinda não há avaliações
- (4.6.3) Sentidos10 - DP - (TesteAvaliacao - CenariosResposta) - U5Documento6 páginas(4.6.3) Sentidos10 - DP - (TesteAvaliacao - CenariosResposta) - U5Maria FranciscaAinda não há avaliações
- Ef11 Questoes Preparacao ExameDocumento15 páginasEf11 Questoes Preparacao ExameMicaela AlbinoAinda não há avaliações
- Teste Texto Editora - 2018Documento4 páginasTeste Texto Editora - 2018Luis VarelaAinda não há avaliações
- Ef10 Dossie Prof Teste Avaliacao 3Documento3 páginasEf10 Dossie Prof Teste Avaliacao 3nelson_honorio0% (1)
- Mensagens10 Criterios ClassificacaoDocumento12 páginasMensagens10 Criterios ClassificacaocarlaAinda não há avaliações
- BioGeo10 TesteGlobal Biologia 2021Documento6 páginasBioGeo10 TesteGlobal Biologia 2021Liliana SilvaAinda não há avaliações
- Características de Um Gerador de Tensão Contínua. Balanço Energético Num Circuito ElétricoDocumento16 páginasCaracterísticas de Um Gerador de Tensão Contínua. Balanço Energético Num Circuito ElétricoMariana Ferreira100% (1)
- Hfen10 Teste Individual Al 1 1 PDFDocumento2 páginasHfen10 Teste Individual Al 1 1 PDFFernando CorreiaAinda não há avaliações
- Fichas de Trabalho 1-3Documento7 páginasFichas de Trabalho 1-3rita machadoAinda não há avaliações
- Odis11 ENL Teste3 CorrecaoDocumento2 páginasOdis11 ENL Teste3 CorrecaoCelina ReixaAinda não há avaliações
- Ficha Biol 10º 2 Obtenção EnergiaDocumento2 páginasFicha Biol 10º 2 Obtenção EnergiapedromaparedesAinda não há avaliações
- Minitestes (Word)Documento7 páginasMinitestes (Word)Paula FernandesAinda não há avaliações
- qr10 03 Teste Aval 13 sd6 Crit CorrecaoDocumento3 páginasqr10 03 Teste Aval 13 sd6 Crit CorrecaoMariaAinda não há avaliações
- Ef10 Teste Avaliacao Global EnunciadoDocumento7 páginasEf10 Teste Avaliacao Global EnunciadocelialuanaAinda não há avaliações
- qr10 03 Teste Aval 12 sd6 Crit CorrecaoDocumento3 páginasqr10 03 Teste Aval 12 sd6 Crit CorrecaoMariaAinda não há avaliações
- qr11 02 Teste Al 21Documento3 páginasqr11 02 Teste Al 21Maria RibeiroAinda não há avaliações
- (4.3.3) Sentidos10 - DP - (TesteAvaliacao - CenariosResposta) - U2Documento6 páginas(4.3.3) Sentidos10 - DP - (TesteAvaliacao - CenariosResposta) - U2HelenaCorreiaAinda não há avaliações
- Ae rq10 Guiao Expl Solucoes Solutos SolidosDocumento3 páginasAe rq10 Guiao Expl Solucoes Solutos SolidosFilipe Miguel Cachide OliveiraAinda não há avaliações
- Ae Geo10 212 ADocumento2 páginasAe Geo10 212 AJoão MoutinhoAinda não há avaliações
- FichaGlobal Física10anoDocumento16 páginasFichaGlobal Física10anoKika AmaralAinda não há avaliações
- Ae - f11 - Teste 3 - Jan22 - EnuncDocumento7 páginasAe - f11 - Teste 3 - Jan22 - EnuncMaria Bazenga100% (1)
- CC - Propriedades e Transformações Da MatériaDocumento4 páginasCC - Propriedades e Transformações Da MatériaSandra AndradeAinda não há avaliações
- Ae f10 11 Prova Global1 v2Documento7 páginasAe f10 11 Prova Global1 v2dianaAinda não há avaliações
- 02 Teste 2 Gases Dispersoes EnunciadoDocumento6 páginas02 Teste 2 Gases Dispersoes Enunciadomariana barbeiroAinda não há avaliações
- FT - 4 - FQ-A - 10Q - O Átomo de Hidrogénio e A Estrutura AtómicaDocumento5 páginasFT - 4 - FQ-A - 10Q - O Átomo de Hidrogénio e A Estrutura AtómicaAna Raquel PintoAinda não há avaliações
- 10Q - (Teste 3) - 01 - 2020Documento7 páginas10Q - (Teste 3) - 01 - 2020cidalia camposAinda não há avaliações
- 10Q Teste3 01 2024Documento6 páginas10Q Teste3 01 2024vickyjogomesAinda não há avaliações
- Teste 3 (2017)Documento6 páginasTeste 3 (2017)jppcg08Ainda não há avaliações
- Criterios Teste2 NovDocumento3 páginasCriterios Teste2 NovTomás SilveiraAinda não há avaliações
- Novo 10Q Teste3)Documento7 páginasNovo 10Q Teste3)Tomás SilveiraAinda não há avaliações
- 10Q - (Teste 3CC) - 01 - 2020Documento3 páginas10Q - (Teste 3CC) - 01 - 2020Tomás SilveiraAinda não há avaliações
- 10Q Teste3 2018 19 CriteriosCorrecaoDocumento3 páginas10Q Teste3 2018 19 CriteriosCorrecaoTomás SilveiraAinda não há avaliações
- Crise Do Messeis de CubaDocumento2 páginasCrise Do Messeis de CubaTomás SilveiraAinda não há avaliações
- 1 4951906466891038926 PDFDocumento213 páginas1 4951906466891038926 PDFBergson Marques MoreiraAinda não há avaliações
- Alimentos Com FerroDocumento1 páginaAlimentos Com FerroPaulo AlbuquerqueAinda não há avaliações
- 2 AnoDocumento2 páginas2 AnoPetrus Negreiro100% (1)
- Cardapio Pati PivaDocumento12 páginasCardapio Pati PivaAlvaro MarceloAinda não há avaliações
- Sebenta - UFCD 4668 Acepipes e EntradasDocumento41 páginasSebenta - UFCD 4668 Acepipes e EntradasSílvia OliveiraAinda não há avaliações
- Cálculos IndustriaisDocumento8 páginasCálculos Industriaisleandromacedo5913Ainda não há avaliações
- Sponser 2012 PTDocumento29 páginasSponser 2012 PTJoão MarinhoAinda não há avaliações
- Cartilha EmbalagensDocumento20 páginasCartilha EmbalagenscllaraujoAinda não há avaliações
- Brigadeiro de Casca de BananaDocumento1 páginaBrigadeiro de Casca de BananaAdelia MozerAinda não há avaliações
- Nova Planilha de Brassagens 2.3 - AzulDocumento12 páginasNova Planilha de Brassagens 2.3 - AzulAlbert Santos100% (1)
- O Que É Uma Doença e Como CurarDocumento404 páginasO Que É Uma Doença e Como Curarroselisp100% (1)
- Heterogenéricos - HeterotônicosDocumento6 páginasHeterogenéricos - HeterotônicosLorrany NatachaAinda não há avaliações
- Miolo CardápioDocumento6 páginasMiolo CardápioBruno RodriguezAinda não há avaliações
- Risoto de CamarãoDocumento2 páginasRisoto de Camarãoerica.missaliAinda não há avaliações
- Simone Barros - Cardápio EncomendasDocumento4 páginasSimone Barros - Cardápio EncomendasREjunta Comunicação50% (10)
- Proposta Buffet Churrasco 2017Documento16 páginasProposta Buffet Churrasco 2017felisbertojunior67% (3)
- Revisão de Matemática - 29-08Documento7 páginasRevisão de Matemática - 29-08wallemdayanasc2Ainda não há avaliações
- Audição para Chapeleiro, Lebre e RatinhoDocumento5 páginasAudição para Chapeleiro, Lebre e RatinhoMaRockaAinda não há avaliações
- Cardápio The BestDocumento2 páginasCardápio The BestThalita CavalcantiAinda não há avaliações
- LICORESDocumento1 páginaLICORESexeusAinda não há avaliações
- $RFEQE0N - Lara JonesDocumento162 páginas$RFEQE0N - Lara JonesPatrícia C.100% (2)
- CrepeDocumento8 páginasCrepeViviana PereiraAinda não há avaliações
- Ácido SórbicoDocumento2 páginasÁcido SórbicoBianca CaetanoAinda não há avaliações
- Estratégia de Guerra - Damrong PinkoonDocumento179 páginasEstratégia de Guerra - Damrong PinkoonhideyukigAinda não há avaliações
- Irmaos Hunt 5Documento143 páginasIrmaos Hunt 5leticia gomes souzaAinda não há avaliações
- DETOXDocumento9 páginasDETOXJardeane MoraisAinda não há avaliações
- Vitrine Tupperware 01/2013Documento31 páginasVitrine Tupperware 01/2013LumaniacsAinda não há avaliações
- Ficha Preenchimento Pré ConsultaDocumento3 páginasFicha Preenchimento Pré ConsultaAna Maria SQAinda não há avaliações
- Forno Elétrico 31 Litros BritaniaDocumento5 páginasForno Elétrico 31 Litros BritaniaRoberto Bruno67% (6)
- Fatias Húngaras DoceDocumento3 páginasFatias Húngaras DoceLourdes CordóAinda não há avaliações