Escolar Documentos
Profissional Documentos
Cultura Documentos
Ae Fqa11
Enviado por
Joaquina JúliaTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Ae Fqa11
Enviado por
Joaquina JúliaDireitos autorais:
Formatos disponíveis
lOMoARcPSD|37908400
1 REAÇÕES ÁCIDO-BASE
©AREAL EDITORES
EXEMPLO
• KBr, NaCℓO4 e Ca(NO3)2 são exemplos de sais que originam soluções aquosas neutras.
• NH4Cℓ, NH4Br e N2H5Cℓ são exemplos de sais que originam soluções aquosas ácidas.
• NaNO2, Ca(CH3COO)2 e KF são exemplos de sais que originam soluções aquosas básicas.
• NH4F, NH4CH3COO ou NH4NO2 são exemplos de sais em que o catião é um ácido conjugado de uma base
fraca e o anião é uma base conjugada de um ácido fraco, pelo que ambos reagem com a água dependendo
o caráter ácido ou base da extensão dessas reações.
1.5 TITULAÇÃO ÁCIDO-BASE
Reações ácido-base
Da reação, em meio aquoso, entre um ácido e uma base, em proporções estequiométricas obtém-se
um sal e água (no caso de se tratar de uma base de Arrhenius).
EXEMPLO
Solução aquosa + Solução aquosa → Solução aquosa + Água
de um ácido de uma base de um sal
HCℓ NaOH NaCℓ H2O
A neutralização corresponde à reação entre os iões H3O+ e OH- durante uma reação ácido-base.
Quando se misturam quantidades estequiométricas de uma solução aquosa de um ácido forte com
uma solução aquosa de uma base forte obtém-se uma solução aquosa neutra de um sal e água, logo
pH = 7, a 25 ºC.
Das reações de neutralização entre ácidos e bases de forças diferentes, em condições estequiométri-
cas, resultam soluções aquosas de sais com pH diferente de 7, a 25 ºC:
Reação ácido fraco – base forte Reação ácido forte – base fraca Reação ácido fraco - base fraca
– ocorre a neutralização com – ocorre a neutralização com – ocorre a neutralização com
formação de H2O; formação de H2O; formação de H2O;
– forma-se uma solução aquosa de – forma-se uma solução aquosa de – forma-se uma solução aquosa de
um sal com carácter básico. um sal com carácter ácido. um sal, que poderá ser ácida,
básica ou neutra.
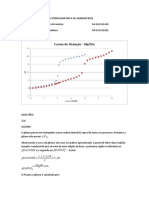
Titulação ácido-base e determinação do ponto de equivalência
Uma titulação ácido-base é um procedimento de análise química que permite determinar a concen-
tração desconhecida de um ácido (ou base) em solução através da reação de neutralização com outra
solução de uma base (ou ácido) e cuja concentração é rigorosamente conhecida. A solução de con-
centração conhecida, que é adicionada em pequenos incrementos a partir da bureta, designa-se titu-
lante e a solução à qual se adiciona o titulante e que está contida num balão de Erlenmeyer, designa-
-se titulado.
O ponto de equivalência, numa titulação ácido-base, atinge-se quando as quantidades de ácido e base
estão nas proporções estequiométricas da reação de neutralização, evidenciadas pela respetiva equa-
ção química. Numa titulação ácido forte - base forte corresponde a pH = 7, a 25 ºC.
QUÍMICA 11.º ANO EM REVISTA
22
Descarregado por Joaquina Júlio (Quinajulio@icloud.com)
Você também pode gostar
- Manual de Ferramentas Manuais - Não ElétricasDocumento98 páginasManual de Ferramentas Manuais - Não ElétricasJoão Paulo Assis Do Prado100% (1)
- Explodido Foton TE254L120Documento151 páginasExplodido Foton TE254L120Stas100% (4)
- Dossiê Do ProfessorDocumento227 páginasDossiê Do Professoraugusta100% (2)
- TÉCNICA - Conserto e Funcionamento de Raquete Mata-Mosquitos Dicas Do ZébioDocumento27 páginasTÉCNICA - Conserto e Funcionamento de Raquete Mata-Mosquitos Dicas Do ZébioDjalma MilanAinda não há avaliações
- Titulação Ácido BaseDocumento16 páginasTitulação Ácido BaseAna Sofia NevesAinda não há avaliações
- Aula Prática - SaisDocumento4 páginasAula Prática - SaisMatheus MathuchenkoAinda não há avaliações
- Ácido BaseDocumento18 páginasÁcido Basecristinajlopes100% (1)
- Q2 1.ácidos e Bases (2. Parte)Documento26 páginasQ2 1.ácidos e Bases (2. Parte)dianaAinda não há avaliações
- Reações Ácido-BaseDocumento20 páginasReações Ácido-BaseMónicaAinda não há avaliações
- Ae rq11 d2s1 1 5 TitulacaoDocumento26 páginasAe rq11 d2s1 1 5 TitulacaoAna Sofia NevesAinda não há avaliações
- 1.3-Acidos e Bases em Solução AquosaDocumento34 páginas1.3-Acidos e Bases em Solução AquosaEcas UnicornAinda não há avaliações
- 2.1.7 Acidez e Basicidade em Soluções Aquosas de SaisDocumento9 páginas2.1.7 Acidez e Basicidade em Soluções Aquosas de SaisMariana MendesAinda não há avaliações
- Comportamento Aì Cido-Base Das Solucì Oì Es de SaisDocumento38 páginasComportamento Aì Cido-Base Das Solucì Oì Es de SaisSimao FerreiraAinda não há avaliações
- Titulações Ácido - Base - Momento Síncrono 11 e 12 MaioDocumento7 páginasTitulações Ácido - Base - Momento Síncrono 11 e 12 MaioFi GeraldesAinda não há avaliações
- Acido-BaseDocumento25 páginasAcido-BaseLeonardo VelhoAinda não há avaliações
- Reações Ácido-Base, Redox e SolubilidadeDocumento16 páginasReações Ácido-Base, Redox e Solubilidaderodrigo santosAinda não há avaliações
- 10 11Q Titulação PDFDocumento21 páginas10 11Q Titulação PDFInês CastanheiraAinda não há avaliações
- Relatório Aula Prática Química Analítica - Hidrólise Dos Sais e Solução TampãoDocumento21 páginasRelatório Aula Prática Química Analítica - Hidrólise Dos Sais e Solução Tampãodigoo_07Ainda não há avaliações
- APznzaa3oeZ9jchLa8ohWzPe-HeTOajW_yVenFamqbSOxGT4q3mhXjXHbO6te7ra_Cvj2Cz_sjf1zs4PtgH91EHONMoS1QcKJtmTlnt2msXosbsZgdxtqliLntfd20fGlzMHvE95FEj7sFvKzwFCEepBNatBb81WWvl3uuKqHAsudUHKwULCpthYJ0gUupaMQiKBTc7jK-BPENoT7YDAPpDocumento16 páginasAPznzaa3oeZ9jchLa8ohWzPe-HeTOajW_yVenFamqbSOxGT4q3mhXjXHbO6te7ra_Cvj2Cz_sjf1zs4PtgH91EHONMoS1QcKJtmTlnt2msXosbsZgdxtqliLntfd20fGlzMHvE95FEj7sFvKzwFCEepBNatBb81WWvl3uuKqHAsudUHKwULCpthYJ0gUupaMQiKBTc7jK-BPENoT7YDAPpXana RosaAinda não há avaliações
- Q2 1. Ácidos e Bases (1. Parte)Documento33 páginasQ2 1. Ácidos e Bases (1. Parte)dianaAinda não há avaliações
- Acidez e Basicidade de Soluções Aquosas de SaisDocumento15 páginasAcidez e Basicidade de Soluções Aquosas de SaisLia SantosAinda não há avaliações
- Ae - q11 - Ácido-Base - Constantes e Pares ConjugadosDocumento15 páginasAe - q11 - Ácido-Base - Constantes e Pares ConjugadosHugo RochaAinda não há avaliações
- Química AnalíticaDocumento8 páginasQuímica AnalíticaJesyka GuedesAinda não há avaliações
- M14 - Acidez e Basicidade em Soluções Aquosas de SaisDocumento8 páginasM14 - Acidez e Basicidade em Soluções Aquosas de SaisDD VitoldasAinda não há avaliações
- Transformações Físicas e Químicas-RESUMODocumento8 páginasTransformações Físicas e Químicas-RESUMOAna VarelaAinda não há avaliações
- Guia de Estudo 8º Ano FQ - Reações QuimicasDocumento9 páginasGuia de Estudo 8º Ano FQ - Reações QuimicasacpalmamaoAinda não há avaliações
- 02 Reações em Sistemas AquososDocumento11 páginas02 Reações em Sistemas AquososDiogo DiasAinda não há avaliações
- Resumos de QuimicaDocumento20 páginasResumos de QuimicaInes CruzAinda não há avaliações
- M13 - Titulação Ácido - BaseDocumento17 páginasM13 - Titulação Ácido - BaseDD VitoldasAinda não há avaliações
- Reações Ácido-BaseDocumento9 páginasReações Ácido-Baseaniaginja999Ainda não há avaliações
- Equilíbrio Ácido-Base - Parte 1Documento46 páginasEquilíbrio Ácido-Base - Parte 1Julia Reis dos SantosAinda não há avaliações
- Aula 5 - Determinação Da Concentração de Acido Acético No VinagreDocumento2 páginasAula 5 - Determinação Da Concentração de Acido Acético No VinagreMarcioAinda não há avaliações
- AQ6 - 4 - Volumetria Ácido-Base - UFCD 4489Documento9 páginasAQ6 - 4 - Volumetria Ácido-Base - UFCD 4489catiaAinda não há avaliações
- Ácidos e Bases em Soluções AquosasDocumento17 páginasÁcidos e Bases em Soluções AquosasRachel SousaAinda não há avaliações
- Titulação - Wikipédia, A Enciclopédia LivreDocumento4 páginasTitulação - Wikipédia, A Enciclopédia LivrephaelgakkaiAinda não há avaliações
- Apostila ProEnem - Matemática e Ciências Natureza - 4.indbDocumento4 páginasApostila ProEnem - Matemática e Ciências Natureza - 4.indbaprovad2023Ainda não há avaliações
- Exp8 PPT 09Documento18 páginasExp8 PPT 09Beatriz EvangelistaAinda não há avaliações
- Aula 06 - Funções InorgânicasDocumento56 páginasAula 06 - Funções InorgânicasDébora Lima de OliveiraAinda não há avaliações
- Exp8 - PPT - 09 (1) Reações Ácido - BaseDocumento18 páginasExp8 - PPT - 09 (1) Reações Ácido - BaseSEAinda não há avaliações
- Exp8 - PPT - 09 Reacoes Acido - BaseDocumento18 páginasExp8 - PPT - 09 Reacoes Acido - BaseMariana RosadoAinda não há avaliações
- 5 - Hidrólise SalinaDocumento2 páginas5 - Hidrólise SalinaOtávio LuizAinda não há avaliações
- Hidrólise Salina!!!!!!!!!!!!!!!!!!!!!!!!!!!Documento3 páginasHidrólise Salina!!!!!!!!!!!!!!!!!!!!!!!!!!!Adriel SeguinsAinda não há avaliações
- Slides ConclusãoDocumento31 páginasSlides Conclusãootavio augusto hegler silvaAinda não há avaliações
- M11 - Ácidos e Bases em Soluções AquosasDocumento18 páginasM11 - Ácidos e Bases em Soluções AquosasDD VitoldasAinda não há avaliações
- Reaçõesácido BaseDocumento25 páginasReaçõesácido BaseRodrigo VidigalAinda não há avaliações
- Hidrólise de SaisDocumento19 páginasHidrólise de SaisJorge Filipe Souza BorgesAinda não há avaliações
- Determinação Da Concentração Molar Do Ácido Acético em Vinagre ComercialDocumento6 páginasDeterminação Da Concentração Molar Do Ácido Acético em Vinagre ComercialwhaksonAinda não há avaliações
- Resumo FQ 1Documento3 páginasResumo FQ 1Beatriz Sofia ValenteAinda não há avaliações
- Resumo Sobre Ácidos e BasesDocumento10 páginasResumo Sobre Ácidos e BasesJulia Camila Magalhães MeloAinda não há avaliações
- Ácidos e Bases Aula 02Documento60 páginasÁcidos e Bases Aula 02Alécia Maria GonçalvesAinda não há avaliações
- Constantes de Acidez e de BasicidadeDocumento10 páginasConstantes de Acidez e de BasicidadeRachel SousaAinda não há avaliações
- AULAS 02. Parte 02 Hidrólise de Sais Edit 05Documento14 páginasAULAS 02. Parte 02 Hidrólise de Sais Edit 05Edhy CabralAinda não há avaliações
- Relatório de Fisico QuimicaDocumento5 páginasRelatório de Fisico Quimicaa27014Ainda não há avaliações
- SaisDocumento22 páginasSaisJosé SilvaAinda não há avaliações
- AULA 08 - Sistemas em Equilibrio-2012Documento73 páginasAULA 08 - Sistemas em Equilibrio-2012Yasmim SantosAinda não há avaliações
- Reaà à Es ácido-Base No Ambiente e em Sistemas VivosDocumento12 páginasReaà à Es ácido-Base No Ambiente e em Sistemas Vivoslimacarolina2506Ainda não há avaliações
- Ficha12 QuímicaDocumento2 páginasFicha12 QuímicaLara FerreiraAinda não há avaliações
- Hidólise SalinaDocumento27 páginasHidólise SalinaJaqueline CavalcanteAinda não há avaliações
- Relatório 5Documento11 páginasRelatório 5Dávylla MoanaAinda não há avaliações
- Hidrólise SalinaDocumento18 páginasHidrólise Salinapedroncio225Ainda não há avaliações
- Ácidos EBasesDocumento3 páginasÁcidos EBasesJaciraAinda não há avaliações
- Relatório Titulação Ácido BaseDocumento2 páginasRelatório Titulação Ácido BaseDaniel Da Silva LimaAinda não há avaliações
- Cópia de Modelo Prontuário FisiDocumento3 páginasCópia de Modelo Prontuário FisiJoaquina JúliaAinda não há avaliações
- FT 1Q Revisões 10º - 11º - 23-24Documento3 páginasFT 1Q Revisões 10º - 11º - 23-24Joaquina JúliaAinda não há avaliações
- Dossie Do ProfessorDocumento1 páginaDossie Do ProfessorJoaquina JúliaAinda não há avaliações
- 8vii Exercicios Porto Editora BG 11o Ano XXDocumento3 páginas8vii Exercicios Porto Editora BG 11o Ano XXJoaquina JúliaAinda não há avaliações
- Trabalho PT Fim DO FIM 2Documento17 páginasTrabalho PT Fim DO FIM 2Joaquina JúliaAinda não há avaliações
- 10ano F 2 5 Geradores de Corrente ContinuaDocumento9 páginas10ano F 2 5 Geradores de Corrente ContinuaJoaquina JúliaAinda não há avaliações
- # Question Type Accuracy: View Player DataDocumento9 páginas# Question Type Accuracy: View Player DataJoaquina JúliaAinda não há avaliações
- 5 Trigonometria - Revisoes 11Documento5 páginas5 Trigonometria - Revisoes 11Joaquina JúliaAinda não há avaliações
- Ter Ou Não Ter Filhos?: Uma Decisão ImportanteDocumento4 páginasTer Ou Não Ter Filhos?: Uma Decisão ImportanteJoaquina JúliaAinda não há avaliações
- Eqt11 Teste 1Documento6 páginasEqt11 Teste 1Joaquina JúliaAinda não há avaliações
- T1 Fqa10 071117 ADocumento8 páginasT1 Fqa10 071117 AInês GuerreiroAinda não há avaliações
- Eqt11 Teste 1Documento6 páginasEqt11 Teste 1Joaquina JúliaAinda não há avaliações
- Da Instalação de Utilização BT: Caracterização SumáriaDocumento1 páginaDa Instalação de Utilização BT: Caracterização SumárialarisaAinda não há avaliações
- Válvulas Direcionais 4/2 e 4/3 Pilotadas Tipo 4WEH... Pilotadas Externamente Tipo 4WH..Documento24 páginasVálvulas Direcionais 4/2 e 4/3 Pilotadas Tipo 4WEH... Pilotadas Externamente Tipo 4WH..chrisleyAinda não há avaliações
- 01 - Lista de Exercícios - Cinemática (Marcio Azulay Exatas)Documento7 páginas01 - Lista de Exercícios - Cinemática (Marcio Azulay Exatas)Lidiane EstudosAinda não há avaliações
- FT11 - Equações TrigonométricasDocumento4 páginasFT11 - Equações TrigonométricasMargarida MartinsAinda não há avaliações
- Sem. Conforto AcústicoDocumento19 páginasSem. Conforto AcústicoJoão PedroAinda não há avaliações
- Fluxograma Eletrica Linha Sistemas Eletricos Energia 2019 2Documento1 páginaFluxograma Eletrica Linha Sistemas Eletricos Energia 2019 2Jeancarlo SathlerAinda não há avaliações
- Tecnomagia e Metal DivinoDocumento3 páginasTecnomagia e Metal Divinotrevor_frekiAinda não há avaliações
- Segunda Via FaturaDocumento2 páginasSegunda Via FaturaDaniel TrindadeAinda não há avaliações
- Manual - Deteccao - Gases - ESPAÇO CONFINADO 2020spinelliDocumento93 páginasManual - Deteccao - Gases - ESPAÇO CONFINADO 2020spinelliAnderson SantosAinda não há avaliações
- BTicino - MH - AutomDocumento24 páginasBTicino - MH - AutomRafael PaixãoAinda não há avaliações
- Relatório 4 - Deformação Elástica de Uma HasteDocumento7 páginasRelatório 4 - Deformação Elástica de Uma HasteMel SilvaAinda não há avaliações
- 34 - EMCD - 3º e 4ºanos - A Contagem Do Tempo (2) - Década, Século e MilénioDocumento3 páginas34 - EMCD - 3º e 4ºanos - A Contagem Do Tempo (2) - Década, Século e MilénioCarla CardosoAinda não há avaliações
- TRATAMENTO DE ÁGUAAS POR INDUÇÃO MAGNÉTICA TCC - 2015.2 - Arthur - Miller - Cosme - Guimares - SoaresDocumento64 páginasTRATAMENTO DE ÁGUAAS POR INDUÇÃO MAGNÉTICA TCC - 2015.2 - Arthur - Miller - Cosme - Guimares - SoaresHélio Ribeiro AlmeidaAinda não há avaliações
- Ensaios Não Destrutivos - CompletoDocumento125 páginasEnsaios Não Destrutivos - CompletoLauriene UFPIAinda não há avaliações
- 02 - Proj ELETRICO - A1Documento1 página02 - Proj ELETRICO - A1LUIZ FERNANDO RODRIGUES COCOAinda não há avaliações
- Ruído e VibraçõesDocumento12 páginasRuído e VibraçõeshudrigosAinda não há avaliações
- Cespe Cebraspe 2022 Petrobras Engenharia de Equipamentos Mecanica ProvaDocumento10 páginasCespe Cebraspe 2022 Petrobras Engenharia de Equipamentos Mecanica ProvaDiego araujoAinda não há avaliações
- Permutações CircularesDocumento3 páginasPermutações CircularesPaulomacenaAinda não há avaliações
- NBR 5626 2020 Sistemas Predias Agua Fria e Agua QuenteDocumento65 páginasNBR 5626 2020 Sistemas Predias Agua Fria e Agua QuenteNayara SimõesAinda não há avaliações
- Bioquimica 1Documento2 páginasBioquimica 1Felipe HiroAinda não há avaliações
- Tradução Instruction Manual HL2-90A - Version 03 - Rev 03Documento44 páginasTradução Instruction Manual HL2-90A - Version 03 - Rev 03rcordeiromanutencaoAinda não há avaliações
- Aula 5 - Biofísica Da VisãoDocumento27 páginasAula 5 - Biofísica Da VisãolaysAinda não há avaliações
- 2016DO Comport LVP Arm Cont Pre Fabricadas HadadeDocumento243 páginas2016DO Comport LVP Arm Cont Pre Fabricadas HadadeJuliana AlvesAinda não há avaliações
- Metodologias Praticas para Elaboração de Projetos ETADocumento70 páginasMetodologias Praticas para Elaboração de Projetos ETAMarcos BastosAinda não há avaliações
- Apostila Francisco - Física - 2º Ano - 2013 PDFDocumento24 páginasApostila Francisco - Física - 2º Ano - 2013 PDFSelson PereiraAinda não há avaliações
- Matematica 16 12Documento2 páginasMatematica 16 12Camila Alves SilvaAinda não há avaliações
- Manual 3105 CDocumento38 páginasManual 3105 CIgor AlvesAinda não há avaliações