Escolar Documentos
Profissional Documentos
Cultura Documentos
Aula10abril - Discussao - Stojkov22 - NETs - Fisiologia - Fisiopatologia - Viasmetabolicas (1) EM PORTUGUES
Enviado por
JEFFERSON VINICIUS DA SILVATítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Aula10abril - Discussao - Stojkov22 - NETs - Fisiologia - Fisiopatologia - Viasmetabolicas (1) EM PORTUGUES
Enviado por
JEFFERSON VINICIUS DA SILVADireitos autorais:
Formatos disponíveis
Machine Translated by Google
REVIEW
publicado: 09 de fevereiro de 2022
doi: 10.3389/fimmu.2022.826515
Fisiológico e Fisiopatológico
Papéis das vias metabólicas para
formação de NET e outros
Funções dos Neutrófilos
2
Darko Stojkov 1,2, Lea Gigon1 , Shuang Peng1 , Robert Lukowski , Peter Ruth2 ,
3 4
Alexander Karaulov , Albert Rizvanov , Nickolai A. Barlev 5,6, Shida Yousefi1
e Hans-Uwe Simon1,3,4,7*
1 Instituto de Farmacologia, Universidade de Berna, Berna, Suíça, 2 Departamento de Farmacologia, Toxicologia e Farmácia Clínica, Instituto de
3
Farmácia, Universidade de Tübingen, Tübingen, Alemanha, Alergologia, Universidade Sechenov, Departamento de Imunologia Clínica e
Moscou, Rússia, 4 Instituto de Medicina Fundamental e Biologia, Universidade Federal de Kazan, Kazan, Rússia, 5º Instituto de Citologia,
Academia Russa de Ciências, São Petersburgo, Rússia, 6º Regulamento do Laboratório de Sinalização Celular, Instituto de Física e Tecnologia de
Moscou, Dolgoprudny, Rússia, 7º Instituto de Bioquímica, Brandemburgo Faculdade de Medicina, Neuruppin, Alemanha
Editado por:
Carlos Rodrigo Hermosilla, Os neutrófilos são as células mais numerosas na população de leucócitos e essenciais para
Universidade de Giessen, Alemanha
a imunidade inata. Para limitar suas funções efetoras, os neutrófilos são capazes de modular
Revisados pela:
a glicólise e outras vias metabólicas celulares. Essas vias metabólicas são essenciais não
Ioannis Mitroulis,
Universidade Demócrito da Trácia, apenas para o uso de energia, mas também para ações efetoras especializadas, como a
Grécia
produção de espécies reativas de oxigênio (ROS), quimiotaxia, fagocitose, degranulação e
Anderson Guimarães-Costa,
Universidade Federal do Rio de Janeiro,
formação de armadilhas extracelulares de neutrófilos (NETs). Foi demonstrado que
Brasil neutrófilos viáveis ativados podem produzir NETs, que consistem em um andaime de DNA
*Correspondência: capaz de se ligar a proteínas de grânulos e microorganismos. A formação de NETs requer
Hans-Uwe Simon
a disponibilidade de quantidades aumentadas de trifosfato de adenosina (ATP), pois é um
hus@pki.unibe.ch
processo celular ativo e, portanto, dependente de energia. Neste artigo, discutimos as vias
Seção de especialidade: glicolíticas e outras vias metabólicas em associação com as funções dos neutrófilos,
Este artigo foi submetido a
enfocando seu papel na construção de NETs no espaço extracelular. Uma melhor
Imunidade Inata Molecular, uma
seção da revista
compreensão dos requisitos das vias metabólicas para as funções dos neutrófilos pode
Fronteiras da Imunologia levar à descoberta de alvos moleculares adequados para desenvolver novas drogas anti-infecciosas e/o
Recebido: 30 de novembro de 2021
Palavras-chave: neutrófilo, metabolismo, armadilhas extracelulares de neutrófilos, interruptor metabólico, glicólise
Aceito: 20 de janeiro de 2022
Publicado: 09 de fevereiro de 2022
Citação:
Stojkov D, Gigon L, Peng S, INTRODUÇÃO
Lukowski R, Ruth P, Karaulov A,
Rizvanov A, Barlev NA, Yousefi S e Simon HU Os neutrófilos são os glóbulos brancos mais abundantes no sangue periférico humano, com uma
(2022) Papéis fisiológicos e fisiopatológicos renovação diária estimada de 1010 a 1011 células (1, 2). Eles exibem um núcleo característico com 3
das vias metabólicas para formação de NET e
a 5 lóbulos segmentados que são conectados a uma fina faixa de material nuclear (3). Os neutrófilos
outras funções de neutrófilos.
são gerados na medula óssea em um processo regulado de granulopoiese. São células terminalmente
Frente. imunol. 13:826515. diferenciadas com meia-vida curta em condições fisiológicas (4-6). Portanto, eles precisam ser
doi: 10.3389/fimmu.2022.826515 constantemente repostos a partir de células precursoras da medula óssea (3). O papel fundamental dos neutrófilos
Fronteiras em Imunologia | www.frontiersin.org 1 Fevereiro 2022 | Volume 13 | Artigo 826515
Machine Translated by Google
Stojkov et ai. As vias metabólicas regulam a formação de NET
é responder e diminuir patógenos extracelulares e participar do início Como a glicólise continua sendo a principal via metabólica no citosol
da resposta imune adaptativa (2, 5). Além disso, os neutrófilos dos neutrófilos, estudos mais recentes identificaram rotas metabólicas
desempenham diversas funções celulares, incluindo explosão adicionais nessas células (3). Por exemplo, os neutrófilos utilizam a
oxidativa, fagocitose, degranulação, produção de diferentes citocinas via das pentoses-fosfato (PPP) para produzir NADPH e ribose. Em
e quimiocinas e formação de armadilha extracelular de neutrófilos certas condições, principalmente devido à disponibilidade limitada de
(NET) ( 2, 7). Muitas funções dos neutrófilos dependem da energia e glicose, os neutrófilos também são capazes de se adaptar ao
da reorganização do citoesqueleto (8, 9). metabolismo dos ácidos graxos e à glutaminólise. Pelo contrário,
quando a glicose é abundante, eles podem armazenar pequenas
Os neutrófilos são equipados com um sistema enzimático quantidades de glicogênio (44). Nesta revisão, discutimos as vias
especializado, chamado nicotinamida adenina dinucleotídeo fosfato metabólicas utilizadas pelos neutrófilos e exploramos as mudanças
(NADPH) oxidase (muitas vezes referido como NOX2), que é capaz metabólicas durante a formação de NET.
de produzir espécies reativas de oxigênio (ROS) em maior quantidade
em comparação com as ROS geradas pelas mitocôndrias. A NADPH
oxidase reduz o oxigênio molecular a superóxido, que serve como FUNÇÕES DE NEUTRÓFILOS E
precursor para a formação do peróxido de hidrogênio, contribuindo VIAS METABÓLICAS ASSOCIADAS
para a morte bacteriana a fim de amortecer a resposta inflamatória
(10). Durante sua atividade antimicrobiana, os neutrófilos liberam Na última década, houve um grande interesse em investigar o impacto
proteínas granulares (3). Três tipos principais de grânulos podem ser da atividade metabólica nas vias reguladoras das células imunes,
distinguidos nos neutrófilos. Durante o estágio de promielócito, os incluindo os neutrófilos (45-48). Em comparação com outras células
grânulos azurófilos são formados. Esses grânulos primários são imunes, como macrófagos e linfócitos, os neutrófilos têm números
grandes e densos e contêm mieloperoxidase (MPO) (11). modestos de mitocôndrias e obtêm sua energia principalmente da
A lactoferrina é encontrada em grânulos específicos ou secundários, glicólise (49, 50). Embora as análises iniciais usando microscopia
que se desenvolvem durante a fase mielócito-metamielócito (12). No eletrônica sugerissem algumas mitocôndrias funcionais apenas em
estágio de banda do desenvolvimento dos neutrófilos, são formados neutrófilos maduros (51, 52), sondas mitocondriais desenvolvidas
os grânulos terciários que contêm gelatinase (13). Os neutrófilos recentemente e novos métodos para quantificar a taxa de consumo
liberam muitas citocinas, incluindo interleucina (IL)-6, IL-1 e fator de de oxigênio (OCR) e a taxa de acidificação extracelular (ECAR)
necrose tumoral alfa (TNF-a), que auxiliam no processo inflamatório resultaram em novos insights sobre o papel funcional das mitocôndrias
atraindo glóbulos brancos adicionais para o local da inflamação (14, nos neutrófilos (3, 9). Está agora bem estabelecido que os neutrófilos
15 ) . expressam componentes do complexo de fosforilação oxidativa
Quando ativados, os neutrófilos migram por quimiotaxia em direção (OXPHOS) (50) e exibem uma rede mitocondrial ativa (53). Eles
aos sítios inflamatórios (16) para combater os microrganismos exibem mitocôndrias funcionais (54) e alterações no potencial
invasores. Os mecanismos precisos das respostas inflamatórias mitocondrial (DYm) foram detectadas em neutrófilos maduros ativados
antimicrobianas dos neutrófilos ainda estão sob intensas investigações. (50, 53). Também foi relatado que a proteína de atrofia óptica 1
Os neutrófilos são capazes de matar microrganismos tanto (OPA1), conhecida por ser responsável por controlar a fusão
intracelularmente por fagocitose quanto extracelularmente, formando mitocondrial e manter as junções das cristas mitocondriais apertadas
NETs contendo DNA liberado e proteínas granuladas (17-19). Nós e para permitir a respiração oxidativa eficiente (55-57), também é
outros relatamos que a estrutura semelhante a uma teia liberada é necessária para a produção de ATP através da glicólise em neutrófilos
composta de DNA mitocondrial (mtDNA) e proteínas granulares (8, 9, (9). Além disso, mitocôndrias funcionais e produção de ATP glicolítico
19–26). Os NETs asseguram a eliminação de patógenos ao prevenir foram necessárias para formar uma rede de microtúbulos intacta e
sua disseminação e aumentar a concentração local de fatores NETs funcionais, ambos contribuindo para a defesa antimicrobiana
antimicrobianos e tóxicos (27). mediada por neutrófilos em um modelo in vivo de infecção pulmonar
Eosinófilos, basófilos, mastócitos e monócitos/macrófagos também por Pseudomonas aeruginosa (P. aeruginosa) (9) .
podem formar armadilhas de DNA extracelular (28-35).
Desde a descoberta de NETs, vários estímulos microbianos e não
infecciosos foram identificados para ativar neutrófilos para induzir a As atividades metabólicas nos neutrófilos ainda não são
formação de NET (24, 36-39). completamente compreendidas, e várias vias metabólicas, incluindo a
A produção de ROS parece ser essencial para a formação de NET glicólise, via ciclo do ácido tricarboxílico (TCA) (também conhecido
(19, 40-42). O aumento de ERO intracelular ativa a glutationilação de como ciclo de Krebs), via das pentoses fosfato (PPP) via OXPHOS,
actina e tubulina, fortemente regulada pela glutaredoxina 1 (Grx1), glicogenólise, glutaminólise e ácido graxo b -oxidação (FAO) são
uma enzima necessária para a deglutationação de actina e consideradas utilizadas pelos neutrófilos para atender aos requisitos
microtúbulos. Portanto, um movimento ativo do citoesqueleto é vital energéticos, biossintéticos e funcionais dos neutrófilos (3, 43, 58-62)
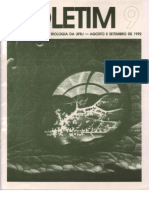
para a formação de NETs (8). Além disso, a reorganização dos (Figura 1).
arranjos de microtúbulos e, consequentemente, a formação de NET, Embora a glicólise seja uma via metabólica dominante para os
demonstraram depender do ATP glicolítico (9). Para executar as neutrófilos, sob depleção de glicose, os neutrófilos dependem
funções efetoras, os neutrófilos contam com vias metabólicas simples, principalmente da degradação do glicogênio armazenado (glicogenólise)
como a glicólise (43). Apesar do (63, 64), e certas funções dos neutrófilos, como a fagocitose, requerem
Fronteiras em Imunologia | www.frontiersin.org 2 Fevereiro 2022 | Volume 13 | Artigo 826515
Machine Translated by Google
Stojkov et ai. As vias metabólicas regulam a formação de NET
FIGURA 1 | Visão geral das principais vias metabólicas em neutrófilos. No citosol de neutrófilos, a glicólise é uma rota metabólica primária que transforma glicose em piruvato por
meio de várias enzimas e reações. O piruvato é convertido em lactato e liberado para fora das células durante a glicólise anaeróbica na ausência de oxigênio. O piruvato
contribui para o ciclo do TCA após a conversão em acetil-coenzima A (acetil Co A) na presença de oxigênio, o que resulta na redução dos intermediários energéticos NADH e
diidroflavina-adenina dinucleotídeo (FADH2) para gerar ATP através da cadeia de transporte de elétrons (ETC) . Os neutrófilos também usam a via das pentoses-fosfato (PPP)
para gerar NADPH e riboses, que são então usadas para construir nucleotídeos, empregando a glicose-6-fosfato, um intermediário da via glicolítica, como ponto de entrada
durante as fases oxidativa e não oxidativa para fabricar NADPH e riboses. O NADPH modula a sinalização redox e é necessário para a produção de ROS dependente
de NADPH oxidase em neutrófilos. As reservas de glicogênio se concentram nos neutrófilos quando os níveis de glicose aumentam, fornecendo suprimento intermediário
glicolítico baseado em glicose sob demanda. Através da síntese de ácidos graxos (FAS), o citrato intermediário do ciclo do TCA pode ser convertido em ácidos graxos
livres, que podem então ser transportados do ambiente extracelular através da via FAO para produzir acetil-CoA, que alimenta o ciclo do TCA e produz significativamente mais
energia na forma de ATP. A glutamina ajuda o ciclo do TCA produzindo a-cetoglutarato através da glutaminólise. Os neutrófilos também usam o transporte de glicerol-3-
fosfato para criar NAD+ a partir de NADH, o que ajuda no potencial de membrana mitocondrial. O HIF-1a aumenta a atividade e a expressão de GLUT1 e GLUT3, resultando em
aumento da captação de glicose, elevação das atividades enzimáticas da hexoquinase 2 (HK2) e fosfofrutoquinase B3 (PFKFB3) e aumento da produção de ATP.
glicogênio armazenado (65). O shunt PPP ou hexose monofosfato Os neutrófilos são freqüentemente encontrados em microambientes
(HMP), que usa o intermediário glicolítico glicose-6-fosfato (G6P) com baixos níveis de oxigênio. Para sobreviver sob condições de
para criar ribose-5-fosfato (R5P) e NADPH no citosol, é necessário hipóxia, os neutrófilos retêm o fator induzível por hipóxia-1a (HIF-1a)
para a formação de ROS pela NADPH oxidase em neutrófilos (58). e a via de detecção de oxigênio da hidroxilase inibidora do fator HIF
Além disso, em caso de disponibilidade limitada de glicose, os (FIH) para diminuir a apoptose dos neutrófilos ( 71, 72). Foi descrito
neutrófilos ativam um metabolismo compensatório de ácidos graxos que a hipóxia inibe a apoptose pela indução de várias enzimas
(66). A FAO mitocondrial transforma ácidos graxos em acil-CoAs, que glicolíticas, incluindo GAPDH, permitindo a produção contínua de
então entra no ciclo do TCA como acetil-CoA, e a energia na forma ATP, que é crítico para a sobrevivência e função dos neutrófilos (73).
de ATP é gerada através da cadeia de transporte de elétrons (3, 47, Sob condições hipóxicas, os neutrófilos de camundongos knockout
67). para HIF-1a são mais propensos à apoptose (71).
A glutamina é outro substrato metabólico usado pelos neutrófilos, Além disso, o HIF-1a e o alvo mamífero da rapamicina (mTOR)
especialmente quando os níveis de glicose estão baixos (3, 68-70). também foram identificados como importantes reguladores da glicólise
A glutamato desidrogenase produz a-cetoglutarato, que alimenta o em neutrófilos (74, 75). O HIF-1a regula positivamente as enzimas
ciclo do TCA (70). hexoquinase 2 (HK2) e fosfofrutoquinase B3
Fronteiras em Imunologia | www.frontiersin.org 3 Fevereiro 2022 | Volume 13 | Artigo 826515
Machine Translated by Google
Stojkov et ai. As vias metabólicas regulam a formação de NET
(PFKFB3) para aumentar a atividade e a expressão do transportador de GLUT1, GLUT3 e GLUT4 (135). Após a ativação, observa-se um
glicose (GLUT) 1 e GLUT3 nos neutrófilos, resultando em aumento da aumento da expressão de superfície de GLUTs seguido por um aumento
absorção de glicose, metabolismo da glicose e geração de ATP (74, 76, na captação de glicose. Uma vez dentro da célula, a glicose é
77). O HIF-1a também foi implicado na formação de NET (78, 79). O imediatamente convertida em glicose-6-fosfato pelas enzimas
aumento da formação de NET foi associado à estabilização do HIF-1a. hexoquinase (136). Cada molécula de G6P é convertida em duas
Assim, a formação reduzida de NET e a morte de bactérias extracelulares moléculas de piruvato e duas moléculas de ATP, bem como NADH. Na
mediada por NET foram descritas em caso de knockdown farmacológico presença de oxigênio (condições aeróbicas), o piruvato pode ser usado
ou genético de HIF-1a (80). Além disso, o HIF-2a, que possui atividades para produzir acetil-Co A, que pode então ser oxidado através do ciclo
sobrepostas ao HIF-1a, também é expresso por neutrófilos, e sua do TCA para produzir energia (ATP a ETC) (3, 47, 67, 134). Muitos
expressão foi regulada positivamente em circunstâncias inflamatórias estudos demonstraram o papel essencial da glicose nos neutrófilos, em
(81). que a depleção de glicose encerrou completamente a maioria das
funções efetoras dos neutrófilos (43, 49, 58, 63) (Figura 1)
Tomados em conjunto, a flexibilidade metabólica sob uma variedade
de condições de estresse ajuda a atender às demandas de energia
desviando eficientemente os metabólitos intermediários criados pelas Via Pentose-Fosfato (PPP)
vias metabólicas operacionais (82). Na Figura 1, descrevemos as Uma via metabólica dependente de glicose alternativa em neutrófilos é a
principais vias metabólicas, que fornecem a energia necessária para PPP, também conhecida como shunt de monofosfato de hexose, que foi
diversas funções dos neutrófilos. Além disso, resumimos as publicações observada tanto em neutrófilos em repouso quanto em neutrófilos
recentes relatando defeito na formação de NET em condições patológicas ativados, bem como durante a formação de NET (58) .
onde as atividades metabólicas dos neutrófilos estão comprometidas O PPP está envolvido na produção de ROS dependente de NADPH
(Tabela 1). oxidase (NOX) e, consequentemente, contribui para a formação de NET (58).
A produção de superóxido via PPP é um catalisador essencial no
Glicólise A processo de morte de bactérias por neutrófilos (137). Defeitos na via
glicólise é uma via metabólica chave que converte glicose em piruvato PPP ou inibição da enzima chave PPP, glicose-6-fosfato desidrogenase
para gerar pequenas quantidades de ATP e NADPH (3, 49, 50, 133, (G6PD), sob altas concentrações de glicose levaram à redução da
134). A glicólise é a principal via metabólica na maioria das células produção de ROS (138).
imunes, incluindo neutrófilos, que dependem da glicólise como fonte de O PPP contém uma fase oxidativa e uma não oxidativa (Figura 2).
ATP (43). Esta via metabólica fundamental não requer oxigênio e Durante a fase oxidativa, G6PD, 6-fosfogluconolactonase e 6-
representa uma sequência de dez reações catalisadas por enzimas (43, fosfogluconato desidrogenase (PGD) convertem G6P em CO2, ribulose-5-
65). Durante a glicólise, os neutrófilos captam glicose extracelular através fosfato e NADPH, para manter o equilíbrio redox durante o estresse
de transportadores de glicose (GLUTs) e expressam vários GLUTs, como celular. Várias enzimas estão envolvidas no processo não oxidativo
TABELA 1 | Alterações metabólicas em doenças associadas a NET.
doenças Mudança metabólica formação NET Resultado Referências
Diabetes mellitus PPP diminuído Aumentado ÿ • Aumento de doenças oculares diabéticas (66, 83–88)
•
Glicólise aumentada Cicatrização de feridas diabéticas prejudicada
•
Inflamação e dano tecidual
PPC aumentado Aumentado ÿ • Aumento de incidentes tromboembólicos
Obesidade (89, 90)
Glicólise aumentada • Alto risco de ocorrências cardiovasculares
Câncer Glicólise aumentada Aumentado ÿ • Promove câncer de mama e metástase hepática (26, 91–95)
•
Aumento da FAO Aumento do crescimento do tumor
LES Diminuição da glicólise Aumento ÿ • Alto grau de inflamação e destruição tecidual, dano endotelial • Autoimunidade e assinaturas (3, 24, 96–102)
de IFN tipo I
RA Aumentado ÿ •
Glicólise aumentada Danos na cartilagem (102–106)
• Ativação imunológica
G6PDD PPP diminuído Diminuiu ÿ •
Atividade microbicida e metabólica prejudicada (58, 107–109)
•
Suscetibilidade à infecção
Sepse Glicólise aumentada Aumentado ÿ • Maior gravidade da sepse e danos aos órgãos (63, 110–119)
•
PPC aumentado Disfunção da barreira intestinal por promover inflamação e apoptose epitelial
Aumento da FAO
CF Glicólise aumentada Aumentado ÿ • Inflamação aumentada (120–124)
• Depuração defeituosa de infecções
• Diminuição da apoptose de neutrófilos •
COVID 19 Glicólise aumentada Aumentado ÿ Aumento da inflamação (124–129)
•
Maior dano e mortalidade de órgãos • Inflamação
Aterosclerose Aumento da FAO Aumentado ÿ aumentada e dano de células endoteliais (130–132)
Fronteiras em Imunologia | www.frontiersin.org 4 Fevereiro 2022 | Volume 13 | Artigo 826515
Machine Translated by Google
Stojkov et ai. As vias metabólicas regulam a formação de NET
FIGURA 2 | Via das pentoses fosfato (PPP). Existem duas fases no PPP: oxidativa e não oxidativa. G6P-desidrogenase (G6PD), 6-fosfogluconolactonase e
6-fosfogluconato desidrogenase (PGD) convertem G6P em CO2, ribulose-5-fosfato e NADPH durante a fase oxidativa para manter o equilíbrio redox sob condições estressantes.
Na fase não oxidativa, enzimas como ribose-5-fosfato isomerase, ribulose-5-fosfato 3-epimerase, uma transcetolase e uma transaldolase convertem a ribulose-5-fosfato em
ácidos nucléicos, precursores de fosfato de açúcar ou precursores glicolíticos, como como frutose-6-fosfato (F6P) e gliceraldeído-3-fosfato (G3P). PPP e glicólise
compartilham um pool de G3P e F6P, resultando na produção de lactato ou piruvato.
fase, incluindo ribose-5-fosfato isomerase, ribulose-5-fosfato 3- isolados de locais inflamatórios acumulam mais glicogênio do que os
epimerase, uma transcetolase (TKT) e uma transaldolase (TAL), que neutrófilos da circulação periférica (64, 139). Como resultado, durante
convertem ribulose-5-fosfato em ácidos nucleicos, precursores de a inflamação, a glicólise parece ser uma rota metabólica importante e
fosfato de açúcar ou precursores glicolíticos como frutose-6-fosfato crítica para os neutrófilos. O conteúdo de glicogênio aumenta à medida
(F6P) e gliceraldeído 3-fosfato (G3P). PPP e glicólise compartilham que os neutrófilos amadurecem (142). Uma vez que glicose suficiente
um pool de G3P e F6P, o que resulta na produção de lactato ou esteja disponível e os níveis intracelulares normais de glicose sejam
piruvato, respectivamente. restabelecidos, a síntese de glicogênio é retomada (49, 143).
A interação da glicose entre o retículo endoplasmático (RE) e o
Metabolismo do glicogênio O citoplasma regula o nível de glicogênio dos neutrófilos (Figura 3).
glicogênio, um polissacarídeo multiramificado armazenado no citosol A ciclagem da glicose no RE desempenha um papel essencial na
dos neutrófilos, é o armazenamento central da glicose, e a apoptose dos neutrófilos e outras funções dos neutrófilos (141). Além
glicogenólise, uma quebra do glicogênio em glicose-1-fosfato, é um disso, foi relatado que a deficiência da glicose-6-fosfatase-b do RE
sinal de disponibilidade limitada de glicose e ATP (63, 139 ) . Os (G6Pase-b, também conhecida como G6PC3) é a base da síndrome
neutrófilos parecem ser o único tipo de célula mieloide capaz de de neutropenia congênita deficiente em G6PC3. Os neutrófilos desses
gliconeogênese e glicogênese, o que revela sua capacidade de criar pacientes exibiram aumento do estresse de RE e apoptose. G6PC3
ATP sob condições de baixo teor de glicose e baixo teor de oxigênio converte G6P em glicose e fosfato, que entra no RE por meio do
(140). A glicose-1-fosfato é convertida em glicose 6-fosfato, que transportador de G6P (G6PT). A deficiência de G6PC3 nesses
muitas vezes é hidrolisada em glicose usando glicose 6-fosfatases pacientes leva a concentrações citoplasmáticas reduzidas de glicose,
(G6Pase) via gliconeogênese (141). Na ausência de glicose, os G6P, lactato e ATP, levando ao aumento da apoptose e neutropenia
neutrófilos dependem da glicogenólise para quebrar o glicogênio típica (144). O aumento da atividade enzimática da glicogênio
armazenado como fonte de glicose (64). Neutrófilos fosforilase leva ao acúmulo adicional de
Fronteiras em Imunologia | www.frontiersin.org 5 Fevereiro 2022 | Volume 13 | Artigo 826515
Machine Translated by Google
Stojkov et ai. As vias metabólicas regulam a formação de NET
FIGURA 3 | Metabolismo do glicogênio. A degradação do glicogênio resulta em glicose-1 fosfato, que é então convertida em glicose-6-fosfato (G6P) pela
fosfoglucomutase. O G6P pode entrar na via da glicólise e ser usado como fonte de energia. Usando a glicose-6-fosfatase (G6Pase), o G6P pode ser hidrolisado em glicose
via gliconeogênese e subsequentemente liberado no sangue. A glicose-6-fosfato também pode ser absorvida pelo PPP e convertida em NADPH ou ribose em vários tecidos.
G6P intracelular que pode ser utilizado em diferentes vias metabólicas respostas funcionais, sugerindo a necessidade essencial de entender
em neutrófilos (145). Os neutrófilos são suscetíveis a flutuações dos melhor o fluxo de glicose em neutrófilos (Figura 3).
níveis de glicose intracelular e extracelular ou absorção prejudicada de
glicose e respondem de acordo (146). Metabolismo da Glutamina A
A deficiência de glicose-6-fosfato translocase (G6PT/ SLC37A4) leva à glutamina é um dos aminoácidos mais abundantes no corpo e pode ser
doença de armazenamento de glicogênio tipo Ib (GSD-1b) usada como substrato na biossíntese de proteínas, antioxidantes,
(147). Os neutrófilos deficientes em GSD-1b acumulam análogos de NADPH e outras vias metabólicas envolvidas na integridade e funções
glicose inibidores da glicólise no citoplasma que afetam a glicosilação celulares (153) . Em uma série de reações bioquímicas, o metabolismo
de proteínas (148), geração de ATP, síntese de NADPH. da glutamina resulta na produção de glutamato, aspartato, lactato e
Subseqüentemente, os neutrófilos de pacientes com doença de amônia (134). A glutamina é necessária para a síntese de precursores
armazenamento de glicogênio exibem quimiotaxia prejudicada, explosão de nucleotídeos, como RNA e DNA, em condições fisiológicas. Quando
oxidativa e atividade bactericida (147, 149, 150) e apoptose aumentada (151).a disponibilidade de glicose é restrita sob configurações fisiopatológicas,
Curiosamente, um estudo recente descobriu que o tratamento de muitas células, incluindo neutrófilos, podem mudar para o metabolismo
pacientes com GSD-1b com um inibidor do cotransportador de glicose de glutaminólise para atender às suas necessidades de energia (70,
e sódio 2 (SGLT2), um medicamento antidiabético, inibe a reabsorção 154-156). Uma vez que entra na célula, a glutamina precisa ser oxidada
renal de glicose, facilitando a excreção do análogo inibitório da glicose, para ser transformada em glutamato (Figura 4). O glutamato então
resolvendo a neutropenia e as disfunções dos neutrófilos ( 152 ). Esses entra na mitocôndria e é oxidado e metabolizado em a-cetoglutarato, o
estudos indicam a importância da glicose no metabolismo energético e que permite que o NAD+ seja oxigenado e convertido em NADH. O
dos neutrófilos dependentes de NADPH oxidase ciclo TCA
Fronteiras em Imunologia | www.frontiersin.org 6 Fevereiro 2022 | Volume 13 | Artigo 826515
Machine Translated by Google
Stojkov et ai. As vias metabólicas regulam a formação de NET
FIGURA 4 | Metabolismo da glutamina. O metabolismo da glutamina resulta na produção de glutamato, aspartato, lactato e amônia. Sob condições fisiológicas, a
glutamina é necessária para a síntese de precursores de nucleotídeos, como RNA e DNA. A família de proteínas transportadoras de aminoácidos neutros acoplados ao sódio
(SNAT) é um dos vários transportadores do tipo transportador (SLCs) responsáveis por trazer a glutamina para dentro da célula. Uma vez dentro da célula, a glutamina é
oxidada e transformada em glutamato. Além disso, o glutamato entra na mitocôndria e é oxidado e metabolizado em a-cetoglutarato, o que permite que o NAD+ seja oxigenado
e convertido em NADH. O ciclo do TCA pode aceitar a-cetoglutarato e criar malato, que é subsequentemente transformado em piruvato pela malato desidrogenase, que
oxigena o NADP+ .
pode aceitar a-cetoglutarato e criar malato, que é subsequentemente os neutrófilos atenuaram a supressão da geração de superóxido induzida
transformado em piruvato pela malato desidrogenase, que oxigena o NADP+ pela adrenalina, resultando no aumento da atividade de produção de
. NADPH via metabolismo da glutamina (159, 160).
O piruvato é subsequentemente convertido em lactato no citosol ou
usado pela mitocôndria para OXPHOS. O NAD+ pode ser restaurado Ácidos Graxos Os
através da geração de lactato em condições de inflamação e baixo oxigênio. ácidos graxos são substratos energéticos para tecidos e células, incluindo
Como um NAD+ citosólico entra na mitocôndria ainda não é conhecido, leucócitos, e estão envolvidos na manutenção da glicose e da homeostase
especialmente porque as mitocôndrias de mamíferos não geram NAD+ e do combustível (161). O metabolismo dos ácidos graxos tem um papel
são consideradas impermeáveis aos nucleotídeos de piridina (134, 157). importante na atividade funcional dos neutrófilos (162).
No entanto, foi recentemente demonstrado que o NAD+ ou NADH citosólico O comprimento da cadeia dos ácidos graxos pode variar de 3 a 30 átomos
pode ser entregue diretamente nas mitocôndrias de mamíferos (134, 157). de carbono e, dependendo do número de átomos de carbono, os ácidos
graxos são caracterizados como ácidos graxos de cadeia curta, média e longa.
Os neutrófilos também podem consumir glutamina em uma taxa mais rápida Os aminoácidos de cadeia curta contêm menos de seis átomos de carbono.
que a glicose (68). Além disso, a glutaminólise, como o PPP, desempenha Aqueles com seis a dez átomos de carbono são ácidos graxos de cadeia
um papel fundamental na formação de NADPH e na expressão do complexo média e ácidos graxos de cadeia longa exibem mais de doze átomos de
NOX (158). Estudos in vitro indicaram que a glutamina aumenta a morte carbono. Os ácidos graxos podem ser monoinsaturados com uma ligação
bacteriana por neutrófilos de pacientes pós-operatórios. A adição de 2 mM carbono-carbono ou poliinsaturados com duas ou mais ligações duplas.
de glutamina extracelular a Além disso, os ácidos graxos sem ligações duplas na molécula são
Fronteiras em Imunologia | www.frontiersin.org 7 Fevereiro 2022 | Volume 13 | Artigo 826515
Machine Translated by Google
Stojkov et ai. As vias metabólicas regulam a formação de NET
conhecidos como ácidos graxos saturados (144, 163). O metabolismo dos as acilcarnitinas localizadas na membrana mitocondrial externa, são
ácidos graxos é aumentado quando as células são expostas a condições geradas pela carnitina palmitoiltransferase-1 (CPT-1) que catalisa uma
limitadas de glicose. A utilização e a oxidação dos ácidos graxos ocorrem ligação éster da carnitina com ácidos graxos de cadeia longa.
nos neutrófilos e são importantes para sua ativação (164). Carnitina-acilcarnitina translocase (CACT) transloca acilcarnitinas através
Além disso, durante a diferenciação e maturação dos neutrófilos, os da membrana mitocondrial interna (167).
ácidos graxos entram na via da FAO para produzir ATP através do As acilcarnitinas renovam a acil-Co A dentro da mitocôndria através da
OXPHOS (165). Também foi demonstrado que os ácidos graxos carnitina palmitoiltransferase-2 (CPT-2), que está localizada na membrana
prejudicam a captação e o metabolismo da glicose (166). mitocondrial interna (168). A carnitina retorna ao citoplasma para outro
Os ácidos graxos são oxidados para produzir acetil-Co A, que é então ciclo, enquanto a acil-Co A entra na via de b-oxidação, criando acetil-Co
convertido em citrato via citrato sintase. A ativação da piruvato A (sob circunstâncias aeróbicas e baixos níveis de ATP) (167). A utilização
desidrogenase quinase (PDK), que inativa a piruvato desidrogenase dos ácidos graxos pelos neutrófilos e, consequentemente, o resultado da
(PDH), é promovida por altas razões acetil-Co A/Co A e NADH/NAD. O interação depende de diversos aspectos, incluindo a presença e ausência
ATP e o citrato bloqueiam a fosfofrutoquinase (PFK), resultando no de inflamação e a concentração dos ácidos graxos. Sob condições in
acúmulo de G6P e inibição da hexoquinase e, portanto, a glicólise é vivo, os ácidos graxos também interagem com outras células, como
prejudicada. A matriz mitocondrial também produz acetil-Co A, que pode macrófagos e células endoteliais (162).
ser oxidado no ciclo do TCA (69) (Figura 5).
Além disso, a carnitina, um composto de amônio quaternário, desempenha
MUDANÇAS DE METABÓLITOS DURANTE A FORMAÇÃO DE
uma tarefa importante na produção de energia devido ao seu papel na
FAO, transportando ácidos graxos de cadeia longa para as mitocôndrias NETs Para formar
para serem oxidados para produção de energia. A carnitina também NETs, os neutrófilos liberam dsDNA como um andaime decorado com
participa da remoção de produtos do metabolismo das células. Adicionalmente,proteínas de grânulos tóxicos (8, 9, 17, 19, 169).
FIGURA 5 | Metabolismo de ácidos graxos. Os ácidos graxos são oxidados para formar acetil-Co A, que é então convertido em citrato pela atividade da citrato sintase. Acetil-Co A
também pode ser produzido pela matriz mitocondrial e posteriormente oxidado no ciclo do TCA. Por meio do FAS, o citrato intermediário do ciclo do TCA pode ser convertido
em ácidos graxos livres (FFA), que podem então ser transportados do ambiente extracelular pela via da FAO para produzir acetil-Co A, alimentando o ciclo do TCA para produzir
significativamente mais energia no forma de ATP.
Fronteiras em Imunologia | www.frontiersin.org 8 Fevereiro 2022 | Volume 13 | Artigo 826515
Machine Translated by Google
Stojkov et ai. As vias metabólicas regulam a formação de NET
Atualmente, vários grupos estudaram os requisitos metabólicos da A atividade da lactato desidrogenase (LDH) também foi relatada
formação de NET (9, 43, 58). A formação de NET requer a produção (176), apoiando a noção de que a glicólise é importante no processo
de ATP glicolítico para reorganizar o citoesqueleto para a liberação de formação de NET. Da mesma forma, a 6-aminonicotinamida [6-
catapulta de grânulos citoplasmáticos juntamente com o DNA AN, um inibidor da glicose-6-fosfato desidrogenase (G6PDH)] pode
mitocondrial (8, 9, 17, 62, 169). Tem sido relatado que a produção interromper o metabolismo da PPP, o que leva à formação de NET (58).
de ATP glicolítico ajuda na montagem da rede de microtúbulos para Subsequentemente, ocorre uma virada metabólica em direção ao
formar NETs (9, 169). Usando abordagens genéticas e farmacológicas, PPP durante a formação de NET (3, 58), acompanhada por aumento
foi demonstrado que a falta de Opa1 reduz a atividade mitocondrial da atividade de G6PD, que desvia o intermediário glicolítico G6P.
ETC I em neutrófilos de camundongos. Como resultado, a produção Em neutrófilos desencadeados por PMA e fibrilas amiloides, o
de ATP via glicólise foi reduzida devido ao nível reduzido de inibidor de G6PD 6-aminonicotinamida (6-AN) bloqueou a geração
disponibilidade de NAD+. Além disso, demonstramos que de ROS e a liberação de dsDNA, sugerindo que G6P é um
camundongos sem Opa1 em populações de neutrófilos (Opa1ND ) combustível para a ativação de NOX2 ( 58). No entanto, a inibição
exibiram uma menor capacidade de defesa antibacteriana, de ROS e NETs foi incompleta, indicando que pode haver fontes
fornecendo evidência direta para o papel das mitocôndrias na adicionais de energia, como uma via glicolítica ativa (3, 43, 176).
formação de NET (9). Além disso, TKT, uma enzima dependente de pirofosfato de
Foi sugerido que a formação de NET depende da glicose, mas tiamina (vitamina B1) que conecta a via das pentoses fosfato e a via
não da glutamina (43). Foi relatado que a captação de glicose glicolítica, mostrou-se importante para a atividade da NADPH oxidase
aumentou após acetato de miristato de forbol (PMA) para induzir e consequentemente para a formação de NET. A supressão
NETs (43). Além disso, a formação de NET depende do aumento da farmacológica de TKT ou um déficit genético na transaldolase 1,
produção intracelular de ROS (19, 40, 170, 171). Os pacientes que enzimas PPP não oxidativas que auxiliam na conversão dos produtos
apresentam doença granulomatosa crônica (DGC) sofrem de uma da reação oxPPP de volta em glicose 6-fosfato, reduzem a explosão
maior suscetibilidade a infecções bacterianas e fúngicas. O distúrbio oxidativa e a formação de NET (177) .
genético é caracterizado por defeitos da NADPH oxidase que resulta Embora os neutrófilos sejam regularmente encontrados sob
em produção prejudicada de ROS (19, 172). condições inflamatórias hipóxicas em tecidos com lactato enriquecido,
A falta de produção suficiente de ROS leva subsequentemente a o papel do lactato na atividade dos neutrófilos recebeu até agora
defeitos na reorganização do citoesqueleto, degranulação, liberação apenas pouca atenção. Dada a atual mudança de paradigma no
de DNA e, finalmente, na formação reduzida de NETs (8). papel do lactato no metabolismo, foi recentemente relatado que o
No entanto, sob certas circunstâncias, na ausência de atividade de lactato desempenha um papel único na formação de NET. Além
NADPH oxidase, as mitocôndrias podem fornecer ROS mitocondriais disso, neutrófilos humanos tratados exogenamente com lactato
suficientes (mitoROS) como um mecanismo compensatório para exibem formação de NET, embora a formação de NET tenha sido
gerar NETs (24). No entanto, o aumento na produção de ROS ocorre drasticamente reduzida quando a atividade de LDH foi inibida (3, 9,
muito mais rapidamente e parece não ser dependente de energia (43). 43, 176). Além disso, o ácido lático produzido por bactérias também
Além disso, 2-desoxi-d-glicose (2-DG), um inibidor da glicólise, pode pode induzir a formação de NET por neutrófilos bovinos (178), e a
bloquear a formação de NET (9, 43) inibindo a glicólise e o PPP. inibição de seu transportador, o monocarboxilato ou enzima LDH,
bloqueia a formação de NET induzida por lactato (64, 178). A LDH
O NADPH usado pelo NOX se origina do PPP, o que demonstra tem a propriedade de converter piruvato e lactato, sugerindo que os
a importância de um metabolismo de glicose fortemente regulado neutrófilos que exploram o lactato durante a formação de NET e a
nas funções dos neutrófilos. Foi demonstrado que a hiperglicemia glicólise contornam o PPP para atuar como uma importante via
aumenta a produção de NETs (88, 134), o que pode explicar a maior metabólica durante a formação de NET. Portanto, a modulação do
incidência de NETs espontâneos observada em pacientes com nível de lactato em condições inflamatórias, como diabetes e sepse,
diabetes tipo 2 (88). Por exemplo, em alta concentração de glicose, poderia controlar a ativação de neutrófilos e a formação de NET.
os neutrófilos foram ativados espontaneamente, mas tiveram menos Além disso, a lipoproteína de baixa densidade oxidada (oxLDL) após
capacidade de responder à estimulação do antígeno bacteriano, a ativação da via TLR causa a formação de NET em PMNs humanos
como o lipopolissacarídeo (LPS) (134). Por outro lado, a hiperglicemia (131) (Figura 6).
também demonstrou reduzir funções-chave dos neutrófilos, como Evidências de um importante papel do metabolismo mitocondrial
fagocitose, produção de ROS e morte bacteriana (134, 173), talvez foram recentemente obtidas quando o fator ativador de plaquetas
devido a NETs instáveis que, além disso, contêm quantidades (PAF) desencadeou hiperpolarização mitocondrial e liberação
reduzidas de peptídeos antimicrobianos em comparação com NETs extracelular de ATP via pannexina-1, resultando na formação de
liberada na presença de concentrações fisiológicas de glicose (174, NET. Curiosamente, o bloqueio do receptor purinérgico P2X1 impediu
175). a hiperpolarização mitocondrial e a formação de NET.
A retirada da glicose do meio leva à erradicação completa dos Assim, o ATP e o canal de ATP panexina 1 (Panx1) contribuem para
NETs (43, 58, 64). Quando a glicose é reposta, a formação de NETs a formação de NET e podem representar alvos terapêuticos (179).
é resgatada (58). Após a ativação dos neutrófilos, a expressão de Concluiu-se ainda que a liberação de NET induzida por PAF é
GLUT1 é aumentada na superfície celular dos neutrófilos, a fim de dependente da glicólise, síntese de ATP mitocondrial e sinalização
captar a glicose para a glicólise (43). purinérgica (180). Estudos recentes revelaram a importância da
Além disso, aumentos na taxa de acidificação extracelular e glutamina na formação de NET. Por exemplo, falta
Fronteiras em Imunologia | www.frontiersin.org 9 Fevereiro 2022 | Volume 13 | Artigo 826515
Machine Translated by Google
Stojkov et ai. As vias metabólicas regulam a formação de NET
FIGURA 6 | O ácido lático bacteriano gerado durante a infecção pode induzir a formação de NET. O ácido lático produzido por bactérias pode causar a formação de NET em neutrófilos
bovinos, e a inibição do transportador de lactato, a enzima monocarboxilato ou lactato desidrogenase (LDH), evita isso. Como o LDH pode converter piruvato e lactato, é possível
que os neutrófilos usem o lactato durante a formação de NET e a glicólise para contornar o PPP. Além disso, a formação de NET em neutrófilos humanos é causada por lipoproteína
de baixa densidade oxidada (oxLDL) de maneira dependente de ROS após a ativação de TLR. Além disso, os ácidos graxos não esterificados (NEFAs), como o ácido oleico (OA) e
o ácido linoleico (LA), iniciam a FAO, permitindo o aumento da produção de ATP e, consequentemente, a formação de NET.
de glutamina ou inibição do complexo V para interromper a função influenciar a extensão da formação de NET (184, 185). O papel do
ATPase mitocondrial inibiu parcialmente a formação de NET, indicando metabolismo dos ácidos graxos na formação de NET é menos
que um metabolismo dependente de mitocôndria dirigido por glutamina estudado, embora tenha sido relatado que os ácidos graxos não
também é utilizado para neutrófilos para formar NETs (3, 64). A esterificados (NEFAs), como o ácido oleico (OA) e o ácido linoleico
translocação mitocondrial em direção à superfície celular após a (LA), frequentemente associados a doenças infecciosas , estão
ativação (8, 9) e sua hiperpolarização para liberar ROS mitocondrial associados a uma maior incidência de infecções e os NEFAs induzem
(180), bem como o DNA mitocondrial oxidado (24) apontam para um a formação de NETs por meio da liberação extracelular de ATP via
papel direto das mitocôndrias na formação de NET (169, 181, 182) . Panexina 1 e subsequente ativação de receptores purinérgicos. O
bloqueio específico de P2X1, um canal catiônico não seletivo, eliminou
NETs poderiam potencialmente ser formadas independentemente a formação de NET após exposição a NEFAs (186) (Figura 6). Além
da NOX NADPH oxidase, dependendo da disponibilidade de disso, outros ácidos graxos, como o Furanoid F-Acid F6, também
quantidades suficientes de ROS mitocondriais (24, 33, 134). Alguns podem ativar os neutrófilos para induzir ROS via NADPH oxidase
patógenos aumentam a produção mitocondrial de ROS (183) que pode (NOX) e atividade mitocondrial, resultando em rápida formação de NET.
resultar em dependência reduzida do metabolismo da glicose. Além disso, Furanoid F-Acid F6 também exigiu proteína quinase B
O nível de oxigênio e o pH também parecem ter um papel importante (AKT) para induzir a formação de NET (187). Ácidos graxos comuns
na formação de NET independente de NOX, pois foi demonstrado que, de cadeia longa, como ácido palmítico (PA), ácido palmitoleico (PO),
em condições ácidas, a glicólise e a produção de ROS são reduzidas ácido esteárico (SA) e ácido oleico causaram a formação de NET via
e, portanto, menos NETs são detectados, indicando que as condições NOX, ERK (quinase regulada por sinal extracelular) e JNK (c-Jun vias
no local de inflamação também pode dependentes da quinase N terminal. Outros relatórios sugeridos
Fronteiras em Imunologia | www.frontiersin.org 10 Fevereiro 2022 | Volume 13 | Artigo 826515
Machine Translated by Google
Stojkov et ai. As vias metabólicas regulam a formação de NET
que os lipídios clorados, aldeído 2-clorograxo e ácido 2-clorograxo (2-ClFA), A perda de peso de pacientes obesos resulta em diminuição da formação de
que é o subproduto da liberação de MPO no fagossomo durante a ativação dos NET (192). Enquanto os neutrófilos normais utilizam a glicólise e o PPP em
neutrófilos, podem converter peróxido de hidrogênio e cloreto em ácido condições fisiológicas e inflamatórias, os neutrófilos de camundongos obesos
hipocloroso (HOCl), levando à formação de NET (188). Este estudo também exibem liberação de NET diminuída, talvez devido à “exaustão” (90). Além
demonstrou que neutrófilos humanos expostos a níveis fisiológicos de 2-ClFAs disso, a capacidade de formar NETs em condição in vivo foi reduzida em
induzem NETs funcionais, embora na ausência de degranulação, e reduzem camundongos obesos. Consequentemente, a formação reduzida de NET e a
unidades formadoras de colônias de Escherichia coli. NETs formados por 2- superativação suprimida de neutrófilos devido à obesidade podem promover
ClFA eram dependentes de cálcio e proteína arginina deiminase 4 (PAD4) infecções e aumentar a gravidade da sepse (90).
(188). A formação de NET também pode ser induzida por lipoproteína oxidada
em correlação com a produção de ROS (131), que é suportada pelos neutrófilos Além disso, a expressão de superfície de GLUT1 foi reduzida em neutrófilos
c-kit+ infiltrados no tumor que utilizam FAO mitocondrial (91). O papel importante ativados por LPS de camundongos com dieta rica em gordura, enquanto a
de diversas vias metabólicas na formação de NET foi intensamente estudado expressão de GLUT1 não foi afetada em neutrófilos em repouso desses
e resumido na Tabela 1. camundongos (90) (Tabela 1).
Fibrose Cística A Fibrose
Cística (FC) é uma síndrome genética caracterizada por mutações no gene
regulador da condutância transmembrana da FC (193). Altos níveis de glicose
VIAS METABÓLICAS NA REDE livre e aminoácidos são encontrados no lúmen das vias aéreas de pacientes
DOENÇAS RELACIONADAS com FC (122). Os neutrófilos CF exibem apoptose suprimida em comparação
com os neutrófilos normais (193). Além disso, observa-se um aumento da
Diabetes O capacidade de formação de NET nos neutrófilos da FC (123), um fenômeno
diabetes é um distúrbio metabólico sistêmico caracterizado pelo aumento dos que tem sido associado ao comprometimento da função pulmonar obstrutiva
níveis de glicose (3). Vários estudos descreveram funções neutrofílicas (120). Os neutrófilos das vias aéreas com FC, mas não os neutrófilos do
prejudicadas em pacientes diabéticos e modelos animais, incluindo adesão de sangue, de pacientes com FC exibem expressão aumentada de GLUT1,
neutrófilos, quimiotaxia, fagocitose, produção de ROS, atividade microbicida, transportador de aminoácidos neutros 2 (ASCT2) e transportador de fosfato
potencial mitocondrial e níveis de ATP (66, 189, 190 ) . inorgânico 1 e 2 (PiT1, PiT2) em comparação com neutrófilos normais,
sugerindo que os processos de adaptação metabólica ocorrem em neutrófilos
A hiperglicemia resulta em diminuição das atividades enzimáticas de G6PD e após seu recrutamento do sangue para o lúmen das vias aéreas da FC (122).
glutaminase (66). Consequentemente, a suposta utilização compensatória da A produção de ROS é diminuída nos neutrófilos da FC nas vias aéreas, em
FAO é observada nos neutrófilos durante a hiperglicemia devido ao metabolismo contraste com os neutrófilos do sangue (121).
defeituoso da glicose e da glutamina (66). Altos níveis de glicose encontrados
em pacientes diabéticos são relatados para aumentar a formação de NET in Além disso, os níveis de GLUT1 e PiT2 nos neutrófilos sanguíneos diminuem
vitro e in vivo em associação com o aumento da atividade da NADPH oxidase com o tratamento oral com corticosteroides (122) (Tabela 1).
(84, 86, 88), demonstrando o papel dos NETs na patogênese do diabetes e
suas complicações como a retinopatia diabética ( DR) (83, 87). Verificou-se
que o desenvolvimento de NETs induzidos por alta glicose está associado à Câncer Os
maquinaria da NADPH oxidase. Além disso, a hiperglicemia a longo prazo neutrófilos associados a tumores (TANs) podem exibir propriedades pró e
permite que os neutrófilos periféricos atravessem a barreira hemato-retiniana antitumorais (3). No adenocarcinoma pulmonar de camundongos, os TANs
(BRB) para formar NETs no corpo vítreo e na retina. O monitoramento de exibem expressão aumentada de GLUT1 e metabolismo da glicose.
produtos circulantes NET no soro de pacientes diabéticos pode ser usado para Esses achados foram associados a uma desaceleração do turnover de
avaliar a gravidade da RD, a fim de minimizar a progressão da doença e neutrófilos em tumores, aumento do crescimento tumoral e diminuição da
oferecer terapia imediata (88). Além disso, melhora na fagocitose de neutrófilos eficácia da radioterapia (94). Neutrófilos imaturos de baixa densidade (iLDNs)
e na produção de ROS após o tratamento com insulina, uma terapia comum dependem da produção de ATP dependente de mitocôndrias através do
para redução da glicose no sangue (66). Além disso, o GLUT4 é translocado catabolismo de glutamato e prolina. Foi demonstrado que eles podem exibir
para a superfície celular após ativação com PMA de maneira sensível à insulina uma função pró-metastática sob condições de privação de nutrientes (92). Além
e pode desempenhar um papel na redistribuição da glicose durante a disso, os neutrófilos são capazes de adaptar um fenótipo oxidativo através da
hipoglicemia. Em contraste, GLUT1 e GLUT3 são expressos na superfície sinalização c-KIT em resposta ao tumor. A produção subseqüente de ROS pela
independente da ativação de neutrófilos e níveis de insulina (135) (Tabela 1). NADPH oxidase permite a supressão mediada por ROS de células T mesmo
em ambiente limitado por glicose e favorece o crescimento do tumor (91). Além
disso, os neutrófilos são atraídos pelo crescimento do tumor para se infiltrar e
formar NETs que modulam o perfil metabólico dos tumores levando ao aumento
da sua sobrevida (93). NETs formados a partir de TANs e suas proteínas
Obesidade A associadas elastase e matrixmetalloproteinase-9 também facilitam o
obesidade está associada a um risco de maior mortalidade devido à inflamação restabelecimento da capacidade proliferativa de células dormentes de câncer
crônica de baixo grau (90). Além disso, atividade aumentada de neutrófilos, de pulmão através da remodelação da matriz extracelular ( 95).
aumento de radicais superóxido e formação de NET são observados em
associação com obesidade (89, 191).
Fronteiras em Imunologia | www.frontiersin.org 11 Fevereiro 2022 | Volume 13 | Artigo 826515
Machine Translated by Google
Stojkov et ai. As vias metabólicas regulam a formação de NET
Além disso, relata-se que os NETs aprisionam células tumorais circulantes, em última análise, em danos nas articulações (106). No meio articular da
levando ao aumento da formação de metástases (194). A infiltração de AR, devido à baixa disponibilidade de oxigênio, o HIF-1a é regulado
neutrófilos no câncer humano de tireóide (TC) foi recentemente relatada positivamente nos neutrófilos, levando ao aumento da atividade glicolítica
como correlacionada com o crescimento tumoral. Além disso, os meios pela regulação positiva da expressão de G3PDH e triosefosfato isomerse-1
condicionados (CM) derivados de TC atraíram neutrófilos, aumentaram para fornecer suprimento de energia ATP (102) (Tabela 1 ) .
sua sobrevivência, causaram alterações morfológicas nos neutrófilos e
desencadearam e alteraram as características cinéticas dos neutrófilos. Aterosclerose Placas
Curiosamente, os neutrófilos anaplásicos (ATC) iniciados com CM contendo LDL e colesterol, bem como hiperlipidemia e inflamação, são as
produziram NETs contendo DNA mitocondrial de maneira dependente de características da aterosclerose (3). As funções dos neutrófilos moduladas
ROS mitocondrial e independente da morte celular (26, 195) (Tabela 1). por alterações metabólicas são relatadas como desempenhando um papel
na patogênese da aterosclerose (201, 202). Consequentemente, a
hiperlipidemia e a hipercolesterolemia desencadeiam a aterosclerose por
Lúpus Eritematoso Sistêmico O lúpus eritematoso meio da indução de neutrofilia (201). A formação de NET é induzida por
sistêmico (LES) é uma doença autoimune caracterizada por alto grau de LDL oxidado e cristais de colesterol (131). Além disso, a diminuição dos
inflamação imunológica e autodestruição, bem como depuração defeituosa níveis de CXCL1, resultando na inibição da biossíntese de NAMPT e
dos TNEs (97, 101). NAD+ , leva à diminuição da infiltração de neutrófilos nas placas
Neutrófilos de pacientes com LES exibem agregação desregulada, ateroscleróticas (203). NETs também foram observados em lesões
fagocitose, explosão oxidativa e formação aumentada de NET (3). ateroscleróticas em camundongos, juntamente com uma elevação nos
A expressão deficiente de GLUT3 e GLUT6 em neutrófilos do LES resulta marcadores pró-inflamatórios IL-1 e IL-6 (204). Além disso, neutrófilos
em aumento da produção intracelular de lactato basal e diminuição da luminicamente aderentes liberando DNA em camundongos deficientes em
produção de ATP. A diminuição da expressão de GLUT3 e GLUT6 resulta apolipoproteína (Apoe-/-) alimentados com uma dieta rica em gordura por
em uma diminuição da capacidade de captação de glicose, resultando em 4 a 6 semanas foram identificados usando uma técnica intravital de
diminuição da atividade glicolítica (100). Além disso, os níveis intracelulares microscopia de dois fótons, mas nenhuma adesão de neutrófilos e,
de glutationa (GSH) e a atividade da g-glutamil transpeptidase são portanto, nenhuma liberação de NET foi observado em camundongos
reduzidos em neutrófilos de pacientes com LES ativo, levando à redução recebendo dieta alimentar (130, 132, 182) (Tabela 1).
da capacidade redox (100). Os NETs são induzidos por complexos imunes
de ribonucleoproteínas (RNP-ICs) encontrados no LES por meio do
aumento da produção de ROS mitocondrial (24). Granulócitos de baixa COVID-19 O
densidade (LDGs), um subconjunto distinto de neutrófilos pró-inflamatórios, COVID-19 é uma condição pró-inflamatória com uma incidência
também foram descritos em pacientes com LES (24) e estão associados desproporcionalmente alta de desenvolvimento de síndrome do desconforto
ao aumento da atividade da doença (196). Os LDGs exibem aumento de respiratório agudo (SDRA), insuficiência renal aguda, arritmia e choque
ROS mitocondrial (24) associado ao aumento da formação de NET (99). (205, 206). Vários indicadores associados a NET, como DNA livre de
células (cfDNA), complexos MPO/NE-DNA e histona citrulinada H3 (CitH3)
Além disso, a formação de NET por LDGs é responsável pelo dano estão consideravelmente elevados na circulação e/ou aspirados traqueais
endotelial (96, 98). Os sintomas lúpicos são resgatados através do de pacientes com COVID-19 (127 , 129, 207–215). O tratamento in vitro
tratamento com 2-DG, metformina e rapamicina em modelos de de neutrófilos isolados de controles saudáveis com soro/plasma de
camundongos, confirmando um papel potencial das alterações metabólicas pacientes com COVID-19 levou à formação de armadilhas de DNA
no LES (197) (Tabela 1). Ainda não está claro por que a formação de NET extracelular, confirmando a presença de substâncias indutoras de NET na
é aumentada em neutrófilos do LES, apesar da expressão reduzida de circulação de pacientes com COVID-19 (127, 129 , 215–218 ).
transportadores de glicose nessas células.
Talvez outros fatores, como o aumento da atividade de ROS mitocondrial, Além disso, os neutrófilos obtidos de pacientes com COVID-19 também
possam compensar a redução da atividade glicolítica. exibiram aumento da formação espontânea de NET in vitro (127, 207, 209,
210).
Artrite Reumatoide A artrite Várias vias metabólicas foram relatadas como desreguladas em
reumatoide (AR) é uma doença autoimune caracterizada por sinovite e neutrófilos de pacientes com COVID-19, como o metabolismo do triptofano,
destruição articular por meio de extensa ativação do sistema imunológico ciclo do TCA, mobilização de ácidos graxos poliinsaturados e biossíntese
(3). Os neutrófilos infiltrados no líquido sinovial articular (SF) liberam de eicosanóides. Além dessas alterações metabólicas, também foi relatado
proteases citotóxicas (198) e apresentam alta produção de ROS (198) e que a própria infecção viral por COVID-19 pode causar reprogramação
expressão aumentada de citocinas (103, 199). As condições de hipóxia metabólica em neutrófilos e PBMC (219, 220). Estudos recentes
nas articulações dos pacientes com AR aumentam a sobrevida dos confirmaram níveis elevados de citocinas inflamatórias, como IL-1b e IL 6,
neutrófilos SF (103). A função prejudicada das células beta e a resistência bem como respostas insuficientes de IL-10 em indivíduos com COVID-19
à insulina em pacientes com AR levam a um risco maior de diabetes (200). grave. Além disso, o receptor solúvel do fator de necrose tumoral 1
Curiosamente, a formação aumentada e acelerada de NET é observada (sTNFR1), um receptor substituto para o TNF-a circulante, e a piruvato
em pacientes com AR (104). Na AR, os NETs estão envolvidos na quinase M2 (PKM2) também aumentaram significativamente em pacientes
degradação da cartilagem, bem como na ativação de sinoviócitos e com COVID-19. A PKM2, enzima que catalisa a etapa final da glicólise, é
macrófagos semelhantes a fibroblastos, resultando um coativador do HIF-1a (221), que
Fronteiras em Imunologia | www.frontiersin.org 12 Fevereiro 2022 | Volume 13 | Artigo 826515
Machine Translated by Google
Stojkov et ai. As vias metabólicas regulam a formação de NET
induz a expressão de enzimas proglicolíticas, como LDH, PDKs através da eliminação bacteriana melhorada e remoção de ATP
(piruvato desidrogenase quinases) e GLUT1. sistêmico (115) (Tabela 1).
Além disso, níveis citosólicos aumentados de lactato e succinato foram
detectados em neutrófilos COVID-19 em comparação com neutrófilos Deficiência de glicose-6-fosfato desidrogenase (G6PD) A
de controle saudáveis. deficiência de G6PD é um
Curiosamente, o acúmulo de succinato citosólico resultou na distúrbio enzimático hereditário caracterizado por uma diminuição na
diminuição da quebra de HIF-1a (222) e, portanto, aumentou os níveis produção de NADPH, resultando em depleção de glutationa e anemia
citosólicos de HIF-1a em neutrófilos COVID-19 (124). hemolítica (3, 227, 228).
O aumento da proporção citosólica de lactato:piruvato foi revelado A G6PD é necessária para a mudança do metabolismo celular da
como uma alteração metabólica fundamental, sugerindo uma mudança glicólise para PPP (229). Além disso, a atividade de G6PD é aumentada
para a glicólise nos neutrófilos do COVID-19 (124). A glicólise e a após a estimulação de PMA em neutrófilos e muda o metabolismo
produção de lactato são processos cruciais no desenvolvimento das para a via PPP, resultando em aumento da formação de NET. Por
respostas antimicrobianas dos neutrófilos (43, 176). O aumento da outro lado, na ausência de atividade de G6PD, o metabolismo de PPP
atividade glicolítica dos neutrófilos do COVID-19 pode fornecer uma e a formação de NET são diminuídos (58). Neutrófilos exibindo
explicação mecanicista para o aumento da formação espontânea de deficiência de G6PD, semelhante à CGD leve, mostraram atividade
NET por neutrófilos isolados de pacientes com COVID-19 grave (209, microbicida e metabólica prejudicada (107). Normalmente, a atividade
210). No entanto, também foram relatados resultados contrastantes bactericida e a função dos neutrófilos não são prejudicadas em
que sugerem um fluxo glicolítico prejudicado e metabolismo oxidativo neutrófilos com deficiência leve de G6PD (108, 109).
em neutrófilos isolados de pacientes com COVID-19 com sintomas de No entanto, em pacientes com deficiência enzimática grave, foi
SDRA (223). Atualmente, as razões para esses achados diferentes observada redução da atividade de G6PD, aumento da suscetibilidade
permanecem obscuras. a infecções devido à redução da geração de NADPH e subsequente
formação de NET prejudicada (109). Curiosamente, a rápida renovação
Sepse A dos neutrófilos e os níveis flutuantes diurnos da atividade de G6PD
sepse é uma síndrome inflamatória sistêmica caracterizada por são suficientes para induzir uma explosão respiratória efetiva (230).
comprometimento da migração e das funções dos neutrófilos (3). A Além disso, sugere-se que a biossíntese de nucleotídeos de
expressão reduzida do receptor de quimiocina CXCR2, do receptor nicotinamida seja suficiente para compensar a deficiência de G6PD,
quinase GPCR e a polimerização de actina prejudicada causam resultando em taxas comparáveis de formação de NET em pacientes
quimiotaxia de neutrófilos defeituosa na sepse (224, 225). Além disso, com G6PD e controles saudáveis (231) (Tabela 1).
a atividade mitocondrial prejudicada, o grande complexo V (síntese de
ATP) e o complexo ETC III e IV foram associados à disfunção da
CONCLUSÕES Os
quimiotaxia de neutrófilos conduzida por LPS em condições sépticas
(113). Foi relatado que o aumento da autofagia em associação com a neutrófilos são capazes de se adaptar ao ambiente tecidual em
formação aumentada de NET melhora a sobrevida de pacientes com condições patológicas, modificando sua atividade metabólica utilizando
sepse (116). A indução da autofagia durante a sepse leva ao diversas vias metabólicas. Um aumento da atividade mitocondrial e
rejuvenescimento funcional da população de neutrófilos e à alteração sua contribuição dentro de uma rede de vias metabólicas de neutrófilos
do metabolismo dos neutrófilos por meio da produção de produtos demonstraram ser críticos para funções antibacterianas mediadas por
intermediários (116). Por outro lado, os níveis aumentados de NET neutrófilos. Alterações patológicas dessas vias contribuem para a
estão associados ao aumento da gravidade da sepse e subsequente doença, resultando em imunodeficiência ou respostas inflamatórias
dano aos órgãos (111, 117). Os NETs são acompanhados de disfunção aceleradas.
da barreira intestinal, ativação do estresse do RE e produção de ROS O mecanismo molecular de formação de NET depende fortemente de
em pacientes com sepse, levando ao aumento da proteína de ligação um metabolismo celular intacto em neutrófilos.
de ácidos graxos intestinais séricos (I-FABP) e D-lactato que se
correlaciona positivamente com a formação de NET, indicando que CONTRIBUIÇÕES DO AUTOR Conceituação:
ácidos graxos e lipídios o metabolismo pode ser necessário para a
DS, SY e H-US. Metodologia: DS, LG e SP. Investigação: DS, LG e
maturação dos neutrófilos durante a sepse (Figura 5) (63, 119).
SP. Visualização: DS, LG, SP e SY. Aquisição de financiamento: SY e
Além disso, a síntese lipídica peroxissômica regulou a inflamação
H-US. Administração de projetos: DS, SY e H-US. Supervisão: SY e H-
sustentando a composição e a viabilidade dos fosfolipídios da
US.
membrana dos neutrófilos (110). A expressão aumentada de G6PD e
Redação – rascunho original: DS, SY e H-US. Redação – revisão e
fosfogluconato desidrogenase também sugere uma via de PPP
edição: DS, RL, PR, AK, AR, NB, SY e H-US. Todos os autores
induzida (Figura 2) (114, 118). Além disso, o ATP plasmático é
contribuíram com o artigo e aprovaram a versão submetida.
necessário para a ativação dos neutrófilos durante a sepse (226),
enquanto o ATP sistêmico reduz a ativação dos neutrófilos e a
quimiotaxia através da interrupção dos mecanismos endógenos de FINANCIAMENTO
sinalização purinérgica (115). Consequentemente, o bloqueio da
sinalização endógena de ATP pela suramina, um antagonista do Swiss National Science Foundation, concessão nº 31003A_173215
receptor P2, aumenta o crescimento bacteriano e a mortalidade, (SY); Swiss National Science Foundation, conceder No.
enquanto a apirase, uma ATP difosfatase, melhora a sobrevida na sepse 310030_184816 (H-US); Programa do Governo Russo
Fronteiras em Imunologia | www.frontiersin.org 13 Fevereiro 2022 | Volume 13 | Artigo 826515
Machine Translated by Google
Stojkov et ai. As vias metabólicas regulam a formação de NET
“Recrutamento dos principais cientistas nas instituições russas de ensino (H-US). A AR foi parcialmente apoiada pelo Programa de Liderança
superior”, concessão nº 075-15-2021-600 Acadêmica Estratégica da Universidade Federal de Kazan (KFU).
20. Mcilroy DJ, Jarnicki AG, Au GG, Lott N, Smith DW, Hansbro PM, et al.
REFERÊNCIAS
Armadilhas extracelulares de neutrófilos de DNA mitocondrial são formadas após
1. Bouma G, Ancliff PJ, Thrasher AJ, Burns SO. Avanços recentes na compreensão dos trauma e cirurgia subsequente. J Crit Care (2014) 29:1133.e1131–1135. doi: 10.1016/
defeitos genéticos do número e função dos neutrófilos. Br J Haematol (2010) 151:312– j.jcrc.2014.07.013 21. Wang H, Li
26. doi: 10.1111/j.1365-2141.2010.08361.x 2. Leliefeld PH, Wessels CM, T, Chen S, Gu Y, Ye S. Armadilha extracelular de neutrófilos DNA mitocondrial e seu
Leenen LP, Koenderman L, Pillay J. O Papel dos Neutrófilos na Disfunção Imune Durante autoanticorpo no lúpus eritematoso sistêmico e um teste de prova de conceito da
Inflamação Grave. Crit Care (2016) 20:73. doi: 10.1186/s13054-016-1250-4 metformina . Arthritis Rheumatol (2015) 67:3190–200. doi: 10.1002/art.39296 22. Amini
P, Stojkov D, Wang X, Wicki S, Kaufmann T, Wong WW, et al.
3. Kumar S, Dikshit M. Insight metabólico de neutrófilos na saúde e na doença. Front NET pode ocorrer independentemente da sinalização RIPK3 e MLKL. Eur J Immunol (2016)
Immunol (2019) 10:2099. doi: 10.3389/fimmu.2019.02099 4. Tak T, Tesselaar K, 46:178–84. doi: 10.1002/eji.201545615 23. Caielli S, Athale S, Domic B, Murat E,
Pillay J, Borghans JA, Koenderman L. Qual é a sua idade mesmo? Determinação das Chandra M, Banchereau R, et al.
meias-vidas de neutrófilos humanos revisitada. J Leukoc Biol (2013) 94:595–601. doi:
10.1189/jlb.1112571 5. Lahoz-Beneytez J, Elemans M, Nucleóides mitocondriais oxidados liberados por neutrófilos impulsionam a produção
Zhang Y, Ahmed R, Salam A, Block M, et al. de interferon tipo I no lúpus humano. J Exp Med (2016) 213:697–713. doi: 10.1084/
Cinética de neutrófilos humanos: modelagem de dados de marcação de isótopos jem.20151876 24. Lood
estáveis suporta meias-vidas curtas de neutrófilos no sangue. Sangue (2016) 127:3431– C, Blanco LP, Purmalek MM, Carmona-Rivera C, De Ravin SS, Smith CK, et al. Armadilhas
8. doi: 10.1182/sangue-2016-03-700336 extracelulares de neutrófilos enriquecidas com DNA mitocondrial oxidado são
6. Hidalgo A, Chilvers ER, Summers C, Koenderman L. O ciclo de vida dos neutrófilos. interferogênicas e contribuem para doenças semelhantes ao lúpus. Nat Med (2016)
Trends Immunol (2019) 40:584–97. doi: 10.1016/j.it.2019.04.013 7. Mantovani A, 22:146–53. doi: 10.1038/nm.4027 25. Ingelsson B, Soderberg D,
Cassatella MA, Costantini C, Jaillon S. Neutrófilos na ativação e regulação da imunidade Strid T, Soderberg A, Bergh AC, Loitto V, et al.
inata e adaptativa. Nat Rev Immunol (2011) 11:519–31. doi: 10.1038/nri3024 8. Stojkov Os linfócitos ejetam teias de DNA mitocondrial interferogênico em resposta a
D, Amini P, Oberson K, Sokollik C, Duppenthaler A, oligodesoxinucleotídeos Cpg e não Cpg da classe C. Proc Natl Acad Sci USA (2018)
Simon HU, et al. 115:E478–87. doi: 10.1073/pnas.1711950115 26. Cristinziano L,
ROS e glutationa equilibram a dinâmica do citoesqueleto na formação de armadilhas Modestino L, Loffredo S, Varricchi G, Braile M, Ferrara AL, et al. Células anaplásicas de
extracelulares de neutrófilos. J Cell Biol (2017) 216:4073–90. doi: 10.1083/jcb.201611168 câncer de tireoide induzem a liberação de armadilhas de DNA extracelular mitocondrial
por neutrófilos viáveis. J Immunol (2020) 204:1362–72. doi: 10.4049/jimmunol.1900543
9. Amini P, Stojkov D, Felser A, Jackson CB, Courage C, Schaller A, et al. 27. Klopf J, Brostjan C, Eilenberg W, Neumayer C.
A formação de armadilhas extracelulares de neutrófilos requer produção de ATP Armadilhas extracelulares de neutrófilos e suas implicações em doenças cardiovasculares e
glicolítico dependente de OPA1. Nat Commun (2018) 9:2958. doi: 10.1038/ inflamatórias.
s41467-018-05387-y Int J Mol Sci (2021) 22:559. doi: 10.3390/ijms22020559 28. Von
10. Dahlgren C, Karlsson A, Bylund J. Intracelular Neutrophil Oxidants: From Laboratory Kockritz-Blickwede M, Goldmann O, Thulin P, Heinemann K, Norrby Teglund A, Rohde M,
Curiosity to Clinical Reality. J Immunol (2019) 202:3127–34. doi: 10.4049/ et al. Atividade antimicrobiana independente de fagocitose de mastócitos por meio da
jimmunol.1900235 formação de armadilhas extracelulares. Sangue (2008) 111:3070–80. doi: 10.1182/
11. Faurschou M, Sorensen OE, Johnsen AH, Askaa J, Borregaard N. Defensin Rich blood-2007-07-104018 29. Yousefi S, Gold JA, Andina N, Lee JJ,
Granules of Human Neutrophils: Characterization of Secretory Properties. Biochim Kelly AM, Kozlowski E, et al. A liberação tipo catapulta de DNA mitocondrial por eosinófilos
Biophys Acta (2002) 1591:29–35. doi: 10.1016/S0167-4889(02)00243-4 contribui para a defesa antibacteriana. Nat Med (2008) 14:949–53. doi: 10.1038/
nm.1855 30. Chow OA, Von Kockritz-Blickwede M, Bright AT, Hensler ME,
12. Borregaard N, Sørensen OE, Theilgaard-Mönch K. Neutrophil Granules: A Library of Zinkernagel AS, Cogen AL, et al. As estatinas aumentam a formação de armadilhas
Innate Immunity Proteins. Trends Immunol (2007) 8:340–5. doi: 10.1016/j.it.2007.06.002 extracelulares de fagócitos. Cell Host Microbe (2010) 8:445–54. doi: 10.1016/
j.chom.2010.10.005 31. Simon D, Hoesli S, Roth N, Staedler S, Yousefi S, Simon HU.
13. Lawrence SM, Corriden R, Nizet V. A ontogenia de um neutrófilo: Mecanismos de Armadilhas de DNA extracelular de eosinófilos em doenças de pele. J Allergy Clin Immunol
granulopoiese e homeostase. Microbiol Mol Biol Rev (2018) 82:e00057–00017. doi: (2011) 127:194–9. doi: 10.1016/j.jaci.2010.11.002
10.1128/MMBR.00057-17 14. Witko-Sarsat V, Rieu P, Descamps-
Latscha B, Lesavre P, Halbwachs Mecarelli L. Neutrófilos: Moléculas, Funções F e Aspectos 32. Morshed M, Yousefi S, Stockle C, Simon HU, Simon D. Thymic Stromal Lymphopoietin
Fisiopatológicos. Lab Invest (2000) 5:617–53. doi: 10.1038/labinvest.3780067 15. estimula a formação de armadilhas extracelulares de eosinófilos.
Hatanaka E, Shimomi FM, Curi R, Campa A. Cloreto de sódio inibe a produção Allergy (2012) 67:1127–37. doi: 10.1111/j.1398-9995.2012.02868.x 33.
de citocinas por neutrófilos humanos estimulados por lipopolissacarídeos e células Morshed M, Hlushchuk R, Simon D, Walls AF, Obata-Ninomiya K, Karasuyama H, et al.
mononucleares. Choque (2007) 1:32–5. doi: 10.1097/ 01.shk.0000238061.69579.a5 Formação independente de NADPH Oxidase de armadilhas de DNA extracelular por
basófilos. J Immunol (2014) 192:5314–23. doi: 10.4049/jimmunol.1303418 34. Yousefi
S, Morshed M, Amini P, Stojkov D,
16. Selvatici R, Falzarano S, Mollica A, Spisani S. Vias de transdução de sinal desencadeadas Simon D, Von Gunten S, et al.
por análogos de formilpeptídeos seletivos em neutrófilos humanos. Eur J Pharmacol Os basófilos exibem atividade antibacteriana através da formação de armadilhas
(2006) 534:1–11. doi: 10.1016/j.ejphar.2006.01.034 17. Brinkmann V, extracelulares. Alergia (2015) 70:1184–8. doi: 10.1111/all.12662 35.
Reichard U, Goosmann C, Fauler B, Uhlemann Y, Weiss DS, et al. Armadilhas Extracelulares Germic N, Fettrelet T, Stojkov D, Hosseini A, Horn MP, Karaulov A, et al.
de Neutrófilos Matam Bactérias. Ciência (2004) 303:1532–5. doi: 10.1126/ A cinética de liberação da peroxidase eosinófila e do DNA mitocondrial é diferente em
science.1092385 associação com a formação da armadilha extracelular eosinófila. Células (2021) 10:306.
18. Clark SR, Ma AC, Tavener SA, Mcdonald B, Goodarzi Z, Kelly MM, et al. doi: 10.3390/cells10020306
A plaqueta TLR4 ativa armadilhas extracelulares de neutrófilos para capturar bactérias 36. Maugeri N, Campana L, Gavina M, Covino C, De Metrio M, Panciroli C, et al.
em sangue séptico. Nat Med (2007) 13:463–9. doi: 10.1038/nm1565 19. Plaquetas Ativadas Apresentam Caixa 1 do Grupo de Alta Mobilidade aos Neutrófilos,
Yousefi S, Mihalache C, Kozlowski E, Schmid I, Simon HU. Neutrófilos viáveis liberam DNA Induzindo Autofagia e Promovendo a Extrusão de Armadilhas Extracelulares de
mitocondrial para formar armadilhas extracelulares de neutrófilos. Cell Death Differ Neutrófilos. J Thromb Haemost (2014) 12:2074–88. doi: 10.1111/ jth.12710
(2009) 16:1438–44. doi: 10.1038/cdd.2009.96
Fronteiras em Imunologia | www.frontiersin.org 14 Fevereiro 2022 | Volume 13 | Artigo 826515
Machine Translated by Google
Stojkov et ai. As vias metabólicas regulam a formação de NET
37. Kolaczkowska E, Jenne CN, Surewaard BG, Thanabalasuriar A, Lee WY, Sanz MJ, et al. 57. Han J, Thompson-Lowrey AJ, Reiss A, Mayorov V, Jia H, Biousse V, et al.
Mecanismos moleculares de formação e degradação de NET revelados por imagem Mutações OPA1 e Haplótipos do DNA Mitocondrial na Atrofia Óptica Autossômica
intravital na vasculatura hepática. Nat Commun (2015) 6:6673. doi: 10.1038/ncomms7673 Dominante. Genet Med (2006) 8:217–25. doi: 10.1097/ 01.gim.0000214299.61930.c0
58. Azevedo EP, Rochael NC,
38. Kenny EF, Herzig A, Kruger R, Muth A, Mondal S, Thompson PR, et al. Guimarães-Costa AB, De Souza-Vieira TS, Ganilho J, Saraiva EM, et al. Uma mudança
Diversos estímulos envolvem diferentes vias de armadilhas extracelulares de neutrófilos. metabólica em direção à via de fosfato de pentose é necessária para a formação de
Elife (2017) 6:e24437. doi: 10.7554/eLife.24437 39. armadilha extracelular de neutrófilos (NET) induzida por acetato de fibrila amilóide e
Knackstedt SL, Georgiadou A, Apel F, Abu-Abed U, Moxon CA, Cunnington AJ, et al. As forbol 12-miristato 13-acetato. J Biol Chem (2015) 290:22174–83. doi: 10.1074/
Armadilhas Extracelulares de Neutrófilos Impulsionam a Patogênese Inflamatória na jbc.M115.640094 59. Six E, Lagresle-Peyrou C, Susini S, De
Malária. Sci Immunol (2019) 4:eaaw0336. doi: 10.1126/sciimmunol.aaw0336 40. Fuchs Chappedelaine C, Sigrist N, Sadek H, et al. A deficiência de AK2 compromete o metabolismo
TA, Abed U, Goosmann energético mitocondrial necessário para a diferenciação de linhagens humanas de
C, Hurwitz R, Schulze I, Wahn V, et al. Novo programa de morte celular leva a armadilhas neutrófilos e linfóides.
extracelulares de neutrófilos. J Cell Biol (2007) 176:231–41. doi: 10.1083/jcb.200606027 Cell Death Dis (2015) 6:e1856. doi: 10.1038/cddis.2015.211 60.
41. Parker H, Dragunow M, Hampton MB, Kettle AJ, Jones R, Mcdonald KE, Willson JA, Ghesquiere B, Sammut D, Daniel E, et al.
Winterbourn CC. Mutações na Succinato Desidrogenase B (SDHB) Aumentam a Sobrevivência de
Os requisitos para NADPH Oxidase e Mieloperoxidase na formação de armadilhas Neutrófilos Independente da Expressão de HIF-1alfa. Sangue (2016) 127:2641–4. doi:
extracelulares de neutrófilos diferem dependendo do estímulo. J Leukoc Biol (2012) 10.1182/blood-2016-02-696922 61.
92:841–9. doi: 10.1189/jlb.1211601 42. Yang H, Riffelmacher T, Clarke A, Richter FC, Stranks A, Pandey S, Danielli S, et al.
Biermann MH, Brauner JM, Liu Y, Zhao Y, Herrmann M. Novos insights sobre armadilhas A geração dependente de autofagia de ácidos graxos livres é crítica para a diferenciação
extracelulares de neutrófilos: mecanismos de formação e papel na inflamação. Front normal de neutrófilos. Imunidade (2017) 47:466–80.e465. doi: 10.1016/
Immunol (2016) 7:302. doi: 10.3389/fimmu.2016.00302 j.immuni.2017.08.005 62.
Richer BC, Salei N, Laskay T, Seeger K. Alterações no metabolismo de neutrófilos após
43. Rodriguez-Espinosa O, Rojas-Espinosa O, Moreno-Altamirano MM, Lopez Villegas EO, ativação e envelhecimento. Inflamação (2018) 41:710–21. doi: 10.1007/s10753-017-0725-
Sanchez-Garcia FJ. Requisitos metabólicos para a formação de armadilhas extracelulares z
de neutrófilos. Immunology (2015) 145:213–24. doi: 10.1111/imm.12437 63. Sbarra AJ, Karnovsky ML. A base bioquímica da fagocitose. EU.
Alterações Metabólicas Durante a Ingestão de Partículas por Leucócitos
44. Gibellini L, De Biasi S, Paolini A, Borella R, Boraldi F, Mattioli M, et al. Polimorfonucleares. J Biol Chem (1959) 234:1355–62. doi: 10.1016/S0021-9258(18)70011-2
Bioenergética alterada e disfunção mitocondrial de monócitos em pacientes com 64. Jeon JH, Hong CW, Kim EY, Lee
pneumonia por COVID-19. EMBO Mol Med (2020) 12:e13001. doi: 10.15252/ JM. Compreensão atual sobre o metabolismo de neutrófilos. Immune Netw (2020) 20:e46.
emmm.202013001 doi: 10.4110/ in.2020.20.e46
45. Fox CJ, Hammerman PS, Thompson CB. Função de Alimentação de Combustível:
Metabolismo Energético e Resposta das Células T. Nat Rev Immunol (2005) 5:844–52. 65. Weisdorf DJ, Craddock PR, Jacob HS. Os granulócitos utilizam diferentes fontes de
doi: 10.1038/nri1710 energia para movimento e fagocitose. Inflamação (1982) 6:245–56. doi: 10.1007/
46. Bordbar A, Mo ML, Nakayasu ES, Schrimpe-Rutledge AC, Kim YM, Metz TO, et al. Análise BF00916406
de Dados Multi-Omic Orientada por Modelo Elucida Imunomoduladores Metabólicos da 66. Alba-Loureiro TC, Hirabara SM, Mendonça JR, Curi R, Pithon-Curi TC. Diabetes Causa
Ativação de Macrófagos. Mol Syst Biol (2012) 8:558. doi: 10.1038/msb.2012.21 Mudanças Marcadas na Função e Metabolismo de Neutrófilos de Ratos. J Endocrinol
(2006) 188:295–303. doi: 10.1677/joe.1.06438
47. O'Neill LA, Hardie DG. Metabolismo da Inflamação Limitada pela AMPK e Pseudo-
Inanição. Nature (2013) 493:346–55. doi: 10.1038/nature11862 48. Pearce EL, 67. Gaber T, Strehl C, Buttgereit F. Regulação metabólica da inflamação. Nat Rev Rheumatol
Pearce EJ. Vias metabólicas na ativação e quiescência de células imunes. Imunidade (2013) (2017) 13:267–79. doi: 10.1038/nrrheum.2017.37 68. Curi TC, De Melo MP,
38:633–43. doi: 10.1016/j.immuni.2013.04.005 49. Borregaard N, Herlin T. Metabolismo De Azevedo RB, Curi R. Glutamine Utilization by Rat Neutrophils. Biochem Soc Trans (1997)
energético de neutrófilos humanos durante a fagocitose. J Clin Invest (1982) 70:550–7. doi: 25:249S. doi: 10.1042/bst025249s 69. Curi R, Newsholme P, Pithon-Curi TC, Pires-
10.1172/JCI110647 50. Van Raam BJ, Sluiter W, De Wit E, Roos D, Verhoeven De-Melo M, Garcia C, Homem-De-Bittencourt Junior PI, et al. Destino metabólico da glutamina
AJ, Kuijpers TW. em linfócitos, macrófagos e neutrófilos. Braz J Med Biol Res (1999) 32:15–21. doi:
O potencial da membrana mitocondrial em neutrófilos humanos é mantido pela atividade 10.1590/S0100-879X1999000100002
do complexo III na ausência de organização supercomplexa. PloS One (2008) 3:e2013.
doi: 10.1371/journal.pone.0002013 51. Zucker-Franklin D. 70. Newsholme P. Por que o metabolismo da L-Glutamina é importante para as células do
Estudos microscópicos eletrônicos de granulócitos humanos: variações estruturais sistema imunológico na saúde, pós-lesão, cirurgia ou infecção? J Nutr (2001)
relacionadas à função. Semin Hematol (1968) 5:109–33. 131:2515S–22S. discussão 2523S-2514S. doi: 10.1093/jn/131.9.2515S 71.
52. Bainton DF, Ullyot JL, Farquhar MG. O desenvolvimento de leucócitos polimorfonucleares Mecklenburgh KI, Walmsley SR, Cowburn AS, Wiesener M, Reed BJ, Upton PD, et al.
neutrofílicos na medula óssea humana. J Exp Med (1971) 134:907–34. doi: 10.1084/ Envolvimento de um sensor de ferroproteína na inibição da apoptose de neutrófilos
jem.134.4.907 mediada por hipóxia. Sangue (2002) 100:3008–16. doi: 10.1182/sangue-2002-02-0454
53. Fossati G, Molding DA, Spiller DG, Moots RJ, White MR, Edwards SW.
A Rede Mitocondrial de Neutrófilos Humanos: Papel na Quimiotaxia, Fagocitose, 72. Walmsley SR, Print C, Farahi N, Peyssonnaux C, Johnson RS, Cramer T, et al. A
Ativação de Explosão Respiratória e Compromisso com a Apoptose. sobrevivência de neutrófilos induzida por hipóxia é mediada pela atividade de NF-
J Immunol (2003) 170:1964–72. doi: 10.4049/jimmunol.170.4.1964 54. Karinch Kappab dependente de HIF-1alpha. J Exp Med (2005) 201:105–15. doi: 10.1084/
AM, Pan M, Lin CM, Strange R, Souba WW. Metabolismo da Glutamina na Sepse e Infecção. jem.20040624
J Nutr (2001) 131:2535S–8S. discussão 2550S-2531S. doi: 10.1093/jn/131.9.2535S 73. Graeber TG, Osmanian C, Jacks T, Housman DE, Koch CJ, Lowe SW, et al.
Seleção mediada por hipóxia de células com potencial apoptótico diminuído em tumores
55. Cipolat S, Rudka T, Hartmann D, Costa V, Serneels L, Craessaerts K, et al. sólidos. Nature (1996) 379:88–91. doi: 10.1038/379088a0
O PARL romboide mitocondrial regula a liberação do citocromo C durante a apoptose 74. Cramer T, Yamanishi Y, Clausen BE, Forster I, Pawlinski R, Mackman N, et al. O
por meio da remodelação de cristais dependentes de OPA1. Cell (2006) 126:163– 75. HIF-1alpha é essencial para a inflamação mediada por células mieloides. Cell (2003)
doi: 10.1016/j.cell.2006.06.021 56. 112:645–57. doi: 10.1016/S0092-8674(03)00154-5 75. Cheng SC,
Frezza C, Cipolat S, Martins De Brito O, Micaroni M, Beznoussenko GV, Rudka T, et al. Quintin J, Cramer RA, Shepardson KM, Saeed S, Kumar V, et al.
OPA1 controla a remodelação da crista apoptótica independentemente da fusão Glicólise aeróbica mediada por Mtor e HIF-1alpha como base metabólica para imunidade
mitocondrial. Cell (2006) 126:177–89. doi: 10.1016/ j.cell.2006.06.025 treinada. Science (2014) 345:1250684. doi: 10.1126/ science.1250684
Fronteiras em Imunologia | www.frontiersin.org 15 Fevereiro 2022 | Volume 13 | Artigo 826515
Machine Translated by Google
Stojkov et ai. As vias metabólicas regulam a formação de NET
76. Semenza GL, Roth PH, Fang HM, Wang GL. Regulação da transcrição de genes que Crescimento do Câncer e Resistência à Radioterapia. Cancer Res (2021) 81:2345–
codificam enzimas glicolíticas por fator induzível por hipóxia 1. J Biol Chem (1994) 57. doi: 10.1158/0008-5472.CAN-20-2870
269:23757–63. doi: 10.1016/S0021-9258(17)31580-6 77. Halligan DN, 95. Rogers T, DeBerardinis RJ. Plasticidade metabólica de neutrófilos: relevância para
Murphy SJ, Taylor CT. O Fator Induzível por Hipóxia (HIF) respostas de patógenos e câncer. Trends Cancer (2021) 7:700–13. doi: 10.1016/
Casais Imunidade Com Metabolismo. Semin Immunol (2016) 28:469–77. doi: j.trecan.2021.04.007
10.1016/j.smim.2016.09.004 78. 96. Denny MF, Yalavarthi S, Zhao W, Thacker SG, Anderson M, Sandy AR, et al.
McInturff AM, Cody MJ, Elliott EA, Glenn JW, Rowley JW, Rondina MT, et al. O alvo Um subconjunto distinto de neutrófilos pró-inflamatórios isolados de pacientes com
mamífero da rapamicina regula a formação de armadilhas extracelulares de lúpus eritematoso sistêmico induz dano vascular e sintetiza ifns tipo I. J Immunol
neutrófilos por meio da indução do fator 1 alfa induzível por hipóxia. Sangue (2012) (2010) 184:3284–97. doi: 10.4049/jimmunol.0902199
120:3118–25. doi: 10.1182/sangue-2012-01-405993
79. Vollger L, Akong-Moore K, Cox L, Goldmann O, Wang Y, Schafer ST, et al. 97. Hakkim A, Furnrohr BG, Amann K, Laube B, Abed UA, Brinkmann V, et al.
Agente quelante de ferro Desferrioxamina estimula a formação de armadilhas O comprometimento da degradação da armadilha extracelular de neutrófilos está
extracelulares de neutrófilos (redes) em neutrófilos derivados do sangue humano. associado à nefrite lúpica. Proc Natl Acad Sci USA (2010) 107:9813–8. doi: 10.1073/
Biosci Rep (2016) 36:e00333. doi: 10.1042/BSR20160031 pnas.0909927107
80. Branitzki-Heinemann K, Mollerherm H, Vollger L, Husein DM, De Buhr N, Blodkamp 98. Villanueva E, Yalavarthi S, Berthier CC, Hodgin JB, Khandpur R, Lin AM, et al.
S, et al. Formação de Armadilhas Extracelulares de Neutrófilos Sob Baixo Nível de Neutrófilos de rede induzem dano endotelial, infiltram tecidos e expõem moléculas
Oxigênio. Front Immunol (2016) 7:518. doi: 10.3389/fimmu.2016.00518 81. imunoestimulantes no lúpus eritematoso sistêmico. J Immunol (2011) 187:538–52.
Thompson AA, Elks PM, Marriott HM, Eamsamarng S, Higgins KR, Lewis A, et al. O fator doi: 10.4049/jimmunol. 1100450
2alfa induzível por hipóxia regula as principais funções dos neutrófilos em humanos,
camundongos e peixes-zebra. Sangue (2014) 123:366–76. doi: 10.1182/ 99. Knight JS, Kaplan MJ. Neutrófilos do lúpus: ganho 'NET' na compreensão da
blood-2013-05-500207 82. patogênese do lúpus. Curr Opin Rheumatol (2012) 24:441–50. doi: 10.1097/
Stincone A, Prigione A, Cramer T, Wamelink MM, Campbell K, Cheung E, et al. O BOR.0b013e3283546703
Retorno do Metabolismo: Bioquímica e Fisiologia da Via Pentose Fosfato. Biol Rev 100. Li KJ, Wu CH, Hsieh SC, Lu MC, Tsai CY, Yu CL. Bioenergética alterada e capacidade
Camb Philos Soc (2015) 90:927–63. doi: 10.1111/brv.12140 redox defeituosa em linfócitos T e neutrófilos estão relacionadas à disfunção celular
e aumento do estresse oxidativo em pacientes com lúpus eritematoso sistêmico
83. Tibrewal S, Ivanir Y, Sarkar J, Nayeb-Hashemi N, Bouchard CS, Kim E, et al. ativo. Clin Dev Immunol (2012) 2012:548516. doi: 10.1155/2012/548516
O Estresse Hiperosmolar Induz a Formação de Armadilhas Extracelulares de
Neutrófilos: Implicações para a Doença do Olho Seco. Invest Ophthalmol Vis Sci 101. Mahajan A, Herrmann M, Munoz LE. Deficiência de depuração e vias de morte
(2014) 55:7961–9. doi: 10.1167/iovs.14-15332 celular: um modelo para a patogênese do LES. Front Immunol (2016) 7:35. doi:
84. Menegazzo L, Ciciliot S, Poncina N, Mazzucato M, Persano M, Bonora B, et al. A 10.3389/fimmu.2016.00035
netose é induzida por glicose alta e associada ao diabetes tipo 2. Acta Diabetol 102. Fresneda Alarcon M, Mclaren Z, Wright HL. Neutrophils in the Pathogenesis of
(2015) 52:497–503. doi: 10.1007/s00592-014-0676-x 85. Wong SL, Demers M, Rheumatoid Arthritis and Systemic Lupus Erythematosus: Same Foe Different MO
Martinod K, Gallant M, Wang Y, Goldfine AB, et al. Front Immunol (2021) 12:649693. doi: 10.3389/fimmu.2021.649693
Diabetes prepara neutrófilos para sofrer netose, o que prejudica a cicatrização de
feridas. Nat Med (2015) 21:815–9. doi: 10.1038/nm.3887 86. 103. Cross A, Bucknall RC, Cassatella MA, Edwards SW, Moots RJ. Os neutrófilos do
Park JH, Kim JE, Gu JY, Yoo HJ, Park SH, Kim YI, et al. Avaliação de Marcadores líquido sinovial transcrevem e expressam moléculas do complexo principal de
Circulantes de Formação de Armadilha Extracelular de Neutrófilos (NET) como histocompatibilidade de classe II na artrite reumatóide. Arthritis Rheum (2003)
Fatores de Risco para Retinopatia Diabética em um Estudo de Associação de Caso-Controle. 48:2796–806. doi: 10.1002/art.11253
Exp Clin Endocrinol Diabetes (2016) 124:557–61. doi: 10.1055/s-0042-101792 104. Khandpur R, Carmona-Rivera C, Vivekanandan-Giri A, Gizinski A, Yalavarthi S,
Knight JS, et al. Redes são uma fonte de autoantígenos citrulinados e estimulam
87. Barliya T, Dardik R, Nisgav Y, Dachbash M, Gaton D, Kenet G, et al. Possível respostas inflamatórias na artrite reumatóide. Sci Transl Med (2013) 5:178ra140.
Envolvimento de Netose em Processos Inflamatórios no Olho: Evidências de uma doi: 10.1126/ scitranslmed.3005580
Pequena Coorte de Pacientes. Mol Vis (2017) 23:922–32.
88. Wang L, Zhou X, Yin Y, Mai Y, Wang D, Zhang X. A hiperglicemia induz a formação 105. Sur Chowdhury C, Giaglis S, Walker UA, Buser A, Hahn S, Hasler P.
de armadilhas extracelulares de neutrófilos através de uma via dependente de Geração aprimorada de armadilhas extracelulares de neutrófilos na artrite reumatóide:
NADPH Oxidase na retinopatia diabética. Front Immunol (2018) 9:3076. doi: 10.3389/ análise das vias subjacentes de transdução de sinal e potencial utilidade diagnóstica.
fimmu.2018.03076 89. Arthritis Res Ther (2014) 16:R122. doi: 10.1186/ar4579
D'Abbondanza M, Martorelli EE, Ricci MA, De Vuono S, Migliola EN, Godino C, et al.
Subprodutos de Redes Plasmáticas Aumentadas em Pacientes com Obesidade 106. Carmona-Rivera C, Carlucci PM, Goel RR, James E, Brooks SR, Rims C, et al.
Grave. Sci Rep (2019) 9:14678. doi: 10.1038/s41598-019-51220-x 90. Armadilhas extracelulares de neutrófilos medeiam danos à cartilagem articular e
Cichon I, Ortmann W, Kolaczkowska E. Caminhos metabólicos envolvidos na formação aumentam a imunogenicidade dos componentes da cartilagem na artrite reumatóide.
de armadilhas extracelulares de neutrófilos espontâneas e induzidas por JCI Insight (2020) 5:e139388. doi: 10.1172/jci.insight.139388 107.
lipopolissacarídeos (redes) diferem em obesidade e inflamação sistêmica. Gray GR, Stamatoyannopoulos G, Naiman SC, Kliman MR, Klebanoff SJ, Austin T, et al.
Int J Mol Sci (2021) 22:7718. doi: 10.3390/ijms22147718 91. Disfunção neutrofílica, doença granulomatosa crônica e anemia hemolítica não
Rice CM, Davies LC, Subleski JJ, Maio N, Gonzalez-Cotto M, Andrews C, et al. Os esferocítica causada por deficiência completa de glicose-6-fosfato desidrogenase.
neutrófilos provocados pelo tumor envolvem o metabolismo mitocondrial para Lancet (1973) 2:530-4. doi: 10.1016/S0140-6736(73)92350-7
contornar as limitações de nutrientes e manter a supressão imunológica. Nat
Commun (2018) 9:5099. doi: 10.1038/s41467-018-07505-2 108. Ardati KO, Bajakian KM, Tabbara KS. Efeito da deficiência de glicose-6-fosfato
92. Hsu BE, Tabaries S, Johnson RM, Andrzejewski S, Senecal J, Lehuede C, et al. desidrogenase na função dos neutrófilos. Acta Haematol (1997) 97:211–5. doi:
Neutrófilos imaturos de baixa densidade exibem flexibilidade metabólica que facilita 10.1159/000203685
a metástase hepática do câncer de mama. Cell Rep (2019) 27:3902– 15.e3906. doi: 109. Siler U, Romão S, Tejera E, Pastukhov O, Kuzmenko E, Valencia RG, et al.
10.1016/j.celrep.2019.05.091 Deficiência grave de glicose-6-fosfato desidrogenase leva à suscetibilidade à
93. Yazdani HO, Roy E, Comerci AJ, van der Windt DJ, Zhang H, Huang H, et al. infecção e à ausência de netose. J Allergy Clin Immunol (2017) 139:212–219 e213.
Armadilhas extracelulares de neutrófilos impulsionam a homeostase mitocondrial doi: 10.1016/j.jaci.2016.04.041 110. Lodhi IJ, Wei X, Yin L,
em tumores para aumentar o crescimento. Câncer Res (2019) 79:5626–39. doi: 10.1158/ Feng C, Adak S, Abou-Ezzi G, et al. A síntese de lipídios peroxissômicos regula a
0008-5472.CAN-19-0800 inflamação sustentando a composição e a viabilidade dos fosfolipídeos da membrana
94. Ancey PB, Contat C, Boivin G, Sabatino S, Pascual J, Zangger N, et al. de neutrófilos. Cell Metab (2015) 21:51–64. doi: 10.1016/j.cmet.2014.12.002
Expressão de GLUT1 em neutrófilos associados a tumores promove pulmão
Fronteiras em Imunologia | www.frontiersin.org 16 Fevereiro 2022 | Volume 13 | Artigo 826515
Machine Translated by Google
Stojkov et ai. As vias metabólicas regulam a formação de NET
111. Czaikoski PG, Mota JM, Nascimento DC, Sonego F, Castanheira FV, Melo PH, et 129. Zuo Y, Yalavarthi S, Shi H, Gockman K, Zuo M, Madison JA, et al.
al. Armadilhas Extracelulares de Neutrófilos Induzem Danos a Órgãos Durante Armadilhas extracelulares de neutrófilos em COVID-19. JCI Insight (2020) 5:
Sepse Experimental e Clínica. PloS One (2016) 11:e0148142. doi: 10.1371/ e138999. doi: 10.1172/jci.insight.138999
journal.pone.0148142 112. Liu 130. Megens RT, Vijayan S, Lievens D, Doring Y, Van Zandvoort MA, Grommes J, et
Z, Bone N, Jiang S, Park DW, Tadie JM, Deshane J, et al. Proteína quinase ativada al. Presença de armadilhas extracelulares de neutrófilos luminais na aterosclerose.
por AMP e glicogênio sintase quinase 3b modulam a gravidade da lesão pulmonar Thromb Haemost (2012) 107:597–8. doi: 10.1160/TH11-09-0650
induzida por sepse. Mol Med (2016) 21:937–50. doi: 10.2119/ 131. Awasthi D, Nagarkoti S, Kumar A, Dubey M, Singh AK, Pathak P, et al.
molmed.2015.00198 Formação de Armadilha Extracelular Induzida por LDL Oxidada em Neutrófilos
113. Liu Z, Bone N, Jiang S, Park DW, Tadie JM, Deshane J, et al. Proteína quinase Humanos via TLR-PKC-IRAK-MAPK e Ativação de NADPH-Oxidase. Free Radic
ativada por AMP e glicogênio sintase quinase 3beta modulam a gravidade da Biol Med (2016) 93:190–203. doi: 10.1016/j.freeradbiomed.2016.01.004
lesão pulmonar induzida por sepse. Mol Med (2016) 21:937–50. doi: 10.2119/ 132. Mostafa MN, Osama M. As implicações das armadilhas extracelulares de
molmed.2015.00198 neutrófilos na fisiopatologia da aterosclerose e aterotrombose. Exp Biol Med
114. Nalos M, Parnell G, Robergs R, Booth D, Mclean AS, Tang BM. (Maywood) (2020) 245:1376–84. doi: 10.1177/1535370220945989 133.
Reprogramação Transcricional das Vias Metabólicas em Pacientes Críticos. Exp Maianski NA, Geissler J, Srinivasula SM, Alnemri ES, Roos D, Kuijpers TW.
de Medicina de Terapia Intensiva (2016) 4:21. doi: 10.1186/s40635-016-0094-1 Caracterização funcional das mitocôndrias em neutrófilos: um papel restrito à
apoptose. Cell Death Differ (2004) 11:143–53. doi: 10.1038/sj.cdd.4401320 134.
115. Li X, Kondo Y, Bao Y, Staudenmaier L, Lee A, Zhang J, et al. O trifosfato de Injarabian L,
adenosina sistêmico prejudica a quimiotaxia de neutrófilos e a defesa do Devin A, Ransac S, Marteyn BS. Mudança metabólica de neutrófilos durante seu ciclo
hospedeiro na sepse. Crit Care Med (2017) 45:e97–e104. doi: 10.1097/CCM. de vida: impacto em sua sobrevivência e ativação. Int J Mol Sci (2019) 21:287.
0000000000002052 doi: 10.3390/ijms21010287 135. Maratou E,
116. Park SY, Shrestha S, Youn YJ, Kim JK, Kim SY, Kim HJ e outros. A autofagia Dimitriadis G, Kollias A, Boutati E, Lambadiari V, Mitrou P, et al. Expressão do
prepara os neutrófilos para a formação de armadilhas extracelulares de neutrófilos transportador de glicose na membrana plasmática de glóbulos brancos em
durante a sepse. Am J Respir Crit Care Med (2017) 196:577–89. doi: 10.1164/ repouso e ativados. Eur J Clin Invest (2007) 37:282–90. doi: 10.1111/
rccm.201603-0596OC j.1365-2362.2007.01786.x 136.
117. Colon DF, Wanderley CW, Franchin M, Silva CM, Hiroki CH, Castanheira FVS, et Huang JB, Kindzelskii AL, Petty HR. Translocação de hexoquinase durante ativação
al. Armadilhas extracelulares de neutrófilos (redes) exacerbam a gravidade da de neutrófilos, quimiotaxia e fagocitose: interrupção por citocalasina D,
sepse infantil. Crit Care (2019) 23:113. doi: 10.1186/s13054-019-2407-8 dexametasona e indometacina. Cell Immunol (2002) 218:95–106. doi: 10.1016/
118. Kumar V. Immunometabolism: Outro caminho para a sepse e seu direcionamento S0008-8749(02)00582-8
terapêutico. Inflamação (2019) 42:765–88. doi: 10.1007/s10753-018-0939-8 119. 137. Cooper MR, Dechatelet LR, Mccall CE, Lavia MF, Spurr CL, Baehner RL.
Sun S, Duan Z, Wang X, Chu C, Yang C, Chen F, et al. Armadilhas extracelulares de Deficiência completa de leucócitos glicose-6-fosfato desidrogenase com atividade
neutrófilos prejudicam as funções de barreira intestinal na sepse ao regular a via bactericida defeituosa. J Clin Invest (1972) 51:769–78. doi: 10.1172/JCI106871
de estresse do retículo endoplasmático mediado por TLR9. Cell Death Dis (2021) 138. Perner A,
12:606. doi: 10.1038/s41419-021-03896-1 120. Marcos V, Zhou Nielsen SE, Rask-Madsen J. Glicose elevada prejudica a produção de superóxido de
Z, Yildirim AO, Bohla A, Hector A, Vitkov L, et al. O CXCR2 medeia a formação de neutrófilos sanguíneos isolados. Intensive Care Med (2003) 29:642–5. doi:
armadilhas extracelulares de neutrófilos independentes de NADPH Oxidase na 10.1007/s00134-002-1628-4
inflamação das vias aéreas da fibrose cística. Nat Med (2010) 16:1018–23. doi: 139. Robinson JM, Karnovsky ML, Karnovsky MJ. Acúmulo de glicogênio em leucócitos
10.1038/nm.2209 121. Cifani N, polimorfonucleares e outras alterações intracelulares que ocorrem durante a
Pompili B, Anile M, Patella M, Diso D, Venuta F, et al. A morte de P. aeruginosa inflamação. J Cell Biol (1982) 95:933–42. doi: 10.1083/ jcb.95.3.933
mediada por espécies reativas de oxigênio é funcional em macrófagos de fibrose
cística humana. PloS One (2013) 8:e71717. doi: 10.1371/ journal.pone.0071717 140. Sadiku P, Willson JA, Ryan EM, Sammut D, Coelho P, Watts ER, et al.
122. Laval J, Touhami Os neutrófilos alimentam respostas imunes eficazes por meio da gliconeogênese
J, Herzenberg LA, Conrad C, Taylor N, Battini JL, et al. e da glicogênese. Cell Metab (2021) 33:411–23.e414. doi: 10.1016/
Adaptação metabólica de neutrófilos nas vias aéreas da fibrose cística envolve j.cmet.2020.11.016
mudanças distintas na expressão do transportador de nutrientes. J Immunol 141. Jun HS, Lee YM, Cheung YY, Mcdermott DH, Murphy PM, De Ravin SS, et al. A
(2013) 190:6043–50. doi: 10.4049/ Falta de Reciclagem de Glicose Entre o Retículo Endoplasmático e o Citoplasma
jimmunol.1201755 123. Gray RD, Hardisty G, Regan KH, Smith M, Robb CT, Duffin R, Subjaz à Disfunção Celular em Neutrófilos com Deficiência de Glicose-6-
et al. A apoptose retardada de neutrófilos aumenta a formação de NET na fibrose Fosfatase-Beta em uma Síndrome de Neutropenia Congênita. Sangue (2010)
cística. Thorax (2018) 73:134–44. doi: 10.1136/ 116:2783–92. doi: 10.1182/blood-2009-12-258491
thoraxjnl-2017-210134 124. McElvaney OJ, Mcevoy NL, Mcelvaney OF, Carroll TP, 142. Wachstein M. A distribuição de glicogênio demonstrável histoquimicamente no
Murphy MP, Dunlea DM, et al. Caracterização da resposta inflamatória à doença sangue humano e células da medula óssea. Sangue (1949) 4:54–9. doi: 10.1182/
grave de COVID 19. Am J Respir Crit Care Med (2020) 202:812–21. doi: 10.1164/ sangue.V4.1.54.54
rccm.202005-1583OC 143. Scott RB. Glicogênio em Leucócitos de Sangue Periférico Humano. EU.
125. Barnes BJ, Adrover JM, Baxter-Stoltzfus A, Borczuk A, Cools-Lartigue J, Crawford Características da Síntese e Turnover de Glicogênio in Vitro. J Clin Invest (1968)
JM, et al. Direcionando potenciais drivers de COVID-19: armadilhas extracelulares 47:344–52. doi: 10.1172/JCI105730
de neutrófilos. J Exp Med (2020) 217:e20200652. doi: 10.1084/jem.20200652 144. Curi R, Levada-Pires AC, Silva EBD, Poma SO, Zambonatto RF, Domenech P, et
126. Laforge al. O papel crítico do metabolismo celular para as funções essenciais dos
M, Elbim C, Frere C, Hemadi M, Massaad C, Nuss P, et al. Danos nos tecidos causados neutrófilos. Cell Physiol Biochem (2020) 54:629–47. doi: 10.33594/000000245
pelo estresse oxidativo induzido por neutrófilos no COVID-19. Nat Rev Immunol 145. Borregaard N, Juhl H. Ativação da cascata glicogenolítica em leucócitos
(2020) 20:515–6. doi: 10.1038/s41577-020-0407-1 127. polimorfonucleares humanos por diferentes estímulos fagocíticos. Eur J Clin
Middleton EA, He XY, Denorme F, Campbell RA, Ng D, Salvatore SP, et al. Invest (1981) 11:257–63. doi: 10.1111/j.1365-2362.1981.tb02114.x
Armadilhas extracelulares de neutrófilos contribuem para a imunotrombose na 146. Rath L, Bui MV, Ellis J, Carey J, Baker J, Taylor L, et al. Rápido e seguro:
síndrome do desconforto respiratório agudo por COVID-19. Blood (2020) otimizando infusões de esclerose múltipla durante a pandemia de COVID-19.
136:1169– 79. doi: 10.1182/ Mult Scler Relat Disord (2021) 47:102642. doi: 10.1016/j.msard.2020.102642
blood.2020007008 128. Schonrich G, Raftery MJ, Samstag Y. Devilishly Radical 147. Veiga-Da-Cunha M, Gerin I, Chen YT, De Barsy T, De Lonlay P, Dionisi Vici C,
Network in COVID 19: Oxidative Stress, Neutrophil Extracellular Traps (Nets) e T et al. Um gene no cromossomo 11q23 que codifica para uma suposta translocase
Cell Suppression. Adv Biol Regul (2020) 77:100741. doi: 10.1016/j.jbior. de glicose 6-fosfato sofre mutação em doenças de armazenamento de glicogênio
2020.100741 tipos Ib e Ic. Am J Hum Genet (1998) 63:976–83. doi: 10.1086/302068
Fronteiras em Imunologia | www.frontiersin.org 17 Fevereiro 2022 | Volume 13 | Artigo 826515
Machine Translated by Google
Stojkov et ai. As vias metabólicas regulam a formação de NET
148. Hayee B, Antonopoulos A, Murphy EJ, Rahman FZ, Sewell G, Smith BN, et al. As mutações 167. Longo N, Amat Di San Filippo C, Pasquali M. Distúrbios do Transporte de Carnitina e do
do G6PC3 estão associadas a um grande defeito da glicosilação: um novo mecanismo Ciclo da Carnitina. Am J Med Genet C Semin Med Genet (2006) 142C:77–85. doi: 10.1002/
para a disfunção dos neutrófilos. ajmg.c.30087 168. Houten SM, Wanders RJA, Ranea-
Glicobiologia (2011) 21:914–24. doi: 10.1093/glycob/cwr023 149. Robles P. Interações metabólicas entre peroxissomos e mitocôndrias com foco especial no
Ambruso DR, Mccabe ER, Anderson D, Beaudet A, Ballas LM, Brandt IK, et al. Complicações metabolismo da acilcarnitina. Biochim Biophys Acta Mol Basis Dis (2020) 1866:165720.
infecciosas e hemorrágicas em pacientes com glicogenose Ib. Am J Dis Child (1985) doi: 10.1016/j.bbadis.2020.165720 169. Yousefi S, Stojkov D, Germic N, Simon D, Wang
139:691–7. doi: 10.1001/archpedi.1985. 02140090053027 X, Benarafa C, et al.
150. Jun HS, Weinstein DA, Lee YM, Mansfield BC, Chou JY. Mecanismos moleculares da Desembaraçando a “netose” das redes. Eur J Immunol (2019) 49:221–7. doi: 10.1002/
disfunção dos neutrófilos na doença de armazenamento de glicogênio tipo Ib. Sangue eji.201747053 170.
(2014) 123:2843–53. doi: 10.1182/sangue-2013-05-502435 Kirchner T, Moller S, Klinger M, Solbach W, Laskay T, Behnen M. O impacto de várias espécies
151. Kuijpers TW, Maianski NA, Tool AT, Smit GP, Rake JP, Roos D, et al. reativas de oxigênio na formação de armadilhas extracelulares de neutrófilos. Mediators
Neutrófilos apoptóticos na circulação de pacientes com doença de armazenamento de Inflamm (2012) 2012:849136. doi: 10.1155/ 2012/849136
glicogênio tipo 1b (GSD1b). Sangue (2003) 101:5021–4. doi: 10.1182/sangue 2002-10-3128
171. Stoiber W, Obermayer A, Steinbacher P, Krautgartner WD. O Papel das Espécies Reativas
152. Wortmann SB, Van Hove JLK, Derks TGJ, Chevalier N, Knight V, Koller A, et al. Tratamento de Oxigênio (ROS) na Formação de Armadilhas Extracelulares (Ets) em Humanos.
de Neutropenia e Disfunção de Neutrófilos na Doença de Armazenamento de Glicogênio Biomoléculas (2015) 5:702–23. doi: 10.3390/biom5020702 172. Bianchi M, Hakkim
Tipo Ib com um Inibidor de SGLT2. Sangue (2020) 136:1033–43. doi: 10.1182/ A, Brinkmann V, Siler U, Seger RA, Zychlinsky A, et al.
blood.2019004465 Restauração da formação de NET por terapia gênica em CGD controla a aspergilose.
153. Cruzat V, Macedo Rogero M, Noel Keane K, Curi R, Newsholme P. Sangue (2009) 114:2619–22. doi: 10.1182/blood-2009-05- 221606
Glutamina: Metabolismo e Função Imune, Suplementação e Tradução Clínica. Nutrientes
(2018) 10:1564. doi: 10.3390/nu10111564 154. Gaglio D, Metallo CM, Gameiro PA, 173. Insuela DBR, Azevedo CT, Coutinho DS, Magalhães NS, Ferrero MR, Ferreira TPT, et al.
Hiller K, Danna LS, Balestrieri C, et al. O glucagon reduz a hiperreatividade das vias aéreas, a inflamação e a remodelação
K-Ras oncogênico separa o metabolismo da glicose e da glutamina para apoiar o induzida pela ovalbumina. Sci Rep (2019) 9:6478. doi: 10.1038/s41598-019-42981-6
crescimento de células cancerígenas. Mol Syst Biol (2011) 7:523. doi: 10.1038/
msb.2011.56 155. Le A, Lane AN, Hamaker M, Bose S, Gouw A, Barbi J, et al. Metabolismo da 174. Joshi MB, Lad A, Bharath Prasad AS, Balakrishnan A, Ramachandra L, Satyamoorthy K. A
Glutamina Independente da Glicose via Ciclagem do TCA para Proliferação e Sobrevivência alta glicose modula a homeostase imunológica mediada por IL-6 através do impedimento
em Células B. Cell Metab (2012) 15:110–21. doi: 10.1016/ j.cmet.2011.12.009 da formação de armadilhas extracelulares de neutrófilos.
FEBS Lett (2013) 587:2241–6. doi: 10.1016/j.febslet.2013.05.053 175.
156. Fan J, Kamphorst JJ, Mathew R, Chung MK, White E, Shlomi T, et al. Arampatzioglou A, Papazoglou D, Konstantinidis T, Chrysanthopoulou A, Mitsios A, Angelidou I,
A fosforilação oxidativa impulsionada pela glutamina é a principal fonte de ATP em células et al. A claritromicina aumenta a atividade antibacteriana e a capacidade de cicatrização
de mamíferos transformadas tanto em normóxia quanto em hipóxia. Mol Syst Biol (2013) de feridas no diabetes mellitus tipo 2, aumentando a carga de LL-37 nas armadilhas
9:712. doi: 10.1038/msb.2013.65 extracelulares de neutrófilos. Front Immunol (2018) 9:2064. doi: 10.3389/fimmu.2018.02064
157. Davila A, Liu L, Chellappa K, Redpath P, Nakamaru-Ogiso E, Paolella LM, et al. Nicotinamida 176. Awasthi D, Nagarkoti S, Sadaf S, Chandra T,
Adenina Dinucleotídeo é Transportado para Mitocôndrias de Mamíferos. Elife (2018) Kumar S, Dikshit M. Formação de lactato dependente de glicólise em neutrófilos: uma ligação
7:e33246. doi: 10.7554/eLife.33246 158. Pithon-Curi TC, Levada AC, metabólica entre NOX-dependente e netose independente. Biochim Biophys Acta Mol
Lopes LR, Doi SQ, Curi R. A glutamina desempenha um papel na produção de superóxido e na Basis Dis (2019) 1865:165542. doi: 10.1016/j.bbadis.2019.165542 177. Riyapa D, Rinchai
expressão de P47phox, P22phox e Gp91phox em neutrófilos de ratos. Clin Sci (Londres) D, Muangsombut V, Wuttinontananchai C, Toufiq M, Chaussabel D, et
(2002) 103:403–8. doi: 10.1042/cs1030403 al. Influência da transcetolase e da vitamina B1 na formação de armadilhas extracelulares (redes)
de neutrófilos dependentes de ROS. PloS One (2019) 14:e0221016. doi: 10.1371/
159. Furukawa S, Saito H, Fukatsu K, Hashiguchi Y, Inaba T, Lin MT, et al. journal.pone.0221016 178. Alarcon P, Manosalva C, Conejeros I, Carretta MD, Munoz-
Extermínio bacteriano intensificado pela glutamina por neutrófilos de pacientes pós- Caro T, Silva LMR, et al. A adesão induzida por ácido D(-)láctico
operatórios. Nutrition (1997) 13:863–9. doi: 10.1016/S0899-9007(97)00271-2 160. de neutrófilos bovinos em células endoteliais depende da formação de armadilhas extracelulares
Furukawa S, Saito H, Inoue T, Matsuda T, Fukatsu K, Han I, et al. de neutrófilos e da expressão de CD11b. Front Immunol (2017) 8:975. doi: 10.3389/
A glutamina suplementar aumenta a fagocitose e a produção intermediária de oxigênio fimmu.2017.00975
reativo por neutrófilos e monócitos de pacientes pós-operatórios in vitro. Nutrição (2000)
16:323–9. doi: 10.1016/ S0899-9007(00)00228-8
179. Sofoluwe A, Bacchetta M, Badaoui M, Kwak BR, Chanson M. ATP amplifica a formação de
161. Khaw KT, Friesen MD, Riboli E, Luben R, Wareham N. Plasma Phospholipid Fatty Acid armadilhas extracelulares de neutrófilos dependentes e independentes de NADPH. Sci
Concentration and Incident Coronary Heart Disease in Men and Women: The EPIC-Norfolk Rep (2019) 9:16556. doi: 10.1038/s41598-019-53058-9 180. Quiroga J, Alarcon P,
Prospective Study. PloS Med (2012) 9:e1001255. doi: 10.1371/journal.pmed.1001255 162. Manosalva C, Taubert A, Hermosilla C, Hidalgo MA, et al. ATP Derivado de Mitocôndrias Participa
Rodrigues HG, Takeo Sato F, Curi R, Vinolo MAR. Ácidos Graxos como da Formação de Armadilhas Extracelulares de Neutrófilos Induzidas por Fator Ativador de
Moduladores do Recrutamento, Função e Sobrevivência de Neutrófilos. Eur J Pharmacol (2016) Plaquetas Através de Sinalização Purinérgica em Vacas. Dev Comp Immunol (2020)
785:50–8. doi: 10.1016/j.ejphar.2015.03.098 163. Burdge GC, Calder PC. Introdução aos 113:103768. doi: 10.1016/j.dci.2020.103768
Ácidos Graxos e Lipídeos. Rev mundial
181. Yousefi S, Simon HU. Netosis - Ele realmente representa o “bomba suicida” da natureza?
Nutr Diet (2015) 112:1–16. doi: 10.1159/000365423 Front Immunol (2016) 7:328. doi: 10.3389/fimmu.2016.00328 182. Yousefi S, Simon
164. Martins De Lima T, Gorjão R, Hatanaka E, Cury-Boaventura MF, Portioli Silva EP, Procópio D, Stojkov D, Karsonova A, Karaulov A, Simon HU. Evidências in vivo para a formação de
J, et al. Mecanismos pelos quais os ácidos graxos regulam a função leucocitária. Clin Sci armadilhas de DNA extracelular. Cell Death Dis (2020) 11:300. doi: 10.1038/
(Londres) (2007) 113:65–77. doi: 10.1042/CS20070006 s41419-020-2497-x
183. Tackenberg H, Moller S, Filippi MD, Laskay T. A pequena Gtpase Cdc42 regula
165. Fan Z, Ley K. Os neutrófilos em desenvolvimento devem comer … eles mesmos! Imunidade negativamente a formação de armadilhas extracelulares de neutrófilos envolvendo
(2017) 47:393–5. doi: 10.1016/j.immuni.2017.08.013 mitocôndrias. Front Immunol (2021) 12:564720. doi: 10.3389/
166. Randle PJ, Garland PB, Hales CN, Newsholme EA. O ciclo de ácidos graxos da glicose. fimmu.2021.564720
Seu Papel na Sensibilidade à Insulina e nos Distúrbios Metabólicos do Diabetes Mellitus. 184. Naffah De Souza C, Breda LCD, Khan MA, De Almeida SR, Camara NOS, Sweezey N, et
Lancet (1963) 1:785–9. doi: 10.1016/S0140-6736(63) 91500-9 al. Ph alcalino promove formação de armadilha extracelular de neutrófilos independente
de NADPH Oxidase: uma questão de mitocondrial
Fronteiras em Imunologia | www.frontiersin.org 18 Fevereiro 2022 | Volume 13 | Artigo 826515
Machine Translated by Google
Stojkov et ai. As vias metabólicas regulam a formação de NET
Geração de Espécies Reativas de Oxigênio e Citrulinação e Clivagem de Histonas. 204. Warnatsch A, Ioannou M, Wang Q, Papayannopoulos V. Inflammation.
Front Immunol (2017) 8:1849. doi: 10.3389/fimmu.2017.01849 185. Khan MA, Armadilhas extracelulares de neutrófilos licenciam macrófagos para produção de
Philip LM, Cheung G, Vadakepeedika S, Grasemann H, Sweezey N, et al. Regulando a citocinas na aterosclerose. Ciência (2015) 349:316–20. doi: 10.1126/ science.aaa8064
Netose: Aumentando o Ph Promove Netose Dependente de NADPH Oxidase.
Front Med (Lausanne) (2018) 5:19. doi: 10.3389/ fmed.2018.00019 205. Wu C, Chen X, Cai Y, Xia J, Zhou X, Xu S, et al. Fatores de risco associados à
síndrome do desconforto respiratório agudo e morte em pacientes com pneumonia
186. Alarcon P, Manosalva C, Quiroga J, Belmar I, Alvarez K, Diaz G, et al. Os ácidos por doença de coronavírus 2019 em Wuhan, China. JAMA Intern Med (2020)
oleico e linoleico induzem a liberação de armadilhas extracelulares de neutrófilos 180:934–43. doi: 10.1001/jamainternmed.2020.0994 206. Wu Z,
via liberação de ATP dependente de pannexina 1 e ativação do receptor P2X1. McGoogan JM. Características e lições importantes do surto da doença de coronavírus
Front Vet Sci (2020) 7:260. doi: 10.3389/fvets.2020.00260 2019 (COVID-19) na China: resumo de um relatório de 72314 casos do Centro
187. Khan MA, Pace-Asciak C, Al-Hassan JM, Afzal M, Liu YF, Oommen S, et al. Chinês de Controle e Prevenção de Doenças. JAMA (2020) 323:1239–42. doi:
Furanoid F-Acid F6 induz netose de forma exclusiva em comparação com ácidos 10.1001/jama.2020.2648 207. Leppkes M, Knopf J, Naschberger E,
graxos C16 e C18 em neutrófilos humanos. Biomoléculas (2018) 8:144. doi: Lindemann A, Singh J, Herrmann I, et al. Oclusão vascular por armadilhas extracelulares
10.3390/ biom8040144 de neutrófilos em COVID-19.
188. Palladino END, Katunga LA, Kolar GR, Ford DA. Ácidos 2-clorogordos: Mediadores EBioMedicine (2020) 58:102925. doi: 10.1016/j.ebiom.2020.102925
lipídicos da formação de armadilhas extracelulares de neutrófilos. J Lipid Res 208. Park HH, Park W, Lee YY, Kim H, Seo HS, Choi DW, et al. Nanosferas tipo melanina
(2018) 59:1424–32. doi: 10.1194/jlr.M084731 revestidas com Dnase bioinspiradas para modulação da desregulação da netose
189. Alba-Loureiro TC, Munhoz CD, Martins JO, Cerchiaro GA, Scavone C, Curi R, et al. associada a infecções. Adv Sci (2020) 7:2001940. doi: 10.1002/advs.202001940
Função e Metabolismo de Neutrófilos em Indivíduos com Diabetes Mellitus. Braz J
Med Biol Res (2007) 40:1037–44. doi: 10.1590/S0100-879X2006005000143 209. Skendros P, Mitsios A, Chrysanthopoulou A, Mastellos DC, Metallidis S, Rafailidis P,
et al. Armadilhas extracelulares de neutrófilos enriquecidos com fator tecidual e
190. Kuwabara WM, Curi R, Alba-Loureiro TC. A autofagia é prejudicada em neutrófilos complemento são os principais impulsionadores da imunotrombose por COVID-19.
de ratos diabéticos induzidos por estreptozotocina. Front Immunol (2017) 8:24. doi: J Clin Invest (2020) 130:6151–7. doi: 10.1172/JCI141374 210.
10.3389/fimmu.2017.00024 Veras FP, Pontelli MC, Silva CM, Toller-Kawahisa JE, De Lima M, Nascimento DC, et al.
191. Bonaventura A, Vecchie A, Abbate A, Montecucco F. Armadilhas extracelulares de Armadilhas extracelulares de neutrófilos desencadeadas por SARS-Cov-2 medeiam
neutrófilos e doenças cardiovasculares: uma atualização. Células (2020) 9:9010231. a patologia do COVID-19. J Exp Med (2020) 217:e20201129. doi: 10.1084/
doi: 10.3390/cells9010231 jem.20201129 211. Fernandez-
192. Roberts HM, Grant MM, Hubber N, Super P, Singhal R, Chapple ILC. Perez MP, Aguila S, Reguilon-Gallego L, De Los Reyes-Garcia AM, Minano A, Bravo-
Impacto da Intervenção Cirúrgica Bariátrica na Função dos Neutrófilos do Sangue Perez C, et al. Armadilhas extracelulares de neutrófilos e fator de Von Willebrand
Periférico (PBN) na Obesidade. Obes Surg (2018) 28:1611–21. doi: 10.1007/ são aliados que influenciam negativamente os resultados da COVID-19. Clin Transl
s11695-017-3063-1 Med (2021) 11:e268. doi: 10.1002/ctm2.268
193. Khan MA, Ali ZS, Sweezey N, Grasemann H, Palaniyar N. Progressão da doença 212. Gueant JL, Gueant-Rodriguez RM, Fromonot J, Oussalah A, Louis H, Chery C, et al.
pulmonar da fibrose cística da infância à idade adulta: neutrófilos, formação de A elastase e a exacerbação da imunidade inata dos neutrófilos estão envolvidas
armadilha extracelular de neutrófilos (NET) e degradação de NET. nas manifestações multiviscerais da COVID-19. Allergy (2021) 76:1846–58. doi:
Genes (Basileia) (2019) 10:183. doi: 10.3390/genes10030183 10.1111/all.14746 213. Lee YY, Park
194. Cools-Lartigue J, Spicer J, Mcdonald B, Gowing S, Chow S, Giannias B, et al. HH, Park W, Kim H, Jang JG, Hong KS, et al. Dnase-1 nanoparticulada de ação
Armadilhas extracelulares de neutrófilos sequestram células tumorais circulantes e prolongada para supressão eficaz de atividades de neutrófilos mediadas por SARS-
promovem metástases. J Clin Invest (2013) 123:3446–58. doi: 10.1172/JCI67484 Cov-2 e tempestade de citocinas. Biomateriais (2021) 267:120389. doi: 10.1016/
195. Cristinziano L, Modestino L, Antonelli A, Marone G, Simon HU, Varricchi G, et al. j.biomaterials.2020.120389
Armadilhas extracelulares de neutrófilos em câncer. Semin Cancer Biol (2021) See More 214. Ouwendijk WJD, Raadsen MP, Van Kampen JJA, Verdijk RM, Von Der Thusen JH,
S1044-1579X(1021)00206. doi: 10.1016/j.semcancer.2021.07.011 Guo L, et al. Níveis elevados de armadilhas extracelulares de neutrófilos persistem
196. Midgley A, Beresford MW. Expressão aumentada de granulócitos de baixa densidade no trato respiratório inferior de pacientes gravemente enfermos com doença de
em pacientes com lúpus eritematoso sistêmico juvenil correlaciona-se com a coronavírus 2019. J Infect Dis (2021) 223:1512–21. doi: 10.1093/infdis/jiab050 215.
atividade da doença. Lúpus (2016) 25:407–11. doi: 10.1177/ 0961203315608959 Petito E,
Falcinelli E, Paliani U, Cesari E, Vaudo G, Sebastiano M, et al.
197. Yin Y, Choi SC, Xu Z, Perry DJ, Seay H, Croker BP, et al. A normalização do Associação de ativação de neutrófilos, mais do que ativação de plaquetas, com
metabolismo das células T CD4+ reverte o lúpus. Sci Transl Med (2015) 7:274ra218. complicações trombóticas na doença de coronavírus 2019. J Infect Dis (2021)
doi: 10.1126/scitranslmed.aaa0835 223:933–44. doi: 10.1093/infdis/jiaa756
198. Wipke BT, Allen PM. Papel essencial dos neutrófilos na iniciação e progressão de 216. Arcanjo A, Logullo J, Menezes CCB, De Souza Carvalho Giangiarulo TC, Dos Reis
um modelo murino de artrite reumatóide. J Immunol (2001) 167:1601–8. doi: MC, De Castro GMM, et al. O papel emergente das armadilhas extracelulares de
10.4049/jimmunol.167.3.1601 199. Wright HL, neutrófilos no coronavírus 2 da síndrome respiratória aguda grave (COVID-19). Sci
Chikura B, Bucknall RC, Moots RJ, Edwards SW. Alterações na expressão de TNF de Rep (2020) 10:19630. doi: 10.1038/s41598-020-76781-0
membrana, ativação de NF-Kb e apoptose de neutrófilos durante inflamação ativa
e resolvida. Ann Rheum Dis (2011) 70:537–43. doi: 10.1136/ard.2010.138065 217. Busch MH, Timmermans S, Nagy M, Visser M, Huckriede J, Aendekerk JP, et al.
Neutrófilos e ativação de contato da coagulação como potenciais condutores de
200. Pi H, Zhou H, Jin H, Ning Y, Wang Y. Metabolismo anormal da glicose na artrite COVID-19. Circulation (2020) 142:1787–90. doi: 10.1161/
reumatóide. BioMed Res Int (2017) 2017:9670434. doi: 10.1155/ 2017/9670434 CIRCULATIONAHA.120.050656
218. Strich JR, Ramos-Benitez MJ, Randazzo D, Stein SR, Babyak A, Davey RT, et al.
201. Drechsler M, Megens RT, Van Zandvoort M, Weber C, Soehnlein O. Fostamatinib inibe armadilhas extracelulares de neutrófilos induzidas por plasma
Neutrofilia desencadeada por hiperlipidemia promove aterosclerose precoce. de paciente com COVID-19: um potencial terapêutico. J Infect Dis (2021) 223:981–
Circulation (2010) 122:1837–45. doi: 10.1161/CIRCULATIONAHA.110.961714 202. 4. doi: 10.1093/infdis/jiaa789
Soehnlein O. Multiple Roles for Neutrophils in Atherosclerosis. Circ Res (2012) 110:875– 219. Gardinassi LG, Souza COS, Sales-Campos H, Fonseca SG. Assinaturas imunes e
88. doi: 10.1161/CIRCRESAHA.111.257535 203. Nencioni A, Da metabólicas do COVID-19 reveladas pela reutilização de dados transcriptômicos.
Silva RF, Fraga-Silva RA, Steffens S, Fabre M, Bauer I, et al. Front Immunol (2020) 11:1636. doi: 10.3389/fimmu.2020.01636 220. Hazeldine
A inibição da nicotinamida fosforribosiltransferase reduz a produção intraplaca de J, Lord JM. Neutrófilos e COVID-19: Participantes Ativos e Alvos Terapêuticos Racionais.
CXCL1 e a infiltração de neutrófilos associada em camundongos ateroscleróticos. Front Immunol (2021) 12:680134. doi: 10.3389/fimmu.2021.680134
Thromb Haemost (2014) 111:308–22. doi: 10.1160/TH13-07-0531
Fronteiras em Imunologia | www.frontiersin.org 19 Fevereiro 2022 | Volume 13 | Artigo 826515
Machine Translated by Google
Stojkov et ai. As vias metabólicas regulam a formação de NET
221. Luo W, Hu H, Chang R, Zhong J, Knabel M, O'meally R, et al. A piruvato quinase 230. Wolach B, Ashkenazi M, Grossmann R, Gavrieli R, Friedman Z, Bashan N, et al.
M2 é um coativador estimulado por PHD3 para o fator 1 induzível por hipóxia. Cell Flutuação diurna da atividade G6PD dos leucócitos. Uma possível explicação para
(2011) 145:732–44. doi: 10.1016/j.cell.2011.03.054 222. a atividade bactericida normal dos neutrófilos e a baixa incidência de infecções
Tannahill GM, Curtis AM, Adamik J, Palsson-Mcdermott EM, Mcgettrick AF, Goel G, et piogênicas em pacientes com deficiência grave de G6PD em Israel. Pediatr Res
al. O succinato é um sinal inflamatório que induz a IL-1b através do HIF-1a. Nature (2004) 55:807–13. doi: 10.1203/01.PDR.0000120680.47846.47 231.
(2013) 496:238–42. doi: 10.1038/nature11986 223. Reyes L, M AS-G, Morrison Cheng ML, Ho HY, Lin HY, Lai YC, Chiu DT. A formação efetiva de NET em neutrófilos
T, Howden AJM, Watts ER, Arienti S, et al. Um tipo I IFN, assinatura de neutrófilos de indivíduos com G6PD Taiwan-Hakka está associada à biossíntese aprimorada
hiperinflamatórios pró-trombóticos é distinta para SDRA COVID-19. Wellcome de NADP(+). Free Radic Res (2013) 47:699–709. doi: 10.3109/10715762.2013.816420
Open Res (2021) 6:38. doi: 10.12688/wellcomeopenres.16584.2 224. Arraes SM,
Freitas MS, Da Silva SV, De Paula
Neto HA, Alves-Filho JC, Auxiliadora Martins M, et al. Quimiotaxia de neutrófilos Conflito de Interesses: Os autores declaram que a pesquisa foi conduzida na ausência
prejudicada na sepse associada à expressão de GRK e inibição da montagem de de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um
actina e fosforilação de tirosina. Sangue (2006) 108:2906–13. doi: 10.1182/sangue potencial conflito de interesses.
2006-05-024638
Nota do editor: todas as reivindicações expressas neste artigo são exclusivamente dos
225. Shen XF, Cao K, Jiang JP, Guan WX, Du JF. Desregulação de neutrófilos durante autores e não representam necessariamente as de suas organizações afiliadas ou do
a sepse: uma visão geral e atualização. J Cell Mol Med (2017) 21:1687–97. doi: editor, dos editores e dos revisores. Qualquer produto que possa ser avaliado neste
10.1111/jcmm.13112 artigo, ou reclamação que possa ser feita por seu fabricante, não é garantido ou
226. Sumi Y, Woehrle T, Chen Y, Bao Y, Li X, Yao Y, et al. O ATP do plasma é endossado pelo editor.
necessário para a ativação de neutrófilos em um modelo de sepse em
camundongos. Choque (2014) 42:142–7. doi: Copyright © 2022 Stojkov, Gigon, Peng, Lukowski, Ruth, Karaulov, Rizvanov, Barlev,
10.1097/SHK.0000000000000180 227. Arese P, De Flora A. Fisiopatologia da hemólise Yousefi e Simon. Este é um artigo de acesso aberto distribuído sob os termos da
na deficiência de glicose-6-fosfato desidrogenase. Semin Hematol (1990) 27:1–40. Creative Commons Attribution License (CC BY). O uso, distribuição ou reprodução em
228. Cappellini MD, Fiorelli G. Deficiência de glicose-6-fosfato desidrogenase. outros fóruns é permitido, desde que o(s) autor(es) original(is) e o(s) detentor(es) dos
Lancet (2008) 371:64–74. doi: 10.1016/S0140-6736(08)60073-2 direitos autorais sejam creditados e que a publicação original nesta revista seja citada,
229. Stanton RC. Glucose-6-Fosfato Desidrogenase, NADPH e Sobrevivência Celular. de acordo com a prática acadêmica aceita. Nenhum uso, distribuição ou reprodução é
IUBMB Life (2012) 64:362–9. doi: 10.1002/iub.1017 permitido que não esteja de acordo com estes termos.
Fronteiras em Imunologia | www.frontiersin.org 20 Fevereiro 2022 | Volume 13 | Artigo 826515
Machine Translated by Google
Stojkov et ai. As vias metabólicas regulam a formação de NET
Contínuo
GLOSSÁRIO
LDH lactose desidrogenase
Los Angeles ácido
LDGs linoleico granulócitos de
iLDNs baixa densidade
2-ClFA aldeído 2-clorogorduroso e ácido 2-clorogorduroso
de LDL lipoproteína de baixa densidade
2-DG 2-desoxi-d-glicose 6-
MPO neutrófilos de
6-AN aminonicotinamida 6-
mtDNA baixa densidade
PGD fosfogluconato desidrogenase acetil-
ÿYm imaturos mieloperoxidase
acetil-CoA coenzima A adenosina
mitoROS DNA mitocondrial
ATP trifosfato aminoácidos
NETs potencial mitocondrial ERO
ASCT2 transportador 2 peptídeos
NADPH mitocondrial neutrófilos armadilhas extracelulares
ATC antimicrobianos anaplásicos
NAD+ nicotinamida adenina dinucleotídeo
AMPs de câncer de tireoide
NADP+ fosfato nicotinamida adenina dinucleotídeo
Apoe-/- deficiente em apolipoproteína
NAMPT nicotinamida-adenina dinucleotídeo fosfato
Panx1 Canal de ATP panexina 1
NÃO nicotinamida
JNK c-Jun N-terminal quinase
NEFAs fosforribosil transferase
CPT-1 carnitina palmitoiltransferase-1
OA óxido
CACT carnitina-acilcarnitina translocase
OPA1 nítrico não
CPT-2 carnitina palmitoiltransferase-2
OCR esterificado ácidos ácido
cfDNA DNA livre de células
OXPHOS oleico atrofia óptica 1 taxa
CGD doença granulomatosa crônica
PA de consumo
CitH3 histona citrulinada H3
PO de oxigênio
CM doença de coronavírus
PPP fosforilação oxidativa ácido
COVID 19 de mídia condicionada-2019
PBMCs palmítico ácido palmitoleico via pentose-
CF fibrose cística
PMA fosfato sangue periférico células
RD retinopatia diabética
PiT1, PiT2 mononucleares forbol-12
FADH2 diidroflavina-adenina dinucleotídeo
PFK miristato 13-acetato
ETC cadeia de transporte de
FAP fosfato transportador 1 &
emergência
elétrons retículo
PAD4 2 fosfofrutoquinase fator
ECAR endoplasmático taxa de acidificação extracelular
PDK ativador de plaquetas proteína
ERK quinase regulada por sinal extracelular
PDH arginina deiminase 4
FAO oxidação de ácidos
PKM2 piruvato desidrogenase
FAS graxos síntese de
ROS quinase piruvato
F6P ácidos graxos frutose-6-
ARDS desidrogenase piruvato quinase
G6P fosfato glicose-6-fosfato
R5P M2 espécies reativas
G6Pase-b glicose-6-fosfatases- b
RNP-ICs de oxigênio síndrome do desconforto
EXCESSO transportador de
RA respiratório ribose-5-
G6PT glicose glicose-6-fosfato transportador
SGLT2 fosfato ribonucleoproteína complexos
G6PD glicose-6-fosfato desidrogenase
SNAT imunes artrite reumatoide sódio glicose cotransportador
Grx1 glutaredoxina
SLCs 2 transportador de aminoácidos
GSD-1b 1 doença de armazenamento de
sTNFR1 neutro acoplado a sódio transportadores do
G3P glicogênio tipo Ib gliceraldeído
TNF-a tipo transportador de solutos
HMP -3-fosfato hexose monofosfato
SA solúvel
HK2 shunt hexoquinase 2
SF receptor do
HOCl ácido hipocloroso
LES fator de necrose tumoral 1 fator
HIF-1a hipóxia-fator induzível-1a
TCA de necrose tumoral alfa
IL interleucina
TKT ácido esteárico
LPS lipopolissacarídeo
TANs líquido sinovial lúpus sistêmico
(Contínuo) CT ciclo do ácido tricarboxílico eritematoso transcetolase neutrófilos assoc
Fronteiras em Imunologia | www.frontiersin.org 21 Fevereiro 2022 | Volume 13 | Artigo 826515
Você também pode gostar
- Bioletim 0Documento45 páginasBioletim 0bioletim100% (1)
- Atividade de Diferenciação CelularDocumento3 páginasAtividade de Diferenciação CelularNatália Rocha100% (1)
- Estudo Dirigido OrganelasDocumento6 páginasEstudo Dirigido OrganelasPentest TestAinda não há avaliações
- Prêmios Nobel 1999 - Sinais intrínsecos nas proteínasDocumento5 páginasPrêmios Nobel 1999 - Sinais intrínsecos nas proteínasRenan Nascimento100% (1)
- AV Biotecnologia e BioinformáticaDocumento3 páginasAV Biotecnologia e BioinformáticadpedelhesAinda não há avaliações
- Organelas e estruturas celularesDocumento10 páginasOrganelas e estruturas celularesAmanda CamargoAinda não há avaliações
- Objectivos Modulo 1Documento82 páginasObjectivos Modulo 1Margarida VideiraAinda não há avaliações
- Exer2 Bio Pism1Documento6 páginasExer2 Bio Pism1GuilhermeAinda não há avaliações
- Citologia no ENEMDocumento5 páginasCitologia no ENEMPedro SoaresAinda não há avaliações
- CITOLOGIADocumento12 páginasCITOLOGIADouglas lima 2 ANO ́BAinda não há avaliações
- Seminário Toxicidade FINALDocumento49 páginasSeminário Toxicidade FINALAna LuísaAinda não há avaliações
- Estudo do estímulo de colágeno através da aplicação de luz LEDDocumento8 páginasEstudo do estímulo de colágeno através da aplicação de luz LEDNSanchez N MartaAinda não há avaliações
- Biologia CelularDocumento83 páginasBiologia CelularAmanda CarolineAinda não há avaliações
- Da Silva Et Al, 2011Documento9 páginasDa Silva Et Al, 2011Francisco Carlos da SilvaAinda não há avaliações
- Célula e DNADocumento59 páginasCélula e DNACdmf CdmfAinda não há avaliações
- Calefee Et Al. (2016)Documento5 páginasCalefee Et Al. (2016)Guilherme FratassiAinda não há avaliações
- Plano de Ensino Biologia Celular Biologia BachareladoDocumento3 páginasPlano de Ensino Biologia Celular Biologia BachareladoLucasBruxelAinda não há avaliações
- Atividade I - 1º Anos BioDocumento1 páginaAtividade I - 1º Anos BioSimone Diehl MacielAinda não há avaliações
- Biotecnologia I - introducçãoDocumento30 páginasBiotecnologia I - introducçãogilsilAinda não há avaliações
- 5 Grupo BCM2Documento15 páginas5 Grupo BCM2moradalopesAinda não há avaliações
- Centro Universitário Arnaldo Horácio FerreiraDocumento10 páginasCentro Universitário Arnaldo Horácio FerreiraBruno RangelAinda não há avaliações
- Genetic Disorders of The Glomerular Filtration Barrier - En.ptDocumento11 páginasGenetic Disorders of The Glomerular Filtration Barrier - En.ptTayane MirandaAinda não há avaliações
- Proteômica Uma Introdução Aos Métodos e AplicaçõesDocumento11 páginasProteômica Uma Introdução Aos Métodos e AplicaçõesMAGNUS7 BRAinda não há avaliações
- Avaliação de MicrobiologiaDocumento5 páginasAvaliação de MicrobiologiaFellipe LimaAinda não há avaliações
- Biologia - Citologia PDFDocumento304 páginasBiologia - Citologia PDFRebeca CristinaAinda não há avaliações
- Análise de MetabolomaDocumento12 páginasAnálise de MetabolomaJonata FreschiAinda não há avaliações
- Moléculas, Células e Tecidos - Muito FáceisDocumento7 páginasMoléculas, Células e Tecidos - Muito FáceisLuan Pablo Pereira Da CostaAinda não há avaliações
- Tecnicas HistológicasDocumento80 páginasTecnicas HistológicasSérgio N. PereiraAinda não há avaliações
- AVALIAÇÃO DE CITOLOGIA-nov 19Documento4 páginasAVALIAÇÃO DE CITOLOGIA-nov 19tudo o que precisava ouvirAinda não há avaliações
- Biologia Celular e Molecular: Estudo das estruturas e funções das célulasDocumento98 páginasBiologia Celular e Molecular: Estudo das estruturas e funções das célulasD CostaAinda não há avaliações
- Moléculas, Células e Tecidos - Fáceis 1Documento10 páginasMoléculas, Células e Tecidos - Fáceis 1Luan Pablo Pereira Da CostaAinda não há avaliações
- Exercício Biologia Molecular AplicadaDocumento2 páginasExercício Biologia Molecular AplicadaJoab Ana MenezesAinda não há avaliações
- Introdução Microbiologia e ParasitologiaDocumento16 páginasIntrodução Microbiologia e ParasitologiaLOURENCIANNE MARRIANEAinda não há avaliações
- Cap 1Documento64 páginasCap 1Ricardo PiresAinda não há avaliações
- Ômicas na prospecção de microrganismosDocumento52 páginasÔmicas na prospecção de microrganismosLeticia PontesAinda não há avaliações
- The Impact of Diet Upon Mitochondrial PhysiologyDocumento26 páginasThe Impact of Diet Upon Mitochondrial PhysiologyGuilherme StrunckAinda não há avaliações
- Beta Secretase 1: A Importância de Sua Inibição para o Avanço de Fármacos Contra o AlzheimerDocumento6 páginasBeta Secretase 1: A Importância de Sua Inibição para o Avanço de Fármacos Contra o AlzheimerGuilheverton LealAinda não há avaliações
- Roteiro AULA 1 e 2 - Introdução À Disciplina e Estrutura de Ácidos NucleicosDocumento4 páginasRoteiro AULA 1 e 2 - Introdução À Disciplina e Estrutura de Ácidos NucleicosJoão Pedro GomesAinda não há avaliações
- TDE1-Estudo de Caso1 - 2024Documento2 páginasTDE1-Estudo de Caso1 - 2024Gabriela MonteiroAinda não há avaliações
- Microscopia de célula vegetalDocumento44 páginasMicroscopia de célula vegetalgrasiela camposAinda não há avaliações
- Biologia molecular: revisão sobre PCR, Captura Híbrida e DNA recombinanteDocumento19 páginasBiologia molecular: revisão sobre PCR, Captura Híbrida e DNA recombinanteCristina CoutinhoAinda não há avaliações
- Dosimetria e Proteção RadiológicaDocumento9 páginasDosimetria e Proteção RadiológicafrodriguesAinda não há avaliações
- Roteiro 7Documento2 páginasRoteiro 7Maria Clara VazAinda não há avaliações
- WB em Veterinaria PDFDocumento16 páginasWB em Veterinaria PDFPsiquiatria TranslacionalAinda não há avaliações
- Dissertacao Alexandra S MelloDocumento86 páginasDissertacao Alexandra S MellocarloscontabiesAinda não há avaliações
- U4 - S4 - PRÉ - Definic e MecanismosDocumento21 páginasU4 - S4 - PRÉ - Definic e MecanismosQuemAinda não há avaliações
- FT3 - Síntese Proteica (C.C.)Documento5 páginasFT3 - Síntese Proteica (C.C.)Patricia PedrosoAinda não há avaliações
- Sinalização Endócrina e AutócrinaDocumento17 páginasSinalização Endócrina e AutócrinaAlexandreAinda não há avaliações
- Revisão de Citologia para Recuperação.Documento16 páginasRevisão de Citologia para Recuperação.Kauã GarciaAinda não há avaliações
- Alterações NeutrófilosDocumento18 páginasAlterações NeutrófilosAndréRicardoAinda não há avaliações
- Lista-8-Citologia-organelas (1)_annotatedDocumento5 páginasLista-8-Citologia-organelas (1)_annotatedWeslley LopesAinda não há avaliações
- A compreensão da epigenética e seus mecanismosDocumento17 páginasA compreensão da epigenética e seus mecanismosLeilane WergenesAinda não há avaliações
- Lista de Exercícios - Citologia e BiotecDocumento13 páginasLista de Exercícios - Citologia e BiotecMarcella GamaAinda não há avaliações
- Projeto PUB IB 2022-2023Documento6 páginasProjeto PUB IB 2022-2023ceu ceuAinda não há avaliações
- Pet 1 - 1 Ano - BioDocumento19 páginasPet 1 - 1 Ano - BioJonathas SantosAinda não há avaliações
- Relatório de aulas práticas sobre bioenergética, metabolismo e biologia celularDocumento5 páginasRelatório de aulas práticas sobre bioenergética, metabolismo e biologia celularDiego HenriqueAinda não há avaliações
- Discursiva Uerj 9090Documento81 páginasDiscursiva Uerj 9090gabAinda não há avaliações
- Biologia Celular e Molecular: Um guia introdutório para aprendizagem de Biologia Celular e MolecularNo EverandBiologia Celular e Molecular: Um guia introdutório para aprendizagem de Biologia Celular e MolecularAinda não há avaliações
- Aula - Vigor de SementesDocumento37 páginasAula - Vigor de Sementesthais nayaraAinda não há avaliações
- Inibição Letal Do Ciclo de KrebsDocumento14 páginasInibição Letal Do Ciclo de KrebsabresserAinda não há avaliações
- Processo de libertação de energia nas célulasDocumento10 páginasProcesso de libertação de energia nas célulasErnesto Conjo100% (1)
- Aula 3.9 Beta - Oxidação RegulaçãoDocumento17 páginasAula 3.9 Beta - Oxidação Regulaçãowalas joãoAinda não há avaliações
- Respiração celular: glicólise, ciclo de Krebs e cadeia respiratóriaDocumento15 páginasRespiração celular: glicólise, ciclo de Krebs e cadeia respiratóriaAline KreiAinda não há avaliações
- FototrofiaDocumento3 páginasFototrofiachiquezaAinda não há avaliações
- Anotações Biologia e Bioquímica Humana UnicesumarDocumento9 páginasAnotações Biologia e Bioquímica Humana UnicesumarSthefany Do NascimentoAinda não há avaliações
- ApostilaNutricao Noturno QBQ0214Documento41 páginasApostilaNutricao Noturno QBQ0214Renan Reixach17% (6)
- Glicólise: introdução ao metabolismo da glicoseDocumento32 páginasGlicólise: introdução ao metabolismo da glicoseAnna Feller Feller100% (1)
- Aula 14 - GluconeogéneseDocumento24 páginasAula 14 - GluconeogéneseaptgaptgAinda não há avaliações
- Apostila de BioquímicaDocumento13 páginasApostila de BioquímicaLívia ChristineAinda não há avaliações
- CITOLOGIADocumento9 páginasCITOLOGIAGiliardi TodtAinda não há avaliações
- Fisiologia vegetal: glicólise, ciclo de Krebs e cadeia respiratóriaDocumento4 páginasFisiologia vegetal: glicólise, ciclo de Krebs e cadeia respiratóriaObsanjoAinda não há avaliações
- Bioquímica Aplicada AtividadesDocumento36 páginasBioquímica Aplicada AtividadeswillamesluluamorAinda não há avaliações
- Metabolismo Energético e o Uso de Suplementos Alimentares: Uma Perspectiva Bioquímica Na Educação FísicaDocumento13 páginasMetabolismo Energético e o Uso de Suplementos Alimentares: Uma Perspectiva Bioquímica Na Educação FísicaYara LimaAinda não há avaliações
- Questionário IDocumento12 páginasQuestionário Ijany SantosAinda não há avaliações
- bioquimica ... ativ discursivaDocumento3 páginasbioquimica ... ativ discursivaCarlos Vinicius GimenesAinda não há avaliações
- AULA 10 - Catabolismo de AminoácidosDocumento8 páginasAULA 10 - Catabolismo de AminoácidosMarcela Lima de BritoAinda não há avaliações
- Respiração Celular: Processo Vital de Liberação de EnergiaDocumento7 páginasRespiração Celular: Processo Vital de Liberação de EnergiaTeresa Gonzalez EnríquezAinda não há avaliações
- Citologia 2013 Metabolismo Energetico IIDocumento186 páginasCitologia 2013 Metabolismo Energetico IIBeboc Deagonal UlfricoAinda não há avaliações
- Mitocôndria e Respiração Celular PDFDocumento18 páginasMitocôndria e Respiração Celular PDFpizza de mussarelaAinda não há avaliações
- Biologia: CapítuloDocumento16 páginasBiologia: CapítuloLayza MeloAinda não há avaliações
- Prova Bioquímica ENFERMAGEMDocumento6 páginasProva Bioquímica ENFERMAGEMSLANGIEAinda não há avaliações
- Gasto Tutoria 1Documento3 páginasGasto Tutoria 1EduardoAinda não há avaliações
- METABOLISMO AULA 2 Editar e Fazer Material PraticoDocumento13 páginasMETABOLISMO AULA 2 Editar e Fazer Material PraticoAllanAinda não há avaliações
- Questo Es - Respirac A o Aero BicaDocumento16 páginasQuesto Es - Respirac A o Aero BicaHeloísa CristinaAinda não há avaliações
- Ciclo Do Ácido CítricoDocumento14 páginasCiclo Do Ácido CítricoEry AlencarAinda não há avaliações
- METABOLISMODocumento49 páginasMETABOLISMODiego Pereira100% (1)
- Respiração aeróbia, fermentação e metabolismo celularDocumento20 páginasRespiração aeróbia, fermentação e metabolismo celularRafaela Afonso100% (1)
- Exercícios Respiração Celular IDocumento2 páginasExercícios Respiração Celular IJamille SouzaAinda não há avaliações