Escolar Documentos
Profissional Documentos
Cultura Documentos
Subs, Misturas e Diagramas
Enviado por
evelenDireitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Subs, Misturas e Diagramas
Enviado por
evelenDireitos autorais:
Formatos disponíveis
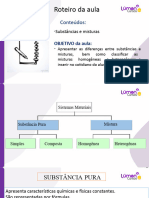
Subs.
Simples
Substancias
Subs. compostas
Subs Puras: TF e TE constantes, características próprias e propried. especificas
Subs Simples: um ou mais átomos de um mesmo elemento químico (H 2, O2)
Subs Compostas: por dois ou mais elementos químicos (H2O, CO2)
Mistura: é formada por duas ou mais substâncias, de acordo com o aspecto visual
de uma mistura, podemos classificá-la em função do seu número de fases:
O ar que respiramos é formado por uma mistura de gases:
• gás nitrogênio (N2) = 78%; • gás oxigênio (O2) = 21%;
• gás argônio (Ar) = 1%; • gás carbônico (CO2) = 0,03%.
Mistura homogênea: toda mistura que apresenta uma única fase
As misturas homogêneas são chamadas soluções.
EX: água de torneira, vinagre, ar, álcool hidratado, pinga, gasolina, soro caseiro,
soro fisiológico e algumas ligas metálicas. OBS: gases são misturas homogêneas.
Mistura heterogênea: toda mistura que apresenta pelo menos duas fases
Alguns exemplos; água e óleo, areia, granito, madeira, sangue, leite, água com gás.
Elementos variedades alotrópicas
Oxigênio – ozônio (O3) e oxigênio (O2) (+ Inst)
carbono - diamante e grafite (+ instável) (Cn)
enxofre - rômbico (+ Inst) (S8) e monoclínico (S8)
fósforo – vermelho (+Inst) (Pn) e branco (P4)
+ estável = - energético / Lembra de uma pessoa muito instável ela gasta mt
energia (pessoa chata) e + estável é uma pessoa tranquila gasta menos energia
Óleo de cozinha: não é uma mistura e sim uma substância isolada
‘’COSPE” g,2,r,v= + Estáveis porque no alfabeto eles vem depois
Solido Liquido Gasoso
Juntinhos- Prox. molecular Forma indefinida
Volume e forma variável
Lig. Químicas intensas Volume definido Menor densidade
Volume e forma definida Certa desorganização Alta desorganização
Alta Organização + Movimentação Muito movimentação
Baixa Movimentação + Energia Cinética Alta Energia Cinética
Baixa Energia Cinética
Monoatômica: He, Ne, Ar, Xe... Diatômica= Cl2, O2... Poliatômica: S8
Fenômeno Químico: alteração da identidade da matéria (Combustão) Quebra de Ligações
- Alteração da Cor ou Cheiro, Borbulhação, liberação de luz/calor, formou precipitado
Fenômeno Físico: Não ocorre alteração da estrutura
- Fusão, vaporização, solidificação, quebrar vidro, rasgar papel
Comportamento anômalo da água - 0 a 4 graus ela dilata.
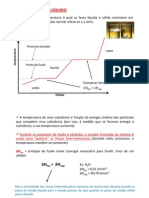
• Substância pura- cte tudo •Mistura Comum- varia tudo
• Misturas eutéticas (TE varia) • Misturas azeotrópicas (TF varia)
Ex: solda (estanho + chumbo) gelo + sal álcool comum (96% de etanol e 4% de água)
A temperatura ambiente é normalmente igual a 20 °C / ‘’totalmente liquefeito’’ = liquido
Critérios de Pureza
Densidade (d)
D= m/v 1ml- 1cm3 / 1L – dm3
10-3 dm3 ------ 10-3. (10-1 m)3
1 ml -------- 10-3 L
Substância- Densidade Fixa, Cte
Mistura – Densidade Variável
Calor Latente- Mudança de fase
Calor Sensível- Mudança de Temperatura
Atomística
Dalton – bola de bilhar
Átomos maciços, esféricos, indivisíveis, imperecíveis (eternos)
Baseou-se em Demócrito e Leucipo (A=sem/ tomos=divisão)
Átomos não são criados, nem destruídos e sim rearranjados
Baseou-se em Lavoisier conservação das massas
Partículas pequenas são os átomos
Razão entre um número de átomos é um número inteiro H2O1
Thomson – Pudim de Passas
Átomos divisíveis e neutro = Carga total nula
Descoberta do elétron
tubo de raios catódicos
esfera difusa, gelatinosa
O átomo é uma esfera de carga elétricas positiva, incrustadas de elétrons
O experimento: feixe de raios provenientes do cátodo (negativo), se dirigia para o ânodo
(positivo). Esses raios eram desviados na direção do pólo positivo de um campo elétrico.
Rutherford- Modelo Planetário
Átomos são nucleares e estáveis
Partícula alfa +2, atravessava a lâmina, algumas eram repelidas e outras desviadas
Núcleo é pequeno, denso é menor que o átomo e positivo. Concentra toda a massa!
Eletrosfera ‘’grande vazio’’ elétrons giram na eletrosfera
Inconsistências os elétrons não para no átomo?
Niels Bohr-Rutherford: Postulados de Bohr
teoria quântica de Max Planck, Rutherford e efeito foto elétrico de Einstein
elétrons andam em orbitas circulares (camadas ou níveis de energia = Eletrosfera)
Cada um desses níveis tem valor determinado de energia = Estados estacionários
Elétrons só podem estar nas camadas e podem dar Saltos quânticos
Elétron absorve energia pula da camada 01 p 02 e fica no estado excitado
Ao voltar pro nível interno ele emite um quantum de energia na forma de luz
James Chadwick- Descoberta do nêutron
Chadwick realizou consistiu, basicamente, em fazer com que feixes de partículas alfa se
colidissem com uma amostra de berílio após a colisão o berílio se transforma em um átomo
de carbono liberando uma partícula que ao passar por um campo positivo e negativo ela
passa direto, ou seja uma partícula neutra.
Na visão de Sommerfeld o átomo é constituído por camadas eletrônicas contendo órbita
circular e órbitas elípticas
Você também pode gostar
- Resumão Geral 1 SemestreDocumento15 páginasResumão Geral 1 SemestreAna PagioroAinda não há avaliações
- Teoria Química Total 2021Documento45 páginasTeoria Química Total 2021Ramon LamarAinda não há avaliações
- Quimica Upe BizuDocumento15 páginasQuimica Upe BizuFábio CavalcantiAinda não há avaliações
- Aula 12-03 LumemDocumento77 páginasAula 12-03 LumemEricson SousaAinda não há avaliações
- Apostila Fisico-Quimica - FarmáciaDocumento20 páginasApostila Fisico-Quimica - FarmáciaPaula KnupferAinda não há avaliações
- Aula de Química - Vem, ENEM - Joel Augusto Moura PortoDocumento42 páginasAula de Química - Vem, ENEM - Joel Augusto Moura PortoJoel Augusto Moura PortoAinda não há avaliações
- O Estudo Da Matã - RiaDocumento84 páginasO Estudo Da Matã - RiaGabrieli LagoooAinda não há avaliações
- Estrutura AtômicaDocumento31 páginasEstrutura Atômicacarol.rocha7755Ainda não há avaliações
- Qumica 10ºanoDocumento3 páginasQumica 10ºanosab_scpAinda não há avaliações
- Glossario de QuimicaDocumento6 páginasGlossario de QuimicaLuiz Gustavo Gonçalves OliveiraAinda não há avaliações
- Resumo Química - 1° BimestreDocumento6 páginasResumo Química - 1° BimestreEmanuele VitóriaAinda não há avaliações
- Aula 2 - Quimica - Tabela PeriodicaDocumento44 páginasAula 2 - Quimica - Tabela PeriodicaRodolpho OmenaAinda não há avaliações
- 3ita 2021Documento22 páginas3ita 2021Jefferson HenriqueAinda não há avaliações
- AULAS Efluentesmarço2017Documento306 páginasAULAS Efluentesmarço2017Sandré SantosAinda não há avaliações
- Matéria e Suas Transformações.Documento21 páginasMatéria e Suas Transformações.Maria GabrielaAinda não há avaliações
- Aula 03. Calculo Estequiometrico e Balanceamento VFDocumento50 páginasAula 03. Calculo Estequiometrico e Balanceamento VFANNA LAURA SANTANA CHAGASAinda não há avaliações
- Apostila Química 1ºanoDocumento8 páginasApostila Química 1ºanoAdriana JesusAinda não há avaliações
- Química IDocumento2 páginasQuímica Ie6d1f340a9Ainda não há avaliações
- 1.2 - UFCD7 - Apresentacao - Reacções de Precipitacao e Equilibrio HeterogeneoDocumento72 páginas1.2 - UFCD7 - Apresentacao - Reacções de Precipitacao e Equilibrio HeterogeneoPaulo Alexandre Alves Massa100% (1)
- 01 - Classificação Da Matéria - Introdução À Teoria Atômica Da Matéria - 2018Documento57 páginas01 - Classificação Da Matéria - Introdução À Teoria Atômica Da Matéria - 2018Chinese WalkerAinda não há avaliações
- 1 TomoDocumento65 páginas1 TomoAbrahao GuimaraesAinda não há avaliações
- AULA 03 - Introdução A QuímicaDocumento36 páginasAULA 03 - Introdução A QuímicaFabian AzevedoAinda não há avaliações
- VOD-Aspectos Macroscópicos Propriedades Da Matéria, Substância, Mistura e Sistema-2019Documento11 páginasVOD-Aspectos Macroscópicos Propriedades Da Matéria, Substância, Mistura e Sistema-2019Israel SoaresAinda não há avaliações
- 1001 - Aula Sobre Introducao À QuimicaDocumento69 páginas1001 - Aula Sobre Introducao À QuimicaPaulo Roberto OliveiraAinda não há avaliações
- Química 1em 1ºbimDocumento54 páginasQuímica 1em 1ºbimraphael12stringsAinda não há avaliações
- Classificação Da Matéria - Introdução À Teoria Atômica Da Matéria - Química GeralDocumento57 páginasClassificação Da Matéria - Introdução À Teoria Atômica Da Matéria - Química GeralJaine Fernandes100% (1)
- CLF 2024.química - Prof.alan - Introdução Á Química - Cap. 1Documento28 páginasCLF 2024.química - Prof.alan - Introdução Á Química - Cap. 1marcmiranda566Ainda não há avaliações
- Química GeralDocumento7 páginasQuímica GeralemillyAinda não há avaliações
- Aula 1 - Intro Propriedades Da Metéria e Energia - QUI003 e QUI029Documento44 páginasAula 1 - Intro Propriedades Da Metéria e Energia - QUI003 e QUI029camila brazAinda não há avaliações
- Teste GlobalDocumento6 páginasTeste GlobalJoana CarvalhoAinda não há avaliações
- Unidade01 QuiDocumento28 páginasUnidade01 QuiPedroLesnecAinda não há avaliações
- Aula 3 - Átomos e Ligações QuímicasDocumento37 páginasAula 3 - Átomos e Ligações QuímicasHeloise RomiAinda não há avaliações
- Química PPT - Introdução A QuímicaDocumento61 páginasQuímica PPT - Introdução A QuímicaQuímica PPT83% (6)
- Quimica PDFDocumento3 páginasQuimica PDFShrek IVAinda não há avaliações
- Trabalho Quimica GeralDocumento19 páginasTrabalho Quimica GeralAngelo da LuzAinda não há avaliações
- Introdução QUI203 - 2023Documento77 páginasIntrodução QUI203 - 2023Tella GarciaAinda não há avaliações
- Conteúdo Da OBQjrDocumento4 páginasConteúdo Da OBQjrDenise LimaAinda não há avaliações
- Ligações Químicas 160519Documento46 páginasLigações Químicas 160519Guilherme LucchiniAinda não há avaliações
- Alguns Conseitos Básicos 2Documento12 páginasAlguns Conseitos Básicos 2Leonardo HitilavaliAinda não há avaliações
- Apresentação QUIMICADocumento52 páginasApresentação QUIMICAliapereira.frnd610Ainda não há avaliações
- Apresentação 1-MenezesDocumento16 páginasApresentação 1-MenezesADEILSON MENEZESAinda não há avaliações
- QuimicaDocumento23 páginasQuimicaTaldo A20Ainda não há avaliações
- RelatórioDocumento20 páginasRelatórioaavicente19Ainda não há avaliações
- NaturezaDocumento59 páginasNaturezarth moAinda não há avaliações
- Introducao QuimicaDocumento61 páginasIntroducao QuimicaFernanda De Oliveira Camacho100% (1)
- Aprofundamento-química-Como Me Organizar para Mandar Bem em Química-06-02-2023Documento10 páginasAprofundamento-química-Como Me Organizar para Mandar Bem em Química-06-02-2023Sr. Van Hastra do CarmoAinda não há avaliações
- INTRODUÇÃODocumento4 páginasINTRODUÇÃOCarlos FerreiraAinda não há avaliações
- AAS LicenciaturaDocumento62 páginasAAS Licenciaturawalas joãoAinda não há avaliações
- Química Revisão GeralDocumento37 páginasQuímica Revisão Geralsuzanachen13Ainda não há avaliações
- Aula T Cap1 Quimica BT MoodleDocumento34 páginasAula T Cap1 Quimica BT MoodleAriana RamosAinda não há avaliações
- A Porção Da Matéria Que Contém Entidades QuímicasDocumento11 páginasA Porção Da Matéria Que Contém Entidades QuímicasveniciuzAinda não há avaliações
- Quimica 18Documento29 páginasQuimica 18ascatanho100% (1)
- Aula 2Documento63 páginasAula 2Isabelly Alves Santos AlberghiniAinda não há avaliações
- 01 Subtancias MisturasDocumento17 páginas01 Subtancias MisturasPaulo Junior0% (1)
- Substancias Misturas e Suas Transformacoes Separacao MisturasDocumento88 páginasSubstancias Misturas e Suas Transformacoes Separacao MisturasAlberto SabinoAinda não há avaliações
- Ácidos e Bases de Brönsted e Lowry: Uma visão aplicada ao meio ambienteNo EverandÁcidos e Bases de Brönsted e Lowry: Uma visão aplicada ao meio ambienteAinda não há avaliações
- Provas Anteriores Efomm 2020Documento34 páginasProvas Anteriores Efomm 2020evelenAinda não há avaliações
- Apostila BBDocumento505 páginasApostila BBWagner Copiadora88% (8)
- Hidro ImprimirDocumento3 páginasHidro ImprimirevelenAinda não há avaliações
- Sistema Colonial ResumoDocumento10 páginasSistema Colonial ResumoevelenAinda não há avaliações
- Curso de Literatura (Trovadorismo, Humanismo e Classicismo)Documento16 páginasCurso de Literatura (Trovadorismo, Humanismo e Classicismo)Gustavo PazAinda não há avaliações
- Tabela PeriodicaDocumento11 páginasTabela PeriodicaevelenAinda não há avaliações
- Ingles - Pronomes TUdoDocumento3 páginasIngles - Pronomes TUdoevelenAinda não há avaliações
- Op 015fv 23 Caderno Prep Caixa GabDocumento14 páginasOp 015fv 23 Caderno Prep Caixa Gabevelen100% (1)
- Idade MédiaDocumento7 páginasIdade MédiaevelenAinda não há avaliações
- Regime MilitarDocumento7 páginasRegime MilitarevelenAinda não há avaliações
- Funcoes InorganicasDocumento2 páginasFuncoes InorganicasevelenAinda não há avaliações
- Idade MédiaDocumento7 páginasIdade MédiaevelenAinda não há avaliações
- Prop PeriodicasDocumento4 páginasProp PeriodicasevelenAinda não há avaliações
- Vegetação Do MundoDocumento4 páginasVegetação Do MundoevelenAinda não há avaliações
- Funções Da Linguagem e Vícios Da LinguagemDocumento3 páginasFunções Da Linguagem e Vícios Da LinguagemevelenAinda não há avaliações
- Orações Coordenadas e SubordinadasDocumento2 páginasOrações Coordenadas e SubordinadasevelenAinda não há avaliações
- Ficha #5 - Geometria Da CircunferênciaDocumento3 páginasFicha #5 - Geometria Da CircunferênciaPapa ÁfricaAinda não há avaliações
- FT FQA11 Física D2 SubD2 SubD3 CamposDocumento4 páginasFT FQA11 Física D2 SubD2 SubD3 CamposHugo AzevedoAinda não há avaliações
- Trabalho Efeito TúnelDocumento6 páginasTrabalho Efeito TúnelPriscilla FreddiAinda não há avaliações
- Planificação de Sólidos GeométricosDocumento3 páginasPlanificação de Sólidos GeométricosCesar Luiz PeixotoAinda não há avaliações
- 2 - Eletronica Automotiva BasicaDocumento69 páginas2 - Eletronica Automotiva BasicaSamael RudekAinda não há avaliações
- Prova de SubestaçãoDocumento6 páginasProva de SubestaçãoMiréli Binder VendruscoloAinda não há avaliações
- 2.9, PROVA - Aula 2 - ATOMICIDADE - Modelos AtômicosDocumento2 páginas2.9, PROVA - Aula 2 - ATOMICIDADE - Modelos AtômicosAndréa Marli Dos SantosAinda não há avaliações
- Catalogo MaquinasDocumento23 páginasCatalogo MaquinasengrfvAinda não há avaliações
- Gerdau - Guia Soldagem MigDocumento14 páginasGerdau - Guia Soldagem MigAlexandre SaitoAinda não há avaliações
- Introdução Resistência Dos MateriaisDocumento39 páginasIntrodução Resistência Dos MateriaisFabio Lunardi AntunesAinda não há avaliações
- Centroide LinhaDocumento17 páginasCentroide LinhaSandro ValerianoAinda não há avaliações
- Pilha de DaniellDocumento5 páginasPilha de DaniellaffsouzaAinda não há avaliações
- Manual Do Proprietario Honda Civic LX-2004Documento186 páginasManual Do Proprietario Honda Civic LX-2004Erico Antonio TeixeiraAinda não há avaliações
- Relatório 1Documento8 páginasRelatório 1Ana Carolina VivanAinda não há avaliações
- Ficha 11 Propriedades PeriodicasDocumento3 páginasFicha 11 Propriedades PeriodicasAgustynho MagimbaAinda não há avaliações
- Isometrias - Porto EditoraDocumento39 páginasIsometrias - Porto EditoraBranca JoaquimAinda não há avaliações
- Design de Embalagens - Papel Cartao de A A Z PDFDocumento65 páginasDesign de Embalagens - Papel Cartao de A A Z PDFSophia LeslieAinda não há avaliações
- Lubrificação - 2 (Uni)Documento54 páginasLubrificação - 2 (Uni)Karina AchcarAinda não há avaliações
- Relatório 6 - Síntese de Detergente LiquidoDocumento9 páginasRelatório 6 - Síntese de Detergente LiquidoMarcel AmorimAinda não há avaliações
- Distancias No UniversoDocumento19 páginasDistancias No Universosusanafariadias100% (1)
- As Profecias Da Piramide - Max Toth (A Pirâmide Submersa No Triângulo Das Bermudas)Documento11 páginasAs Profecias Da Piramide - Max Toth (A Pirâmide Submersa No Triângulo Das Bermudas)Alberto Alcolumbre Jr.Ainda não há avaliações
- Processo de ImersãoDocumento2 páginasProcesso de ImersãoDavi GóesAinda não há avaliações
- GED-2855 Fornecimento em Tensão Primária 15kV, 25kV e 34,5kV - Volume 1Documento74 páginasGED-2855 Fornecimento em Tensão Primária 15kV, 25kV e 34,5kV - Volume 1motta_cimtec100% (2)
- NBR 06091 - Ancoragem de Cintos de SegurancaDocumento9 páginasNBR 06091 - Ancoragem de Cintos de Segurancapac_aAinda não há avaliações
- A Primeira Lista VFDocumento17 páginasA Primeira Lista VFRodrigo Cruz50% (2)
- IT 017 - Coleta de Amostras para Cliente - Rev 02Documento4 páginasIT 017 - Coleta de Amostras para Cliente - Rev 02LimaanalabAinda não há avaliações
- Apostila de HidrostáticaDocumento17 páginasApostila de HidrostáticaAline LuzAinda não há avaliações
- A Origem Das Escalas Musicais PDFDocumento6 páginasA Origem Das Escalas Musicais PDFRanieque Ramos100% (1)
- Relatório de InspeçãoDocumento4 páginasRelatório de InspeçãoMikhail Tibes SoaresAinda não há avaliações