Escolar Documentos
Profissional Documentos
Cultura Documentos
EXERCICIOSUV
Enviado por
julia.d.rodriguesTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
EXERCICIOSUV
Enviado por
julia.d.rodriguesDireitos autorais:
Formatos disponíveis
UNIVERSIDADE FEDERAL DE VIÇOSA
DEPARTAMENTO DE QUÍMICA
MÉTODOS FÍSICOS DE IDENTIFICAÇÃO DE COMPOSTOS ORGÂNICOS
EXERCÍCIOS: ESPECTROSCOPIA UV-VISÍVEL
1. Discuta detalhadamente o efeito do pH sobre os espectros na região do ultravioleta de
compostos fenólicos e aminas aromáticas.
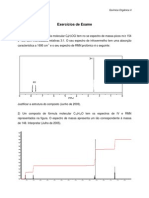
2. A irradiação da α-santonina, dissolvida em ácido acético, com luz ultravioleta, utilizando-se uma
lâmpada de mercúrio de alta pressão, resultou na formação dos compostos [1] (23%) e [2] (10%).
Quando a irradiação foi conduzida com a α-satonina dissolvida em uma mistura de água e
acetonitrila (9:7), foram obtidos os compostos [2] (36%) e [3] (12%).
a) Calcule os valores de λmax para cada um dos quatro compostos apresentados.
b) Com base nos valores de λmax obtidos, seria possível distinguir cada um dos
compostos dos demais? Justifique detalhadamente sua resposta.
3. O tratamento do cloreto de ácido aromático mostrado a seguir com AlCl3 pode resultar na
formação de dois compostos bicíclicos ([4] e [5]). O composto formado em maior
quantidade, quando dissolvido em etanol, apresentou em seu espectro no ultravioleta um
λmax igual a 274 nm. Qual é a fórmula estrutural desse composto? Justifique sua resposta.
4. O espectro no ultravioleta de um composto orgânico dissolvido em cicloexano apresentou
λmax= 303 nm e quando dissolvido em metanol exibiu λmax= 307 nm. Explique
detalhadamente qual é a natureza da transição que resultou nesses máximos de absorção.
Explique a variação nos valores de λmax observados
5. O tratamento de um mol 2-metilcicloeptanona com um mol Br2 na presença de quantidade
catalítica de PBr3 levou à formação de uma mistura de compostos que, ao ser tratada com
Li2CO3 em DMF a 100 °C resultou em um composto em 73% de rendimento. O espectro no
ultravioleta desse composto dissolvido em etanol apresentou λmax = 236 nm. Qual é a
fórmula estrutural provável para este composto?
6. A reação de adição de Me2CuLi à 2-(etoxicarbonilmetil)-cicloepta-2,4-6-trien-1-ona
resultou na formação do composto [6] (C16H12O3), cujo espectro no ultravioleta obtido
apresentou um máximo de absorção em 273 nm. Qual é a fórmula estrutural provável para
este composto?
7. Explique porque um solvente polar geralmente desloca o máximo da transição p→ p* para
maiores comprimentos de onda e a transição n→ p* para menores comprimentos de onda.
8. O espectro no ultravioleta da but-3-en-2-ona apresenta um máximo de absorção em 213 nm
e outro em 320 nm. Explique porque o espectro apresenta esses dois máximos, e qual deles
deve apresentar maior valor de ε.
9. O espectro no ultravioleta de um composto líquido de fórmula molecular C5H6 apresenta um
máximo de absorção em 240 nm. Proponha uma fórmula estrutural para o composto
compatível com esses dados.
10. Quais transições eletrônicas são possíveis de ocorrer quando os compostos listados a seguir
são irradiados com radiação na região do ultravioleta ?
a) CH4
b) CH3Cl
c) H2C=0
d) Br2
11. Explique as variações observadas nos valores de λmax para os seguintes compostos:
a) CH3Cl, λmax = 173 nm
b) CH3Br, λmax = 204 nm
c) CH3I, λmax = 258 nm
12. A cetona cíclica mostrada a seguir apresenta um máximo de absorção em λmax = 238 nm
(εmax = 2535). Explique essa observação.
13. Explique as diferenças observadas nos valores de λmax e εmax para os dois compostos
aromáticos isoméricos mostrados a seguir: Explique essa observação.
14. É possível distinguir os isômeros dos produtos naturais eremophilona e allo-eremophilona
por espectroscopia no ultravioleta? Explique detalhadamente sua resposta.
15. Para um composto recém sintetizado, com fórmula molecular C9H120, foi proposta a
fórmula estrutural dada a seguir. O espectro no ultravioleta desse composto foi obtido e se
observou um máximo em 300 nm, com absorvância igual a 1,34.
a) A estrutura proposta está correta? Caso negativo, proponha uma fórmula que
satisfaça os dados espectroscópicos fornecidos, mantendo o mesmo esqueleto
carbônico.
b) Se o espectro foi obtido com a amostra em uma célula com caminho óptico de 1
cm, e a partir de uma solução de 2 mg da amostra em 100 mL de solvente, calcule a
absortividade molar da substância.
Você também pode gostar
- Apostila Química Orgânica: Carbono, Dienos E AromáticosNo EverandApostila Química Orgânica: Carbono, Dienos E AromáticosAinda não há avaliações
- Lista de Exercicios 3Documento7 páginasLista de Exercicios 3Fabricio Dutra0% (1)
- Espectrofotometria Na Indústria FarmaceuticaDocumento12 páginasEspectrofotometria Na Indústria FarmaceuticaPatrícia Fernandes Do CarmoAinda não há avaliações
- Lista 1AODocumento3 páginasLista 1AOpatilos3884Ainda não há avaliações
- LISTA - Espectroscopia Eletrônica - FINALDocumento4 páginasLISTA - Espectroscopia Eletrônica - FINALAna PaulaAinda não há avaliações
- Lista 1 Unidade 1 2 e 3 Fund Química Eema 2015Documento3 páginasLista 1 Unidade 1 2 e 3 Fund Química Eema 2015Bruna GuilhermeAinda não há avaliações
- Relatório Projeto 1Documento16 páginasRelatório Projeto 1teodoro2512Ainda não há avaliações
- 1 Lista 2017 - Princípios de QuímicaDocumento3 páginas1 Lista 2017 - Princípios de QuímicaBruna guiAinda não há avaliações
- Prova 2016.2Documento3 páginasProva 2016.2Felizarda Raimunda MahumanaAinda não há avaliações
- Infravermelho - FundamentosDocumento15 páginasInfravermelho - FundamentosAnonymous xauweRn4wAinda não há avaliações
- Espectros de MassaDocumento4 páginasEspectros de MassaAlcidênio PessoaAinda não há avaliações
- 1a LISTA QuímicaDocumento2 páginas1a LISTA QuímicacopiadorsafadoAinda não há avaliações
- Lista1qui102 100716121952 Phpapp01Documento5 páginasLista1qui102 100716121952 Phpapp01iolandafrotaAinda não há avaliações
- ExerciciosDocumento9 páginasExerciciosadeliaAinda não há avaliações
- Lista 1 Quimica InstrumentalDocumento3 páginasLista 1 Quimica InstrumentalduduAinda não há avaliações
- Departamento de Química Orgânica e Inorgânica: Conceitos Fundamentais e EstequiometriaDocumento6 páginasDepartamento de Química Orgânica e Inorgânica: Conceitos Fundamentais e EstequiometriaMaria JúlliaAinda não há avaliações
- Tulueno, Antraceno e AftalenoDocumento14 páginasTulueno, Antraceno e AftalenovaldemarbastanteAinda não há avaliações
- 03 Exercícios UV VisDocumento4 páginas03 Exercícios UV VisLeonardo Pereira100% (1)
- Aula 03 de 05 (Espectroscopia UV, IV, AA, Flourescencia, Fosforescencia) - ProfDocumento114 páginasAula 03 de 05 (Espectroscopia UV, IV, AA, Flourescencia, Fosforescencia) - ProfNelson VirgilioAinda não há avaliações
- Infravermelho - Lista de Exercícios 2014Documento10 páginasInfravermelho - Lista de Exercícios 2014Chemical SallesAinda não há avaliações
- 2015 SemifinalDocumento16 páginas2015 SemifinaliolaAinda não há avaliações
- FT Revisão Química 10 Propriedades e Transformações Da Matéria 20-21Documento5 páginasFT Revisão Química 10 Propriedades e Transformações Da Matéria 20-21jotaAinda não há avaliações
- Lista de Exercícios II GabaritoDocumento18 páginasLista de Exercícios II GabaritoThais Eliel De SouzaAinda não há avaliações
- Lista 4 - QI2 2019Documento2 páginasLista 4 - QI2 2019walas joãoAinda não há avaliações
- Gabarito AromaticidadeDocumento7 páginasGabarito AromaticidadeLucas CalvetAinda não há avaliações
- Ficha FQDocumento2 páginasFicha FQHelenaMagalhaesAinda não há avaliações
- 1-Ficha Exerccios Quimica 1parte - 2223 - tp1Documento4 páginas1-Ficha Exerccios Quimica 1parte - 2223 - tp1Gabriel PereiraAinda não há avaliações
- Lista de Química 1° A.P.2Documento3 páginasLista de Química 1° A.P.2Hiuri Oliveira VasquesAinda não há avaliações
- Lista de Exercicios de Ressonancia Magnetica NuclearDocumento11 páginasLista de Exercicios de Ressonancia Magnetica NuclearVanin Silva De SouzaAinda não há avaliações
- Reação de Substituição em AlcanosDocumento26 páginasReação de Substituição em AlcanosGleison100% (1)
- Le 2 CQDocumento4 páginasLe 2 CQFazisvaldo PimentãoAinda não há avaliações
- Exp. 3 - Espectroscopia de AbsorçãoDocumento12 páginasExp. 3 - Espectroscopia de AbsorçãoLUCAS OLIVEIRA CESARAinda não há avaliações
- Prova Mestrado IQ Unicamp 2011-2sDocumento7 páginasProva Mestrado IQ Unicamp 2011-2srennan_ps49950% (2)
- Semifinal TesteDocumento10 páginasSemifinal TesteDiogo Oliveira como alunoAinda não há avaliações
- Exercicios de ExameDocumento3 páginasExercicios de ExameAlberto GomesAinda não há avaliações
- 2021 SemifinalDocumento12 páginas2021 SemifinaliolaAinda não há avaliações
- Prática 8 Inorgânica 2Documento3 páginasPrática 8 Inorgânica 2Leilane Natsumi Alves KanbaraAinda não há avaliações
- 04-Espectroscopia de Absorção MolecularDocumento20 páginas04-Espectroscopia de Absorção MolecularYURI MARTINS NUNESAinda não há avaliações
- Recuperação Final - Quimica - 3pvDocumento2 páginasRecuperação Final - Quimica - 3pvGabriel MaiaAinda não há avaliações
- Lista 1 PDFDocumento3 páginasLista 1 PDFThierry RodriguesAinda não há avaliações
- 0140 Lista1 2010Documento3 páginas0140 Lista1 2010Diógenes LimaAinda não há avaliações
- Revisão Sobre IsomeriaDocumento12 páginasRevisão Sobre IsomeriaIgor Botelho De Almeida100% (1)
- Outras Reações Na Química OrgânicaDocumento14 páginasOutras Reações Na Química OrgânicaGleisonAinda não há avaliações
- Exercícios de Química AnalíticaDocumento7 páginasExercícios de Química AnalíticaÁghata CostaAinda não há avaliações
- Ciências Físico-Químicas 10º Ano Ficha de Trabalho Preparação Teste 1Documento14 páginasCiências Físico-Químicas 10º Ano Ficha de Trabalho Preparação Teste 1Lu LopesAinda não há avaliações
- CinéticaDocumento6 páginasCinéticaCarlos LiraAinda não há avaliações
- Cespe 2012 Pefoce Perito Criminal Quimica ProvaDocumento8 páginasCespe 2012 Pefoce Perito Criminal Quimica ProvaThiago FagundesAinda não há avaliações
- Infravermelho - Lista de Exercícios 2014Documento13 páginasInfravermelho - Lista de Exercícios 2014ÉricoGrissa0% (1)
- Resolução de Isômeros Ópticos Oficial 2Documento6 páginasResolução de Isômeros Ópticos Oficial 2Leandro Shiroma100% (1)
- Interpretação de FT-IRDocumento4 páginasInterpretação de FT-IRlfbb0132Ainda não há avaliações
- 2 Lista de Exercícios - Unidade 5Documento2 páginas2 Lista de Exercícios - Unidade 5Joana D'arc UFPIAinda não há avaliações
- Curso de Aeco Completo - TransparenciaDocumento397 páginasCurso de Aeco Completo - Transparencialeticiams_Ainda não há avaliações
- Lista de Exercícios 1 - Fenomenos de Transporte III - DifusãoDocumento2 páginasLista de Exercícios 1 - Fenomenos de Transporte III - DifusãoFelipe Castro0% (1)
- Lista1 FQ 2015Documento6 páginasLista1 FQ 2015FábioAlvesAinda não há avaliações
- 04 Estereoquimica Exercicios Propostos QA 2012Documento8 páginas04 Estereoquimica Exercicios Propostos QA 2012Indi Assis RodriguesAinda não há avaliações
- Determinação SimultâneaDocumento12 páginasDeterminação SimultâneapitchyrilloAinda não há avaliações
- LISTA DE EXERCICIOS - 2o BIMESTRE 2011Documento3 páginasLISTA DE EXERCICIOS - 2o BIMESTRE 2011Valdir OliveiraAinda não há avaliações
- Lista de Exercícios de EstereoDocumento4 páginasLista de Exercícios de EstereoRafael GrossoAinda não há avaliações
- QUI236 - Prática 4Documento6 páginasQUI236 - Prática 4julia.d.rodriguesAinda não há avaliações
- QUI152 - Lista de Exercícios - 03Documento10 páginasQUI152 - Lista de Exercícios - 03julia.d.rodriguesAinda não há avaliações
- QUI236 - Prática 3Documento6 páginasQUI236 - Prática 3julia.d.rodriguesAinda não há avaliações
- Prática 02Documento17 páginasPrática 02julia.d.rodriguesAinda não há avaliações
- Prática 01Documento21 páginasPrática 01julia.d.rodriguesAinda não há avaliações
- CadernodepraticasQUI320 14082019112954Documento68 páginasCadernodepraticasQUI320 14082019112954julia.d.rodriguesAinda não há avaliações
- Prática 8Documento4 páginasPrática 8julia.d.rodriguesAinda não há avaliações
- Prática 10Documento6 páginasPrática 10julia.d.rodriguesAinda não há avaliações
- Ficha Tecnica 151 Oleo de Girassol Rev 05Documento2 páginasFicha Tecnica 151 Oleo de Girassol Rev 05NYAM CYRIL MUNANGAinda não há avaliações
- Fispq Detergente Amoniaco Ali CleanDocumento3 páginasFispq Detergente Amoniaco Ali CleanELIANEAinda não há avaliações
- Adição À CarbonilaDocumento2 páginasAdição À CarbonilaDaniel BassoAinda não há avaliações
- Biologia - FotossínteseDocumento5 páginasBiologia - FotossínteseIves LimaAinda não há avaliações
- Insalubridade Devido Ao Uso de Óleos Minerais e GraxasDocumento4 páginasInsalubridade Devido Ao Uso de Óleos Minerais e GraxasExata CorbeliaAinda não há avaliações
- Biologia 8a Classe PDFDocumento32 páginasBiologia 8a Classe PDFPaulo ConceicaoAinda não há avaliações
- Uímica: Ead - Ita/ImeDocumento9 páginasUímica: Ead - Ita/Imethyago montteiroAinda não há avaliações
- Revisaoufsc 2023Documento44 páginasRevisaoufsc 2023JANAÍNA DOS SANTOSAinda não há avaliações
- BIO - AP - Bioquímica - Exercícios - Carboidratos e LipídeosDocumento10 páginasBIO - AP - Bioquímica - Exercícios - Carboidratos e Lipídeoscassio.batista1Ainda não há avaliações
- Titulação de Uma Solução de Ácido Acético (Vinagre)Documento3 páginasTitulação de Uma Solução de Ácido Acético (Vinagre)Andressa GlinskiAinda não há avaliações
- FT - 05.00.08200 - Primer Poliuretano CinzaDocumento1 páginaFT - 05.00.08200 - Primer Poliuretano CinzaRodrigo GobboAinda não há avaliações
- Descomplica Ebook QuimicaDocumento50 páginasDescomplica Ebook QuimicaMikailOpintoAinda não há avaliações
- Sem Licitacao Anexo 0176Documento7 páginasSem Licitacao Anexo 0176PauloHBMiguelAinda não há avaliações
- Avaliação Do Emprego de Biossurfactante Na Biorremediação de Solos Contaminados Com Óleo DieselDocumento162 páginasAvaliação Do Emprego de Biossurfactante Na Biorremediação de Solos Contaminados Com Óleo DieselLUCAS PAIXÃO VIEIRAAinda não há avaliações
- Processos Biologicos - Capitulo 1Documento46 páginasProcessos Biologicos - Capitulo 1Fiscal PelotenseAinda não há avaliações
- Quimica OrganicaDocumento14 páginasQuimica OrganicaGoverno AmedeAinda não há avaliações
- Atividade 4 - Saúde - Biologia e Bioquímica Humana - 53-2023Documento3 páginasAtividade 4 - Saúde - Biologia e Bioquímica Humana - 53-2023Cavalini Assessoria AcadêmicaAinda não há avaliações
- Mitocôndria e Respiração Celular PDFDocumento18 páginasMitocôndria e Respiração Celular PDFpizza de mussarelaAinda não há avaliações
- Histórico Da Química OrgânicaDocumento15 páginasHistórico Da Química OrgânicaGabryelle MartinsAinda não há avaliações
- Fispq Hipoclorito de SodioDocumento11 páginasFispq Hipoclorito de SodioHaroldo MarreiroAinda não há avaliações
- Catálogo EoraDocumento24 páginasCatálogo EorasuportemarliriosAinda não há avaliações
- Oxidação de Aminoácidos e Produção de UreiaDocumento10 páginasOxidação de Aminoácidos e Produção de UreiaErika BennaiaAinda não há avaliações
- Introdução A Química OrgânicaDocumento22 páginasIntrodução A Química OrgânicaKauã CoelhoAinda não há avaliações
- Relatório Bioq - CarboidratosDocumento14 páginasRelatório Bioq - CarboidratosJoão Victor SodreAinda não há avaliações
- Exp. ExtraçãoDocumento4 páginasExp. ExtraçãoRansMilerDantasAinda não há avaliações
- ENVIRONMENTAL APPLICATIONS - Soxhlet Extraction - En.ptDocumento9 páginasENVIRONMENTAL APPLICATIONS - Soxhlet Extraction - En.ptCarol SilvaAinda não há avaliações
- Influencia Dos Plastificantes de Origem Vegetal em PVCDocumento10 páginasInfluencia Dos Plastificantes de Origem Vegetal em PVCGustavoAinda não há avaliações
- A Formação de Nódulo em LeguminosasDocumento36 páginasA Formação de Nódulo em Leguminosasgustavo lopesAinda não há avaliações
- 2b-Lignanas, Ligninas e Suberização: Tecido Suberizado Tecido LenhificadoDocumento26 páginas2b-Lignanas, Ligninas e Suberização: Tecido Suberizado Tecido LenhificadoMatheus AlmeidaAinda não há avaliações
- FO Inspeção de Material QuebrávelDocumento1 páginaFO Inspeção de Material QuebrávelBruna RazzanoAinda não há avaliações