Escolar Documentos
Profissional Documentos
Cultura Documentos
Aula 05 - Ligações Químicas - EnEM 2023
Enviado por
Endro PeixotoDireitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Aula 05 - Ligações Químicas - EnEM 2023
Enviado por
Endro PeixotoDireitos autorais:
Formatos disponíveis
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Aula 05 – Ligações Químicas
Aprenda como os átomos se ligam e as propriedades que esses
compostos adquirem com isso.
AULA 05 – LIGAÇÕES QUÍMICAS 1
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
SUMÁRIO
INTRODUÇÃO 4
1. ESTABILIDADE ATÔMICA 4
1ª Diretriz: Tendência Eletrônica Da Classificação Dos Elementos Químicos. 5
2ª Diretriz: Tendências Eletrônicas Dos Ametais E Do Hidrogênio. 6
3ª Diretriz: Tendências Eletrônicas Dos Metais. 7
2. TIPOS DE LIGAÇÕES ENTRE OS ÁTOMOS 10
3. LIGAÇÃO IÔNICA 11
Fórmula Iônica 12
Propriedades Dos Compostos Iônicos 17
4. LIGAÇÃO METÁLICA 24
Ligação Metálica 24
Propriedades Metálicas 26
Ligas Metálicas 29
5. LIGAÇÃO COVALENTE 35
Montando moléculas. 38
Ligação covalente coordenada ou dativa. 40
Exceções à Regra do Octeto. 42
Ressonância. 44
Casos Importantes. 44
6. QUESTÕES FUNDAMENTAIS 45
7. JÁ CAIU NOS PRINCIPAIS VESTIBULARES 47
Ligação Iônica. 47
AULA 05 – LIGAÇÕES QUÍMICAS 2
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Ligação Metálica. 54
Ligação Covalente. 60
8. GABARITO SEM COMENTÁRIOS 69
9. RESOLUÇÕES DAS QUESTÕES FUNDAMENTAIS 70
10. QUESTÕES RESOLVIDAS E COMENTADAS 72
11. CONSIDERAÇÕES FINAIS DAS AULAS 106
12. REFERÊNCIAS 107
AULA 05 – LIGAÇÕES QUÍMICAS 3
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Introdução
Seja bem-vindo(a) a mais uma aula de Química Geral. Agora é o momento de
compreender sobre as propriedades dos elementos químicos e as ligações químicas, que é pré-
requisito para entender geometria molecular, interações intermoleculares, equilíbrio iônico,
orgânica, etc. Enfim, entendeu né?! Essa aula é uma das principais, portanto, o desenvolvimento
dos tópicos será bem detalhado, passo a passo, para não haver confusão.
Are you ready? Não esqueça da água, do café e de um lanche.
1. Estabilidade Atômica
Todas as substâncias, na natureza, tendem a adquirir estabilidade. Entende-se por
estabilidade: menor estado energético em que a substância é encontrada. Portanto, os átomos
são encontrados, no planeta Terra, ligados a fim de adquirir estabilidade eletrônica. Os únicos
elementos que não se ligam a outros para adquirir estabilidade são os gases nobres. Sabendo
disso, em 1916, Lewis e Kossel elaboraram uma teoria a partir da configuração eletrônica dos
gases nobres e denominaram teoria do octeto.
Teoria do octeto ou regra do octeto: muitos átomos adquirem estabilidade eletrônica
quando apresentam oito elétrons na camada de valência.
Caro estudante, essa regra é a mais difundida no ensino médio para compreendermos a
estabilidade dos átomos, que é pré-requisito para entender as ligações químicas. Atualmente, o
modelo mais aceito que justifica as ligações químicas é a teoria do orbital atômico (TOA) e a
Teoria do Orbital Molecular (TOM). Porém, a TOA envolve muitos conhecimentos matemáticos
que não compõem a matriz curricular do ensino médio. Ou seja, a fim de facilitar e aprimorar seu
entendimento sobre química, tomando como base a regra do octeto, irei definir a regra de
estabilidade atômica de maneira simplificada.
Regra simplificada de estabilidade atômica: os átomos tendem a ficar estáveis quando
apresentam configuração eletrônica semelhante a um gás nobre.
Os gases nobres apresentam as seguintes configurações eletrônicas:
AULA 05 – LIGAÇÕES QUÍMICAS 4
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Hélio 1s2
Neônio [He] 2s2 2p6
Argônio [Ne] 3s2 3p6
Kriptônio [Ar] 4s2 3d10 4p6
Xenônio [Kr] 5s2 4d10 5p6
Radônio [Xe] 6s2 4f14 5d10 6p6
Os átomos apresentam tendência a ganhar ou perder elétrons a fim de apresentar
configuração eletrônica semelhante a um gás nobre. Por exemplo, como os elementos
hidrogênio, sódio, magnésio, nitrogênio e flúor atingem a estabilidade eletrônica?
Percebemos que alguns elementos apresentam a tendência de perder elétrons e outros
de ganhar elétrons, assim irei direcionar o seu estudo por algumas diretrizes de aprendizado.
Essas diretrizes direcionam a sua compreensão de estabilidade atômica dos elementos
químicos.
1ª Diretriz: Tendência Eletrônica Da Classificação Dos
Elementos Químicos.
Nas condições ambientes de temperatura e pressão, tem-se:
AULA 05 – LIGAÇÕES QUÍMICAS 5
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Gás nobre Não altera a quantidade de elétrons.
Estabilidade atômica
Ametal Necessita de elétron(s).
Hidrogênio Necessita 1 elétron.
Metal Perde elétron(s).
Os gases nobres não ganham e nem perdem elétrons em condições ambientes de
temperatura e pressão. A seguir, a tendência eletrônica dos outros grupos.
2ª Diretriz: Tendências Eletrônicas Dos Ametais E Do
Hidrogênio.
Os ametais apresentam forte força de atração sobre os elétrons de valência devido ao
tamanho do raio atômico e à quantidade de prótons em seus núcleos. Os ametais necessitam
de mais elétrons na camada de valência para uma configuração eletrônica estável, que é
semelhante ao gás nobre mais próximo. A forma mais estável do hidrogênio é a que possui dois
elétrons em sua única camada eletrônica.
A fim de atingir a condição de estabilidade eletrônica, determina-se a quantidade de
elétrons necessária de cada ametal e do hidrogênio:
AULA 05 – LIGAÇÕES QUÍMICAS 6
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
O grupo mais próximo dos gases nobres – os halogênios – necessita receber um elétron;
o segundo grupo, recebe dois elétrons; o terceiro, recebe 3; e o quarto grupo, recebe 4 elétrons.
O elemento boro necessita de três elétrons porque é uma exceção à estabilidade da
configuração eletrônica de um gás nobre, portanto, o átomo de boro possui 3 elétrons na camada
de valência e se estabiliza com 6 elétrons na camada de valência.
3ª Diretriz: Tendências Eletrônicas Dos Metais.
Os metais apresentam baixa atração sobre os elétrons de valência, portanto tendem a
perder elétrons. A estabilidade dos cátions dos metais é dividida em dois blocos: valência fixa e
valência variável.
Cátions de metais de valência fixa.
Os cátions de metais de valência fixa são os metais que, ao formarem cátions, perdem
sempre a mesma quantidade de elétrons para adquirirem a estabilidade eletrônica. Os metais de
valência fixa mais importantes são:
AULA 05 – LIGAÇÕES QUÍMICAS 7
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Li+ Be2+ A 3+
Zn2+ Ag+
Na+ Mg2+
K+ Ca2+
Rb+ Sr2+
Cs+ Ba2+
Fr+ Ra2+
Nem todos os metais apresentam configuração eletrônica semelhante a um gás nobre,
por exemplo a distribuição eletrônica do cátion bivalente do zinco.
30Zn: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 → 30Zn
2+: 1s2 2s2 2p6 3s2 3p6 3d10
Portanto, não se aplica com rigor a regra da estabilidade atômica para os metais. A
maneira que recomendo para saber a estabilidade dos metais é decorar a tabela dos cátions de
metais de valência fixa.
Cátions de metais de valência variável.
Os cátions de metais de valência variável são os metais que, ao formarem cátions, perdem
quantidades variáveis de elétrons para adquirirem a estabilidade eletrônica. A pergunta que pode
estar passando por sua cabeça deve ser: como irei saber quantos elétrons o metal de valência
variável perde? A resposta para essa pergunta é: dependerá de qual átomo ou grupo de átomos
esse metal estiver combinado. Porém, muita calma por enquanto, só quero que você entenda
que existem valências variáveis. Os metais que não estão listados em “metais de valência fixa”
apresentam valência variável. Abaixo são listados os metais de valência variável mais
encontrados nas provas de vestibular:
AULA 05 – LIGAÇÕES QUÍMICAS 8
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Por que alguns metais apresentam valência variável?
A fim de ilustrar esse tópico, vamos falar de um caso específico: o elemento ferro. O
elemento ferro apresenta 26 prótons e seus dois cátions formados são Fe 2+ e Fe3+. A distribuição
eletrônica do átomo e de seus cátions é representado abaixo.
Os elétrons que apresentam maior facilidade para serem retirados do átomo ferro
encontram-se na última camada eletrônica, ou seja, no subnível 4s. Assim, o ferro perde elétrons
da camada de valência. Se o ferro perder três elétrons, ele apresentará todos os orbitais do
subnível 3d com um elétron desemparelhado e essa configuração confere um ganho de
estabilidade ao íon formado. Veja um exemplo que explica a possibilidade de valência variável
para um metal do bloco p:
AULA 05 – LIGAÇÕES QUÍMICAS 9
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Perceba que os cátions formados pelo elemento chumbo apresentam todos os elétrons
emparelhados, consequentemente, confere maior estabilidade.
2. Tipos De Ligações Entre Os Átomos
Com exceção dos gases nobres, os átomos realizam ligações químicas para atingirem
condições estáveis. Existem três tipos de ligações químicas: ligação iônica, ligação covalente e
a ligação metálica.
A ligação iônica ocorre quando há transferência de elétrons entre os átomos. Essa ligação
é encontrada nas combinações: metal-ametal e metal-hidrogênio. Os metais tendem a perder
elétrons e o hidrogênio, ou os ametais, tendem a receber elétrons.
A ligação covalente ocorre quando há compartilhamento de elétrons. Essa ligação é
encontrada nas combinações: ametal-ametal, ametal-hidrogênio e hidrogênio-hidrogênio. O
ametal e o hidrogênio necessitam aumentar a quantidade de elétrons na camada de valência
para adquirirem a estabilidade eletrônica, devido a isso acabam compartilhando elétrons.
A ligação metálica ocorre quando há deslocalização de elétrons entre os átomos
metálicos, majoritariamente.
Portanto,
AULA 05 – LIGAÇÕES QUÍMICAS 10
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Lembre-se que os gases nobres não formam combinações com átomos para formar
ligações químicas, pois já são estáveis isolados.
3. Ligação Iônica
A ligação iônica é formada a partir da interação entre os íons: cátions e ânions. A força
que mantém esses íons ligados é a força eletrostática, ou seja, cargas opostas se atraem e
cargas iguais se repelem. O cátion é formado quando um átomo perde elétron e o ânion é
formado quando ele ganha elétron. Os metais tendem a ser cátions, e o hidrogênio e os ametais
tendem a ser os ânions.
Ocorrência da ligação iônica:
metal + ametal
ligação iônica
metal + hidrogênio
Simplificadamente, para Linus Pauling, uma ligação com transferência de elétrons ocorre
quando o valor da diferença de eletronegatividade entre os elementos é maior ou igual a 1,7.
Portanto, podemos identificar os compostos que apresentam ligação iônica por:
AULA 05 – LIGAÇÕES QUÍMICAS 11
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
NaC CaO H2O CO2
Valores de Na = 0,9 Ca = 1,0 H = 2,1 C = 2,5
eletronegatividade:
Cl = 3,0 O = 3,5 O = 3,5 O = 3,5
Diferença de 3,0 – 0,9 = 2,1 3,5 – 1,0 = 2,5 3,5 – 2,1 = 1,4 3,5 – 2,5 = 1,0
eletronegatividade:
2,1 > 1,7 2,5 > 1,7 1,4 < 1,7 1,0 < 1,7
Conclusão: Iônico Iônico Não é iônico Não é iônico
Existem várias exceções para essa regra da diferença de eletronegatividade de Linus
Pauling, sendo uma delas a ligação HF. As eletronegatividades dos elementos hidrogênio e do
flúor são 2,1 e 4,0, respectivamente. Portanto, a diferença de eletronegatividade entre eles é de
1,9, que é maior que 1,7. Porém, a ligação entre flúor e hidrogênio não é iônica, mas sim
covalente. Essa ligação será explicada futuramente nesta aula.
Fórmula Iônica
A ligação iônica será ilustrada pela combinação de dois elementos químicos: sódio e cloro.
O elemento sódio possui tendência a perder 1 elétron e o cloro apresenta tendência a ganhar 1
elétron, portanto, no contato entre eles, ocorre a transferência de 1 elétron. A seguir é
representado a formação da ligação entre esses átomos utilizando a fórmula de Lewis ou
fórmula eletrônica. A fórmula de Lewis indica os átomos e seus respectivos elétrons na camada
de valência.
AULA 05 – LIGAÇÕES QUÍMICAS 12
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Porém os compostos iônicos não são formados, somente, pela combinação de 1 cátion e
1 ânion. O composto iônico é um aglomerado de cátions e ânions. Os cátions circundam os
ânions e vice-versa.
Qual seria a fórmula do composto formado? Na12C12? Não! Os compostos iônicos são
representados por uma fórmula iônica que representa a proporção mínima entre o cátion e o
ânion em que o somatório das cargas entre os íons seja igual a zero.
Figura 5 - estrutura tridimensional de um composto iônico [Fonte: OSweetNature/Shutterstock].
Existem diversas formas de empacotamento de partículas iônicas. Essas diferenças de
empacotamento serão apresentadas em breve, na aula de retículos cristalinos.
AULA 05 – LIGAÇÕES QUÍMICAS 13
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Fórmula iônica: (cátion)x(ânion)y
A seguir mais exemplos das fórmulas iônicas dos compostos produzidos pela combinação
entre metais e ametais:
Combinação: Mg e F Ca e O Al e S
Condição de 𝑡𝑒𝑛𝑑ê𝑛𝑐𝑖𝑎 𝑡𝑒𝑛𝑑ê𝑛𝑐𝑖𝑎 𝑡𝑒𝑛𝑑ê𝑛𝑐𝑖𝑎
Mg → Mg2+ Ca → Ca2+ Al → Al3+
estabilidade de
cada elemento: 𝑡𝑒𝑛𝑑ê𝑛𝑐𝑖𝑎 𝑡𝑒𝑛𝑑ê𝑛𝑐𝑖𝑎 𝑡𝑒𝑛𝑑ê𝑛𝑐𝑖𝑎
F→ F- O→ O2- S→ S2-
Íons formados: Mg2+ e F- Ca2+ e O2- Al3+ e S2-
Fórmula iônica: MgF2 CaO Al2S3
Como identificar o cátion e o ânion a partir da fórmula iônica?
1º Passo: identifique a carga de valência fixa do ânion e/ou do cátion.
2º Passo: identifique a carga e a quantidade dos cátions e ânions.
3º Passo: balanceie as cargas entre os íons – o somatório das cargas de todos os cátions e
ânions deve ser igual a zero).
Exemplos:
Fórmula iônica: FeBr3 CaCO3 PbO2 NaHCO3
1º passo: 𝑡𝑒𝑛𝑑ê𝑛𝑐𝑖𝑎 𝑡𝑒𝑛𝑑ê𝑛𝑐𝑖𝑎 𝑡𝑒𝑛𝑑ê𝑛𝑐𝑖𝑎 𝑡𝑒𝑛𝑑ê𝑛𝑐𝑖𝑎
Fe?+ → cátion Ca → Ca2+ Pb?+ → cátion Na → Na+
Identifique as
de valência variável de valência variável
cargas dos ânions CO3 → CO3?- HCO3 → HCO3?-
e os cátions de 𝑡𝑒𝑛𝑑ê𝑛𝑐𝑖𝑎 𝑡𝑒𝑛𝑑ê𝑛𝑐𝑖𝑎
valência fixa. Br → Br- O→ O2-
2º passo: 1 cátion Fe?+ 1 cátion Ca2+ 1 cátion Pb?+ 1 cátion Na+
proporção entre
cátions e ânions. e e e e
AULA 05 – LIGAÇÕES QUÍMICAS 14
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
3 ânions Br- 1 ânion CO3?- 2 ânions O2- 1 ânion HCO3?-
3º passo: balanceie
as cargas.
Cátion e Ânion: Fe3+ Ca2+ Pb4+ Na+
Br- CO32- O2- HCO3-
Futuramente, na aula de funções inorgânicas, será apresentada outra forma de determinar
a carga dos ânions poliatômicos. Essa maneira será construída a partir das fórmulas dos ácidos
e bases.
Um átomo metálico não expulsa os seus elétrons de valência, ou seja, ele, em seu estado
fundamental, permanece com seu elétron até que alguma energia seja suficiente para retirá-lo.
A partir da reação entre sódio metálico e gás cloro, como seria a estimativa energética da reação
para formação do cloreto de sódio, em seu estado sólido? A transformação total energética
compreende, basicamente, a transferência de elétrons, a mudança de estado físico e à
organização das partículas.
Primeiramente, estima-se a quantidade de energia envolvida na transferência do elétron.
Para retirar um elétron de um átomo metálico, é necessário fornecer energia e o valor dessa
energia corresponde à energia de ionização. Um ametal, por sua vez, ao receber um elétron
libera energia, devido à sua condição de maior estabilidade (vide afinidade eletrônica).
O reagente utilizado é o C2, que apresenta dois átomos de cloro ligados quimicamente.
Assim, o rompimento dessa ligação requer absorção de energia.
AULA 05 – LIGAÇÕES QUÍMICAS 15
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
As mudanças de estado também diferem em energia. O sistema gasoso apresenta maior
energia cinética que o sólido. Portanto, a reação do gás cloro e formação do cloreto de sódio,
libera energia devido a mudança de estado físico.
Na natureza, quanto maior a organização de um sistema, maior a quantidade de energia
armazenada nesse processo. Por exemplo, ao construir um castelo de cartas, é necessário
gastar bastante energia para poder organizar toda a estrutura. Essa estrutura, uma vez montada,
apresenta a energia gasta transformada em energia potencial ou energia armazenada. O
composto iônico, no estado sólido, é uma estrutura organizada, logo, armazena energia para
poder ser organizado.
Portanto, juntando todas essas etapas energéticas, tem-se:
Liberação de energia Absorção de energia
Experimentalmente, sabemos que a energia liberada na reação de gás cloro com o sódio
metálico é de 98,2 kcal. Essa energia pode ser calculada pelo somatório de diversas etapas
energéticas:
AULA 05 – LIGAÇÕES QUÍMICAS 16
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Ao final de todas as etapas, conclui-se que a formação do cloreto de sódio sólido a partir
de sódio sólido e cloro gasoso é exotérmico.
Propriedades Dos Compostos Iônicos
Os compostos iônicos:
são duros.
Figura 3 - compostos iônicos apresentam dificuldade de serem
penetrados e, geralmente, apresentam grande resistência a serem
riscados [fonte: Deniz Altindas/unsplash].
AULA 05 – LIGAÇÕES QUÍMICAS 17
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
são quebradiços.
Figura 3 - parede com rachadura [fonte: struppi0601/pixabay].
são sólidos nas condições ambientes.
Figura 2 - estrutura sólida iônica [fonte: Flickr].
apresentam elevadas temperaturas de fusão e
ebulição.
Figura 3 - bloco de material iônico resistente à alta temperatura
[fonte: NjoyHarmony/Pixabay].
AULA 05 – LIGAÇÕES QUÍMICAS 18
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
conduzem corrente elétrica no estado líquido e
dissolvidos em água.
Figura 3 - condução de eletricidade [fonte: TheoLeo/Pixabay].
O sal de cozinha não possui calorias, por que existe o sal light?
A caloria (cal) é uma unidade de medida para
energia e não é adotada como Unidade Internacional
de Unidades, mas sim o Joule (J). Contudo, caloria e
quilocaloria são unidades utilizadas para comparar a
energia armazenada em alimentos e a energia gasta
em atividades físicas. Os alimentos fornecem energia,
basicamente, em três constituintes: carboidratos,
Figura 1Figura 3 - colher com
Figura 2 - sal [fonte:
colher Unsplash
com sal [fonte: Unsplash].
proteínas e lipídios. A tabela abaixo relaciona diversos
alimentos e atividades e suas respectivas calorias.
Kcal/porção Atividade Kcal/hora
Alimento física
Alface 4 kcal/2 folhas (20g) Andar 350
Apresuntado 22 kcal/fatia(15 g) Correr 800
AULA 05 – LIGAÇÕES QUÍMICAS 19
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Pão francês 135 kcal/unidade (50 g) Dormir 60
Pão de queijo 68 kcal/unidade (20 g) Pedalar 450
Pão integral de trigo 130,5 kcal/unidade (50 g) Falar 100
Lasanha 139 kcal/porção (100 g) Nadar 500
Pastel de queijo 380 kcal/unidade (100 g) Rir 90
Açaí 530 kcal/copo pequeno (240 mL) Meditar 50
Cerveja 140 kcal/1 lata (350 mL) Musculação 440
pesada
Pizza quatro queijos 432 kcal/fatia (140 g)
Subir escadas 1050
Sanduíche fast-food 600 kcal-900 kcal/sanduíche correndo
O sal de cozinha, em sua composição, não apresenta carboidrato, lipídio ou proteína, ou
seja, não existe absorção calórica pelo corpo humano. O termo light, utilizado em algumas
embalagens, refere-se à diminuição do teor de sódio. O consumo de 2 g a 4 g de potássio contido
em frutas e vegetais reduz a pressão arterial e previne a hipertensão arterial. Portanto, o sal light
apresenta em sua composição 50% de cloreto de sódio e 50% de cloreto de potássio. O sal light
apresenta 197 mg de sódio por grama de sal.
Outros sais comercializados;
Sal refinado – é obtido através da evaporação da água do mar e, posteriormente, aquecido para
que sua umidade atinja o valor máximo de 0,05%. Após o processo de refinamento e
branqueamento ocorre a adição de iodato de potássio denominado iodação. O iodato de potássio
é realizado para prevenção do bócio. O sal refinado apresenta 400 mg de sódio por grama de
sal.
AULA 05 – LIGAÇÕES QUÍMICAS 20
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Sal marinho – não, necessariamente, é obtido pela evaporação da água do mar. A diferença em
sua composição é que não acontecem as etapas de branqueamento, refinamento, tratamento
térmico e iodação. O sal marinho não apresenta iodato de potássio. O sal marinho apresenta 420
mg de sódio por grama de sal.
Sal grosso – percorre as etapas do sal refinado, porém é finalizado em um processo de
recristalização mais lento para formar cristais maiores.
Sal líquido – solução aquosa de água, cloreto de sódio e outros sais. O sal líquido apresenta
197 mg de sódio por grama de sal.
Sal rosa do Himalaia – por definição, o sal rosa do Himalaia é considerado um sal marinho,
porque não passou por nenhuma etapa de processamento. Esse sal foi formado há milênios na
Cordilheira do Himalaia. O sal rosa apresenta 230 mg de sódio por grama de sal.
A utilização moderada do cloreto de sódio ou a utilização de sais com menor quantidade
de sódio têm sido alternativas importantes para a manutenção da saúde. O consumo excessivo
de sódio provoca: aumento da pressão arterial, aumento de doenças cardiovasculares, aumento
da retenção de líquidos corporais e sobrecarga no funcionamento dos rins.
(FATEC SP/2017)
Cinco amigos estavam estudando para a prova de Química e decidiram fazer um jogo
com os elementos da Tabela Periódica:
• cada participante selecionou um isótopo dos elementos da Tabela Periódica e anotou
sua escolha em um cartão de papel;
• os jogadores Fernanda, Gabriela, Júlia, Paulo e Pedro decidiram que o vencedor seria
aquele que apresentasse o cartão contendo o isótopo com o maior número de nêutrons.
Os cartões foram, então, mostrados pelos jogadores.
A ligação química que ocorre na combinação entre os isótopos apresentados por Júlia e
Pedro é
AULA 05 – LIGAÇÕES QUÍMICAS 21
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
a) iônica, e a fórmula do composto formado é CaC.
b) iônica, e a fórmula do composto formado é CaC2.
c) covalente, e a fórmula do composto formado é CCa.
d) covalente, e a fórmula do composto formado é Ca2C.
e) covalente, e a fórmula do composto formado é CaC2.
Comentário:
O isótopo de Júlia é o metal cálcio, enquanto o Pedro escolheu o cloro, que é um ametal.
A ligação química entre um metal e um ametal é uma ligação iônica através da transferência
de elétrons do metal para o ametal. O cálcio forma um cátion de valência fixa perdendo dois
elétrons: Ca2+. O cloro é um halogênio e apresenta a tendência a ganhar um elétron,
formando o íon C-. Portanto, a combinação do Ca2+ e C- apresenta a fórmula CaC2,
porque são necessários dois ânions monovalentes para neutralizar um cátion bivalente.
Gabarito: B
(UFRGS RS/2017)
Os elementos X, Y e Z apresentam as seguintes configurações eletrônicas:
X: 1s22s22p63s1
Y: 1s22s22p63s23p5
Z: 1s22s22p6
A respeito desses elementos, pode-se afirmar que
a) X e Y tendem a formar ligação iônica.
b) Y e Z tendem a formar ligação covalente.
c) X não tende a fazer ligações nem com Y nem com Z.
d) dois átomos de X tendem a fazer ligação covalente entre si.
e) dois átomos de Z tendem a fazer ligação iônica entre si.
Comentário:
Sabendo a localização dos elementos químicos a partir da configuração eletrônica, tem-
se:
X: 1s22s22p63s1 – metal alcalino.
Y: 1s22s22p63s23p5 – halogênio – todos os halogênios são ametais.
Z: 1s22s22p6 – gás nobre
Julgando os itens:
AULA 05 – LIGAÇÕES QUÍMICAS 22
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
a) Certo. A ligação entre metal e ametal é uma ligação iônica, porque ocorre transferência
eletrônica.
b) Errado. O elemento Z é um gás nobre e não realiza ligações com outros elementos,
nas condições ambientes de temperatura e pressão.
c) Errado. O elemento X é um metal que faz ligação iônica com o elemento Y, porém não
realiza ligações com o elemento Z, porque este é um gás nobre.
d) Errado. X é um metal e não realiza ligações covalentes, somente os ametais e o
hidrogênio realizam.
e) Errado. O elemento Z é um gás nobre e não realiza ligações com outros elementos,
nas condições ambientes de temperatura e pressão.
Gabarito: A
(CEFET MG/2016)
Ao reagir um metal alcalinoterroso do terceiro período da Tabela Periódica dos Elementos
com um halogênio do segundo período forma-se um composto _______________ de
fórmula ____________.
Os termos que completam corretamente as lacunas são, respectivamente,
a) iônico e MgF2.
b) iônico e Na2O.
c) molecular e Na2S.
d) molecular e MgC2.
Comentário:
A combinação de um metal com ametal produz um composto iônico, formado pela
transferência de elétrons entre os elementos. O elemento que se situa no terceiro período
(terceira linha) do grupo 2 (metal alcalinoterroso) é o magnésio. O elemento que se situa
no segundo período (terceira linha) do grupo 17 (halogênio) é o flúor.
O magnésio forma cátion de valência fixa e perde dois elétrons da camada de valência
formando o cátion Mg2+.
Os halogênios recebem um elétron para adquirir a estabilidade eletrônica.
Portanto, a combinação entre Mg2+ e F- produz o composto iônico MgF2, porque são
necessários dois ânions monovalentes para neutralizar um cátion bivalente.
Gabarito: A
(UNIRG TO/2016)
Os elementos químicos genéricos, X e Y, apresentam as seguintes distribuições
eletrônicas:
X = 1s2 2s2 2p6 3s1
Y = 1s2 2s2 2p6 3s2 3p1
AULA 05 – LIGAÇÕES QUÍMICAS 23
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Suponha que os dois elementos reajam com o cloro. De acordo com as distribuições
eletrônicas e as respectivas estruturas de Lewis, as fórmulas moleculares desses
compostos serão:
a) XC e YC
b) XC2 e YC2
c) XCe YC3
d) XC3 e YC3
Comentário:
A partir das configurações eletrônicas de X e Y concluímos que X é um metal alcalino e
Y é um metal e pertence à família do boro. X possui 1 elétron na camada de valência,
enquanto Y, possui 3 elétrons. O cloro é um halogênio e forma o ânion C-.
Logo, a combinação dos íons X+ e C- produz o composto XC. A combinação dos íons
Y3+ e Cl- produz o composto YC3.
Gabarito: C
4. Ligação Metálica
As ligações metálicas acontecem quando um material apresenta um ou mais metais.
Alguns materiais metálicos apresentam ametais em sua composição, porém em pequena
proporção.
Ligação Metálica
Os metais são formados por núcleos que apresentam baixa atração sobre o(s) elétron(s)
da camada de valência, portanto estabilizam-se quando perdem esse(s) elétron(s). Por isso, a
combinação química entre metais não ocorre transferência eletrônica. A ligação entre átomos
metálicos ocorre quando os elétrons deles ficam deslocalizados, ou seja, os elétrons
movimentam-se livres (ou semilivres) entre os cátions. O movimento dos elétrons deslocalizados
é denominado mar de elétrons. A representação da ligação metálica encontrada em uma amostra
de ferro é feita por:
AULA 05 – LIGAÇÕES QUÍMICAS 24
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Como seria a representação da fórmula química dessa amostra de ferro? Fe32? Não!
Apesar da notação Fen já foi utilizada na História, atualmente, omite-se o termo n. A fórmula
química para uma amostra de ferro metálico é: Fe. As substâncias metálicas são indicadas pelos
símbolos dos elementos químicos, tais como Cu (s), Pb (s), Au (s) e Hg ().
Ligação metálica: cátions metálicos cercados por elétrons deslocalizados (mar de elétrons).
Atualmente, a ligação metálica é explicada pelo modelo da teoria de bandas, que
corresponde a teoria de combinação de orbitais atômicos formando bandas de energia. Essa
teoria não se aplica aos estudos do ensino médio, logo não será objeto de estudo dessa aula.
A notação química de uma amostra gasosa do gás nobre He (g) é parecida com a notação
de uma amostra de barra de ferro sólida Fe(s). Porém, os átomos de hélio encontram-se isolados
sem ligações químicas, enquanto os metais combinam-se por ligação metálica.
Portanto, cuidado com a compreensão dessas notações. Gases nobres são substâncias
monoatômicas e metais são substâncias de aglomerados de átomos.
Metal Gás nobre
AULA 05 – LIGAÇÕES QUÍMICAS 25
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Propriedades Metálicas
Os materiais metálicos:
conduzem corrente elétrica.
Figura 3 - os metais são bons condutores de eletricidade [fonte: Pixabay].
conduzem calor.
Figura 3Figura 5 - os metais são bons condutores de calor [fonte:
Pixabay].
AULA 05 – LIGAÇÕES QUÍMICAS 26
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
são sólidos à temperatura ambiente, com
exceção do mercúrio, que é líquido. O gálio
apresenta baixa temperatura de fusão, 29 °C,
mas nas condições ambientes de
temperatura e pressão é sólido.
Figura 4Figura 5 - material metálico sólido [fonte: Unsplash].
são maleáveis.
Figura 5Figura 6 - ferreiro moldando uma ferradura [fonte: Unsplash].
são dúcteis, ou seja, são capazes de formar
fios.
Figura 6Figura 7 - fios de metal para produzir o arame farpado [fonte:
Unsplash].
AULA 05 – LIGAÇÕES QUÍMICAS 27
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
são tenazes, ou seja, suportam pressões.
Figura 7Figura 8 - pressão em CD [fonte: Unsplash].
apresentam baixa dureza, ou seja,
apresentam a capacidade de serem
riscados.
Figura 8Figura 9 - metal riscado [fonte: Pixabay].
AULA 05 – LIGAÇÕES QUÍMICAS 28
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
são brilhosos, ou seja, refletem a luz
intensamente.
Figura 9Figura 10 - brilho metálico [fonte: Unsplash].
Ligas Metálicas
Uma mistura homogênea que apresenta propriedade metálica é denomina liga metálica.
Essa mistura pode ser formada apenas por metais ou apresentar uma pequena quantidade de
ametal.
Liga metálica: material com propriedades metálicas formado por uma mistura de elementos
químicos, em que o elemento majoritário é um metal.
As principais ligas metálicas utilizadas na indústria são:
Liga Composição Média Aplicação
metálica
AULA 05 – LIGAÇÕES QUÍMICAS 29
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Aço ≈98% de Fe
0,5 a 2% de C
Figura 10 - o aço é usado como estrutura de suportes [fonte: Unsplash].
Aço inox 75% de Fe e C
18% de Cr
7% de Ni
Figura 11 - o aço inoxidável é muito utilizado na fabricação de utensílios
domésticos [fonte: Pixabay].
Latão 70% de Cu
30% de Zn
Figura 12 - o latão é utilizado para confecção de instrumentos musicais
[fonte: Unsplash].
AULA 05 – LIGAÇÕES QUÍMICAS 30
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Bronze 90% de Cu
10% de Sn
Figura 13 - medalha de bronze [fonte: Unsplash].
Amálgama 50% de Hg
50% de Zn
Figura 14 - as antigas obturações eram feitas por uma liga metálica de
mercúrio [fonte: Shutterstock].
Ouro 18k 75% de Au
13% de Ag
12% de Cu
Figura 15 - as ligas de ouro 18k são usadas em joias [fonte: Unsplash].
AULA 05 – LIGAÇÕES QUÍMICAS 31
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Solda 67% de Pb
elétrica
33% de Sn
Figura 16 - a solda é utilizada para unir peças metálicas [fonte: Unsplash].
Existe ouro rosa?
Já ouviu falar em ouro branco ou ouro rosa? Por que esses materiais
apresentam essa coloração? Não é porque os átomos de ouro são de
outra espécie e apresentam cores branco ou rosa. Além do mais, já
discutimos em outras aulas que a coloração de materiais depende da
reflexão da luz. A verdade é que o ouro rosa e o ouro branco são ligas
metálicas, e não são as únicas. As principais ligas de ouro 18k
utilizadas em joias são:
Figura 17 - relógio de ouro rose ou
ouro rosa [fonte: Unsplash].
Ouro amarelo 75% de Au + 12,5% de Ag + 12,5 % de Cu
Ouro vermelho 75% de Au + 25 % de Cu
Ouro rosé 75% de Au + 2,75% de Ag + 22,25 % de Cu
AULA 05 – LIGAÇÕES QUÍMICAS 32
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Ouro branco 75% de Au + 25% de Pd
Ouro verde 75% de Au + 15% de Ag + 6% de Cu + 4% de
Cd
Ouro negro 75% de Au + 25% de Co
(UEPG PR/2017)
Sobre as propriedades dos compostos metálicos, assinale o que for correto.
01. Possuem brilho devido à reflexão da luz sobre a sua superfície polida.
02. São maleáveis e dúcteis, e por isso podem ser convertidos em lâminas e fios.
04. Caracteristicamente possuem baixo ponto de fusão e ebulição.
08. Por não possuírem elétrons livres, não são capazes de conduzir corrente elétrica.
Comentários:
A partir dos itens, julga-se:
01. Certo. A coloração de um material não luminoso é consequência da luz que ele reflete,
quanto mais regular a superfície do metal, melhor a reflexão.
02. Certo. Os metais são maleáveis e dúcteis devido à natureza da ligação metálica.
04. Errado. A maior parte dos metais apresenta elevada temperatura de fusão e ebulição,
com exceção do mercúrio e do gálio.
08. Errado. Os metais são bons condutores de eletricidade devido aos elétrons livres ou
deslocalizados ou semilivres.
Gabarito: 03
(UEG GO/2017- adaptado)
Neste ano, cientistas da Universidade de Harvard anunciaram a produção de hidrogênio
metálico, submetendo hidrogênio molecular a altas pressões.
Dentre as propriedades características de compostos metálicos, encontra-se a
AULA 05 – LIGAÇÕES QUÍMICAS 33
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
A) baixa condutividade elétrica.
B) utilização como isolantes térmicos.
C) tendência a formar ânions devido a sua baixa energia de ionização.
D) liberdade de seus elétrons de valência de se locomoverem através do sólido.
Comentários:
Julgando os itens, tem-se:
A) Errado. Os metais apresentam elétrons livres, por isso são bons condutores de
eletricidade.
B) Errado. Os metais apresentam as partículas próximas, logo, propagam facilmente a
vibração. Quanto maior a propagação de vibração das partículas, maior a capacidade
térmica de um material.
C) Errado. Os metais apresentam facilidade em perder elétrons, logo, exibem baixos
valores de energia de ionização.
D) Certo. Um composto com características metálicas apresenta seus átomos ligados por
ligação metálica: elétrons deslocalizados espalhados entre cátions. O movimento desses
elétrons – mar de elétrons – permite a passagem da corrente elétrica.
Gabarito: D
(ENEM/2013)
A palha de aço, um material de baixo custo e vida útil pequena, utilizada para lavar louças,
é um emaranhado de fios leves e finos que servem para a remoção por atrito dos resíduos
aderidos aos objetos.
A propriedade do aço que justifica o aspecto físico descrito no texto é a
a) ductilidade.
b) maleabilidade.
c) densidade baixa.
d) condutividade elétrica.
e) condutividade térmica.
Comentários:
A propriedade que justifica a utilização de um material metálico para a produção de fios
de pequena espessura é a ductibilidade. Os metais são maleáveis, conduzem corrente
elétrica e conduzem calor, mas essas propriedades não justificam a capacidade de
formarem fios. O item c está errado porque os metais apresentam elevada densidade.
Gabarito: A
AULA 05 – LIGAÇÕES QUÍMICAS 34
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
5. Ligação Covalente
Os ametais e o hidrogênio apresentam tendência a ganhar elétrons para adquirir
configuração eletrônica estável. A ligação desses elementos ocorre por compartilhamento de
elétrons. Um dos primeiros químicos a estudar sobre isso foi o americano Gilbert Lewis (1875 –
1946).
A molécula de H2 é formada pela ligação covalente entre dois átomos de hidrogênio. A
construção da ligação química entre esses átomos pode ser entendida por:
1H: 1s1 → necessita o acréscimo de um elétron para adquirir estabilidade
eletrônica.
A ligação entre dois átomos de hidrogênio ocorre pela força de atração dos núcleos pelos
elétrons compartilhados, porém não existem somente forças de atração envolvidas nessa
ligação. As forças repulsivas também se encontram: entre os elétrons e entre os núcleos.
AULA 05 – LIGAÇÕES QUÍMICAS 35
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Os núcleos dos átomos de hidrogênio da ligação covalente se afastam, mas os núcleos
‘duelam’ atrativamente pelos elétrons compartilhados. Portanto, existe uma distância média que
caracteriza essa ligação química. O gráfico que representa a relação entre a energia potencial
(ou energia armazenada) e a distância entre os núcleos é representado abaixo.
AULA 05 – LIGAÇÕES QUÍMICAS 36
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Distância entre os núcleos de hidrogênio
elevada energia acumulada devido a proximidade
<74 entre os núcleos.
(sistema instável)
distância da ligação covalente entre os átomos de
= 74 hidrogênio.
(sistema estável)
átomos de hidrogênio isolados.
> 74
(sistema instável)
A ligação entre os átomos de hidrogênio tem valor médio próximo de 74 pm. Lembre-se
que os átomos nunca ficam parados a temperaturas maiores que 0 K, portanto a distância entre
os hidrogênios oscila a cada instante.
Sobre a natureza elétrica dessa ligação química, define-se:
Ligação covalente ou ligação molecular: é o compartilhamento de um ou mais pares de
elétrons entre dois átomos.
As ligações covalentes são, normalmente, representadas por duas fórmulas: fórmula
eletrônica e fórmula estrutural. A fórmula eletrônica ou fórmula de Lewis representa, além dos
elétrons compartilhados, todos os elétrons da camada de valência de todos os átomos. A fórmula
estrutural ou fórmula de Couper representa cada par de elétrons compartilhado por um traço e
não representa os elétrons não compartilhados. Exemplos:
Fórmula eletrônica ou fórmula de Fórmula estrutural ou fórmula de
Lewis Couper
AULA 05 – LIGAÇÕES QUÍMICAS 37
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Nas ligações covalentes podem ocorrer compartilhamento de um, dois ou três pares
eletrônicos entre dois átomos, sendo classificados em ligação simples, dupla ou tripla,
respectivamente.
H2 O2 N2
Ligação covalente Ligação covalente dupla Ligação covalente tripla
simples
1 par de elétrons (2 2 pares de elétrons (4 3 pares de elétrons (6
elétrons) compartilhado. elétrons) compartilhados. elétrons) compartilhados.
Quanto maior o número de ligações entre dois átomos, maior a aproximação entre eles.
Portanto,
Para ligação covalente entre elementos iguais, tem-se:
Distâncialigação tripla < Distâncialigação dupla < Distâncialigação simples
Montando moléculas.
A seguir, será apresentada uma estratégia para montar moléculas de forma mais rápida.
Inicialmente, a partir da tabela periódica ou da configuração eletrônica dos elementos, podemos
determinar o número de ligações covalentes que cada átomo necessita para atingir à estabilidade
eletrônica.
AULA 05 – LIGAÇÕES QUÍMICAS 38
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Sabendo a quantidade de ligações que cada elemento químico necessita, adote o passo
a passo:
1º passo: determine o número de ligações para cada elemento
químico.
2º passo: coloque, como átomo central, aquele átomo que
realiza o maior número de ligações. Caso haja empate, adote
como átomo central aquele que apresenta maior raio atômico.
3º passo: realize as ligações covalentes que cada átomo
necessita. Ao iniciar, dê preferência aos átomos periféricos.
Por enquanto, não se preocupe com a geometria da molécula. Até o momento, mantenha-
se focado em compreender a quantidade de ligações que cada elemento realiza. Fique à vontade
para colocar os átomos ligados em qualquer posição. Nossa próxima aula abordará sobre essa
organização dos átomos, ou seja, geometria molecular.
Exemplos:
AULA 05 – LIGAÇÕES QUÍMICAS 39
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Ligação covalente coordenada ou dativa.
A ligação coordenada ou dativa é muito questionada na Química dos vestibulares, porque
pode ser considerada expansão do octeto (vide a seguir) ou ligação dativa. Nesse momento
iremos apresentar a ideia da ligação covalente dativa ou coordenada.
AULA 05 – LIGAÇÕES QUÍMICAS 40
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Essa ligação pode ser encontrada quando um elemento químico, que já realizou as
ligações químicas necessárias, apresenta elétrons não compartilhados em sua camada de
valência e os utiliza para estabilizar um outro átomo que necessita de um par de elétrons.
Portanto, ao compartilhar os dois elétrons, ambos os elementos apresentarão estabilidade
eletrônica. Importante frisar que a ligação covalente dativa é realizada a partir de um par de
elétron não ligante de um átomo.
A fim de montar moléculas, adote a seguinte estratégia:
Primeiramente, faça as ligações químicas, conforme aprendeu até o momento.
Posteriormente, identifique os elétrons não compartilhados no átomo central e realize a ligação
dativa. A ligação dativa pode ser representada por – ou →.
Aí vai uma dica para construir mais facilmente a fórmula estrutural de molécula triatômica
do tipo HXO. Essa fórmula geral HXO corresponde à um oxiácido, que será trabalhado nas aulas
de ácidos inorgânicos.
Comece ligando o hidrogênio ao oxigênio, depois ligue o oxigênio ao elemento X da
fórmula e finalize as ligações dos demais. A seguir, alguns exemplos:
AULA 05 – LIGAÇÕES QUÍMICAS 41
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
HNO3 H2SO4 HClO4
Exceções à Regra do Octeto.
Alguns átomos estabilizam-se apresentando configurações eletrônicas diferentes aos dos
gases nobres. A seguir, serão apresentados três grupos de elementos que são exceções,
estabilizando-se: com menos de oito elétrons, com mais de oito elétrons e com números ímpares
de elétrons.
Átomos estáveis com menos de oito elétrons na camada de valência.
Os elementos com menos de oito elétrons na camada de valência que formam compostos
estáveis são: berílio, boro e alumínio.
O berílio, quando combinado com elementos ametálicos de baixa eletronegatividade ou
hidrogênio, forma compostos moleculares, por exemplo, o BeH2. O berílio estabiliza-se com
quatro elétrons na camada de valência.
O alumínio, quando combinado com elementos que não são muito eletronegativos, pode
formar compostos moleculares. Todavia, o alumínio, em presença de elementos de elevada
eletronegatividade, forma compostos iônicos. O alumínio apresenta-se estável com seis elétrons
na camada de valência, por exemplo, o composto AH3:
O boro é um ametal e sua configuração eletrônica mais estável apresenta seis elétrons na
camada de valência. Por exemplo, o composto BH3:
AULA 05 – LIGAÇÕES QUÍMICAS 42
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Átomos estáveis com mais de oito elétrons na camada de valência.
Alguns átomos são estáveis quando apresentam mais de oito elétrons na camada de
valência. Alguns exemplos dessa exceção são encontrados em compostos de enxofre ou de
fósforo. O enxofre pode estabilizar-se com 12 elétrons na camada de valência e o fósforo com
10. As moléculas SF6 e PCl5 são exemplos da expansão à regra do octeto.
Em condições específicas, os gases nobres podem se ligar a outros elementos químicos.
Por exemplo, o xenônio a 400 °C reage com o gás flúor formando um composto sólido de
temperatura de fusão de 128 °C e fórmula molecular XeF2. Além do XeF2, a reação do flúor com
o xenônio é possível obter XeF4 e XeF6.
Átomos estáveis com número ímpar de elétrons na camada de valência.
As moléculas NO, NO2 e N2O apresentam números ímpares de elétrons na camada de
valência dos átomos e não se estabilizam segundo a regra do octeto. Essas moléculas
apresentam elétrons desemparelhados e são chamadas de radicais livres.
AULA 05 – LIGAÇÕES QUÍMICAS 43
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Ressonância.
A ressonância ou também chamada de mesomeria é um fenômeno de deslocalização dos
elétrons encontrados em compostos moleculares. Os compostos ressonantes apresentam mais
de uma fórmula estrutural para a sua representação.
O ozônio, por exemplo, pode ser representado de três formas, sendo que uma delas
representa a contribuição das duas outras fórmulas. As estruturas ressonantes ou formas
canônicas são formadas por elétrons deslocalizados entre ametais.
O comprimento da ligação entre os átomos de oxigênio encontrado na molécula de ozônio
é menor que a ligação simples e maior que a ligação dupla. Assim, essa ligação é classificada
como ligação híbrida de ressonância. O termo híbrido quer dizer misturado, ou seja, a mistura
da ligação simples com a dupla.
Outros exemplos de casos ressonantes são:
Casos Importantes.
Por vezes, encontramos questões que solicitam a fórmula estrutural de íon poliatômico. O
ânion poliatômico é uma espécie carregada negativa em que, geralmente, o elétron adquirido
encontra-se com o átomo mais eletronegativo. Todavia, em um cátion poliatômico, o átomo
AULA 05 – LIGAÇÕES QUÍMICAS 44
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
menos eletronegativo, geralmente, cede o elétron e recebe uma ligação dativa. A representação
de íons pode ser feita com ou sem colchetes.
Cátion Ânion
H3O+ NO3-
Outro caso importante é o do monóxido de carbono (CO). Essa molécula é representada a seguir.
6. Questões Fundamentais
I. Questão fundamental 01.
A partir das tabelas de valência fixa de cátions e ânions, escreva as fórmulas iônicas
obtidas pelas combinações dos elementos a seguir.
a) Ca e F.
b) A e S.
c) Zn e N.
d) K e C.
e) Mg e N.
II. Questão fundamental 02.
A partir das tabelas de valência fixa de cátions e ânions, identifique o cátion e o ânions
das fórmulas seguintes.
a) KC .
AULA 05 – LIGAÇÕES QUÍMICAS 45
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
b) K2CO3.
c) FeS.
d) PbO2.
e) NaHSO3.
f) KNO3.
g) FeC 3.
h) Au2O.
i) MgSO4.
j) Na2C2O4.
III. Questão fundamental 03.
Escreva as fórmulas estruturais das moléculas seguintes.
a) CO2
b) H2O
c) NH3
d) HNO2
e) CCl4
f) H2S
g) O3
h) H2SO3
i) H3BO3
j) CS2
k) H2CO3
l) PH3
AULA 05 – LIGAÇÕES QUÍMICAS 46
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
7. Já Caiu Nos Principais Vestibulares
Ligação Iônica.
1. (ETEC SP/2020)
John Goodenough, Stanley Whittingham e Akira Yoshino são os vencedores do Prêmio
Nobel 2019 de Química pelo desenvolvimento de baterias de íons de lítio. Atualmente, celulares,
notebooks e carros elétricos saem de fábrica com esse tipo de bateria.
Com essa descoberta, é possível armazenar uma grande quantidade de energia em
baterias pequenas e leves. Se fôssemos utilizar outros tipos de bateria, como por exemplo,
bateria de hidreto de níquel ou bateria de níquel cádmio, para armazenarmos a mesma
quantidade de energia, teríamos baterias com o tamanho e massa duas ou até mesmo três vezes
maiores que as baterias de íons de lítio. Outra vantagem desse tipo de bateria é o fato de não
possuírem o efeito memória, conhecido popularmente como o vício da bateria. Devido a essa
característica que facilita a vida do usuário, ela não requer tanta atenção nos processos de carga
e descarga.
Contudo, com todos os avanços, as baterias continuam extremamente sensíveis à
temperatura. Quando expostas ao calor, podem perder parte de sua capacidade total e se
decompor mais rápido que o normal.
Os íons de lítio, usados em baterias, são provenientes de compostos iônicos. Um exemplo
de composto iônico é o sal cloreto de sódio, no qual átomos de sódio se ligam a átomos de cloro
por meio de ligação iônica, na razão de 1 :1, como todos os cloretos de metais alcalinos.
Sabendo que o lítio também é um metal alcalino, podemos afirmar que os átomos de lítio
se ligam a átomos de cloro formando o composto cloreto de lítio, representado, corretamente,
por
a) Li2C
b) Li2C 2
c) CLi2
d) C2Li2
e) LiC
2. (Fac. Direito de São Bernardo do Campo SP/2020)
A seguir estão representadas as configurações eletrônicas da camada de valência dos
átomos X e Y:
X: 4s2 4p5
Y: 4s2
AULA 05 – LIGAÇÕES QUÍMICAS 47
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Assinale a alternativa que apresenta, respectivamente, o tipo de ligação que ocorre entre
esses átomos e a fórmula do composto.
a) Iônica, XY
b) Covalente, YX2
c) Iônica, YX2
d) Covalente, XY
3. (FPS PE/2020)
Suponha que um laboratório consiga produzir o elemento X de número atômico 120 e que
esse elemento tenha propriedades similares às dos outros elementos de sua família.
É possível deduzir que o óxido formado por esse elemento teria a fórmula:
a) X2O
b) XO2
c) X2O3
d) X2O5
e) XO
4. (UFPR/2019)
Nos relógios mostrados a seguir, as posições, que são originalmente ocupadas por
números, foram substituídas por símbolos de elementos químicos, cujos números atômicos
correspondem ao numeral original do relógio.
As substâncias neutras formadas a partir da leitura das horas marcadas nos relógios I, II
e III são, respectivamente:
a) LiF – MgO – BeF.
b) LiF – Mg2O – BeF.
c) LiF – MgO – BeF2.
AULA 05 – LIGAÇÕES QUÍMICAS 48
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
d) Li2F – MgO – BeF2.
e) Li2F – Mg2O – BeF2.
5. (UFPR/2019)
A usina de energia de Hellisheidi, na Islândia, vem testando um novo método para
combater o aquecimento global: transformar o gás carbônico (CO 2) em pedra. O processo ocorre
em duas etapas: primeiro o CO2 é dissolvido em água em altas pressões (25 bar) e depois
injetado no solo numa temperatura de 230 ºC. A mineralização do gás carbônico ocorre de
maneira rápida, devido à reatividade e composição do solo da região, rica em ferro, cálcio e
magnésio. As duas etapas da remoção de CO2 estão esquematizadas de maneira simplificada
ao lado.
CO2(g) + H2O() ⎯25
⎯bar
⎯→ CO32- (aq) + 2H+(aq)
CO32- (aq)+ Ca2+(aq) ⎯230
⎯⎯ ºC
→ CaCO3(s)
Fonte: 1. <https://www.bbc.com/portuguese>. Acessado em 23 de maio 2018. Adaptado. 2. Mater, J. M. et alii, Rapid carbon mineralization for
permanent disposal of anthropogenic carbon dioxide emissions. Science, Vol. 352, Issue 6291, pp. 1312-1314.
A remoção desse gás da atmosfera ocorre por:
a) formação de composto iônico.
b) reação de oxidorredução.
c) ligação covalente com a rocha.
d) alteração do estado de agregação.
e) adsorção de CO2 numa matriz porosa.
6. (FAMERP SP/2019)
A combinação dos elementos Ca e Br forma uma substância solúvel em água, de fórmula
__________. Uma solução aquosa dessa substância é classificada como __________ de
eletricidade.
As lacunas do texto devem ser preenchidas por:
a) Ca2Br – condutora.
b) CaBr2 – condutora.
c) Ca2Br – não condutora.
d) CaBr2 – não condutora.
e) CaBr – condutora.
AULA 05 – LIGAÇÕES QUÍMICAS 49
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
7. (PUC SP/2018)
Observe a figura abaixo e assinale a alternativa INCORRETA.
Fonte: Ohara Augusto. Radicais livres bons, maus e naturais.
Ed. Oficina de textos, 2006.
a) Átomos que pertencem à família dos metais alcalinos formam cátions monovalentes.
b) Átomos que pertencem ao grupo 17 formam ânions monovalentes.
c) A ligação iônica ocorre entre cátions e ânions e é caracterizada pela existência de forças
de atração eletrostática entre eles.
d) Na ligação iônica, apenas átomos que perdem e ganham a mesma quantidade de
elétrons podem se combinar.
8. (UFSC/2017)
Jogos Olímpicos Rio 2016: o que é o pó que os ginastas passam nas mãos antes da
competição?
O pó branco utilizado pelos atletas nas mãos e pés em competições de ginástica artística
é comumente conhecido como “pó de magnésio”. Esse pó é, na realidade, o carbonato de
magnésio, que possui ação antiumectante, utilizado para diminuir a sensação escorregadia
durante as acrobacias. O pó atua absorvendo o suor e diminuindo os riscos de o ginasta cair e
se machucar. Sem a utilização do “pó de magnésio”, o risco de lesões seria maior, mas apenas
os atletas utilizam, já que o pó desidrata a pele e pode causar manchas.
Disponível em: <http://www.vavel.com/br/mais-esportes/647755-ginastica-
artistica-tudo-o-que-voc-precisa-saber-para-o-rio-2016.html>. [Adaptado].
Imagem disponível em: <http://globoesporte.globo.com/outros-esportes/fotos/
2012/12/retrospectiva-fotos-mais-bonitas-de-2012.html>. Acesso em: 11 ago. 2016.
Sobre o assunto, é correto afirmar que:
AULA 05 – LIGAÇÕES QUÍMICAS 50
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
01. o contato do carbonato de magnésio com o suor produzido nas mãos de um ginasta
resulta na produção de íons Mg2– e CO32+.
02. na forma de íons Mg2+, o magnésio possui dez elétrons distribuídos em dois níveis
eletrônicos.
04. o magnésio é classificado como um metal de transição.
08. o magnésio na forma reduzida (Mg0) não conduz eletricidade.
16. a ligação entre íons magnésio e íons carbonato possui elevado caráter covalente e,
portanto, o carbonato de magnésio não se dissolve no suor do ginasta.
32. ao espalhar 8,43 g de carbonato de magnésio nas mãos, o ginasta estará utilizando
0,100 mol de magnésio e 0,100 mol de carbonato.
64. existem 243 g de magnésio em 10,0 mol de carbonato de magnésio.
9. (Mackenzie SP/2017)
Em dezembro de 2016, a IUPAC (International Union of Pure and Applied Chemistry)
oficializou a nomenclatura dos novos elementos químicos, presentes no sétimo período da tabela
periódica. Assim, os elementos 113 (grupo 13), 115 (grupo 15), 117 (grupo 17) e 118 (grupo 18)
passaram a ser denominados, respectivamente, de Nihonium (Nh), Moscovium (Mc), Tennessine
(Ts) e Oganesson (Og).
Pode-se afirmar que o elemento
Dado: Número atômico (Z): O = 8
a) Nh forma o íon Nh3–.
b) Mc é um metal de transição.
c) Ts é um elemento representativo e pertence ao mesmo grupo do oxigênio.
d) Og é um gás nobre e apresenta configuração da camada de valência 6s 2 6p6.
e) Nh pode combinar-se com um halogênio (X), formando o composto hipotético NhX3.
10. (UEPG PR/2016)
Sobre a configuração eletrônica e a Teoria do Octeto, assinale o que for correto.
01. O átomo de número atômico 15, ao perder 3 elétrons, adquire a configuração de gás
nobre.
02. Os halogênios, como o flúor e o cloro, atingem o octeto quando recebem elétrons na
camada de valência.
04. Os metais alcalinos terrosos adquirem configuração eletrônica de gás nobre quando
formam íons com número de carga +2.
08. Átomos dos elementos do grupo 1 da tabela periódica, como o sódio e o potássio,
possuem uma tendência acentuada a perder elétrons da camada de valência.
AULA 05 – LIGAÇÕES QUÍMICAS 51
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
11. (EsPCEX/2015)
Compostos iônicos são aqueles que apresentam ligação iônica. A ligação iônica é a
ligação entre íons positivos e negativos, unidos por forças de atração eletrostática.
(Texto adaptado de: Usberco, João e Salvador, Edgard, Química: química geral, vol 1,
pág 225, Saraiva, 2009).
Sobre as propriedades e características de compostos iônicos são feitas as seguintes
afirmativas:
I. apresentam brilho metálico.
II. apresentam elevadas temperaturas de fusão e ebulição.
III. apresentam boa condutibilidade elétrica quando em solução aquosa.
IV. são sólidos nas condições ambiente (25 °C e 1atm).
V. são pouco solúveis em solventes polares como a água.
Das afirmativas apresentadas estão corretas apenas
a) II, IV e V.
b) II, III e IV.
c) I, III e V.
d) I, IV e V.
e) I, II e III.
12. (IME RJ/2015)
Dados os elementos abaixo,
𝟑𝟓 𝟒𝟎
𝟏𝟕𝜱 ; 𝟐𝟎𝜳 𝒆 𝟏𝟎𝟕
𝟒𝟕𝜴
marque a alternativa correta, considerando-se as condições de 1 atm e 25ºC.
a) Φ é encontrado livre na natureza na forma de gás monoatômico.
b) Φ combina-se com Ψ formando um composto solúvel em água.
c) Φ combina-se com Ω formando um composto solúvel em água.
d) Ψ combina-se com Ω formando um composto gasoso.
e) Ω é um mau condutor de eletricidade.
AULA 05 – LIGAÇÕES QUÍMICAS 52
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
13. (ESCS DF/2014)
As emissões radioativas são empregadas na radioterapia para destruir células doentes ou
impedi-las de se reproduzirem. Em 1987, uma cápsula contendo cloreto de césio-137 foi
abandonada junto a um equipamento nas antigas instalações do Instituto Goiano de
Radioterapia, em Goiânia. A cápsula foi encontrada e aberta pelo dono de um ferro-velho, o que
causou o maior acidente radioativo da história do Brasil.
O cloreto de césio é um compost
a) molecular com fórmula química CsC2.
b) iônico com fórmula química CsC.
c) iônico com fórmula química CsC2.
d) molecular com fórmula química CsC.
14. (IFSP/2014)
O cloreto de potássio, KC, vem sendo utilizado no chamado “sal light”, substituindo parte
do cloreto de sódio que constitui o sal comum. Sabendo que o potássio é um elemento do grupo
1 da tabela periódica (metal alcalino) e que o cloro é um elemento do grupo 17 da tabela periódica
(halogênio), pode-se afirmar que as ligações químicas existentes nos cristais de cloreto de
potássio são
a) iônicas.
b) metálicas.
c) covalentes simples.
d) covalentes duplas.
e) covalentes triplas.
15. (ENEM/2014)
As propriedades físicas e químicas de uma certa substância estão relacionadas às
interações entre as unidades que a constituem, isto é, as ligações químicas entre átomos ou íons
e as forças intermoleculares que a compõem. No quadro, estão relacionadas algumas
propriedades de cinco substâncias.
AULA 05 – LIGAÇÕES QUÍMICAS 53
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Qual substância apresenta propriedades que caracterizam o cloreto de sódio (NaC)?
a) I
b) II
c) III
d) IV
e) V
16. (ITA SP/2012)
Considere os seguintes pares de moléculas:
I. LiC e KC
II. AC3 e PC3
III. NC3 e AsC3
Assinale a opção com as três moléculas que, cada uma no seu respectivo par, apresentam
ligações com o maior caráter covalente.
a) LiC, AC3 e NC3
b) LiC, PC3 e NC3
c) KC, AC3 e AsC3
d) KC, PC3 e NC3
e) KC, AC3 e NC3
Ligação Metálica.
17. (Fac. Israelita de C. da Saúde Albert Einstein SP/2020)
Considere as seguintes informações sobre uma liga metálica de bismuto:
AULA 05 – LIGAÇÕES QUÍMICAS 54
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
As características dessa liga metálica permitem seu uso em
a) destiladores de água.
b) isolantes elétricos.
c) fusíveis de dispositivos eletroeletrônicos.
d) panelas antiaderentes.
e) blocos de motores automotivos.
18. (UFRGS RS/2019)
Na coluna da direita abaixo, estão relacionadas algumas substâncias químicas; na da
esquerda, características dessas substâncias.
Associe adequadamente a coluna da esquerda à da direita.
( ) Sólido com alta maleabilidade e brilho metálico
( ) Gás com coloração esverdeada
( ) Gás pouco denso e altamente inflamável
( ) Substância condutora de eletricidade quando fundida
1. Cloreto de sódio
2. Ouro
3. Cloro
4. Bromo
5. Hidrogênio
A sequência correta de preenchimento dos parênteses, de cima para baixo, é
a) 1 – 2 – 3 – 4.
b) 1 – 3 – 5 – 2.
c) 2 – 3 – 4 – 5.
d) 3 – 2 – 4 – 1.
e) 2 – 3 – 5 – 1.
AULA 05 – LIGAÇÕES QUÍMICAS 55
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
19. (UECE/2019)
A nível de ilustração, os núcleos dos átomos são considerados ilhas mergulhadas em um
mar de elétrons. Essa comparação nos leva a concluir que se trata de uma ligação química
a) metálica.
b) iônica.
c) covalente polar.
d) covalente apolar.
20. (UERJ/2020)
O QUE NOSSAS METÁFORAS DIZEM DE NÓS
1Para o poeta Robert Frost, a vida era um caminho que passa por encruzilhadas
inevitáveis; para 2Fernando Pessoa, uma sombra que passa sobre um rio. Shakespeare via o
mundo como um palco 3e Scott Fitzgerald percebia os seres humanos como barcos contra a
corrente. Metáforas como essas 4nos rodeiam, mas não só quando seguramos um livro nas
mãos. Em nosso uso cotidiano da língua, 5elas são tão presentes que nem sequer percebemos.
São exemplos “teto de vidro impede a carreira 6das mulheres”, “a bolha do aluguel”, “cortar o mal
pela raiz”. Considerada a forma por excelência da 7linguagem figurada, a metáfora às vezes é
tida como mero embelezamento do discurso.
8Entretanto, desde 1980, com a publicação do livro Metáforas da vida cotidiana, essa
figura retórica 9recuperou seu protagonismo. Os autores George Lakoff e Mark Johnson
mostraram que as alegorias 10desenham o mapa conceitual a partir do qual observamos,
pensamos e agimos. Com frequência são 11nossa bússola invisível, orientando tanto os gestos
instintivos que fazemos como as decisões mais 12importantes que tomamos. É muito provável
que aqueles que concebem a vida como uma cruz e 13os que a entendem como uma viagem não
reajam da mesma forma ante um mesmo dilema. As 14metáforas são ferramentas eficazes e de
múltiplas utilidades. Ao partir de elementos já conhecidos, 15nos ajudam a examinar realidades,
conceitos e teorias novas de uma maneira prática. Também nos 16servem para abordar
experiências traumáticas nas quais a linguagem literal se revela impotente. 17São vigorosos
atalhos que a mente usa para assimilar situações complexas em que a literalidade 18acaba sendo
tediosa, limitada e confusa. É mais fácil para nós entender que a depressão é uma 19espécie de
buraco negro e que o DNA é o manual de instruções de cada ser vivo.
20As figurações dão coesão às identidades coletivas, pois circulam sem cessar até se
incorporarem 21à linguagem cotidiana. Há alguns anos, os psicólogos Paul Thibodeau e Lera
Boroditsky, da 22Universidade Stanford (E.U.A.), analisaram os resultados de um debate sobre
políticas contra a 23criminalidade que recorria a duas metáforas. Quando o problema era ilustrado
como se houvesse 24predadores devorando a comunidade, a resposta era endurecer a vigilância
policial e aplicar leis 25mais severas. No entanto, quando o problema era exposto como um vírus
infectando a cidade, a 26opção era a de adotar medidas para erradicar a desigualdade e melhorar
a educação. Comparações 27ruins levam a políticas ruins, escreveu o Nobel de Economia Paul
Krugman.
AULA 05 – LIGAÇÕES QUÍMICAS 56
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
28No campo da medicina, tem havido mudanças de paradigma no que diz respeito ao
impacto 29emocional das metáforas. Num recente seminário organizado pela Universidade de
Navarra 30(Espanha), a linguista Elena Semino dissertou sobre os efeitos de abordar o câncer
como se 31fosse uma guerra, provocando sensações negativas quando o paciente acredita estar
“perdendo a 32batalha”, mesmo que isso possa ser estimulante para outros. O erro, segundo a
especialista, reside 33em misturar os campos semânticos da guerra e da saúde. Para corrigir
essa questão, a linguista 34elabora o que chama de “cardápio de metáforas”, para que médicos
e pacientes enfrentem a doença 35de forma mais construtiva.
36As boas metáforas nos trazem outras perspectivas, fronteiras menos rígidas e novas
categorizações 37que substituem aquelas já desgastadas.
MARTA REBÓN
Adaptado de brasil.elpais.com, 11/04/2018.
Há um tipo de ligação interatômica em que os elétrons das camadas mais externas
transitam entre os cátions da rede cristalina. Por essa característica, tal ligação é comparada a
um “mar de elétrons”.
“Mar de elétrons” é uma metáfora que se refere ao seguinte tipo de ligação:
a) iônica
b) metálica
c) covalente
d) de hidrogênio
21. (Mackenzie SP/2018)
Assinale (V) para verdadeiro e (F) para falso, para as afirmações abaixo.
( ) Os metais apresentam alta condutividade elétrica, mas baixa condutividade térmica.
( ) O bronze é uma liga formada por cobre e estanho.
( ) Compostos iônicos conduzem corrente elétrica em meio aquoso e quando fundidos.
( ) A ligação covalente ocorre entre metais e não metais. O KBr é um exemplo.
( ) O dióxido de carbono é uma molécula apolar, mas que possui ligações covalentes
polares.
A sequência correta de preenchimento dos parênteses, de cima para baixo é
a) F, F, V, F e V.
b) F, V, V, F e V.
c) V, F, V, F e V.
d) F, F, V, F e F.
e) V, V, F, V e F.
AULA 05 – LIGAÇÕES QUÍMICAS 57
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
22. (IFRS/2017)
Em uma Olimpíada, os atletas buscam suas melhores marcas, simbolizadas pelas
medalhas de ouro, prata e bronze. Sobre esses materiais são feitas as afirmações:
I. O ouro é um metal excelente condutor de calor e eletricidade, cujo símbolo é Au.
II. A prata é um metal mais reativo que o ouro, por isso não é tão nobre e seu símbolo é
Pt.
III. O bronze é um metal de cor amarronzada, muito duro, cujo símbolo é Br.
Assinale a alternativa que contém a(s) afirmação(ões) correta(s).
a) I
b) II
c) III
d) I e II
e) II e III
23. (UEMG/2016)
“Minha mãe sempre costurou a vida com fios de ferro. ”
EVARISTO, 2014, p. 9.
Identifique na tabela a seguir a substância que possui as propriedades do elemento
mencionado no trecho acima.
A resposta CORRETA é:
a) Substância A.
b) Substância B.
c) Substância C.
d) Substância D.
24. (UERJ/2015)
Para fabricar um dispositivo condutor de eletricidade, uma empresa dispõe dos materiais
apresentados na tabela abaixo:
AULA 05 – LIGAÇÕES QUÍMICAS 58
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
M aterial Composição química
I C
II S
III As
IV Fe
Sabe-se que a condutividade elétrica de um sólido depende do tipo de ligação interatômica
existente em sua estrutura. Nos átomos que realizam ligação metálica, os elétrons livres são os
responsáveis por essa propriedade.
Assim, o material mais eficiente para a fabricação do dispositivo é representado pelo
seguinte número:
a) I
b) II
c) III
d) IV
25. (UCS RS/2015)
O mercúrio é um metal líquido à temperatura ambiente, conhecido desde os tempos
antigos da Grécia. Apresenta boa condutividade elétrica, além de formar amálgamas
relativamente consistentes com ouro, prata e chumbo. É frequentemente utilizado na fabricação
de termômetros, barômetros, lâmpadas e interruptores elétricos. Industrialmente, esse metal
pode ser obtido a partir do tratamento térmico do mineral cinábrio (HgS), na presença de gás
oxigênio, em um alto forno. Esse processo, conhecido como ustulação, pode ser representado
simplificadamente por meio da equação química descrita abaixo.
HgS (s) + O2 (g) → Hg () + SO2 (g)
Considerando as informações do enunciado, assinale a alternativa correta.
a) 1,0 mol de mercúrio é produzido a partir de 2,0 mols de gás oxigênio na reação de
ustulação do cinábrio.
b) Os átomos de mercúrio e enxofre no cinábrio estão unidos entre si por meio de ligações
metálicas.
c) O gás oxigênio utilizado na reação de ustulação do cinábrio apresenta uma ligação
covalente normal tripla em sua estrutura química e geometria angular.
d) A reação química que ocorre durante a ustulação do cinábrio é de análise.
e) A substância composta obtida na reação de ustulação do cinábrio é polar e solúvel em
água.
AULA 05 – LIGAÇÕES QUÍMICAS 59
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
26. (UNESP SP/2014)
Três substâncias puras, X, Y e Z, tiveram suas condutividades elétricas testadas, tanto no
estado sólido como no estado líquido, e os dados obtidos encontram-se resumidos na tabela.
Com base nessas informações, é correto classificar como substância(s) iônica(s)
a) Y e Z, apenas.
b) X, Y e Z.
c) X e Y, apenas.
d) Y, apenas.
e) X, apenas.
27. (PUC GO/2014)
Três substâncias (I, II e III) foram caracterizadas experimentalmente de modo a obter duas
importantes propriedades: ponto de fusão (°C) e condutividade elétrica.
Substância Ponto de fusão C Condutividade elétrica
Estado sólido :
I 801
não, estado líquido : sim
Estado sólido :
II − 56,57
não, estado líquido : não
Estado sólido :
III 1.538
sim, estado líquido : sim
A partir destas informações, pode-se concluir que as substâncias I, II e III,
respectivamente, são formadas por ligações:
a) Metálicas, covalentes e iônicas.
b) Iônicas, covalentes e metálicas.
c) Metálicas, covalentes e metálicas.
d) Covalentes, metálicas e iônicas.
Ligação Covalente.
28. (PUC-GO/2021)
AULA 05 – LIGAÇÕES QUÍMICAS 60
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Leia o fragmento do texto sobre o registro da imagem de ligação e ruptura de átomos:
[...]
Cientistas britânicos e alemães fizeram história ao registrar, pela primeira vez, a união de
átomos em uma escala 500 mil vezes menor que um fio de cabelo humano. Os pesquisadores
usaram métodos avançados para capturarem a quebra de uma ligação química entre dois
átomos de rênio.
[...]
O experimento utilizou átomos de rênio, porque, devido a seu número atômico alto, é mais
fácil de ser visualizado. [...] No experimento, observou-se que dois átomos de rênio se ligam
principalmente por meio de uma ligação quádrupla.
(Disponível em: https://olhardigital.com.br/ciencia-e-espaco/noticia/cientistas-registram-a-primeira-imagem-de-ligacao-e-ruptura-de-atomos/95633.
Acesso em: 22 jan. 2020. Adaptado.)
A respeito dos átomos e suas ligações, leia as assertivas a seguir:
I - As ligações covalentes existem, principalmente, entre átomos, cuja diferença de
eletronegatividade não é muito elevada.
II - Normalmente, entre átomos de metal pode haver a formação de uma ligação metálica
em que os elétrons da camada de valência formam uma nuvem eletrônica entre os átomos,
mantendo-os unidos.
III - As exceções à regra do octeto ocorrem em átomos centrais relativamente grandes
como os elementos de transição interna, diferentemente do que ocorre com os elementos de
transição externa.
Em relação às assertivas lidas, assinale a única alternativa cujo(s) item(ns) está(ão)
correto(s):
(A) I e II apenas.
(B) I e III apenas.
(C) II apenas.
(D) II e III apenas.
29. (Univag MT/2020)
O mineral constituído por carbeto de cálcio (CaC2), conhecido popularmente como
carbureto, quando em contato com água, libera um gás inflamável, o acetileno (C 2H2), que na
presença de uma fonte de ignição entra em combustão, como mostra a figura.
(www.manualdomundo.com.br)
AULA 05 – LIGAÇÕES QUÍMICAS 61
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
O acetileno entra em combustão de acordo com a reação:
2C2H2 (g) + 5O2 (g) → 4CO2 (g) + 2H2O (g)
A ligação química na molécula de carbeto de cálcio é do tipo __________ e o número de
oxidação do carbono nesse composto é __________. Na molécula dióxido de carbono, a ligação
é do tipo __________ e o número de oxidação do carbono nesse composto é __________.
Assinale a alternativa que preenche, respectivamente, as lacunas do texto.
a) covalente; – 2; iônica; – 4
b) iônica; – 2; covalente; + 4
c) iônica; – 1; iônica; + 4
d) covalente; – 2; covalente; + 2
e) iônica; – 1; covalente; + 4
30. (FATEC SP/2020)
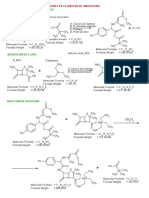
A Química do Slime
A jornada histórica do slime tem início nas primeiras décadas do século XX, quando James
Wright criou um material com características muito parecidas com a borracha. Atualmente,
devido às mais variadas formulações disponibilizadas em plataformas e mídias digitais, pode-se
produzir o próprio slime em casa.
O slime caseiro pode ser produzido pela mistura de duas colheres de chá de bicarbonato
de sódio (NaHCO3), 100 mL de água boricada (solução de ácido bórico, H 3BO3) e 60 g de cola
de isopor (constituída de poliacetato de vinila, PVAc). Quando misturamos o bicarbonato de sódio
com o ácido bórico, ocorre uma reação química que produz gás carbônico, água e borato de
sódio (Na3BO3).
A dissociação, em solução aquosa, do borato e do bicarbonato de sódio libera íons sódio
(Na+), que vão interagir com as moléculas do PVAc, formando um composto de elevada
viscosidade e elasticidade.
Os íons sódio interagem com a estrutura do PVAc conforme representado.
A reação entre o ácido bórico e o bicarbonato de sódio também origina o tetraborato de
sódio, conhecido como “Bórax” (Na2B4O7). Este, em meio básico, transforma-se em
tetrahidroxiborato, conforme representado na equação 1.
AULA 05 – LIGAÇÕES QUÍMICAS 62
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Equação 1
O PVAc reage com moléculas de água produzindo álcool polivinílico (PVA), conforme
representado na equação 2.
Equação 2
O tetrahidroxiborato reage com o PVA (equação 3), formando novas ligações que
interligam as cadeias do polímero que constitui o slime.
Equação 3
<https://tinyurl.com/y4vmmd9w>
Acesso em: 01.10.2019. Adaptado.
Na equação 3, as ligações químicas I, II, III e IV, formadas no trecho da cadeia do slime,
são denominadas
a) ligações iônicas.
b) ligações covalentes.
c) ligações metálicas.
AULA 05 – LIGAÇÕES QUÍMICAS 63
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
d) ligações de hidrogênio.
e) ligações apolares.
31. (PUC Camp SP/2020)
Futuro com mais espirros
O aumento do nível do mar e as crescentes emissões de dióxido de carbono, ligados
diretamente às mudanças climáticas provocadas pela atividade humana na Terra, têm relação
com uma piora nos estados de alergia – principalmente durante a primavera. Isso porque, com
a prolongação das estações quentes, expande-se também o período de reprodução das plantas,
e com a presença elevada de pólen ocorrem mais casos de alergia.
(Adaptado de: Revista Galileu, julho de 2019, p. 12)
O dióxido de carbono possui fórmula estrutural
a) O=C
b) O=C=O
c) O–C–O
d) O=O–C
e) C–O–O
32. (FGV SP/2020)
Entre os diversos defensivos químicos empregados na agricultura estão o Malathion® e o
florpirauxifen-benzil. Suas fórmulas estruturais estão representadas a seguir.
Na estrutura da molécula do Malathion®, o átomo que apresenta expansão da camada de
valência, efetuando mais ligações químicas do que a quantidade prevista pela regra do octeto, o
AULA 05 – LIGAÇÕES QUÍMICAS 64
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
total de elétrons que esse átomo apresenta em sua camada de valência nessa molécula e a
designação dessa camada são, respectivamente,
a) fósforo, 10 e N.
b) fósforo, 10 e M.
c) fósforo, 12 e M.
d) enxofre, 10 e M.
e) enxofre, 12 e N.
33. (UEG GO/2019)
As ligações químicas explicam o elo de estabilidade entre átomos para a formação de
sistemas moleculares. De forma sintética, elas podem ser classificadas como iônicas, covalentes
e metálicas. Com base nos conceitos de ligações químicas, dentre os compostos a seguir,
aquelas que podem ser classificadas como majoritariamente estabilizadas por ligações
covalentes são
a) HCl e diamante
b) barra de ferro e H2O
c) MgCl2 e grafite
d) NaCl e AlH4+
e) KI e NH3
34. (FCM MG/2019)
Geralmente os átomos compartilham, ganham ou perdem elétrons a fim de atingir o octeto,
ou seja, oito elétrons na última camada, como a maioria dos gases nobres. Contudo existem
exceções à regra do octeto, como:
I. Moléculas com número ímpar de elétrons.
II. Moléculas com deficiência de elétrons.
III. Moléculas com expansão do octeto.
Assinale a alternativa onde ocorrem, não respectivamente, essas três situações:
a) BF3 – NO2 – NH3.
b) BF3 – NO – PCl5.
c) BeCl2 – ClO2 – PCl3.
d) BeCl2 – CHCl3 – NH4Cl.
AULA 05 – LIGAÇÕES QUÍMICAS 65
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
35. (UCS RS/2017)
O gráfico a seguir mostra, de forma simplificada, como a energia potencial do sistema
varia à medida em que dois átomos de hidrogênio no estado fundamental se aproximam para
formar uma molécula de gás hidrogênio.
Com base nessas informações, assinale a alternativa correta.
a) A distância ideal para que haja o compartilhamento efetivo dos elétrons de dois átomos
de hidrogênio e, consequentemente, a formação da ligação covalente H–H deve ser superior a
0,74 Å.
b) O aumento da distância internuclear de dois átomos de hidrogênio favorece a
superposição entre os orbitais 1s e, consequentemente, a formação da ligação covalente H–H.
c) O aumento abrupto da energia potencial observado para valores inferiores a 0,74 Å é
consequência da atração eletrostática entre os núcleos de dois átomos de hidrogênio, uma vez
que a distância entre eles torna-se muito grande.
d) A ligação covalente que se estabelece entre os dois átomos de hidrogênio para formar
a molécula de gás hidrogênio é do tipo sigma p-p.
e) A energia potencial no ponto mínimo do gráfico corresponde à variação de energia
necessária para a formação da ligação covalente H–H.
36. (FPS PE/2017)
O bromo é um elemento não metálico e líquido, à temperatura ambiente, que evapora
facilmente, formando um vapor avermelhado. Considere o esquema abaixo, que representa o
bromo passando por diferentes transformações.
𝟏 𝟏 𝟏 𝟐 𝟑
𝑩𝒓𝟐 (𝒍) → 𝑩𝒓𝟐 (𝒈) → 𝑩𝒓 (𝒈) → 𝑩𝒓+ (𝒈) + 𝟏𝒆−
𝟐 𝟐
A respeito do bromo e dessas transformações, assinale a afirmativa incorreta.
a) Durante a transformação 1,são rompidas interações intermoleculares.
b) As moléculas de Br2, no estado líquido, se ligam através de forças de London.
c) Nas transformações 1, 2 e 3, o bromo absorve energia.
d) Durante a transformação 2,são rompidas ligações covalentes.
AULA 05 – LIGAÇÕES QUÍMICAS 66
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
e) A energia envolvida na transformação 3 é a afinidade eletrônica do bromo.
37. (UFJF MG/2017)
O selênio quando combinado com enxofre forma o sulfeto de selênio, substância que
apresenta propriedades antifúngicas e está presente na composição de xampus anticaspa. Qual
o tipo de ligação química existente entre os átomos de enxofre e selênio?
a) Covalente.
b) Dipolo-dipolo.
c) Força de London.
d) Iônica.
e) Metálica.
38. (UFJF MG/2015)
O óxido nitroso – N2O(g) –, também conhecido como gás hilariante, foi o primeiro
anestésico utilizado em cirurgias. Hoje, também pode ser utilizado na indústria automobilística
para aumentar a potência de motores de combustão interna. Abaixo, está representada uma
possibilidade da estrutura de Lewis dessa molécula.
De acordo com a fórmula apresentada, marque a opção que descreve CORRETAMENTE
as ligações existentes no N2O.
a) Uma ligação iônica e duas ligações covalentes simples.
b) Duas ligações covalentes, sendo uma tripla e uma simples.
c) Duas ligações covalentes simples.
d) Duas ligações iônicas.
e) Duas ligações covalentes, sendo uma dupla e uma simples.
39. (UERJ/2014)
O ciclo do nitrogênio é extremamente importante para os seres vivos. Esse elemento faz
parte de diversos compostos orgânicos, como proteínas e ácidos nucleicos. Na tabela, há
exemplos de formas químicas do nitrogênio incorporadas por alguns seres vivos.
AULA 05 – LIGAÇÕES QUÍMICAS 67
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
O nitrato, íon de geometria trigonal plana, serve como fonte de nitrogênio para as
bactérias.
Observe as seguintes fórmulas estruturais:
A fórmula que corresponde ao íon nitrato está identificada pelo seguinte número:
a) I
b) II
c) III
d) IV
40. (IFSP/2013)
A ligação química entre dois átomos de nitrogênio (Z = 7) é representada corretamente
pela fórmula estrutural
a) N+N–.
b) N3+N3–.
c) N-N.
d) N=N.
e) NN.
AULA 05 – LIGAÇÕES QUÍMICAS 68
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
41. (UECE/2012)
Para que suas flores vivam uma semana a mais, basta diluir 1 mg de Viagra na água do
vaso. A sugestão é de pesquisadores de Israel e da Austrália, que testaram os efeitos do
medicamento em vegetais e descobriram que o óxido nítrico, componente que ajuda a tratar a
disfunção erétil, também preserva as flores por mais tempo.
Com relação ao óxido nítrico, pode-se afirmar corretamente que
a) no ar, pode converter-se em ácido nitroso, cuja composição química é H2NO2.
b) conforme sua estrutura, apresenta-se como um híbrido de ressonância.
c) é gasoso, inorgânico, incolor, possui seis elétrons do nitrogênio e seis do oxigênio,
tendo um elétron desemparelhado.
d) pela distribuição dos elétrons em sua estrutura é diamagnético.
8. Gabarito Sem Comentários
1. E 14. A 29. E
2. C 15. B 30. B
3. E 16. B 31. B
4. C 17. C 32. B
5. A 18. E 33. A
6. B 19. A 34. B
7. D 20. B 35. E
8. 98 21. B 36. E
9. E 22. A 37. A
10. 14 23. B 38. B
11. B 24. D 39. B
12. B 25. E 40. E
13. B 26. D 41. B
27. B
28. A
AULA 05 – LIGAÇÕES QUÍMICAS 69
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
9. Resoluções Das Questões Fundamentais
I. Questão fundamental 01.
A partir das tabelas de valência fixa de cátions e ânions, escreva as fórmulas iônicas
obtidas pelas combinações dos elementos a seguir.
Tabela de cátions de valência fixa
Tabela de ânions de valência fixa
a) Ca e F. – Ca2+ e F- → CaF2.
b) Al e S. – Al3+ e S2- → Al2S3.
c) Zn e N. – Zn2+ e N3- → Zn3N2.
d) K e Cl. – K+ e Cl- → KCl.
e) Mg e N. – Mg2+ e N3- → Mg3N2.
II. Questão fundamental 02.
A partir das tabelas de valência fixa de cátions e ânions, identifique o cátion e o ânion das
fórmulas seguintes.
Tabela de cátions de valência fixa
AULA 05 – LIGAÇÕES QUÍMICAS 70
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Tabela de ânions de valência fixa
a) KCl. – K+ e Cl-.
b) K2CO3. – K+ e CO32-.
c) FeS. – Fe2+ e S2-.
d) PbO2. – Pb4+ e O2-.
e) NaHSO3. – Na+ e HSO3-.
f) KNO3. – K+ e NO3-.
g) FeCl3. – Fe3+ e Cl-.
h) Au2O. – Au+ e O2-.
i) MgSO4. – Mg2+ e SO42-.
j) Na2C2O4. – Na+ e C2O42-.
III. Questão fundamental 03.
Escreva as fórmulas estruturais das moléculas seguintes.
g) O3
a) CO2
O
O C O O O
b) H2O
h) H2SO3
O O
H H O O
H S H
AULA 05 – LIGAÇÕES QUÍMICAS 71
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
c) NH3 i) H3BO3
N
H H H O B O H
H
O
H
d) HNO2
O O
N H j) CS2
S C S
e) CCl4
k) H2CO3
Cl O
H O
Cl C Cl C H
Cl O
l) PH3
f) H2S P
H H
S H
H H
10. Questões Resolvidas E Comentadas
1. (ETEC SP/2020)
John Goodenough, Stanley Whittingham e Akira Yoshino são os vencedores do Prêmio
Nobel 2019 de Química pelo desenvolvimento de baterias de íons de lítio. Atualmente, celulares,
notebooks e carros elétricos saem de fábrica com esse tipo de bateria.
Com essa descoberta, é possível armazenar uma grande quantidade de energia em
baterias pequenas e leves. Se fôssemos utilizar outros tipos de bateria, como por exemplo,
bateria de hidreto de níquel ou bateria de níquel cádmio, para armazenarmos a mesma
quantidade de energia, teríamos baterias com o tamanho e massa duas ou até mesmo três vezes
maiores que as baterias de íons de lítio. Outra vantagem desse tipo de bateria é o fato de não
possuírem o efeito memória, conhecido popularmente como o vício da bateria. Devido a essa
característica que facilita a vida do usuário, ela não requer tanta atenção nos processos de carga
e descarga.
Contudo, com todos os avanços, as baterias continuam extremamente sensíveis à
temperatura. Quando expostas ao calor, podem perder parte de sua capacidade total e se
decompor mais rápido que o normal.
Os íons de lítio, usados em baterias, são provenientes de compostos iônicos. Um exemplo
de composto iônico é o sal cloreto de sódio, no qual átomos de sódio se ligam a átomos de cloro
por meio de ligação iônica, na razão de 1 :1, como todos os cloretos de metais alcalinos.
AULA 05 – LIGAÇÕES QUÍMICAS 72
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Sabendo que o lítio também é um metal alcalino, podemos afirmar que os átomos de lítio
se ligam a átomos de cloro formando o composto cloreto de lítio, representado, corretamente,
por
a) Li2C
b) Li2C 2
c) CLi2
d) C2Li2
e) LiC
Comentários:
O lítio é um metal alcalino da família IA, ou seja, ele tende a cede 1 elétron para o cloro,
que tende a receber esse elétron. Sendo assim, a fórmula do sal cloreto de lítio é: LiC.
Gabarito: E
2. (Fac. Direito de São Bernardo do Campo SP/2020)
A seguir estão representadas as configurações eletrônicas da camada de valência dos
átomos X e Y:
X: 4s2 4p5
Y: 4s2
Assinale a alternativa que apresenta, respectivamente, o tipo de ligação que ocorre entre
esses átomos e a fórmula do composto.
a) Iônica, XY
b) Covalente, YX2
c) Iônica, YX2
d) Covalente, XY
Comentários:
O átomo X está no 4º período e possui 7 elétrons na camada de valência, ou seja, ele é
um halogênio e é ávido para receber 1 elétron. Já o átomo Y, está no mesmo período, porém na
família IIA, porque possui 2 elétrons de valência, sendo um metal alcalino terroso. Portanto, Y
cede dois elétrons para X, formando uma ligação iônica e o composto de fórmula: YX 2.
Gabarito: C
3. (FPS PE/2020)
AULA 05 – LIGAÇÕES QUÍMICAS 73
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Suponha que um laboratório consiga produzir o elemento X de número atômico 120 e que
esse elemento tenha propriedades similares às dos outros elementos de sua família.
É possível deduzir que o óxido formado por esse elemento teria a fórmula:
a) X2O
b) XO2
c) X2O3
d) X2O5
e) XO
Comentários:
O elemento cujo número atômico é 120 possui 120 elétrons, logo, a distribuição eletrônica
é dada por: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6 8s2.
Sendo assim, esse seria um elemento da família IIA, porque possui 2 elétrons na camada de
valência, logo, ao interagir com o oxigênio, cederia os 2 elétrons que o oxigênio precisa para
completar o octeto.
Portanto, o óxido formado por esse elemento teria a fórmula de XO.
Gabarito: E
4. (UFPR/2019)
Nos relógios mostrados a seguir, as posições, que são originalmente ocupadas por
números, foram substituídas por símbolos de elementos químicos, cujos números atômicos
correspondem ao numeral original do relógio.
As substâncias neutras formadas a partir da leitura das horas marcadas nos relógios I, II
e III são, respectivamente:
a) LiF – MgO – BeF.
b) LiF – Mg2O – BeF.
c) LiF – MgO – BeF2.
d) Li2F – MgO – BeF2.
e) Li2F – Mg2O – BeF2.
AULA 05 – LIGAÇÕES QUÍMICAS 74
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Comentários:
Analisando cada relógio, tem-se:
I. Átomos: F e Li. O lítio é metal alcalino e tende a ceder um elétron para o flúor, formando
o LiF.
II. Átomos: O e Mg. O magnésio é um metal alcalino terroso e tende a ceder seus 2
elétrons da camada de valência para completar a valência do oxigênio, formando o óxido MgO.
II. Átomos: Be e F. O berílio é um metal alcalino terroso e tende a ceder seus dois elétrons,
logo, ele cede um elétron para cada átomo de flúor, formando o: BeF 2.
Gabarito: C
5. (UFPR/2019)
A usina de energia de Hellisheidi, na Islândia, vem testando um novo método para
combater o aquecimento global: transformar o gás carbônico (CO 2) em pedra. O processo ocorre
em duas etapas: primeiro o CO2 é dissolvido em água em altas pressões (25 bar) e depois
injetado no solo numa temperatura de 230 ºC. A mineralização do gás carbônico ocorre de
maneira rápida, devido à reatividade e composição do solo da região, rica em ferro, cálcio e
magnésio. As duas etapas da remoção de CO2 estão esquematizadas de maneira simplificada
ao lado.
CO2(g) + H2O() ⎯25
⎯bar
⎯→ CO32- (aq) + 2H+(aq)
CO32- (aq)+ Ca2+(aq) ⎯230
⎯⎯ ºC
→ CaCO3(s)
Fonte: 1. <https://www.bbc.com/portuguese>. Acessado em 23 de maio 2018. Adaptado. 2. Mater, J. M. et alii, Rapid carbon mineralization for
permanent disposal of anthropogenic carbon dioxide emissions. Science, Vol. 352, Issue 6291, pp. 1312-1314.
A remoção desse gás da atmosfera ocorre por:
a) formação de composto iônico.
b) reação de oxidorredução.
c) ligação covalente com a rocha.
d) alteração do estado de agregação.
e) adsorção de CO2 numa matriz porosa.
Comentários:
Analisando alternativa por alternativa, tem-se:
a) Certa. A etapa final para remoção do CO2 é dada com a formação do CaCO3, que é um
composto iônico, uma vez que cálcio cede 2 elétrons para o carbonato (CO 32-) e este foi formado
a partir do CO2.
b) Errada. Nota-se que, nas duas reações, o carbono continua com nox +4, o oxigênio
com nox -2, o cálcio com nox +2 e o hidrogênio com nox +1. Logo, não há redução nem oxidação.
AULA 05 – LIGAÇÕES QUÍMICAS 75
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
c) Errada. O sólido formado, CaCO3, que é um composto iônico, representa a remoção do
gás.
d) Errada. O CO2 gasoso é transformado em outro composto, o CaCO3, na forma sólida,
tratando de um processo químico. Sendo assim, o CO2 não muda de estado de agregação, mas
se transforma em outra substância.
e) Errada. O CO2 é dissolvido em água dando a primeira etapa do processo. Sendo assim,
ele não fica adsorvido em uma matriz porosa.
Gabarito: A
6. (FAMERP SP/2019)
A combinação dos elementos Ca e Br forma uma substância solúvel em água, de fórmula
__________. Uma solução aquosa dessa substância é classificada como __________ de
eletricidade.
As lacunas do texto devem ser preenchidas por:
a) Ca2Br – condutora.
b) CaBr2 – condutora.
c) Ca2Br – não condutora.
d) CaBr2 – não condutora.
e) CaBr – condutora.
Comentários:
Seguindo o fluxo de ideias do trecho, tem-se:
I. O cálcio é um metal alcalino terroso que tende a ceder os elétrons para o halogênio, o
bromo, logo, forma-se o CaBr2.
II. O CaBr2 é um sal: o brometo de cálcio e todos os brometos de metais alcalinos e
alcalinos terrosos são solúveis em água. Com isso, há a liberação de íons, favorecendo a
condução de corrente elétrica:
𝐶𝑎𝐵𝑟2 → 𝐶𝑎2+ + 𝐵𝑟 −
Portanto, o trecho completo é dado por:
A combinação dos elementos Ca e Br forma uma substância solúvel em água, de fórmula
CaBr2. Uma solução aquosa dessa substância é classificada como condutora de eletricidade.
Gabarito: B
7. (PUC SP/2018)
Observe a figura abaixo e assinale a alternativa INCORRETA.
AULA 05 – LIGAÇÕES QUÍMICAS 76
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Fonte: Ohara Augusto. Radicais livres bons, maus e naturais.
Ed. Oficina de textos, 2006.
a) Átomos que pertencem à família dos metais alcalinos formam cátions monovalentes.
b) Átomos que pertencem ao grupo 17 formam ânions monovalentes.
c) A ligação iônica ocorre entre cátions e ânions e é caracterizada pela existência de forças
de atração eletrostática entre eles.
d) Na ligação iônica, apenas átomos que perdem e ganham a mesma quantidade de
elétrons podem se combinar.
Comentários
Julgando as alternativas, tem-se:
a) certo. Os metais alcalinos formam cátions de valência fixa +1.
b) certo. Os halogênios apresentam a tendência a capturar um elétron e adquirir
estabilidade eletrônica semelhante a um gás nobre.
c) certo. A ligação iônica ocorre entre a força de atração de cargas opostas dos cátions e
ânions.
d) errado. Na ligação iônica, a quantidade total de elétrons transferidos é a mesma, ou
seja, a quantidade total de elétrons cedidos é igual à quantidade total de elétrons recebidos.
Porém, esse balanceamento não necessariamente precisa ocorrer entre dois átomos.
Gabarito: D
8. (UFSC/2017)
Jogos Olímpicos Rio 2016: o que é o pó que os ginastas passam nas mãos antes da
competição?
AULA 05 – LIGAÇÕES QUÍMICAS 77
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
O pó branco utilizado pelos atletas nas mãos e pés em competições de ginástica artística
é comumente conhecido como “pó de magnésio”. Esse pó é, na realidade, o carbonato de
magnésio, que possui ação antiumectante, utilizado para diminuir a sensação escorregadia
durante as acrobacias. O pó atua absorvendo o suor e diminuindo os riscos de o ginasta cair e
se machucar. Sem a utilização do “pó de magnésio”, o risco de lesões seria maior, mas apenas
os atletas utilizam, já que o pó desidrata a pele e pode causar manchas.
Disponível em: <http://www.vavel.com/br/mais-esportes/647755-ginastica-
artistica-tudo-o-que-voc-precisa-saber-para-o-rio-2016.html>. [Adaptado].
Imagem disponível em: <http://globoesporte.globo.com/outros-esportes/fotos/
2012/12/retrospectiva-fotos-mais-bonitas-de-2012.html>. Acesso em: 11 ago. 2016.
Sobre o assunto, é correto afirmar que:
01. o contato do carbonato de magnésio com o suor produzido nas mãos de um ginasta
resulta na produção de íons Mg2– e CO32+.
02. na forma de íons Mg2+, o magnésio possui dez elétrons distribuídos em dois níveis
eletrônicos.
04. o magnésio é classificado como um metal de transição.
08. o magnésio na forma reduzida (Mg0) não conduz eletricidade.
16. a ligação entre íons magnésio e íons carbonato possui elevado caráter covalente e,
portanto, o carbonato de magnésio não se dissolve no suor do ginasta.
32. ao espalhar 8,43 g de carbonato de magnésio nas mãos, o ginasta estará utilizando
0,100 mol de magnésio e 0,100 mol de carbonato.
64. existem 243 g de magnésio em 10,0 mol de carbonato de magnésio.
Comentários
Julgando os itens, tem-se:
01. errado. Os íons formados são Mg2+ e CO32-.
02. certo. Distribuição eletrônica do íon Mg2+ é 1s2 2s2 2p6, logo 10 elétrons em dois níveis
de energia.
04. errado. O magnésio é classificado como um metal de alcalinoterroso.
08. errado. Todos os metais, em sua forma metálica (M0), conduzem eletricidade, porque
apresentam elétrons deslocalizados.
16. errado. A ligação entre metais e ametais apresenta característica eletrostática, ou seja,
ligação iônica. A ligação covalente ocorre compartilhamento de elétrons e ocorre entre ametais
e/ou hidrogênio.
32. certo. A massa molar do carbonato de cálcio (MgCO3) é igual a 84,3 g/mol. Em 8,43 g
de carbonato de cálcio, apresenta 0,1 mol de carbonato de cálcio. Portanto, 0,1 mol de MgCO 3
apresente 0,1 mol de Mg2+ e 0,1 mol de CO32-.
64. certo. Em 10 mol de MgCO3, existem 10 mols de magnésio. Sabendo que a massa
molar do magnésio é igual a 24,3 g/mol, em 10 mols de magnésio possuem 243 g.
Gabarito: 98
AULA 05 – LIGAÇÕES QUÍMICAS 78
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
9. (Mackenzie SP/2017)
Em dezembro de 2016, a IUPAC (International Union of Pure and Applied Chemistry)
oficializou a nomenclatura dos novos elementos químicos, presentes no sétimo período da tabela
periódica. Assim, os elementos 113 (grupo 13), 115 (grupo 15), 117 (grupo 17) e 118 (grupo 18)
passaram a ser denominados, respectivamente, de Nihonium (Nh), Moscovium (Mc), Tennessine
(Ts) e Oganesson (Og).
Pode-se afirmar que o elemento
Dado: Número atômico (Z): O = 8
a) Nh forma o íon Nh3–.
b) Mc é um metal de transição.
c) Ts é um elemento representativo e pertence ao mesmo grupo do oxigênio.
d) Og é um gás nobre e apresenta configuração da camada de valência 6s 2 6p6.
e) Nh pode combinar-se com um halogênio (X), formando o composto hipotético NhX3.
Comentários
Julgando os itens, tem-se:
a) Errado. Somente o boro do grupo 13 apresenta tendência a ganhar elétrons, portanto
o elemento Nh formaria cátions de valência variável.
b) Errado. Todos os elementos do grupo 15 são elementos representativos. Os elementos
de transição pertencem aos grupos 3 a 12.
c) Errado. Ts é um elemento representativo e pertence ao grupo 17, grupo dos halogênios.
O oxigênio pertence aos calcogênios.
d) Errado. Og é um gás nobre e apresenta configuração da camada de valência 7s 2 7p6.
e) Certo. O elemento Nh apresenta comportamento metálico. O Nh apresenta a mesma
tendência eletrônica que o metal alumínio, portanto perde 3 elétrons para adquirir estabilidade.
Os halogênios precisam de um elétron para ficar estável, assim a combinação de Nh 3+ e X-
produz o composto NhX3.
Gabarito: E
10. (UEPG PR/2016)
Sobre a configuração eletrônica e a Teoria do Octeto, assinale o que for correto.
01. O átomo de número atômico 15, ao perder 3 elétrons, adquire a configuração de gás
nobre.
02. Os halogênios, como o flúor e o cloro, atingem o octeto quando recebem elétrons na
camada de valência.
AULA 05 – LIGAÇÕES QUÍMICAS 79
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
04. Os metais alcalinos terrosos adquirem configuração eletrônica de gás nobre quando
formam íons com número de carga +2.
08. Átomos dos elementos do grupo 1 da tabela periódica, como o sódio e o potássio,
possuem uma tendência acentuada a perder elétrons da camada de valência.
Comentários
Julgando os itens, tem-se:
01. Errado. O átomo de número atômico 15 apresenta configuração eletrônica 1s 2 2s2 2p6
3s2 3p3, ao perder 3 elétrons apresenta a configuração eletrônica 1s2 2s2 2p6 3s2. A configuração
eletrônica de um gás nobre termina em p6, com exceção do hélio que é 1s2.
02. Certo. Os ametais estabilizam-se quando recebem elétrons nos subníveis
incompletos.
04. Certo. Os metais alcalinos terrosos formam cátions de valência fixa +2.
08. Certo. Os metais perdem elétrons para adquirir estabilidade eletrônica.
Gabarito: 14
11. (EsPCEX/2015)
Compostos iônicos são aqueles que apresentam ligação iônica. A ligação iônica é a
ligação entre íons positivos e negativos, unidos por forças de atração eletrostática.
(Texto adaptado de: Usberco, João e Salvador, Edgard, Química: química geral, vol 1, pág 225, Saraiva, 2009).
Sobre as propriedades e características de compostos iônicos são feitas as seguintes
afirmativas:
I. apresentam brilho metálico.
II. apresentam elevadas temperaturas de fusão e ebulição.
III. apresentam boa condutibilidade elétrica quando em solução aquosa.
IV. são sólidos nas condições ambiente (25 °C e 1atm).
V. são pouco solúveis em solventes polares como a água.
Das afirmativas apresentadas estão corretas apenas
a) II, IV e V.
b) II, III e IV.
c) I, III e V.
d) I, IV e V.
e) I, II e III.
AULA 05 – LIGAÇÕES QUÍMICAS 80
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Comentários
Julgando os itens, tem-se:
I. errado. Os compostos iônicos não apresentam superfícies polidas que apresentam
brilho característico. O brilho é uma propriedade dos metais.
II. certo. A forte força de interação entre cátions e ânions, bem como a estrutura
organizada de partículas justifica a alta temperatura de fusão e ebulição.
III. certo. Os compostos iônicos, em água, sofrem dissociação e formam íons em solução
aquosa. Esses íons são os responsáveis pela condutibilidade elétrica.
IV. certo. Os compostos iônicos são sólidos devido ao empacotamento das partículas
iônicas.
V. errado. Os compostos iônicos podem ser solúveis ou insolúveis. A solubilidade deles
depende dos cátions e ânions.
Gabarito: B
12. (IME RJ/2015)
Dados os elementos abaixo,
𝟑𝟓 𝟒𝟎
𝟏𝟕𝜱 ; 𝟐𝟎𝜳 𝒆 𝟏𝟎𝟕
𝟒𝟕𝜴
marque a alternativa correta, considerando-se as condições de 1 atm e 25ºC.
a) Φ é encontrado livre na natureza na forma de gás monoatômico.
b) Φ combina-se com Ψ formando um composto solúvel em água.
c) Φ combina-se com Ω formando um composto solúvel em água.
d) Ψ combina-se com Ω formando um composto gasoso.
e) Ω é um mau condutor de eletricidade.
Comentários
Realiza-se a distribuição eletrônica dos elementos:
35
17𝛷 ∶ 1s2 2s2 2p6 3s2 3p5
40
20𝛹 : 1s2 2s2 2p6 3s2 3p6 4s2
107
47𝛺 : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d10
Para resolver essa questão é importante saber ou consultar a tabela de solubilidade de
sais, porque ainda não estudamos essa aula ainda.
Julgando os itens, tem-se:
a) errado. Os átomos que são encontrados livres na natureza na forma de gás
monoatômico são os gases nobres que terminam a distribuição eletrônica em p 6, com exceção
do hélio que apresenta a configuração 1s2.
AULA 05 – LIGAÇÕES QUÍMICAS 81
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
b) certo. O elemento com número atômico 17 é o cloro, que forma compostos iônicos
solúveis em água, com exceção quando se combina com átomos de prata, chumbo II e mercúrio
I. O elemento com número atômico 20 é o cálcio.
c) errado. O elemento com número atômico 17 é o cloro, enquanto o elemento com
número 47 é a prata. O composto cloreto de prata é insolúvel.
d) errado. Os dois elementos do item d) são metálicos, portanto, quando combinados,
formam ligas metálicas sólidas.
e) errado. O elemento que termina a configuração eletrônica em d é um metal. Os metais
são condutores de eletricidade. O elemento citado é a prata que é um bom condutor de
eletricidade devido a sua baixa capacidade de perder elétrons, quando comparado aos outros
metais. Um metal quando perde elétrons, ou seja, realiza ligação iônica, perde a sua
condutibilidade elétrica.
Gabarito: B
13. (ESCS DF/2014)
As emissões radioativas são empregadas na radioterapia para destruir células doentes ou
impedi-las de se reproduzirem. Em 1987, uma cápsula contendo cloreto de césio-137 foi
abandonada junto a um equipamento nas antigas instalações do Instituto Goiano de
Radioterapia, em Goiânia. A cápsula foi encontrada e aberta pelo dono de um ferro-velho, o que
causou o maior acidente radioativo da história do Brasil.
O cloreto de césio é um compost
a) molecular com fórmula química CsC2.
b) iônico com fórmula química CsC.
c) iônico com fórmula química CsC2.
d) molecular com fórmula química CsC.
Comentários
A ligação química entre o césio (metal) e o cloro (ametal) é a ligação iônica. O césio forma
cátion de valência fixa monovalente, enquanto o cloro apresenta-se como ânion monovalente.
A combinação do Cs+ e Cl- produz o composto iônico de fórmula CsC.
Gabarito: B
14. (IFSP/2014)
O cloreto de potássio, KC, vem sendo utilizado no chamado “sal light”, substituindo parte
do cloreto de sódio que constitui o sal comum. Sabendo que o potássio é um elemento do grupo
1 da tabela periódica (metal alcalino) e que o cloro é um elemento do grupo 17 da tabela periódica
(halogênio), pode-se afirmar que as ligações químicas existentes nos cristais de cloreto de
potássio são
AULA 05 – LIGAÇÕES QUÍMICAS 82
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
a) iônicas.
b) metálicas.
c) covalentes simples.
d) covalentes duplas.
e) covalentes triplas.
Comentários
A ligação química entre o potássio (metal) e o cloro (ametal) é a ligação iônica, porque
ocorre transferência de elétrons. O potássio forma cátion de valência fixa monovalente, enquanto
o cloro apresenta-se como ânion monovalente.
A combinação do K+ e Cl- produz o composto iônico de fórmula KC.
Gabarito: A
15. (ENEM/2014)
As propriedades físicas e químicas de uma certa substância estão relacionadas às
interações entre as unidades que a constituem, isto é, as ligações químicas entre átomos ou íons
e as forças intermoleculares que a compõem. No quadro, estão relacionadas algumas
propriedades de cinco substâncias.
Qual substância apresenta propriedades que caracterizam o cloreto de sódio (NaC)?
a) I
b) II
c) III
d) IV
e) V
Comentários
O cloreto de sódio (NaCl) é um composto iônico porque é formado de metal e ametal. Os
compostos iônicos apresentam as seguintes propriedades:
- duros,
- quebradiços,
AULA 05 – LIGAÇÕES QUÍMICAS 83
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
- sólidos à temperatura ambiente,
- elevadas temperaturas de fusão e ebulição,
- apresentam solubilidade em água,
- conduzem corrente elétrica quando fundidos ou em soluções aquosas, mas não
conduzem corrente elétrica no estado sólido.
Gabarito: B
16. (ITA SP/2012)
Considere os seguintes pares de moléculas:
I. LiC e KC
II. AC3 e PC3
III. NC3 e AsC3
Assinale a opção com as três moléculas que, cada uma no seu respectivo par, apresentam
ligações com o maior caráter covalente.
a) LiC, AC3 e NC3
b) LiC, PC3 e NC3
c) KC, AC3 e AsC3
d) KC, PC3 e NC3
e) KC, AC3 e NC3
Comentários
As ligações podem ser comparadas segundo dois critérios antagônicos: caráter iônico e
caráter covalente. O caráter iônico refere-se à maior diferença de eletronegatividade entre os
elementos envolvidos, facilitando, assim, a transferência de elétrons. O caráter covalente refere-
se à maior tendência ao compartilhamento de elétrons, sendo assim, a menor diferença de
eletronegatividade entre os elementos.
K e Li são do mesmo grupo, porém quanto maior o número atômico, maior a
eletropositividade. Portanto, o potássio aumenta o caráter iônico e o lítio aumenta o caráter
covalente quando combinados com o elemento cloro.
Alumínio é um metal, enquanto o fósforo é um ametal. Portanto, a ligação covalente ocorre
entre ametais. Logo, o fósforo forma ligações mais covalentes.
A diferença de eletronegatividade entre o nitrogênio e o cloro é menor que a diferença de
eletronegatividade entre cloro e arsênio, por isso, a ligação nitrogênio-cloro apresenta maior
caráter covalente.
Gabarito: B
17. (Fac. Israelita de C. da Saúde Albert Einstein SP/2020)
Considere as seguintes informações sobre uma liga metálica de bismuto:
AULA 05 – LIGAÇÕES QUÍMICAS 84
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
As características dessa liga metálica permitem seu uso em
a) destiladores de água.
b) isolantes elétricos.
c) fusíveis de dispositivos eletroeletrônicos.
d) panelas antiaderentes.
e) blocos de motores automotivos.
Comentários:
As características que podem ser retiradas dessa tabela é o fato de a liga metálica ter
ponto de fusão de 343 K (ou 70 °C), o que é um valor baixo, comparado com o ponto de fusão
da água, por exemplo. Além disso, trata-se de uma liga metálica, logo, ela é boa condutora de
eletricidade. Sendo assim, analisando alternativa por alternativa, tem-se:
a) Errada. Os destiladores tem a capacidade de purificar a água para torna-la boa para o
consumo. Sendo assim, a peça de metal que compõe essa estrutura não pode ter ponto de fusão
baixo, uma vez que pode contaminar o sistema de purificação.
b) Errada. Como visto, a liga é boa condutora, logo, não faz sentido ela ser parte de um
isolante elétrico.
c) Certa. Ideal para fusíveis, porque, além de conduzir corrente elétrica, possui baixo ponto
de fusão. Uma vez que os fusíveis não devem trabalhar a altas temperaturas.
d) Errada. As panelas antiaderentes possuem essa característica por serem feitas de
teflon. Além disso, o arcabouço metálico precisa ser construído por uma liga resistente a altas
temperaturas da chama do fogão, o que não é o caso.
E) Errada. Os motores automotivos atingem altas temperaturas e, como vimos, a liga
possui ponto de fusão muito baixo.
Gabarito: C
18. (UFRGS RS/2019)
Na coluna da direita abaixo, estão relacionadas algumas substâncias químicas; na da
esquerda, características dessas substâncias.
Associe adequadamente a coluna da esquerda à da direita.
( ) Sólido com alta maleabilidade e brilho metálico
AULA 05 – LIGAÇÕES QUÍMICAS 85
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
( ) Gás com coloração esverdeada
( ) Gás pouco denso e altamente inflamável
( ) Substância condutora de eletricidade quando fundida
1. Cloreto de sódio
2. Ouro
3. Cloro
4. Bromo
5. Hidrogênio
A sequência correta de preenchimento dos parênteses, de cima para baixo, é
a) 1 – 2 – 3 – 4.
b) 1 – 3 – 5 – 2.
c) 2 – 3 – 4 – 5.
d) 3 – 2 – 4 – 1.
e) 2 – 3 – 5 – 1.
Comentários:
Analisando a coluna da esquerda com a da direita, tem-se:
(2) Sólido com alta maleabilidade e brilho metálico. O ouro é um metal que pode ser
transformado em lâminas, ou seja, é maleável. Além disso, possui brilho metálico.
(3) Gás de coloração esverdeada: o cloro é caracterizado pela sua coloração verde.
(5) Gás pouco denso e altamente inflamável: o hidrogênio é um gás de massa molar
pequena comparado a outros gases, ou seja, também tem pouca densidade. Além disso, ele é
altamente inflamável.
(1) Substância condutora de eletricidade quando fundida: essa é uma característica dos
sais, como o cloreto de sódio, já que em meio aquoso ou no estado líquido, libera íons,
favorecendo a condução elétrica.
A única espécie que ficou de fora foi o bromo, Br2, que é um líquido vermelho, volátil e
denso, sendo seus vapores irritantes às mucosas.
Gabarito: E
19. (UECE/2019)
A nível de ilustração, os núcleos dos átomos são considerados ilhas mergulhadas em um
mar de elétrons. Essa comparação nos leva a concluir que se trata de uma ligação química
a) metálica.
AULA 05 – LIGAÇÕES QUÍMICAS 86
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
b) iônica.
c) covalente polar.
d) covalente apolar.
Comentários:
Analisando alternativa por alternativa, tem-se:
a) Certa. A ligação metálica é caracterizada justamente por esse mar de elétrons que se
desloca sobre a estrutura dos átomos de metais, conferindo a eles suas propriedades como boa
condutividade elétrica, brilho metálico.
b) Errada. A ligação iônica se caracteriza pela doação de elétrons de uma espécie para à
outra mais eletronegativa, visando a estabilidade de ambos.
c) Errada. A ligação covalente é marcada pelo compartilhamento de elétrons e seu caráter
polar é resultante de um momento dipolo entre as cargas diferente de zero.
d) Errada. Analogamente à ligação covalente polar, a diferença da covalente apolar é que
seu momento dipolo é igual a zero.
Gabarito: A
20. (UERJ/2020)
O QUE NOSSAS METÁFORAS DIZEM DE NÓS
1Para o poeta Robert Frost, a vida era um caminho que passa por encruzilhadas
inevitáveis; para 2Fernando Pessoa, uma sombra que passa sobre um rio. Shakespeare via o
mundo como um palco 3e Scott Fitzgerald percebia os seres humanos como barcos contra a
corrente. Metáforas como essas 4nos rodeiam, mas não só quando seguramos um livro nas
mãos. Em nosso uso cotidiano da língua, 5elas são tão presentes que nem sequer percebemos.
São exemplos “teto de vidro impede a carreira 6das mulheres”, “a bolha do aluguel”, “cortar o mal
pela raiz”. Considerada a forma por excelência da 7linguagem figurada, a metáfora às vezes é
tida como mero embelezamento do discurso.
8Entretanto, desde 1980, com a publicação do livro Metáforas da vida cotidiana, essa
figura retórica 9recuperou seu protagonismo. Os autores George Lakoff e Mark Johnson
mostraram que as alegorias 10desenham o mapa conceitual a partir do qual observamos,
pensamos e agimos. Com frequência são 11nossa bússola invisível, orientando tanto os gestos
instintivos que fazemos como as decisões mais 12importantes que tomamos. É muito provável
que aqueles que concebem a vida como uma cruz e 13os que a entendem como uma viagem não
reajam da mesma forma ante um mesmo dilema. As 14metáforas são ferramentas eficazes e de
múltiplas utilidades. Ao partir de elementos já conhecidos, 15nos ajudam a examinar realidades,
conceitos e teorias novas de uma maneira prática. Também nos 16servem para abordar
experiências traumáticas nas quais a linguagem literal se revela impotente. 17São vigorosos
atalhos que a mente usa para assimilar situações complexas em que a literalidade 18acaba sendo
tediosa, limitada e confusa. É mais fácil para nós entender que a depressão é uma 19espécie de
buraco negro e que o DNA é o manual de instruções de cada ser vivo.
20As figurações dão coesão às identidades coletivas, pois circulam sem cessar até se
incorporarem 21à linguagem cotidiana. Há alguns anos, os psicólogos Paul Thibodeau e Lera
Boroditsky, da 22Universidade Stanford (E.U.A.), analisaram os resultados de um debate sobre
AULA 05 – LIGAÇÕES QUÍMICAS 87
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
políticas contra a 23criminalidade que recorria a duas metáforas. Quando o problema era ilustrado
como se houvesse 24predadores devorando a comunidade, a resposta era endurecer a vigilância
policial e aplicar leis 25mais severas. No entanto, quando o problema era exposto como um vírus
infectando a cidade, a 26opção era a de adotar medidas para erradicar a desigualdade e melhorar
a educação. Comparações 27ruins levam a políticas ruins, escreveu o Nobel de Economia Paul
Krugman.
28No campo da medicina, tem havido mudanças de paradigma no que diz respeito ao
impacto 29emocionaldas metáforas. Num recente seminário organizado pela Universidade de
Navarra 30(Espanha), a linguista Elena Semino dissertou sobre os efeitos de abordar o câncer
como se 31fosse uma guerra, provocando sensações negativas quando o paciente acredita estar
“perdendo a 32batalha”, mesmo que isso possa ser estimulante para outros. O erro, segundo a
especialista, reside 33em misturar os campos semânticos da guerra e da saúde. Para corrigir
essa questão, a linguista 34elabora o que chama de “cardápio de metáforas”, para que médicos
e pacientes enfrentem a doença 35de forma mais construtiva.
36As boas metáforas nos trazem outras perspectivas, fronteiras menos rígidas e novas
categorizações 37que substituem aquelas já desgastadas.
MARTA REBÓN
Adaptado de brasil.elpais.com, 11/04/2018.
Há um tipo de ligação interatômica em que os elétrons das camadas mais externas
transitam entre os cátions da rede cristalina. Por essa característica, tal ligação é comparada a
um “mar de elétrons”.
“Mar de elétrons” é uma metáfora que se refere ao seguinte tipo de ligação:
a) iônica
b) metálica
c) covalente
d) de hidrogênio
Comentários:
Analisando alternativa por alterantiva, tem-se:
a) Errada. A ligação iônica se caracteriza pela doação de elétrons de uma espécie para à
outra mais eletronegativa, visando a estabilidade de ambos.
b) Certa. A ligação metálica é caracterizada justamente por esse mar de elétrons que se
desloca sobre a estrutura dos átomos de metais, conferindo a eles suas propriedades como boa
condutividade elétrica, brilho metálico.
c) Errada. A ligação covalente é marcada pelo compartilhamento de elétrons entre as
espécies.
d) Errada. A ligação de hidrogênio é a força intermolecular mais forte que ocorre entre
dipolos permanentes das moléculas. Sendo assim, os átomos de hidrogênio de uma molécula
se liga com átomos de oxigênio, flúor ou nitrogênio (elementos bem eletronegativos) de outra.
Gabarito: B
AULA 05 – LIGAÇÕES QUÍMICAS 88
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
21. (Mackenzie SP/2018)
Assinale (V) para verdadeiro e (F) para falso, para as afirmações abaixo.
( ) Os metais apresentam alta condutividade elétrica, mas baixa condutividade térmica.
( ) O bronze é uma liga formada por cobre e estanho.
( ) Compostos iônicos conduzem corrente elétrica em meio aquoso e quando fundidos.
( ) A ligação covalente ocorre entre metais e não metais. O KBr é um exemplo.
( ) O dióxido de carbono é uma molécula apolar, mas que possui ligações covalentes
polares.
A sequência correta de preenchimento dos parênteses, de cima para baixo é
a) F, F, V, F e V.
b) F, V, V, F e V.
c) V, F, V, F e V.
d) F, F, V, F e F.
e) V, V, F, V e F.
Comentários
Julgando os itens, tem-se:
( F ) Os metais apresentam altas condutividades elétrica e térmica.
( V ) O bronze é uma liga formada por uma mistura dos metais cobre e estanho, sendo
cobre o elemento majoritário.
( V ) Compostos iônicos, quando dissolvidos em água, conduzem corrente elétrica porque
apresentam seus íons livres.
( F ) A ligação iônica ocorre entre metais e não metais. O KBr é um exemplo. A ligação
covalente ocorre entre ametais e/ou hidrogênio.
( V ) As ligações covalentes polares são aquelas que ocorrem entre elementos químicos
diferentes, enquanto a ligação covalente apolar ocorre entre elementos iguais. Devido à
geometria da molécula de dióxido de carbono, as polaridades das ligações carbono-oxigênio se
anulam, conforme será visto na aula seguinte.
Gabarito: B
22. (IFRS/2017)
Em uma Olimpíada, os atletas buscam suas melhores marcas, simbolizadas pelas
medalhas de ouro, prata e bronze. Sobre esses materiais são feitas as afirmações:
I. O ouro é um metal excelente condutor de calor e eletricidade, cujo símbolo é Au.
II. A prata é um metal mais reativo que o ouro, por isso não é tão nobre e seu símbolo é
Pt.
AULA 05 – LIGAÇÕES QUÍMICAS 89
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
III. O bronze é um metal de cor amarronzada, muito duro, cujo símbolo é Br.
Assinale a alternativa que contém a(s) afirmação(ões) correta(s).
a) I
b) II
c) III
d) I e II
e) II e III
Comentários
Julgando os itens, tem-se:
I. correto. O ouro é um metal excelente condutor de calor e eletricidade, porque apresenta
baixa capacidade de reagir com outros elementos. Um metal quando reage perde a
deslocalização dos elétrons que é a característica fundamental para a condutibilidade elétrica.
Quanto mais nobre o metal, melhor a sua capacidade de conduzir eletricidade.
II. errado. A prata é mais reativa que o ouro, mas o seu símbolo é Ag. O símbolo Pt é do
elemento platina.
III. errado. O bronze é uma mistura metálica formada de cobre e estanho. O símbolo Br
representa o elemento bromo.
Gabarito: A
23. (UEMG/2016)
“Minha mãe sempre costurou a vida com fios de ferro. ”
EVARISTO, 2014, p. 9.
Identifique na tabela a seguir a substância que possui as propriedades do elemento
mencionado no trecho acima.
A resposta CORRETA é:
a) Substância A.
b) Substância B.
c) Substância C.
d) Substância D.
AULA 05 – LIGAÇÕES QUÍMICAS 90
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Comentários
Os metais são formados por vários átomos ligados por elétrons deslocalizados, por isso
são bons condutores de energia elétrica. Apresentam elevada temperatura de fusão e ebulição,
com exceção do mercúrio e do gálio.
Gabarito: B
24. (UERJ/2015)
Para fabricar um dispositivo condutor de eletricidade, uma empresa dispõe dos materiais
apresentados na tabela abaixo:
M aterial Composição química
I C
II S
III As
IV Fe
Sabe-se que a condutividade elétrica de um sólido depende do tipo de ligação interatômica
existente em sua estrutura. Nos átomos que realizam ligação metálica, os elétrons livres são os
responsáveis por essa propriedade.
Assim, o material mais eficiente para a fabricação do dispositivo é representado pelo
seguinte número:
a) I
b) II
c) III
d) IV
Comentários
O dispositivo elétrico necessita de uma substância que tenha a característica de conduzir
corrente elétrica. Essa característica é encontrada nos metais devido aos seus elétrons
deslocalizados. Portanto, a melhor escolha é o elemento ferro.
Gabarito: D
25. (UCS RS/2015) Errei por vacilo, falta de atenção. Questão fácil
O mercúrio é um metal líquido à temperatura ambiente, conhecido desde os tempos
antigos da Grécia. Apresenta boa condutividade elétrica, além de formar amálgamas
relativamente consistentes com ouro, prata e chumbo. É frequentemente utilizado na fabricação
de termômetros, barômetros, lâmpadas e interruptores elétricos. Industrialmente, esse metal
pode ser obtido a partir do tratamento térmico do mineral cinábrio (HgS), na presença de gás
AULA 05 – LIGAÇÕES QUÍMICAS 91
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
oxigênio, em um alto forno. Esse processo, conhecido como ustulação, pode ser representado
simplificadamente por meio da equação química descrita abaixo.
HgS (s) + O2 (g) → Hg () + SO2 (g)
Considerando as informações do enunciado, assinale a alternativa correta.
a) 1,0 mol de mercúrio é produzido a partir de 2,0 mols de gás oxigênio na reação de
ustulação do cinábrio.
b) Os átomos de mercúrio e enxofre no cinábrio estão unidos entre si por meio de ligações
metálicas.
c) O gás oxigênio utilizado na reação de ustulação do cinábrio apresenta uma ligação
covalente normal tripla em sua estrutura química e geometria angular.
d) A reação química que ocorre durante a ustulação do cinábrio é de análise.
e) A substância composta obtida na reação de ustulação do cinábrio é polar e solúvel em
água.
Comentários
Julgando os itens, tem-se:
a) errado. 1,0 mol de mercúrio é produzido a partir de 1 mol de gás oxigênio na reação de
ustulação do cinábrio.
b) errado. Os átomos de mercúrio e enxofre no cinábrio estão unidos entre si por meio de
ligações iônicas. A ligação iônica ocorre entre um metal e um ametal.
c) errado. O gás oxigênio apresenta uma ligação covalente normal dupla em sua estrutura
química:
O O
d) errado. A reação química que ocorre durante a ustulação do cinábrio é de simples-troca
ou deslocamento.
e) certo. A substância composta obtida na reação de ustulação do cinábrio é polar e
solúvel em água. O SO2 é polar porque apresenta geometria molecular angular (vide aula
seguinte de polaridade).
Gabarito: E
26. (UNESP SP/2014)
Três substâncias puras, X, Y e Z, tiveram suas condutividades elétricas testadas, tanto no
estado sólido como no estado líquido, e os dados obtidos encontram-se resumidos na tabela.
AULA 05 – LIGAÇÕES QUÍMICAS 92
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Com base nessas informações, é correto classificar como substância(s) iônica(s)
a) Y e Z, apenas.
b) X, Y e Z.
c) X e Y, apenas.
d) Y, apenas.
e) X, apenas.
Comentários
Os compostos iônicos não conduzem corrente elétrica em estado sólido, mas no estado
líquido conduzem. Isso ocorre porque os compostos iônicos apresentam íons em sua
composição, porém no estado sólido estão retidos, enquanto no estado líquido estão livres e
movimentam-se.
Gabarito: D
27. (PUC GO/2014)
Três substâncias (I, II e III) foram caracterizadas experimentalmente de modo a obter duas
importantes propriedades: ponto de fusão (°C) e condutividade elétrica.
Substância Ponto de fusão C Condutividade elétrica
Estado sólido :
I 801
não, estado líquido : sim
Estado sólido :
II − 56,57
não, estado líquido : não
Estado sólido :
III 1.538
sim, estado líquido : sim
A partir destas informações, pode-se concluir que as substâncias I, II e III,
respectivamente, são formadas por ligações:
a) Metálicas, covalentes e iônicas.
b) Iônicas, covalentes e metálicas.
c) Metálicas, covalentes e metálicas.
d) Covalentes, metálicas e iônicas.
AULA 05 – LIGAÇÕES QUÍMICAS 93
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Comentários
Substância I: não conduz corrente elétrica no estado sólido, mas conduz corrente elétrica
no estado líquido. Isso é um indício de substância iônica. A elevada temperatura de fusão
confirma essa tese.
Substância II: Não pode ser iônico porque apresenta baixa temperatura de fusão e não
pode ser iônico ou metálico porque não conduz corrente elétrica nos estados líquido e sólido.
Portanto, essa substância é formada de ligações covalentes.
Substância III: conduz corrente elétrica no estado sólido, só pode ser formada de
substância metálica.
Gabarito: B
28. (PUC-GO/2021)
Leia o fragmento do texto sobre o registro da imagem de ligação e ruptura de átomos:
[...]
Cientistas britânicos e alemães fizeram história ao registrar, pela primeira vez, a união de
átomos em uma escala 500 mil vezes menor que um fio de cabelo humano. Os pesquisadores
usaram métodos avançados para capturarem a quebra de uma ligação química entre dois
átomos de rênio.
[...]
O experimento utilizou átomos de rênio, porque, devido a seu número atômico alto, é mais
fácil de ser visualizado. [...] No experimento, observou-se que dois átomos de rênio se ligam
principalmente por meio de uma ligação quádrupla.
(Disponível em: https://olhardigital.com.br/ciencia-e-espaco/noticia/cientistas-registram-a-primeira-imagem-de-ligacao-e-ruptura-de-atomos/95633.
Acesso em: 22 jan. 2020. Adaptado.)
A respeito dos átomos e suas ligações, leia as assertivas a seguir:
I - As ligações covalentes existem, principalmente, entre átomos, cuja diferença de
eletronegatividade não é muito elevada.
II - Normalmente, entre átomos de metal pode haver a formação de uma ligação metálica
em que os elétrons da camada de valência formam uma nuvem eletrônica entre os átomos,
mantendo-os unidos.
III - As exceções à regra do octeto ocorrem em átomos centrais relativamente grandes
como os elementos de transição interna, diferentemente do que ocorre com os elementos de
transição externa.
Em relação às assertivas lidas, assinale a única alternativa cujo(s) item(ns) está(ão)
correto(s):
(A) I e II apenas.
(B) I e III apenas.
(C) II apenas.
(D) II e III apenas.
Comentários:
AULA 05 – LIGAÇÕES QUÍMICAS 94
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Analisando afirmativa por afirmativa, tem-se:
I. Certa. Quando os átomos possuem diferença de eletronegatividade pequena, a
tendência é de haver ligações covalentes, onde há um compartilhamento dos elétrons.
II. Certa. Os átomos de metal formam entre si a ligação metálica, em que a característica
principal é a presença do mar de elétrons.
III. Errada. Alguns elementos como boro e alumínio se estabilizam com seis elétrons na
camada de valência e eles são elementos representativos. Além disso, o fósforo e o enxofre
ficam estável com 10 e 12 elétrons, respectivamente, devido à expansão do octeto pela presença
de orbitais d.
Gabarito: A
29. (Univag MT/2020)
O mineral constituído por carbeto de cálcio (CaC2), conhecido popularmente como
carbureto, quando em contato com água, libera um gás inflamável, o acetileno (C 2H2), que na
presença de uma fonte de ignição entra em combustão, como mostra a figura.
Figura 18(www.manualdomundo.com.br)
O acetileno entra em combustão de acordo com a reação:
2C2H2 (g) + 5O2 (g) → 4CO2 (g) + 2H2O (g)
A ligação química na molécula de carbeto de cálcio é do tipo __________ e o número de
oxidação do carbono nesse composto é __________. Na molécula dióxido de carbono, a ligação
é do tipo __________ e o número de oxidação do carbono nesse composto é __________.
Assinale a alternativa que preenche, respectivamente, as lacunas do texto.
a) covalente; – 2; iônica; – 4
b) iônica; – 2; covalente; + 4
c) iônica; – 1; iônica; + 4
d) covalente; – 2; covalente; + 2
e) iônica; – 1; covalente; + 4
Comentários:
Seguindo o fluxo de ideias do trecho a ser completo, tem-se:
AULA 05 – LIGAÇÕES QUÍMICAS 95
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
I. O carbeto de cálcio, CaC2, é composto por um metal e por um ametal, ou seja, eles
formam ligação iônica.
II. Como o cálcio é um metal da família IIA, tem o nox +2, então, o nox do carbono do
carbeto de cálcio é igual a -1.
III. No CO2, tem-se 2 ametais se relacionando, ou seja, as ligações são do tipo covalente.
IV. Como o nox do oxigênio é igual a -2, então, o nox do carbono é igual a +4.
Portanto, o trecho completo é dado por:
A ligação química na molécula de carbeto de cálcio é do tipo iônica e o número de
oxidação do carbono nesse composto é -1. Na molécula dióxido de carbono, a ligação é do tipo
covalente e o número de oxidação do carbono nesse composto é +4.
Gabarito: E
30. (FATEC SP/2020)
A Química do Slime
A jornada histórica do slime tem início nas primeiras décadas do século XX, quando James
Wright criou um material com características muito parecidas com a borracha. Atualmente,
devido às mais variadas formulações disponibilizadas em plataformas e mídias digitais, pode-se
produzir o próprio slime em casa.
O slime caseiro pode ser produzido pela mistura de duas colheres de chá de bicarbonato
de sódio (NaHCO3), 100 mL de água boricada (solução de ácido bórico, H 3BO3) e 60 g de cola
de isopor (constituída de poliacetato de vinila, PVAc). Quando misturamos o bicarbonato de sódio
com o ácido bórico, ocorre uma reação química que produz gás carbônico, água e borato de
sódio (Na3BO3).
A dissociação, em solução aquosa, do borato e do bicarbonato de sódio libera íons sódio
(Na+), que vão interagir com as moléculas do PVAc, formando um composto de elevada
viscosidade e elasticidade.
Os íons sódio interagem com a estrutura do PVAc conforme representado.
A reação entre o ácido bórico e o bicarbonato de sódio também origina o tetraborato de
sódio, conhecido como “Bórax” (Na2B4O7). Este, em meio básico, transforma-se em
tetrahidroxiborato, conforme representado na equação 1.
Equação 1
AULA 05 – LIGAÇÕES QUÍMICAS 96
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
O PVAc reage com moléculas de água produzindo álcool polivinílico (PVA), conforme
representado na equação 2.
Equação 2
O tetrahidroxiborato reage com o PVA (equação 3), formando novas ligações que
interligam as cadeias do polímero que constitui o slime.
Equação 3
<https://tinyurl.com/y4vmmd9w>
Acesso em: 01.10.2019. Adaptado.
Na equação 3, as ligações químicas I, II, III e IV, formadas no trecho da cadeia do slime,
são denominadas
a) ligações iônicas.
b) ligações covalentes.
c) ligações metálicas.
d) ligações de hidrogênio.
e) ligações apolares.
AULA 05 – LIGAÇÕES QUÍMICAS 97
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Comentários:
Nota-se que as ligações químicas I, II, III e IV são ligações C-O, ou seja, formadas entre
ametais, logo, elas são ligações covalentes.
Gabarito: B
31. (PUC Camp SP/2020)
Futuro com mais espirros
O aumento do nível do mar e as crescentes emissões de dióxido de carbono, ligados
diretamente às mudanças climáticas provocadas pela atividade humana na Terra, têm relação
com uma piora nos estados de alergia – principalmente durante a primavera. Isso porque, com
a prolongação das estações quentes, expande-se também o período de reprodução das plantas,
e com a presença elevada de pólen ocorrem mais casos de alergia.
(Adaptado de: Revista Galileu, julho de 2019, p. 12)
O dióxido de carbono possui fórmula estrutural
a) O=C
b) O=C=O
c) O–C–O
d) O=O–C
e) C–O–O
Comentários:
O dióxido de carbono, CO2, é formado através de 2 ligações duplas do átomo de carbono
com cada átomo de oxigênio. Sendo assim, o carbono compartilha seus 2 pares de elétrons com
o oxigênio:
𝑂=𝐶=𝑂
Gabarito: B
32. (FGV SP/2020)
Entre os diversos defensivos químicos empregados na agricultura estão o Malathion® e o
florpirauxifen-benzil. Suas fórmulas estruturais estão representadas a seguir.
AULA 05 – LIGAÇÕES QUÍMICAS 98
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Na estrutura da molécula do Malathion®, o átomo que apresenta expansão da camada de
valência, efetuando mais ligações químicas do que a quantidade prevista pela regra do octeto, o
total de elétrons que esse átomo apresenta em sua camada de valência nessa molécula e a
designação dessa camada são, respectivamente,
a) fósforo, 10 e N.
b) fósforo, 10 e M.
c) fósforo, 12 e M.
d) enxofre, 10 e M.
e) enxofre, 12 e N.
Comentários:
O fósforo está no 3º período da tabela periódica, ou seja, ele possui o subnível d para
expandir seu octeto. Sendo assim, possui 5 elétrons na camada de valência, mas consegue fazer
5 ligações, ultrapassando os 8 elétrons e ficando com 10 elétrons na sua camada de valência.
Como visto, isso só é possível por ele ter 3 camadas, podendo ter o orbital d. Essa 3ª
camada é representada pela letra M.
Gabarito: B
33. (UEG GO/2019)
As ligações químicas explicam o elo de estabilidade entre átomos para a formação de
sistemas moleculares. De forma sintética, elas podem ser classificadas como iônicas, covalentes
e metálicas. Com base nos conceitos de ligações químicas, dentre os compostos a seguir,
aquelas que podem ser classificadas como majoritariamente estabilizadas por ligações
covalentes são
a) HCl e diamante
b) barra de ferro e H2O
c) MgCl2 e grafite
AULA 05 – LIGAÇÕES QUÍMICAS 99
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
d) NaCl e AlH4+
e) KI e NH3
Comentários:
Analisando alternativa por alternativa, tem-se:
a) Certa. O hidrogênio e o cloro são ametais, logo, no HCl, eles se unem por ligação
covalente. Do mesmo modo, o diamante, composto por átomos de carbono, tem-se os elétrons
sendo compartilhados pelos átomos do carbono covalentemente.
b) Errada. A barra de ferro, composta pelo metal ferro, faz ligações metálicas, que são
características desse material. Já a água, o oxigênio e o hidrogênio, ambos ametais, se
relacionam por ligações covalentes.
c) Errada. O MgCl2 é um sal formado por um ametal e o metal, que tem avidez por ceder
seus elétrons, formando ligação iônica. Já o grafite, que é formado por átomos de carbono,
possui a mesma ideia descrita nas ligações do diamante, mudando apenas a disposição dos
átomos.
d) Errada. Tanto o NaCl quanto o AlH4+ formam ligações iônicas, uma vez que se tem a
relação entre metal e ametal em ambas situações, favorecendo esse tipo de ligação.
e) Errada. O KI, assim como o NaCl, forma ligação iônica. Já a amônia, NH 3, composta
por ametais, forma se ligam covalentemente.
Gabarito: A
34. (FCM MG/2019)
Geralmente os átomos compartilham, ganham ou perdem elétrons a fim de atingir o octeto,
ou seja, oito elétrons na última camada, como a maioria dos gases nobres. Contudo existem
exceções à regra do octeto, como:
I. Moléculas com número ímpar de elétrons.
II. Moléculas com deficiência de elétrons.
III. Moléculas com expansão do octeto.
Assinale a alternativa onde ocorrem, não respectivamente, essas três situações:
a) BF3 – NO2 – NH3.
b) BF3 – NO – PCl5.
c) BeCl2 – ClO2 – PCl3.
d) BeCl2 – CHCl3 – NH4Cl.
Comentários
Analisando alternativa por alternativa, tem-se:
AULA 05 – LIGAÇÕES QUÍMICAS 100
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
a) Errada. O BF3 se encaixa na molécula com deficiência de elétrons, porque ele se
estabiliza com seus 6 elétrons. Já o NO2, tem-se um número ímpar de elétrons (6 do oxigênio e
5 do nitrogênio, totalizando 17 elétrons). No NH3, o nitrogênio fica estável por fazer mais 3
ligações, completando 8 elétrons.
b) Certa. Como visto no comentário acima, o BF3 já atende a um critério (número II). O
NO possui 11 elétrons, ou seja, um número ímpar, porque 6 são do oxigênio e 5 do nitrogênio.
Já o PCl5 traz a expansão do octeto, uma vez que o átomo de fósforo fica com 10 elétrons: 5 da
sua camada de valência + 5 compartilhados com o cloro.
c) Errada. No BeCl2, o átomo de berílio cede um elétron para cada átomo de cloro,
completando a regra do octeto. No ClO2, tem-se uma quantidade ímpar de elétrons, ou seja, 12
do oxigênio com 7 do cloro, fechando 19 elétrons. Já o PCl3, tem-se a estabilidade do fósforo em
8 elétrons.
d) Errada. Como visto no comentário acima, o BeCl2 não se encaixa nos critérios, assim
como o CHCl3, em que o átomo de carbono faz as 4 ligações a fim de cumprir a regra do octeto.
No NH4Cl, o íon NH4+ cede um elétron para o átomo de cloro.
Gabarito: B
35. (UCS RS/2017)
O gráfico a seguir mostra, de forma simplificada, como a energia potencial do sistema
varia à medida em que dois átomos de hidrogênio no estado fundamental se aproximam para
formar uma molécula de gás hidrogênio.
Com base nessas informações, assinale a alternativa correta.
a) A distância ideal para que haja o compartilhamento efetivo dos elétrons de dois átomos
de hidrogênio e, consequentemente, a formação da ligação covalente H–H deve ser superior a
0,74 Å.
b) O aumento da distância internuclear de dois átomos de hidrogênio favorece a
superposição entre os orbitais 1s e, consequentemente, a formação da ligação covalente H–H.
c) O aumento abrupto da energia potencial observado para valores inferiores a 0,74 Å é
consequência da atração eletrostática entre os núcleos de dois átomos de hidrogênio, uma vez
que a distância entre eles torna-se muito grande.
d) A ligação covalente que se estabelece entre os dois átomos de hidrogênio para formar
a molécula de gás hidrogênio é do tipo sigma p-p.
AULA 05 – LIGAÇÕES QUÍMICAS 101
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
e) A energia potencial no ponto mínimo do gráfico corresponde à variação de energia
necessária para a formação da ligação covalente H–H.
Comentários
Julgando os itens, tem-se:
a) errado. Distâncias maiores que 0,74 representam o rompimento da ligação covalente.
b) errado. O aumento da distância internuclear de dois átomos de hidrogênio favorece o
rompimento da ligação covalente entre os orbitais 1s dos hidrogênios.
c) errado. O aumento abrupto da energia potencial observado para valores inferiores a
0,74 Å é consequência da repulsão eletrostática entre os núcleos de dois átomos de hidrogênio,
uma vez que a distância entre eles se torna muito pequena.
d) errado. A ligação covalente que se estabelece entre os dois átomos de hidrogênio para
formar a molécula de gás hidrogênio é do tipo sigma. O elemento hidrogênio não apresenta
subnível p ocupado por elétrons.
e) certo. A estabilidade da molécula de H2 é representada pela distância que é indicada
com o menor valor de energia potencial.
Gabarito: E
36. (FPS PE/2017)
O bromo é um elemento não metálico e líquido, à temperatura ambiente, que evapora
facilmente, formando um vapor avermelhado. Considere o esquema abaixo, que representa o
bromo passando por diferentes transformações.
𝟏 𝟏 𝟏 𝟐 𝟑
𝑩𝒓𝟐 (𝒍) → 𝑩𝒓𝟐 (𝒈) → 𝑩𝒓 (𝒈) → 𝑩𝒓+ (𝒈) + 𝟏𝒆−
𝟐 𝟐
A respeito do bromo e dessas transformações, assinale a afirmativa incorreta.
a) Durante a transformação 1,são rompidas interações intermoleculares.
b) As moléculas de Br2, no estado líquido, se ligam através de forças de London.
c) Nas transformações 1, 2 e 3, o bromo absorve energia.
d) Durante a transformação 2,são rompidas ligações covalentes.
e) A energia envolvida na transformação 3 é a afinidade eletrônica do bromo.
Comentários
Julgando os itens, tem-se:
a) certo. Durante a transformação 1, são rompidas interações entre as moléculas do Br 2,
porque aconteceu mudança de estado físico.
b) certo. As forças de London são interações que conectam partículas de polaridade baixa
ou nula e são também denominadas dipolo induzido – dipolo induzido.
c) certo. A transformação 1 absorve energia para romper as interações entre as moléculas.
A transformação 2 absorve energia para romper a força de atração envolvida na ligação
AULA 05 – LIGAÇÕES QUÍMICAS 102
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
covalente. A transformação 3 absorve energia para retirar o elétron do átomo, ou seja, a energia
de ionização.
d) certo. Durante a transformação 2, são rompidas ligações covalentes entre os átomos
de bromo dentro da molécula.
e) errado. A energia envolvida na transformação 3 é a energia de ionização do bromo.
Afinidade eletrônica corresponde à energia liberada quando o átomo de bromo captura um
elétron.
Gabarito: E
37. (UFJF MG/2017)
O selênio quando combinado com enxofre forma o sulfeto de selênio, substância que
apresenta propriedades antifúngicas e está presente na composição de xampus anticaspa. Qual
o tipo de ligação química existente entre os átomos de enxofre e selênio?
a) Covalente.
b) Dipolo-dipolo.
c) Força de London.
d) Iônica.
e) Metálica.
Comentários
A ligação química que ocorre entre ametais é a ligação covalente. Tanto o selênio quanto
o enxofre são ametais.
Explicando as outras ligações:
b) Dipolo-dipolo – interação entre moléculas polares.
c) Força de London – interação entre moléculas apolares.
d) Iônica – ligação entre metais e ametais caracterizada pela transferência de elétrons.
e) Metálica – ligação entre átomos metálicos caracterizada pela deslocalização dos
elétrons.
Gabarito: A
38. (UFJF MG/2015)
O óxido nitroso – N2O(g) –, também conhecido como gás hilariante, foi o primeiro
anestésico utilizado em cirurgias. Hoje, também pode ser utilizado na indústria automobilística
para aumentar a potência de motores de combustão interna. Abaixo, está representada uma
possibilidade da estrutura de Lewis dessa molécula.
AULA 05 – LIGAÇÕES QUÍMICAS 103
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
De acordo com a fórmula apresentada, marque a opção que descreve CORRETAMENTE
as ligações existentes no N2O.
a) Uma ligação iônica e duas ligações covalentes simples.
b) Duas ligações covalentes, sendo uma tripla e uma simples.
c) Duas ligações covalentes simples.
d) Duas ligações iônicas.
e) Duas ligações covalentes, sendo uma dupla e uma simples.
Comentários
O N2O é um composto formado apenas por ametais, portanto é formado de ligações
covalentes. Não apresenta ligação metálica e nem ligação iônica.
Apresenta três pares eletrônicos entre os átomos de nitrogênio e, assim, caracteriza uma
ligação tripla. Apresenta um par eletrônico entre o átomo de nitrogênio e oxigênio e, assim,
caracteriza uma ligação simples.
Gabarito: B
39. (UERJ/2014)
O ciclo do nitrogênio é extremamente importante para os seres vivos. Esse elemento faz
parte de diversos compostos orgânicos, como proteínas e ácidos nucleicos. Na tabela, há
exemplos de formas químicas do nitrogênio incorporadas por alguns seres vivos.
O nitrato, íon de geometria trigonal plana, serve como fonte de nitrogênio para as
bactérias.
Observe as seguintes fórmulas estruturais:
AULA 05 – LIGAÇÕES QUÍMICAS 104
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
A fórmula que corresponde ao íon nitrato está identificada pelo seguinte número:
a) I
b) II
c) III
d) IV
Comentários
O íon nitrato (NO3-) apresenta ressonância, ou seja, a sua carga negativa movimenta-se
pelos átomos de oxigênio, que são mais eletronegativos. Cada oxigênio da estrutura precisa de
dois elétrons a mais para completar a estabilidade eletrônica.
Um oxigênio apresenta uma ligação dupla, outro realiza uma ligação dativa e o último
oxigênio realiza uma ligação simples e detém o elétron do íon.
O O O
N N N
O O O O O O
Gabarito: B
40. (IFSP/2013)
A ligação química entre dois átomos de nitrogênio (Z = 7) é representada corretamente
pela fórmula estrutural
a) N+N–.
b) N3+N3–.
c) N-N.
d) N=N.
e) NN.
Comentários
Cada átomo de nitrogênio necessita de três ligações para adquirir a condição de
estabilidade, portanto a molécula de N2 é formada por uma ligação tripla.
Gabarito: E
41. (UECE/2012)
AULA 05 – LIGAÇÕES QUÍMICAS 105
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Para que suas flores vivam uma semana a mais, basta diluir 1 mg de Viagra na água do
vaso. A sugestão é de pesquisadores de Israel e da Austrália, que testaram os efeitos do
medicamento em vegetais e descobriram que o óxido nítrico, componente que ajuda a tratar a
disfunção erétil, também preserva as flores por mais tempo.
Com relação ao óxido nítrico, pode-se afirmar corretamente que
a) no ar, pode converter-se em ácido nitroso, cuja composição química é H2NO2.
b) conforme sua estrutura, apresenta-se como um híbrido de ressonância.
c) é gasoso, inorgânico, incolor, possui seis elétrons do nitrogênio e seis do oxigênio,
tendo um elétron desemparelhado.
d) pela distribuição dos elétrons em sua estrutura é diamagnético.
Comentários
Julgando os itens, tem-se:
a) errado. A substância NO é inerte em água, ácidos e bases. Ela é classificada como um
óxido inerte.
b) certo. O NO é uma exceção à regra do octeto porque apresenta número ímpar de
elétrons na camada de valência dos átomos. Portanto apresenta deslocalização de ligações e
elétron desemparelhado.
c) errado. É gasoso, inorgânico, incolor, possui cinco elétrons do nitrogênio e seis do
oxigênio, tendo um elétron desemparelhado.
d) errado. Por apresentar um elétron desemparelhado, é um composto paramagnético.
Gabarito: B
11. Considerações Finais das Aulas
Muito bem, pequeno gafanhoto!
Finalizou um importantíssimo capítulo.
Agora é momento de relaxar e fazer um intervalo. Fico muito feliz que tenha terminado
esse capítulo. Com certeza, você está mais próximo da aprovação.
Eu diria que a próxima aula é a continuação dessa aqui. A próxima aula apresenta
geometria molecular, polaridade e forças intermoleculares. Uma parte do conteúdo que
apresenta muita aplicação e DESPENCA nos vestibulares! Vamos que já caminhamos bem, mas
ainda falta bastante.
AULA 05 – LIGAÇÕES QUÍMICAS 106
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
“A persistência é o caminho do êxito.”
Charles Chaplin
12. Referências
Figura 5 – Shutterstock. Disponível em https://www.shutterstock.com/pt/image-vector/ionic-
compound-crystal-structure-positive-negative-1122169052 . Acesso em 12 de março de 2019.
Figura 6 – Unsplash. Disponível em https://unsplash.com/photos/t1XLQvDqt_4 . Acesso em 13
de março de 2019.
Figura 7 – Pixabay. Disponível em https://pixabay.com/pt/photos/rachadura-parede-concreto-
textura-695010/ . Acesso em 13 de março de 2019.
Figura 8 – Flickr. Disponível em
https://www.flickr.com/photos/64738468@N00/150849103/in/photolist-ek9bB-5tajaV-dqZZMn-
8MiXhB-dqZYYB-muY6Rc-oPowoo-bpexTp-hrReg8-2KcaX-2aBdZMY-aBmY2V-b6zCWp-
ne59MA-9UhK1L-4oVC5Q-dAhr3H-29qwmd8-dAhmEa-EqK5o-8prZLr-jsMaKz-hqBB8N-
8EygsS-9egaqE-dCiL19-9Fx3sz-4YaHeQ-92JTS8-38w7L9-4Ld53g-7dGGy2-eFwSAx-
QWbBCU-4sMmUJ-3d5zTq-prcsap-U7QkB8-ceoSQo-roZ8Vp-4zsGD2-4fBixP-bbmcSe-5j6X2e-
2MP2ij-29Z82Ge-SUDcuq-erHB4u-fwaNbk-bxbe69 . Acesso em 13 de março de 2019.
Figura 9 – Pixabay. Disponível em https://pixabay.com/pt/photos/acetileno-alum%C3%ADnio-
sopro-lat%C3%A3o-1239322/ . Acesso em 13 de março de 2019.
Figura 10 – Pixabay. Disponível em https://pixabay.com/pt/photos/id%C3%A9ia-importante-
l%C3%A2mpada-el%C3%A9trica-2520520/ . Acesso em 13 de março de 2019.
Figura 11 – Unsplash. Disponível em https://unsplash.com/photos/4OfaTz6SdYs . Acesso em
14 de março de 2019.
Figura 12 – Pixabay. Disponível em https://pixabay.com/pt/photos/arame-cabos-
el%C3%A9trica-rede-1098059/ . Acesso em 13 de março de 2019.
Figura 13 – Pixabay. Disponível em https://pixabay.com/pt/photos/bules-panelas-
fog%C3%A3o-chama-1858601/ . Acesso em 13 de março de 2019.
Figura 14 – Unsplash. Disponível em https://unsplash.com/photos/dKeB0-M9iiA . Acesso em
13 de março de 2019.
Figura 15 – Unsplash. Disponível em https://unsplash.com/photos/aZGNnaXkHNI . Acesso em
13 de março de 2019.
Figura 16 – Unsplash. Disponível em https://unsplash.com/photos/EAiHb92D2-s . Acesso em
13 de março de 2019.
Figura 17 – Unsplash. Disponível em https://unsplash.com/photos/1iVKwElWrPA . Acesso em
13 de março de 2019.
Figura 18 – Pixabay. Disponível em https://pixabay.com/pt/vectors/lascado-riscado-dvd-
danificados-149628/ . Acesso em 13 de março de 2019.
Figura 19 – Unsplash. Disponível em https://unsplash.com/photos/OHPdgstNFGs . Acesso em
13 de março de 2019.
Figura 20 – Unsplash. Disponível em https://unsplash.com/photos/j5gCOKZdm6I . Acesso em
13 de março de 2019.
AULA 05 – LIGAÇÕES QUÍMICAS 107
ESTRATÉGIA VESTIBULARES –LIGAÇÕES QUÍMICAS
Figura 21 – Pixabay. Disponível em https://pixabay.com/pt/photos/ovos-frito-lado-ensolarado-
acima-1467283/ . Acesso em 13 de março de 2019.
Figura 22 – Unsplash. Disponível em https://unsplash.com/photos/9HkBtMf_3TU . Acesso em
13 de março de 2019.
Figura 23 – Unsplash. Disponível em https://unsplash.com/photos/6X7y8b0IN6M . Acesso em
13 de março de 2019.
Figura 24 – Shutterstock. Disponível em https://www.shutterstock.com/pt/image-photo/macro-
tooth-amalgam-filling-50880346 . Acesso em 13 de março de 2019.
Figura 25 – Unsplash. Disponível em https://unsplash.com/photos/q0t_kn_Yau4 . Acesso em
13 de março de 2019.
Figura 26 – Unsplash. Disponível em https://unsplash.com/photos/HHaKG9DaQ6w . Acesso
em 13 de março de 2019.
Figura 27 – Unsplash. Disponível em https://unsplash.com/photos/VRERJ5Mjp4c . Acesso em
13 de março de 2019.
Bibliografia
· Mario Tolentino e Romeu C. Rocha-Filho, Alguns aspectos históricos da classificação
periódica dos elementos químicos. Disponível em:
http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0100-40421997000100014 Acesso em
07 de março de 2019.
· Luiza Oliveira. Expectativa de vida: 55 anos.
Disponível em: https://www.uol/copadomundo/especiais/alcoolismo-na-russia-expectativa-de-
vida-e-de-55-anos-por-causa-do-alcool.htm#expectativa-de-vida-55-anos . Acesso em 07 de
março de 2019.
Complemente seus estudos com postagens de minhas redes sociais:
@professorprazeres
Folha de versão
12/01/2023
AULA 05 – LIGAÇÕES QUÍMICAS 108
Você também pode gostar
- Resumo - Ligações Químicas - Aula 05Documento17 páginasResumo - Ligações Químicas - Aula 05Endro PeixotoAinda não há avaliações
- Captura de Tela 2022-06-23 À(s) 14.53.26Documento39 páginasCaptura de Tela 2022-06-23 À(s) 14.53.26izabellatorremuradAinda não há avaliações
- Aula 013 Ligacoes Quimicas Parte 01Documento20 páginasAula 013 Ligacoes Quimicas Parte 01Gabriel SimãoAinda não há avaliações
- Aula 1-Estrutura Atomica AtualDocumento98 páginasAula 1-Estrutura Atomica AtualAilton Langa100% (1)
- Química GeralDocumento76 páginasQuímica GeralPatrício Simão PSAinda não há avaliações
- 3 Ligacoes Quimicas e Geometria MolecularDocumento6 páginas3 Ligacoes Quimicas e Geometria MolecularLarissa PaivaAinda não há avaliações
- Ligações Químicas - Teoria Do Octeto, Ligação Iônica, Ligação Metálica e CovalenteDocumento15 páginasLigações Químicas - Teoria Do Octeto, Ligação Iônica, Ligação Metálica e CovalentePedroAinda não há avaliações
- Aula 9 Ano - Ligações Químicas PDFDocumento27 páginasAula 9 Ano - Ligações Químicas PDFYasmim RossafaAinda não há avaliações
- LCM FUNDAM QUIMICA I - AULA 4 Tabela Periodica-1Documento15 páginasLCM FUNDAM QUIMICA I - AULA 4 Tabela Periodica-1Vitória CristianAinda não há avaliações
- Ligações Químicas AlunosDocumento2 páginasLigações Químicas AlunosjosianeAinda não há avaliações
- 2 Módulo B - QuimicaDocumento42 páginas2 Módulo B - QuimicaMarilene MateusAinda não há avaliações
- Aula Ligação QuímicaaaaaaaaaDocumento40 páginasAula Ligação QuímicaaaaaaaaaAna Julia Saad LopesAinda não há avaliações
- Capitulo II - Estrutura Atomica e Ligacao InteratomicaDocumento24 páginasCapitulo II - Estrutura Atomica e Ligacao InteratomicaBenilde Gonçalvês Gulube GulubeAinda não há avaliações
- Ligações QuímicasDocumento9 páginasLigações QuímicasGonçalo Rilhas100% (1)
- Ligações Químicas - Química GeralDocumento29 páginasLigações Químicas - Química GeralJean Carlos CarlosAinda não há avaliações
- 4 - Ligação QuímicaDocumento40 páginas4 - Ligação QuímicaRicardo MagalhãesAinda não há avaliações
- Ligações QuímicasDocumento4 páginasLigações QuímicasWellington PimentelAinda não há avaliações
- FÍSICODocumento18 páginasFÍSICOMajibo GilbertAinda não há avaliações
- Aula 1 - AnaliticaDocumento40 páginasAula 1 - AnaliticaCaic FigueiredoAinda não há avaliações
- AULA 3 ComoÁtomos 1 Séries 4ºbim-23Documento19 páginasAULA 3 ComoÁtomos 1 Séries 4ºbim-23kailysantos574Ainda não há avaliações
- Ligações Químicas - Prof. Sérgio MatosDocumento5 páginasLigações Químicas - Prof. Sérgio MatosÉrica RamosAinda não há avaliações
- Aula 4 Conceitos Básicos de Ligação QuímicaDocumento14 páginasAula 4 Conceitos Básicos de Ligação QuímicaJorge CarlosAinda não há avaliações
- Ligações Químicas: Prof. Marcel PiovezanDocumento29 páginasLigações Químicas: Prof. Marcel PiovezanGabriel de Carvalho da SilvaAinda não há avaliações
- Chemistry ModuleDocumento42 páginasChemistry ModuleRudyalves Filipe MatiasAinda não há avaliações
- Aula 4 - Ligações QuímicaDocumento98 páginasAula 4 - Ligações QuímicaAbner AlmeidaAinda não há avaliações
- Ligações QuímicasDocumento29 páginasLigações QuímicasNathan SouzaAinda não há avaliações
- Capítulo III Ligações QuímicasDocumento70 páginasCapítulo III Ligações QuímicasPedro SilvaAinda não há avaliações
- LigionicacovalenteDocumento26 páginasLigionicacovalenteDilan FlorAinda não há avaliações
- Aula 3 - Química Orgânica - 2 PDFDocumento40 páginasAula 3 - Química Orgânica - 2 PDFCaic FigueiredoAinda não há avaliações
- 13284107052012fundamento de Quimica Aula 06Documento13 páginas13284107052012fundamento de Quimica Aula 06Anselmo Costa guilhermeAinda não há avaliações
- Apostila Ligações Químicas 2Documento2 páginasApostila Ligações Químicas 2Nayara GomesAinda não há avaliações
- Aula 3 - Como Os Átomos Formam A MatériaDocumento19 páginasAula 3 - Como Os Átomos Formam A MatériaCarlos SchirmerAinda não há avaliações
- Capitulo Vi Ligaçoes QuimicasDocumento57 páginasCapitulo Vi Ligaçoes QuimicasBranca LopesAinda não há avaliações
- Naftal Naftal-FCT-UZ-2020Documento20 páginasNaftal Naftal-FCT-UZ-2020Lédice NhataveAinda não há avaliações
- Escola Estadual de Ensino Médio Demétrio Ribeiro: QuímicaDocumento92 páginasEscola Estadual de Ensino Médio Demétrio Ribeiro: QuímicaMerlohnAinda não há avaliações
- Aula - Ligações Iônicas Ou EletrovalentesDocumento15 páginasAula - Ligações Iônicas Ou EletrovalentesSibery BarrosAinda não há avaliações
- Aula 2 - Ligações Químicas, Propriedades e CristalinidadeDocumento52 páginasAula 2 - Ligações Químicas, Propriedades e CristalinidadeRodrigo de Oliveira PezzinAinda não há avaliações
- QG Bio Aula 03 Ligação QuímicaDocumento36 páginasQG Bio Aula 03 Ligação Químicaborgesanaluiza222Ainda não há avaliações
- Aula 2 - Tabela Periódica PDFDocumento74 páginasAula 2 - Tabela Periódica PDFLeonardo MacielAinda não há avaliações
- 1 Ano - InSD - FA3 - Ligações Iônicas e MetálicasDocumento31 páginas1 Ano - InSD - FA3 - Ligações Iônicas e MetálicasMackenzie WeasleyAinda não há avaliações
- Resumo qg06 Ligação IônicaxDocumento4 páginasResumo qg06 Ligação IônicaxCarine BonifácioAinda não há avaliações
- Aula - Regra Do Octeto e Tipos de Ligaà à Es Quà MicasDocumento21 páginasAula - Regra Do Octeto e Tipos de Ligaà à Es Quà Micashanic51870Ainda não há avaliações
- Aula 4 - MoléculasDocumento34 páginasAula 4 - Moléculasaugusto cesar januarioAinda não há avaliações
- Química 2 SérieDocumento4 páginasQuímica 2 SérieJosileide De Castro SantanaAinda não há avaliações
- 4337 - 11.08.2015 18.46.18 - UnidadeIIEstruturaatomicaDocumento32 páginas4337 - 11.08.2015 18.46.18 - UnidadeIIEstruturaatomicaAugusto RolimAinda não há avaliações
- Ligações Químicas: 3 Série Aula 1 - 3 BimestreDocumento18 páginasLigações Químicas: 3 Série Aula 1 - 3 Bimestrenatii37nvAinda não há avaliações
- 15324916022012fundamentos de Quimica Aula 6Documento18 páginas15324916022012fundamentos de Quimica Aula 6Jefferson RibeiroAinda não há avaliações
- Ligações Químicas22Documento14 páginasLigações Químicas22renatamarques93fourAinda não há avaliações
- Professora: Adriana LúciaDocumento39 páginasProfessora: Adriana LúciaGabriel AlvesAinda não há avaliações
- Eletricidade IndustrialDocumento31 páginasEletricidade IndustrialRerisson Jaqueline RodriguesAinda não há avaliações
- Lista de Química 1Documento3 páginasLista de Química 1Joao NetoAinda não há avaliações
- Aula+6+-+Ligações+Quimicas Fabiana+AlmeidaDocumento49 páginasAula+6+-+Ligações+Quimicas Fabiana+AlmeidaBené JúniorAinda não há avaliações
- QuímicaDocumento9 páginasQuímicaItalo Rafael Machado SantosAinda não há avaliações
- Aula 03 Ligações Químicas e Materias CerâmicosDocumento63 páginasAula 03 Ligações Químicas e Materias CerâmicosJunior LopesAinda não há avaliações
- Ligações Químicas - FinalDocumento15 páginasLigações Químicas - Finalrenatamarques93fourAinda não há avaliações
- 09 - Ligações Químicas FINALDocumento47 páginas09 - Ligações Químicas FINALprofnonocmmAinda não há avaliações
- Aula 3 - Estrutura Dos Materiais CerâmicosDocumento76 páginasAula 3 - Estrutura Dos Materiais CerâmicosMateus MarquesAinda não há avaliações
- QUIMICA - LIsta Ligações 9-ANODocumento7 páginasQUIMICA - LIsta Ligações 9-ANOCatherineNettoAinda não há avaliações
- Íons e Ligações QuímicasDocumento8 páginasÍons e Ligações Químicaserika.poa.rsAinda não há avaliações
- Fundamentos de Química: Física Quântica e EletromagnetismoNo EverandFundamentos de Química: Física Quântica e EletromagnetismoAinda não há avaliações
- Aula 06 - Molécula Geometria e Interações - EnEM 2023Documento122 páginasAula 06 - Molécula Geometria e Interações - EnEM 2023Endro PeixotoAinda não há avaliações
- Aula 12 - Funções Orgânicas Oxigenadas - EnEM 2023Documento117 páginasAula 12 - Funções Orgânicas Oxigenadas - EnEM 2023Endro PeixotoAinda não há avaliações
- Aula 09 - Fundamentos Da Oxirredução - EnEM 2023Documento91 páginasAula 09 - Fundamentos Da Oxirredução - EnEM 2023Endro PeixotoAinda não há avaliações
- Aula 11 - Reações Inorgânicas - EnEM 2023Documento93 páginasAula 11 - Reações Inorgânicas - EnEM 2023Endro PeixotoAinda não há avaliações
- Aula 10 - Hidrocarbonetos - Extensivo 2024Documento70 páginasAula 10 - Hidrocarbonetos - Extensivo 2024Endro PeixotoAinda não há avaliações
- Aula 13 - Funções Orgânicas Nitrogenadas - EnEM 2023Documento75 páginasAula 13 - Funções Orgânicas Nitrogenadas - EnEM 2023Endro PeixotoAinda não há avaliações
- Aula 07 - Funções Inorgânicas - EnEM 2023Documento123 páginasAula 07 - Funções Inorgânicas - EnEM 2023Endro PeixotoAinda não há avaliações
- Aula 08 - Química Orgânica Fundamentos - EnEM 2023Documento96 páginasAula 08 - Química Orgânica Fundamentos - EnEM 2023Endro PeixotoAinda não há avaliações
- Aula 14 - Demais Funções Orgânicas - EnEM 2023Documento37 páginasAula 14 - Demais Funções Orgânicas - EnEM 2023Endro PeixotoAinda não há avaliações
- Resumo - Aula 12 - Funções Orgânicas - OxigenadasDocumento14 páginasResumo - Aula 12 - Funções Orgânicas - OxigenadasEndro PeixotoAinda não há avaliações
- Resumo - Funções Inorgânicas - Aula 07Documento23 páginasResumo - Funções Inorgânicas - Aula 07Endro PeixotoAinda não há avaliações
- Aula 16 - Geometria AnalíticaDocumento136 páginasAula 16 - Geometria AnalíticaEndro PeixotoAinda não há avaliações
- Resumo - Aula 13 - Funções Orgânicas - NitrogenadasDocumento9 páginasResumo - Aula 13 - Funções Orgânicas - NitrogenadasEndro PeixotoAinda não há avaliações
- Pré-Projeto de Pesquisa - Aprendizagem HíbridaDocumento11 páginasPré-Projeto de Pesquisa - Aprendizagem HíbridaEndro PeixotoAinda não há avaliações
- Aula 02 - Conhecimentos Numéricos (Parte 2) - ENEM 2023Documento66 páginasAula 02 - Conhecimentos Numéricos (Parte 2) - ENEM 2023Endro PeixotoAinda não há avaliações
- Aula 00 - Artes - EnEM - 2022Documento150 páginasAula 00 - Artes - EnEM - 2022Endro PeixotoAinda não há avaliações
- Aula 14 - ENEM 2022 - Lucas CostaDocumento94 páginasAula 14 - ENEM 2022 - Lucas CostaEndro PeixotoAinda não há avaliações
- Aula 14 - ENEM 2022 - Lucas CostaDocumento94 páginasAula 14 - ENEM 2022 - Lucas CostaEndro PeixotoAinda não há avaliações
- Aula 04 - GênerosDocumento66 páginasAula 04 - GênerosEndro PeixotoAinda não há avaliações
- Aula 02 - Conhecimentos Numéricos (Parte 2) - ENEM 2023Documento66 páginasAula 02 - Conhecimentos Numéricos (Parte 2) - ENEM 2023Endro PeixotoAinda não há avaliações
- Slides Comentados - Aula 14 Teoria - 2021Documento90 páginasSlides Comentados - Aula 14 Teoria - 2021Endro PeixotoAinda não há avaliações
- Resumo Físico QuímicaDocumento7 páginasResumo Físico QuímicaCarla AlvesAinda não há avaliações
- PROVA DE QUÍMICA 3 AnoDocumento2 páginasPROVA DE QUÍMICA 3 AnoJoyce Santana100% (3)
- Nomenclatura IõesDocumento4 páginasNomenclatura IõesJosé NevesAinda não há avaliações
- Fórmula Química É Uma Representação Simbólica Da Molécula de Uma SubstânciaDocumento2 páginasFórmula Química É Uma Representação Simbólica Da Molécula de Uma SubstânciaanicetoAinda não há avaliações
- Ficha V Compostos OrgânicosDocumento2 páginasFicha V Compostos OrgânicosNarcisa Alexandra FilipeAinda não há avaliações
- RX Sintesis Amoxicilina PDFDocumento2 páginasRX Sintesis Amoxicilina PDFEfrain CuellarAinda não há avaliações
- (Biblioteca Básica de Ciência e Cultura) Jean-Paul Auffray - O Átomo (2001, Instituto Piaget)Documento133 páginas(Biblioteca Básica de Ciência e Cultura) Jean-Paul Auffray - O Átomo (2001, Instituto Piaget)SgffaaAinda não há avaliações
- Módulo 6 de Química Da 8, 9 e 10 Classe em PDFDocumento226 páginasMódulo 6 de Química Da 8, 9 e 10 Classe em PDFRomao Massango Romix100% (4)
- Exercícios (4 Exercícios) Do 2° Ano Do ProvãoDocumento4 páginasExercícios (4 Exercícios) Do 2° Ano Do Provãot5fj5zgw5jAinda não há avaliações
- 1ºano P2Documento3 páginas1ºano P2rsantini4Ainda não há avaliações
- Exercício CarbonoDocumento5 páginasExercício CarbonoGabriel SantanaAinda não há avaliações
- Atividade de QuimicaDocumento1 páginaAtividade de QuimicaCapivaraAinda não há avaliações
- Atividades de Ciência4 ÁguaDocumento5 páginasAtividades de Ciência4 ÁguaÂngela MartinsAinda não há avaliações
- 1° Avaliação 3° AnoDocumento2 páginas1° Avaliação 3° AnoDaiana MedeirosAinda não há avaliações
- Exercicios Sobre Estruturas de Pontos 3a Semana Do Mes 05Documento3 páginasExercicios Sobre Estruturas de Pontos 3a Semana Do Mes 05Ana Maria MilanoAinda não há avaliações
- 3AV2 QUIM 1EM ANA TipoADocumento2 páginas3AV2 QUIM 1EM ANA TipoAAna Célia FerreiraAinda não há avaliações