Escolar Documentos
Profissional Documentos
Cultura Documentos
TOMUFMG
Enviado por
DênisPiresdeLimaDireitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
TOMUFMG
Enviado por
DênisPiresdeLimaDireitos autorais:
Formatos disponíveis
Teoria do Orbital Molecular - Prof. J. D.
Ayala
-1-
TEORIA DO ORBITAL MOLECULAR
ORBITAIS NAS MOLCULAS
A teoria dos orbitais moleculares (MO) constitui uma alternativa para se ter uma viso
da ligao. De acordo com este enfoque, todos os eltrons de valncia tm uma influncia na
estabilidade da molcula. (Eltrons dos nveis inferiores tambm podem contribuir para a ligao,
mas para muitas molculas simples o efeito demasiado pequeno.) Alm disso, a teoria MO
considera que os orbitais atmicos, AOs, do nvel de valncia, deixam de existir quando a molcula
se forma, sendo substitudos por um novo conjunto de nveis energticos que correspondem a novas
distribuies da nuvem eletrnica (densidade de probabilidade). Esses novos nveis energticos
constituem uma propriedade da molcula como um todo e so chamados, conseqentemente de
orbitais moleculares.
O clculo das propriedades dos orbitais moleculares feito comumente assumindo que
os AOs se combinam para formar MOs. As funes de onda dos orbitais atmicos so combinados
matematicamente para produzir as funes de onda dos MOs resultantes. O processo
remanescente da mistura de orbitais atmicos puros para formar orbitais hbridos, exceto que, na
formao de orbitais moleculares, orbitais atmicos de mais de um tomo so combinados ou
misturados. No entanto, como no caso da hibridizao, o nmero de orbitais novos formados igual
ao nmero de orbitais atmicos originrios da combinao.
Da mesma maneira que nos orbitais atmicos, estamos interessados em dois aspectos
moleculares:
1) as formas de suas distribuies espaciais da densidade de probabilidade;
2) suas energias relativas.
O diagrama usual de x r para o orbital 1s de um tomo A (Figura 1a) deve, porm ser
modificado para levar em conta a variao de r entre - e +, resultando no diagrama mostrado na
Figura 1b.
Teoria do Orbital Molecular - Prof. J. D. Ayala
-2-
Figura 1 - Diagramas de x r para o orbital 1s.
DISTRIBUIES ESPACIAIS DOS ORBITAIS MOLECULARES
Iniciaremos observando os MOs que so formados quando dois tomos idnticos se
ligam numa molcula diatmica. Usando um enfoque simples, consideremos que um AO de um
tomo se combina com um AO de um segundo tomo para formar dois MOs. Para que esse
processo seja efetivo, duas condies devem ser introduzidas:
1) os AOs devem ter energias comparveis;
2) eles devem se sobrepor de maneira significativa.
Os clculos da mecnica quntica para a combinao dos AOs originais consistem em:
1) uma adio das funes de onda do AO;
2) uma subtrao das funes de onda do AO.
Quando os dois tomos so diferentes, includo um fator que leva em conta o fato de que os dois
AOs no contribuem igualmente para a formao dos MOs. Os resultados, ento, so duas novas
funes de onda MO, uma de adio e outra de subtrao. Como sempre, o quadrado da funo de
onda para um eltron nos d informaes acerca da probabilidade de encontrar este eltron em
Teoria do Orbital Molecular - Prof. J. D. Ayala
-3-
vrias regies do espao. Quando isto feito para um MO, resultam informaes sobre a densidade
de probabilidade para um eltron ocupando aquele MO e, a partir dessas informaes, as superfcies
limites correspondentes (e tambm os nveis energticos) podem ser encontradas. Este mtodo
conhecido como a combinao linear de orbitais atmicos, ou mtodo LCAO (Linear Combinations
Atomic Orbitals) (Figuras 2 e 3)
a)
b)
Figura 2 - Formao de orbitais moleculares ligantes e antiligante pela
adio e subtrao de orbitais atmicos
Quando duas funes 1s so adicionadas, elas se reforam entre si por toda parte e
principalmente na regio entre os dois ncleos. Esta redistribuio de densidade eletrnica entre os
ncleos ajuda a abaixar a energia potencial coulmbica. (Figura 3 - linha cheia superior). Como
Teoria do Orbital Molecular - Prof. J. D. Ayala
-4-
resultado, este orbital tem caractersticas ligantes e denomina-se 1s. Quando um orbital atmico
subtrado do outro, eles se cancelam exatamente entre si em um plano que est situado a meio
caminho entre os ncleo, produzindo, portanto, um plano nodal. A funo de onda molecular de
sinal oposto em cada lado deste plano nodal (Figura 2b). Quando se eleva a funo de onda ao
quadrado (Figura 3 - linha cheia inferior), a densidade de probabilidade resultante obviamente
positiva em todos os lugares, exceto no plano nodal, onde zero. Esta deficincia de densidade
eletrnica na regio internuclear ajuda a aumentar a energia potencial coulmbica do siatema e o n
na funo de onda produz um aumento na energia cintica do eltron. A energia total .
consequentemente, alta, e molcula no est ligada e o orbital descrito como antiligante.
Deve-se ter em mente que as representaes dos orbitais moleculares so anlogas s
representaes dos AO e podem ser interpretadas de duas maneiras equivalentes, elas mostram:
1) a(s) regio(es) na(s) qual(is) o eltron passa a maior parte do tempo, isto , a(s) regio(es) de
maior probabilidade de encontrar o eltron ou, alternativamente,
2) a(s) regio(es) na(s) qual(is) a densidade da carga eletrnica alta.
Na Figura 4 so mostradas as superfcies limites de dois orbitais moleculares que so
formados pela combinao de dois orbitais atmicos ls. Vemos esquerda a sobreposio dos AOs
ls e, direita, os MOs resultantes. O MO formado pela subtrao de funes de onda AO
representado por *s (leia: "sigma asterisco"), enquanto o formado pela adio representado por
s. O contraste entre esses dois MOs gritante. H obviamente um aumento da densidade eletrnica
de carga entre os ncleos no orbital s, mas um decrscimo na mesma regio no orbital *s . Por
essa razo, o orbital, s chamado orbital ligante, e o *s , de orbital antiligante. O primeiro tende
a estabilizar a ligao, enquanto o ltimo tende a desestabiliz-la. Ambos so chamados orbitais
porque esto centrados e so simtricos ao redor do eixo de ligao. Uma seco de cada orbital
feita perpendicularmente ao eixo de ligao apresenta um formato circular.
Teoria do Orbital Molecular - Prof. J. D. Ayala
-5-
Pela combinao linear de um orbital 2s de um tomo A com um orbital 2s do tomo B,
obtemos aproximaes dos orbitais moleculares 2s, Ligante e antiligante:
2s N A ( 2s ) + B( 2s )
*2s N * A ( 2s ) B( 2s )
O processo completamente anlogo aquele empregado para 1s e 1*s . As quantidades
N e N* so fatores de normalizao. O orbital *2s possui um plano nodal entre os dois ncleos,
consequentemente ele antiligante e tem energia maior do que o orbital 2s que no possui este
plano nodal e Ligante (Figura 5).
Observa-se que h uma superfcie nodal rodeando os ncleos tanto no orbital 2s como
no orbital *2s , o que os distingue dos orbital 1s e 1*s .
Na Figura 6, esto indicados os sinais das funes de onda de acordo com a conveno
usual. Pode ser observado que os lbulos positivos dos orbitais esto orientados na direo positiva
dos eixos, dando-se preferncia para o eixo x. Para os orbitais s, o lbulo externo sempre
considerado positivo (Figura 5).
Se dois orbitais esto a uma distncia infinita um do outro, a sua superposio nula.
Quando se aproximam, eles se superpem e formam um orbital molecular Ligante (superposio
positiva) e um antiligante (superposio negativa).
Teoria do Orbital Molecular - Prof. J. D. Ayala
-6-
Figura 7 - Exemplo de superposio negativa e positiva de orbitais atmicos
A superposio ser positiva se corresponder combinao de funes de onda de
mesmo sinal e ser negativa se os sinais forem opostos. A Figura 7 mostra estes resultados.
Notamos que, na Figura 7a, o orbital 2pz da direita tem seu lbulo negativo orientado
segundo a direo positiva do eixo z, o que significa que ele foi multiplicado por menos 1. Isso
eqivale a dizer que, em vez de soma, foi feita uma subtrao dos AO, enquanto que a Figura 7b
mostra uma soma dos AO, pois ambos AO esto orientados na mesma direo do eixo z.
Teoria do Orbital Molecular - Prof. J. D. Ayala
-7-
A combinao de dois orbitais p pode produzir resultados diferentes dependendo de
quais orbitais p so usados. Se o eixo x o eixo de ligao, ento dois orbitais 2px podem se
sobrepor apropriadamente se eles se aproximarem segundo um nico eixo, como mostrado na
Figura 8. Os MOs resultantes constituem, como antes, um orbital ligante (x) com carga eletrnica
acumulada entre os ncleos e um MO antiligante ( *x ) com decrscimo de carga entre os ncleos.
Esses orbitais so tambm classificados como , porque so simtricos ao redor do eixo de ligao.
Eles so designados x e *x para indicar que derivaram de orbitais atmicos px.
Quando orbitais 2py e 2pz se sobrepem para formar MOs, eles o fazem lado a lado,
como apresentado na Figura 9. Em cada caso, o resultado um orbital antiligante com quatro
lbulos e um orbital ligante com dois lbulos. Esses orbitais no so simtricos em relao ao eixo
de ligao; em vez disso, existem duas regies, em lados opostos ao eixo da ligao, nas quais a
densidade da nuvem de carga alta. Isto caracterstico de um orbital .
Observe que, como antes, o orbital ligante permite uma alta concentrao da carga
eletrnica na regio entre os ncleos, enquanto o orbital antiligante mostra uma diminuio da
densidade de carga nessa regio. (Na realidade, cada orbital antiligante tem um plano nodal entre os
dois ncleos).
Teoria do Orbital Molecular - Prof. J. D. Ayala
-8-
Teoria do Orbital Molecular - Prof. J. D. Ayala
-9-
Quando orbitais atmicos se combinam, eles passam a compartilhar uma regio do
espao. Se a superposio entre os orbitais positiva, os lbulos envolvidos se fundem e formam
um lbulo nico no orbital molecular resultante. Se a superposio entre os orbitais negativa, no
ocorre a fuso dos lbulos, aparecendo um plano nodal entre eles e a densidade eletrnica na regio
internuclear diminui. A Figura 10 ilustra, de modo esquemtico, as formas de diversos MO obtidos
por combinaes lineares de AO.
Teoria do Orbital Molecular - Prof. J. D. Ayala
- 10 -
ENERGIAS DOS ORBITAIS MOLECULARES
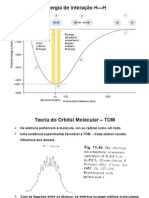
Consideremos, como exemplo, a formao da molcula H2 a partir dos dois tomos a
uma distncia infinita um do outro. Inicialmente, seus orbitais no se superpem e a energia
potencial do sistema considerado igual a zero. medida que eles se aproximam, comea a haver
interaes entre seus orbitais, formando-se um MO Ligante e um MO antiligante. Os eltrons
ocupam o orbital molecular Ligante, em que maior a densidade eletrnica na regio internuclear.
Dessa foram, ser favorecida a atrao ncleo-eltron e minimizada a repulso ncleo-ncleo, com
a conseqente diminuio da energia potencial do sistema (Figura 11).
Quanto mais prximos os ncleos dos tomos de hidrognio ficam um do outro, tanto
mais se superpem os orbitais e menor torna-se a energia. H, todavia, um limite para a
aproximao, a partir do qual passa a dominar a repulso entre os ncleos. Existe, pois, uma
separao de equilbrio, que denominada comprimento de ligao, ao qual corresponde uma
energia mnima, a energia de ligao.
Teoria do Orbital Molecular - Prof. J. D. Ayala
- 11 -
Quando dois orbitais atmicos se combinam para formar dois orbitais moleculares, a
energia do MO ligante sempre menor do que a dos AOs, enquanto a energia do MO antiligante
maior. Nas Figuras 12 e 13 aparecem as relaes de energias entre os AOs ls e os resultantes MOs
s e *s para o caso de uma molcula diatmica homonuclear, na qual os dois tomos so iguais. Na
Figura 13, esquerda e direita esto os nveis de energia ls de dois tomos do elemento A
(identificados com A e A'). No centro encontram-se os nveis de energia s e *s da molcula A-A'.
As linhas tracejadas diagonais mostram que os MOs se formaram dos AOs indicados. A Figura 13
poder ser usada para mostrar a formao dos MOs de um par de qualquer orbital s (2s, 3s, 4s, etc.).
Em cada caso, um orbital antiligante (de energia mais alta) e um orbital ligante (de energia mais
baixa) so formados.
Teoria do Orbital Molecular - Prof. J. D. Ayala
- 12 -
Consideremos a seguir a formao dos orbitais moleculares de um par de orbitais 2px
cujos lbulos esto dirigidos para o eixo de ligao. (Ver Figura 14). Novamente, temos a formao
de um par de MOs, um ligante (x) e um antiligante ( *x ).
Em seguida observe os AOs 2py e 2pz, que se sobrepem lado a lado. Os MOs
formados a partir deles so mostrados na Figura 15. A sobreposio py-py exatamente igual
sobreposio pz- pz (exceto pela orientao) e assim os MOs formam dois conjuntos de orbitais de
mesma energia: os orbitais y e z (ligantes) e os orbitais *y e *z (antiligantes).
Teoria do Orbital Molecular - Prof. J. D. Ayala
- 13 -
PREENCHIMENTO DOS ORBITAIS MOLECULARES
Tendo-se em mente o procedimento Aufbau, pelo qual os eltrons so adicionados um a
um ao diagrama de energia dos AOs com o objetivo de construir a configurao eletrnica dos
tomos, usaremos agora uma tcnica semelhante para preencher os nveis energticos do diagrama
de MO; desejamos construir a configurao eletrnica de molculas diatmicas homonucleares no
estado fundamental. Como antes, adicionaremos eltrons a partir da base do diagrama para cima,
para os orbitais de maior energia.
H2 e He2. O preenchimento do diagrama MO para as primeiras duas molculas mostrado na
Figura 13.
H2. A molcula mais simples a de hidrognio. A Figura 16 mostra, esquerda e direita, eltrons
colocados em dois tomos de H no-ligados e, no meio do diagrama, a molcula de H2 no estado
fundamental. Os dois eltrons ls vo constituir um par (spins opostos) no orbital s (ligante) da
molcula. Este par constitui uma ligao simples. A configurao eletrnica da molcula de
hidrognio pode ser escrita como: H2: (s)2
He2. Consideremos, a seguir, a molcula que poderia ser formada por dois tomos de hlio, cada
um dos quais capaz de fornecer dois eltrons para a molcula. O total de quatro eltrons, dois a
mais que no H2, de maneira que a distribuio no MO ser a da Figura 17. A configurao
eletrnica no estado fundamental na molcula de He2 dever ser:
( )2
*
He2: (s)2 s
Teoria do Orbital Molecular - Prof. J. D. Ayala
- 14 -
*
Dizemos "dever ser" devido ao fato de que o s (antiligante) est agora preenchido e
seu efeito desestabilizador cancela o efeito estabilizador do orbital s. O resultado que no h uma
fora de atrao entre os tomos de hlio devido ao nmero igual de eltrons ligantes e antiligantes
e, assim, He2 no existe.
Na teoria dos orbitais moleculares a ordem de ligao definida como:
Ordem . de . ligao =
nmero . de . eltrons . ligantes nmero . de . eltrons . antiligantes
2
Assim, a ordem de ligao na molcula de H2 :
Ordem . de . ligao =
20
=1
2
enquanto na molcula hipottica de He2 :
Ordem . de . ligao =
22
=0
2
Li2 e Be2. Desde que o preenchimento de dois MOs formados de orbitais ls est completo, passase para os dois MOs formados a partir dos orbitais 2s. Estes MOs so similares queles que j
foram preenchidos.
Li2. Essa molcula possui um total de seis eltrons, mas quatro deles esto na "camada" K (interna)
dos tomos de Li. Os eltrons de valncia dos dois tomos de Li so usados para preencher um
novo MO s, como mostrado na Figura 18. Os orbitais atmicos ls esto praticamente no
perturbados e no so mostrados no diagrama. A configurao muito semelhante do H2, e a
ordem de ligao, que somente pode ser determinada com os eltrons de valncia, igual a
20
,
2
ou seja, l. Representando cada um dos orbitais ls preenchidos por K (para a camada K), a
configurao eletrnica do Li2 pode ser escrita como: Li2: KK(s)2
Teoria do Orbital Molecular - Prof. J. D. Ayala
- 15 -
Com uma ordem de ligao igual a 1 possvel prever a existncia da molcula Li2.
Molculas de ltio no existem no estado lquido ou slido, mas sem dvida as molculas
diatmicas so encontradas no ltio gasoso. A energia de ligao do Li2 105 kJ mol-l. Ela menor
do que a do H2 (432 kJ mol-l) porque h uma blindagem do ncleo pela "camada" K completa de
cada tomo.
Be2. Indo para a molcula hipottica Be2, encontraremos uma situao semelhante do He2. O
nmero atmico do berlio 4 e o "stimo" e o "oitavo" eltrons na molcula iro para o orbital *s
(veja Figura 18). A desestabilizao efetuada pelo *s preenchido, cancela o efeito de estabilizao
do orbital s, a ordem da ligao zero e, portanto, a molcula de Be2 no deve ser estvel.
Realmente, Be2 estvel no estado fundamental no existe. Se existir, a configurao eletrnica no
estado fundamental seria: Be2 : KK(s)2( *s )2
B2 at Ne2. A seguir consideraremos a seqncia B2, C2, N2, O2, F2 e Ne2, percorrendo, assim, as
demais molculas diatmicas homonucleares do segundo perodo. Os MOs a serem preenchidos so
os orbitais ligantes e antiligantes e que so representados nas Figuras 14 e 15. Entretanto,
quando tentamos combinar esses dois diagramas em um, encontramos uma pequena dificuldade. A
energia relativa dos orbitais y e z (Figura 15) menor do que a do orbital s (Figura 14) do B2 ao
N2, mas maior para o resto da seqncia, O2 at Ne2. Assim, as energias dos MOs para B2, C2 e N2
so mostradas na Figura 19a e para O2, F2 e Ne2 na Figura 19b. A diferena principal nas Figuras
19.25a e b a energia relativa de s comparada com as energias dos orbitais y e z.
Teoria do Orbital Molecular - Prof. J. D. Ayala
- 16 -
A mudana na seqncia das energias MO entre N2 e O2 ocorre porque y e z,
neste caso, algum carter s, fato que ignoramos quando decidimos usar a simplificao,
combinao de AOs para formar dois MOs. ("Um AO mais um AO fornece dois Mos"). O
carter s nesses orbitais decresce medida que a carga cresce no perodo, por causa disso a
energia de x fica abaixo da energia y e z no O2.
B2. A Figura 20 mostra o preenchimento dos MOs para B2 ,C2 e N2. Na primeira molcula, B2, h
somente um eltron em cada orbital y e z. Como so orbitais ligantes, e como em todos os nveis
de energia mais baixos os eltrons antiligantes compensam exatamente os eltrons ligantes, a ordem
de ligao 1. (Podemos chamar a ligao de ligao simples, mas talvez ela seja melhor descrita
como duas meias ligaes.) Note que os orbitais y e z tm igual energia, e assim, os dois eltrons
Teoria do Orbital Molecular - Prof. J. D. Ayala
- 17 -
no se emparelham no mesmo orbital. Por ocuparem diferentes orbitais, os eltrons podem ocupar
regies diferentes do espao, evitando um ao outro e reduzindo a repulso inter-eletrnica. A
configurao eletrnica no B2 escrita como: B2: KK(s)2( *s )2(y)1(z)1
A base experimental para essa configurao provm das medidas magnticas: B2
paramagntico, e as medidas indicam que dois eltrons desemparelhados esto presentes na
molcula.
Como o Li2, o B2 no uma molcula que voc possa encontrar em um frasco, nas
prateleiras do almoxarifado. O boro elementar encontrado como um slido, no qual o arranjo dos
tomos de B complexo. A temperaturas muito altas, entretanto, as molculas de B2 podem ser
detectadas no estado gasoso.
C2. Adicionando mais dois eltrons (um para cada tomo), obteremos a configurao para o C2 vista
na Figura 20. Esses eltrons so adicionados aos orbitais y e z, preenchendo-os. Todos os eltrons
esto agora emparelhados e, assim, C2 no paramagntico. A ordem da ligao no C2 2, porque
h quatro eltrons ligantes a mais na molcula. A configurao eletrnica no C2 :
Teoria do Orbital Molecular - Prof. J. D. Ayala
- 18 -
C2: KK(s)2( *s )2(y)2(z)2
Como a ordem de ligao diferente de zero, o C2 deve existir e na verdade foi
detectado a altas temperaturas. (A temperatura ambiente, o carbono existe principalmente em duas
formas slidas, grafite e diamante, cada um em retculo covalente).
N2. O ltimo preenchimento do diagrama de MO na Figura 20 o da molcula de nitrognio, N2.
Ela tem um conjunto de seis eltrons de ligao, que corresponde a uma ordem de ligao igual a 3.
Estes eltrons ocupam os orbitais y e z e x, dando ao N2 a configurao:
N2 : KK(s)2( *s )2(y)2(z)2(x)2
O N2 , sem dvida, muito estvel e comum, e ns o inalamos toda vez que respiramos.
As medidas magnticas indicam que todos os eltrons esto emparelhados no N2. (No
paramagntico). O modelo MO da molcula N2 est muito bem correlacionado com aquele
apresentado pela Teoria da Ligao de Valncia. Os seis eltrons dos orbitais y e z e x
correspondem aos seis eltrons da estrutura de Lewis: ( :N:::N: ).
um pouco arriscado tentar correlacionar o modelo MO com a estrutura de Lewis. Isto
vai bem com o N2 , mas no com todas as molculas. Mesmo no N2 podemos tirar concluses
erradas, se os seis pontos do meio da estrutura de Lewis representam a tripla ligao; ento o par
isolado do tomo N deve ser um ligante, enquanto o outro seria um antiligante. Isso tem pouco
sentido. Estruturas de Lewis so limitadas, como se pode ver.
O2. A adio de mais dois eltrons configurao do N2 leva ao preenchimento dos nveis do O2,
como aparece esquerda na Figura 21 e na Figura 22. Observe que esses dois eltrons devem ir
para orbitais antiligantes, resultando em um decrscimo na ordem de ligao (de 3, no N2) para 2. O
valor mais baixo da ordem de ligao consistente com o fato de O2 ter uma energia de ligao
menor e uma distncia de ligao maior que o N2. A configurao eletrnica do O2 :
O2 : KK(s)2( *s )2(x)2(y)2(z)2( y )1( z )1
*
Um dos primeiros triunfos da teoria MO foi a sua capacidade de mostrar que a molcula
de O2 paramagntica. (Sua configurao eletrnica mostra que ele tem dois eltrons
desemparelhados). Este o grande contraste com a TLV, que leva estrutura de Lewis (:::: ).
Teoria do Orbital Molecular - Prof. J. D. Ayala
- 19 -
F2. A adio de mais dois eltrons nos d o diagrama que mostrado no centro da Figura 21. Como
os orbitais * (antiligantes) esto ambos preenchidos, a ordem da ligao no F2 somente 1. Isto
est de acordo com os dados experimentais determinados para a energia e o comprimento da
ligao, pois ambos so aqueles esperados para uma ligao simples. Alm disso, F2 mostra ser
diamagntico, o que consistente com a ausncia de eltrons desemparelhados. A configurao do
F2 :
F2: KK(s)2( *s )2(x)2(y)2(z)2( y )2( z )2
*
Ne2. A adio de mais dois eltrons preenche o orbital *x , reduzindo a ordem de ligao para zero.
O estado fundamental para Ne2 nunca foi observado. Se existisse, sua configurao eletrnica seria:
Ne2: KK(s)2( *s )2(x)2(y)2(z)2( y )2( z )2( *x )2
*
Teoria do Orbital Molecular - Prof. J. D. Ayala
- 20 -
Teoria do Orbital Molecular - Prof. J. D. Ayala
- 21 -
Como se pode observar na Figura 22, temos uma outra nomenclatura para os orbitais,
onde o subscrito g ("gerade") se refere s funes de ondas dos orbitais simtricos em relao ao
eixo, enquanto que o subscrito u ("ungerade") se refere as funes de ondas dos orbitais
assimtricas em relao ao eixo.
Teoria do Orbital Molecular - Prof. J. D. Ayala
- 22 -
Teoria do Orbital Molecular - Prof. J. D. Ayala
- 23 -
Teoria do Orbital Molecular - Prof. J. D. Ayala
- 24 -
Teoria do Orbital Molecular - Prof. J. D. Ayala
- 25 -
ORBITAIS NAS MOLCULAS
A teoria dos orbitais moleculares (MO) constitui uma alternativa para se ter uma viso
da ligao. De acordo com este enfoque, todos os eltrons de valncia tm uma influncia na
estabilidade da molcula. (Eltrons dos nveis inferiores tambm podem contribuir para a ligao,
mas para muitas molculas simples o efeito demasiado pequeno.) Alm disso, a teoria MO
considera que os orbitais atmicos, AOs, do nvel de valncia, deixam de existir quando a molcula
se forma, sendo substitudos por um novo conjunto de nveis energticos que correspondem a novas
distribuies da nuvem eletrnica (densidade de probabilidade). Esses novos nveis energticos
constituem uma propriedade da molcula como um todo e so chamados, conseqentemente de
orbitais moleculares.
Teoria do Orbital Molecular - Prof. J. D. Ayala
- 26 -
Teoria do Orbital Molecular - Prof. J. D. Ayala
- 27 -
Teoria do Orbital Molecular - Prof. J. D. Ayala
- 28 -
Teoria do Orbital Molecular - Prof. J. D. Ayala
- 29 -
Teoria do Orbital Molecular - Prof. J. D. Ayala
Ligaes em escies planas do tipo AB3
- 30 -
Teoria do Orbital Molecular - Prof. J. D. Ayala
- 31 -
Teoria do Orbital Molecular - Prof. J. D. Ayala
- 32 -
Você também pode gostar
- Teoria Do Orbital Molecular TOMDocumento21 páginasTeoria Do Orbital Molecular TOMAna Laura ValerianoAinda não há avaliações
- Tom CloaDocumento4 páginasTom CloaJosé BritesAinda não há avaliações
- 3 Aula Orbitais MolecularesDocumento11 páginas3 Aula Orbitais MolecularesAdonilson FreitasAinda não há avaliações
- ResumosDocumento43 páginasResumosGuilherme RodriguesAinda não há avaliações
- Teoria Do Orbital MolecularDocumento17 páginasTeoria Do Orbital MolecularAlexandre MedinaAinda não há avaliações
- Teoria Dos Orbitais Moleculares (TOM)Documento9 páginasTeoria Dos Orbitais Moleculares (TOM)Dharma InitiativeAinda não há avaliações
- Teoria Do Orbital MolecularDocumento28 páginasTeoria Do Orbital MolecularVinicius GuimarãesAinda não há avaliações
- Química GeralDocumento6 páginasQuímica GeralannaAinda não há avaliações
- TOM Aula Formulas Funcao OndaDocumento11 páginasTOM Aula Formulas Funcao OndaLUIZA NAZARETHAinda não há avaliações
- Aplicação Da Teoria Do Orbital MolecularDocumento14 páginasAplicação Da Teoria Do Orbital MolecularTatianyAinda não há avaliações
- Ligações Covalentes - TomDocumento64 páginasLigações Covalentes - TomMarcus Vinicius100% (1)
- 11013617012017quimica Inorganica I Aula 03Documento10 páginas11013617012017quimica Inorganica I Aula 03AtumaneAli ChaleAinda não há avaliações
- Teoria Dos Orbitais MolecularesDocumento28 páginasTeoria Dos Orbitais MolecularesArtur GomesAinda não há avaliações
- Universidade Estadual de Feira de SantanaDocumento11 páginasUniversidade Estadual de Feira de SantanaEdmondDantesAinda não há avaliações
- Compostos ComplexosDocumento9 páginasCompostos ComplexosAlbino José JoaquimAinda não há avaliações
- Quimica Dos Compostos Inorganicos I Aula 6Documento28 páginasQuimica Dos Compostos Inorganicos I Aula 6Caroline FerreiraAinda não há avaliações
- Química Orgânica GeralDocumento15 páginasQuímica Orgânica GeralngdqyvcyopckcyjtsnAinda não há avaliações
- Aula 5 - Ligações Químicas Parte IIDocumento60 páginasAula 5 - Ligações Químicas Parte IIGustavo Carvalho SilvaAinda não há avaliações
- Slide - Geometria MolecularDocumento39 páginasSlide - Geometria MolecularjojojAinda não há avaliações
- F2.7 Ficha7 QuímicaDocumento6 páginasF2.7 Ficha7 QuímicaÂngela Carneiro100% (1)
- Resumo P1 - Interações Atômico-Moleculares UFABCDocumento5 páginasResumo P1 - Interações Atômico-Moleculares UFABCDavi OzolinAinda não há avaliações
- Compostos de Coordenação - Parte 5Documento22 páginasCompostos de Coordenação - Parte 5Bruno AlvesAinda não há avaliações
- Apostila Quimica Organica1Documento174 páginasApostila Quimica Organica1machadrsAinda não há avaliações
- Aula 1 - Ligações Quimicas em QoDocumento42 páginasAula 1 - Ligações Quimicas em QoMarcioAinda não há avaliações
- Tom 1 PDFDocumento42 páginasTom 1 PDFmanuellaamattos19Ainda não há avaliações
- TOM PARTES 1, 2 e 3Documento8 páginasTOM PARTES 1, 2 e 3Amanda JustinianoAinda não há avaliações
- TOM e ExerciciosDocumento3 páginasTOM e ExerciciosAndrade29Ainda não há avaliações
- Apostila - Fundamentos Materiais - 2012 - 1Documento28 páginasApostila - Fundamentos Materiais - 2012 - 1Eduardo VasconcellosAinda não há avaliações
- Ligações Químicas III 050614Documento64 páginasLigações Químicas III 050614wrafael1Ainda não há avaliações
- 18414816022012quimica Dos Compostos Inorganicos II Aula 7Documento19 páginas18414816022012quimica Dos Compostos Inorganicos II Aula 7Mi_MDAinda não há avaliações
- 09132604042014quimica Inorganica II Aula 7Documento19 páginas09132604042014quimica Inorganica II Aula 7NOOB FilosóficoAinda não há avaliações
- Aula 03 - O Modelo Atômico Atual - Orbitais AtômicosDocumento50 páginasAula 03 - O Modelo Atômico Atual - Orbitais Atômicosmatheus mgaAinda não há avaliações
- Unidade 4-2010Documento26 páginasUnidade 4-2010Mango lavoAinda não há avaliações
- Apontamentos - Modelo QuânticoDocumento16 páginasApontamentos - Modelo QuânticoAna LopesAinda não há avaliações
- Lista 2 Exercícios de Química Inorgânica I ResolvidosDocumento10 páginasLista 2 Exercícios de Química Inorgânica I Resolvidosromezioh7716Ainda não há avaliações
- Resumo. Teoria Dos Orbitais MolecularesDocumento5 páginasResumo. Teoria Dos Orbitais MolecularesClaudinei MartinsAinda não há avaliações
- Aula 9 - Teoria Do Orbital MolecularDocumento32 páginasAula 9 - Teoria Do Orbital Molecularmax_patricioAinda não há avaliações
- Modelo Quântico - ResumoDocumento2 páginasModelo Quântico - ResumoOswaldo JohansenAinda não há avaliações
- TOM Aplicada Aos Compostos de CoordenaoDocumento4 páginasTOM Aplicada Aos Compostos de CoordenaoAna Laura ValerianoAinda não há avaliações
- Cap.9 McQuarrieDocumento55 páginasCap.9 McQuarriekarinaAinda não há avaliações
- Lista 2 - Fernanda AzevedoDocumento7 páginasLista 2 - Fernanda AzevedoferAinda não há avaliações
- Teoria Dos Orbitais MolecularesDocumento6 páginasTeoria Dos Orbitais MolecularesISABELLE HAYASHI FUGIKAVAAinda não há avaliações
- Mecanica QuanticaDocumento8 páginasMecanica QuanticaagrapacanatejugaAinda não há avaliações
- Unidade 1 - Aspectos Gerais Das Ligações Químicas Parte - 3Documento20 páginasUnidade 1 - Aspectos Gerais Das Ligações Químicas Parte - 3Maíra MalonnAinda não há avaliações
- De Orbitais Âtomicos A Orbitais MolecularesDocumento42 páginasDe Orbitais Âtomicos A Orbitais MolecularesRebecaAinda não há avaliações
- Resumo Capítulo 2 CallisterDocumento3 páginasResumo Capítulo 2 CallisterLarissa RibeiroAinda não há avaliações
- Modelo Atômico AtualDocumento36 páginasModelo Atômico Atualthiago_quimic@100% (1)
- 14263207062016quimica de Coordenacao Aula 7Documento17 páginas14263207062016quimica de Coordenacao Aula 7Filipe Barros AraujoAinda não há avaliações
- Modelo QuânticoDocumento19 páginasModelo Quânticodidi sofiAinda não há avaliações
- Teoria Dos Orbitais MolecularesDocumento17 páginasTeoria Dos Orbitais MolecularesReinaldo RorizAinda não há avaliações
- Ficha Trabalho - Polaridade e Geometria MolecularDocumento4 páginasFicha Trabalho - Polaridade e Geometria Moleculara14841Ainda não há avaliações
- Geometria - RevisaoDocumento14 páginasGeometria - RevisaoDébora VitóriaAinda não há avaliações
- Ae rq10 d2s1 1 3 Geometria e PolaridadeDocumento19 páginasAe rq10 d2s1 1 3 Geometria e PolaridadeMatilde C.Ainda não há avaliações
- 9 Quim Tec I Ligação Química Teorias de Ligação Parte 3Documento7 páginas9 Quim Tec I Ligação Química Teorias de Ligação Parte 3Guilherme AzevedoAinda não há avaliações
- Resumo PPT 8Documento3 páginasResumo PPT 8Margarida GonçalvesAinda não há avaliações
- Relat Rio IX ExpVDocumento10 páginasRelat Rio IX ExpVBruno XavierAinda não há avaliações
- Química Orgânica - Aula 2Documento33 páginasQuímica Orgânica - Aula 2Wiomar OliveiraAinda não há avaliações
- Modelo Atual Do ÁtomoDocumento20 páginasModelo Atual Do ÁtomoClebson GomesAinda não há avaliações
- Livro QuimicaOrganicaTeorica PDFDocumento308 páginasLivro QuimicaOrganicaTeorica PDFLuan Sampaio67% (3)
- Lista de Exercícios 1 - Modelo Atômico e Números Quânticos - Prof Aline JoanaDocumento2 páginasLista de Exercícios 1 - Modelo Atômico e Números Quânticos - Prof Aline JoanaJúlia Blank HolzAinda não há avaliações
- Variação Do Raio Atômico Devido À Blindagem e À Repulsão Eletrônica Mundo QuímicoMundo QuímicoDocumento7 páginasVariação Do Raio Atômico Devido À Blindagem e À Repulsão Eletrônica Mundo QuímicoMundo QuímicoLuma MouraAinda não há avaliações
- Estrutura Atômica-ProfDocumento73 páginasEstrutura Atômica-ProfFernando HenriqueAinda não há avaliações
- Modelo Da Nuvem Eletrónica - ResumoDocumento2 páginasModelo Da Nuvem Eletrónica - ResumoMaria BentoAinda não há avaliações
- 04 A Química: Teoria Quântica ModernaDocumento8 páginas04 A Química: Teoria Quântica Modernahiinacio3Ainda não há avaliações
- Química 10Documento39 páginasQuímica 10Diogo AlexandreAinda não há avaliações