Escolar Documentos
Profissional Documentos
Cultura Documentos
Mapa Mental - Funções Inorgânicas
Enviado por
FABRICIO BAUER PERESTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Mapa Mental - Funções Inorgânicas
Enviado por
FABRICIO BAUER PERESDireitos autorais:
Formatos disponíveis
FUNÇÕES INORGÂNICAS
ÁCIDOS BASES SAIS ÓXIDOS
SUBSTÃNCIA QUE, EM SUBSTÃNCIA QUE COMPOSTO QUE EM COMPOSTO BINÁRIO
ÁGUA, LIBERA OS ÍONS DISSOLVIDA EM ÁGUA ÁGUA DISSOCIA OXIGENADO, NO QUAL O
H+ DISSOCIA-SE COMO LIBERANDO UM CÁTION OXIGÊNIO É O ELEMENTO
ÂNION EXCLUSIVAMENTE >< H+ E UM ÃNION >< MAIS ELETRONEGATIVO
OH- OH-
Neutralizam bases
Esfriam a mat. orgânica Conduzem corrente Fórmula geral C2Oy, em
Características Gerais formando sal e água Sabor caustico elétrica em solução que y é a carga do cátion
Apresentam sabor azedo Deixam vermelha a Os sais têm sabor salgado Combinação de dois
Desidrata a mat. orgânica solução alcoólica de Reage com ácido, elementos 0 + outro
fenolftaleína hidróxido, sais e metais elemento
H2SO4 - Ác. Sulfúrico Na0H - Hidróx. de Na NaHCO3 - Bicarb. de Na Fe3O4 - Tetróx. de triferro
Especiais importantes HCL - Ác. Clorídrico Ca(OH)2- Hidróx. de Ca CaCO3 - Carbonato de Ca Al2O3 - Óxido de Al
HNO3 - Ác. Nítrico Mg(OH)2 - Hidróx. de Mg NaNO3 - Nitrato de Na H2O2 - Peróxido de H
Quanto a presença Quanto ao nº de HO Ácidos ou básicos Ácidos ou básicos
Classificação /ausência de oxigênio Quanto a solubilidade em Neutro ou normais Anfóteros
Quanto ao nº de H água Neutros
ionizáveis Quanto ao de dissociação Peróxidos
Quanto ao grau de iônica
ionização
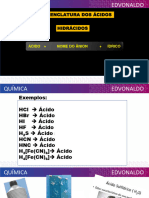
Ácidos (radical do elemento) Hidróxido de (Nome do (Nome do ânion) de (Nome (Prefixo) + óxido de (Prefixo)
Nomenclatura Geral
+ ídrico .: p/ Hidrácidos elemento) do cátion) + elemento
Ácido (radical do elemento)
+ ico .: p/ Oxiácidos
Você também pode gostar
- 770 - Manual Grampo de Ancoragem (GA-9-180KN-TR68 Ex II 2D T3)Documento30 páginas770 - Manual Grampo de Ancoragem (GA-9-180KN-TR68 Ex II 2D T3)j3fersonAinda não há avaliações
- Aulão ENEM - Ácidos 2021Documento29 páginasAulão ENEM - Ácidos 2021AMANDA CAROLINE ANTUNES OLIVEIRAAinda não há avaliações
- SaisDocumento22 páginasSaisJosé SilvaAinda não há avaliações
- Acidos Nomenclatura Bases 01Documento40 páginasAcidos Nomenclatura Bases 01Thiago SantosAinda não há avaliações
- Funções InorgânicasDocumento57 páginasFunções InorgânicasMicaela Neiva100% (1)
- Quimica Geral I - Aula 5Documento45 páginasQuimica Geral I - Aula 5giuliakemelymorena85Ainda não há avaliações
- Funções Inorgânicas - Parte 1Documento30 páginasFunções Inorgânicas - Parte 1Isabella DondoniAinda não há avaliações
- Funções InorganicasDocumento40 páginasFunções InorganicasFelipe CabralAinda não há avaliações
- Bases, Sais e ÓxidosDocumento7 páginasBases, Sais e ÓxidosThays LopesAinda não há avaliações
- Funções Inorganicas - Quim Geral - AlunosDocumento23 páginasFunções Inorganicas - Quim Geral - AlunosAnthonyAinda não há avaliações
- Funes - Inorganicas - 2023 (2) - 231107 - 114334Documento52 páginasFunes - Inorganicas - 2023 (2) - 231107 - 114334loisafernandesfeller2006Ainda não há avaliações
- Aula02 QADocumento35 páginasAula02 QAIzabelli de Castro BaptistaAinda não há avaliações
- Ácido BaseDocumento37 páginasÁcido BaseHenioAinda não há avaliações
- Aula - Funções Inorgânicas PDFDocumento55 páginasAula - Funções Inorgânicas PDFClarissa MoraesAinda não há avaliações
- 1 - Introdução - Funções Inorgânicas (2º Ano) 01 - 02 - 2024Documento32 páginas1 - Introdução - Funções Inorgânicas (2º Ano) 01 - 02 - 2024nezukokamado635Ainda não há avaliações
- Aula 3° Funções InorgânicasDocumento34 páginasAula 3° Funções InorgânicasM. CORDEIROZAinda não há avaliações
- Funções InorgânicasDocumento22 páginasFunções InorgânicasYsa FialhoAinda não há avaliações
- Funcões Inoganicas 1ABDocumento52 páginasFuncões Inoganicas 1ABLukinha HhhhsAinda não há avaliações
- Funções Inorgânicas - CompletoDocumento73 páginasFunções Inorgânicas - CompletoLuzimary GodinhoAinda não há avaliações
- Aula Funções QuímicasDocumento5 páginasAula Funções QuímicasMaura Eduarda100% (3)
- Química MateriaDocumento18 páginasQuímica MateriaJunim2321100% (2)
- Funcoes Inorganicas ÀCIDO, BASE, SAL E ÓXIDODocumento30 páginasFuncoes Inorganicas ÀCIDO, BASE, SAL E ÓXIDOMarcus Vinicius CarinaAinda não há avaliações
- Ionização e Dissociação Iónica. Autoionização Da ÁguaDocumento24 páginasIonização e Dissociação Iónica. Autoionização Da ÁguaAna Celia MendesAinda não há avaliações
- Funçoes Ácidos e Bases.Documento41 páginasFunçoes Ácidos e Bases.bianca.temoteoAinda não há avaliações
- Revisão ProvaDocumento12 páginasRevisão ProvaAlisson MartinsAinda não há avaliações
- Acidos BasesDocumento73 páginasAcidos BasesIkaro RozaAinda não há avaliações
- Descrição Dos Tipos de Funções Químicas, Suas Propriedades e Seus Efeitos Químicos e BiológicosDocumento38 páginasDescrição Dos Tipos de Funções Químicas, Suas Propriedades e Seus Efeitos Químicos e BiológicosNistezy.Ainda não há avaliações
- Aula 6 - PH, Ácidos e BasesDocumento32 páginasAula 6 - PH, Ácidos e BasesRuan SilvaAinda não há avaliações
- Funções InorgânicasDocumento7 páginasFunções InorgânicasEmídio Junior DuoAinda não há avaliações
- Ácidos e Bases em Soluções AquosasDocumento17 páginasÁcidos e Bases em Soluções AquosasRachel SousaAinda não há avaliações
- Funcoes InorganicasDocumento49 páginasFuncoes InorganicasPedro FerreiraAinda não há avaliações
- Sais e ÓxidosDocumento36 páginasSais e ÓxidosImperatrizzAinda não há avaliações
- Estudo Comparativo Entre As Teorias Acido-BaseDocumento36 páginasEstudo Comparativo Entre As Teorias Acido-BaseMarciana ClaudioAinda não há avaliações
- Química Básica - Cap 4 PDFDocumento38 páginasQuímica Básica - Cap 4 PDFJackson SantosAinda não há avaliações
- 03 - Química - Pss1Documento16 páginas03 - Química - Pss1profciroteixeiraAinda não há avaliações
- Teoria Prótonica - AutoionizaçãoDocumento40 páginasTeoria Prótonica - AutoionizaçãoCesar MedeirosAinda não há avaliações
- Estudo Comparativo Entre As Teorias Acido-BaseDocumento37 páginasEstudo Comparativo Entre As Teorias Acido-BaseIury MedeirosAinda não há avaliações
- ÁcidosDocumento31 páginasÁcidosKeila DiasAinda não há avaliações
- Ácidos e BasesDocumento33 páginasÁcidos e BasesImperatrizzAinda não há avaliações
- Funções InorgânicasDocumento34 páginasFunções InorgânicasIago FacchinAinda não há avaliações
- Ácidos, Bases, Sais e ÓxidosDocumento4 páginasÁcidos, Bases, Sais e ÓxidosKanasa 03Ainda não há avaliações
- Funções Inorgânicas Aula 4 e 11.Documento39 páginasFunções Inorgânicas Aula 4 e 11.faleiri.paulaAinda não há avaliações
- Quimica MateriaDocumento17 páginasQuimica MateriaprofessormedeirosAinda não há avaliações
- Aula 06 - Funções InorgânicasDocumento56 páginasAula 06 - Funções InorgânicasDébora Lima de OliveiraAinda não há avaliações
- Acido, Base, Sal e Oxido 2Documento23 páginasAcido, Base, Sal e Oxido 2Louise FrancoAinda não há avaliações
- Aula - Funcoes Inorganicas - SlideDocumento17 páginasAula - Funcoes Inorganicas - SlideWellen BarbosaAinda não há avaliações
- Funções InorgânicasDocumento3 páginasFunções InorgânicasRaquelAinda não há avaliações
- Resumo Das Funçoes InorgânicasDocumento5 páginasResumo Das Funçoes InorgânicascdvorakAinda não há avaliações
- A2 - FUNÇÕES INORGÂNICAS - Sais e ÓxidosDocumento11 páginasA2 - FUNÇÕES INORGÂNICAS - Sais e ÓxidosTamires QueirozAinda não há avaliações
- AcidosDocumento15 páginasAcidosAngelica SmaniottoAinda não há avaliações
- Tema IVa - Funcoes InorganicasDocumento75 páginasTema IVa - Funcoes InorganicasChelsia GoveAinda não há avaliações
- 03 Reações Inorgânicas - IMPDocumento3 páginas03 Reações Inorgânicas - IMPLADY LAURA PANTOJA PEREIRA DE CARVALHOAinda não há avaliações
- Equilíbrio Ácido-BaseDocumento28 páginasEquilíbrio Ácido-BaseSarah MartinsAinda não há avaliações
- Química InorgânicaDocumento8 páginasQuímica Inorgânicaandrielle de jesusAinda não há avaliações
- Ae - q11 - Ácido-Base - Constantes e Pares ConjugadosDocumento15 páginasAe - q11 - Ácido-Base - Constantes e Pares ConjugadosHugo RochaAinda não há avaliações
- Sais e ÓxidosDocumento4 páginasSais e ÓxidosBruno GabrielAinda não há avaliações
- Aula 06 - Funções Inorgânicas (Ácidos e Bases)Documento6 páginasAula 06 - Funções Inorgânicas (Ácidos e Bases)Marcelo NogueiraAinda não há avaliações
- Quimica Geral - Cefet-RJDocumento110 páginasQuimica Geral - Cefet-RJmarcelo andradeAinda não há avaliações
- Substâncias Inorgânicas7Documento20 páginasSubstâncias Inorgânicas7Hélson RicardoAinda não há avaliações
- Trabalho de Cienc. Dos Materiais 3Documento16 páginasTrabalho de Cienc. Dos Materiais 3FABRICIO BAUER PERESAinda não há avaliações
- Metalurgia I - Cementita e CarbonetosDocumento7 páginasMetalurgia I - Cementita e CarbonetosFABRICIO BAUER PERESAinda não há avaliações
- Centro de Educação Profissional Abílio Paulo: Fabrício Bauer PeresDocumento14 páginasCentro de Educação Profissional Abílio Paulo: Fabrício Bauer PeresFABRICIO BAUER PERESAinda não há avaliações
- Normas Básicas para Trabalhar No Laboratório de QuímicaDocumento30 páginasNormas Básicas para Trabalhar No Laboratório de QuímicaFABRICIO BAUER PERESAinda não há avaliações
- Funções Inogânicas: Professora: Normelia Ondina Lalau de FariasDocumento50 páginasFunções Inogânicas: Professora: Normelia Ondina Lalau de FariasFABRICIO BAUER PERESAinda não há avaliações
- Estudo Dirigido Tabela PeriódicoDocumento2 páginasEstudo Dirigido Tabela PeriódicoFABRICIO BAUER PERESAinda não há avaliações
- Universidade Do Extremo Sul Catarinense - Unesc: Fabricio Bauer PeresDocumento7 páginasUniversidade Do Extremo Sul Catarinense - Unesc: Fabricio Bauer PeresFABRICIO BAUER PERESAinda não há avaliações
- Unidade de Bombeio MecânicoDocumento8 páginasUnidade de Bombeio MecânicoRodolfo AquinoAinda não há avaliações
- Fisica AtividadeDocumento7 páginasFisica AtividadeOTO MALTEZAinda não há avaliações
- Aula 2 - Cinemática de Ponto Material - 2 - 1 Movimento RetílineoDocumento9 páginasAula 2 - Cinemática de Ponto Material - 2 - 1 Movimento RetílineoEric EspíndolaAinda não há avaliações
- Ficha 19Documento2 páginasFicha 19tita32Ainda não há avaliações
- Impressao ISA 75.01Documento10 páginasImpressao ISA 75.01Bruno LimaAinda não há avaliações
- Folder ForrosDocumento2 páginasFolder ForrosEmanuel CarvalhoAinda não há avaliações
- Fasciculo Actualizado Da 10 ClasseDocumento42 páginasFasciculo Actualizado Da 10 ClasseJoão K. Nguenzi100% (1)
- MC e MD - Ed. Residencial - Diadema - R00Documento8 páginasMC e MD - Ed. Residencial - Diadema - R00Marcelo Alves Do NascimentoAinda não há avaliações
- Questionário Material Isolante.Documento4 páginasQuestionário Material Isolante.Aurea MessiasAinda não há avaliações
- Procedimento para Bloqueio e Isolamento de FonteDocumento8 páginasProcedimento para Bloqueio e Isolamento de Fontevladimir carraAinda não há avaliações
- Integrador M3000-8 - GUIA DE CONSULTA RÁPIDA-1Documento4 páginasIntegrador M3000-8 - GUIA DE CONSULTA RÁPIDA-1Wildemar VelosoAinda não há avaliações
- Inversões No Plano HiperbólicoDocumento9 páginasInversões No Plano HiperbólicoEsteves SemetafísicaAinda não há avaliações
- Referencial AerodinâmicoDocumento1 páginaReferencial AerodinâmicoGuilherme MartinsAinda não há avaliações
- MCU - Exercicios e AP1Documento6 páginasMCU - Exercicios e AP1William Gomes de MacedoAinda não há avaliações
- Relatório Mecânica Dos Solos - LLDocumento11 páginasRelatório Mecânica Dos Solos - LLmaykon.xtreme211Ainda não há avaliações
- Liebert NXL 1100kva SL 30610 SPDocumento12 páginasLiebert NXL 1100kva SL 30610 SPG Man MaxAinda não há avaliações
- Exercícos - CinemáticaDocumento3 páginasExercícos - CinemáticaJucelino Santos CarvalhoAinda não há avaliações
- Aula 06 - Geometria Espacial I - ITA 2024Documento250 páginasAula 06 - Geometria Espacial I - ITA 2024João Gabriel Ferreira CalixtoAinda não há avaliações
- Cappo Prime IIDocumento1 páginaCappo Prime IIYhann Karllos Alves MesquitaAinda não há avaliações
- Energia Mec - Impulso - Qte - MovdocxDocumento2 páginasEnergia Mec - Impulso - Qte - MovdocxCelio JuniorAinda não há avaliações
- Capacidade Cap4Documento20 páginasCapacidade Cap4Célia CorreiaAinda não há avaliações
- Analise Dimensional - 9anoDocumento2 páginasAnalise Dimensional - 9anogabymentaaaAinda não há avaliações
- DIMENSIONAMENTO DE ESTRUTURAS DE EDIFÍCIOS E ESTRUTURAS ESPECIAIS. Pedro Martins Mendes e José J. Oliveira PedroDocumento12 páginasDIMENSIONAMENTO DE ESTRUTURAS DE EDIFÍCIOS E ESTRUTURAS ESPECIAIS. Pedro Martins Mendes e José J. Oliveira PedroMaurício100% (1)
- CNC Ombr Mat 18 0122 EdceDocumento39 páginasCNC Ombr Mat 18 0122 EdceCézar NobreAinda não há avaliações
- Fabiola Queda LivreDocumento9 páginasFabiola Queda LivreGrasielle SantanaAinda não há avaliações
- FT-950 User PTDocumento151 páginasFT-950 User PTSandro TolosaAinda não há avaliações
- Desenho Técnico Mecânico - Soldagem e SimbologiaDocumento38 páginasDesenho Técnico Mecânico - Soldagem e SimbologiaNeto CarronAinda não há avaliações
- d29b - Cinemática de Mecanismos - Questionário Unidade IIDocumento17 páginasd29b - Cinemática de Mecanismos - Questionário Unidade IILucasAinda não há avaliações
- Atividade Hidrocarbonetos 3°anoDocumento1 páginaAtividade Hidrocarbonetos 3°anoJessica Jacinta SilvaAinda não há avaliações