Escolar Documentos
Profissional Documentos
Cultura Documentos
Pratica11 Tit Potenc
Enviado por
Maria Angélica MenckDireitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Pratica11 Tit Potenc
Enviado por
Maria Angélica MenckDireitos autorais:
Formatos disponíveis
MINISTRIO DA EDUCAO UNIVERSIDADE TECNOLGICA FEDERAL DO PARAN - UTFPR DEPARTAMENTO ACADMICO DE QUMICA E BIOLOGIA TECNLOGO EM PROCESSOS AMBIENTAIS
Qumica Analtica
Prtica no 11 Anlise Volumtrica
Titulao Potenciomtrica Curvas de pH MATERIAIS E REAGENTES
- suporte - garra - 1 copo de bquer de 50m - 1 copo de bquer de 250m - pipeta volumtrica de 20m - bureta de 50m - pipeta de 5m - funil
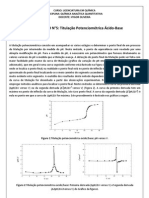
INTRODUO: A titulao potenciomtrica consiste em acompanhar os vrios estgios e determinar o ponto final de um processo de titulao por intermdio da medida do pH. Neste mtodo, o ponto de equivalncia ser revelado por uma abrupta modificao do pH. Para a medida do pH, necessrio um potencimetro que fornece diretamente os valores variveis do pH medida que a titulao avana. A deteco do ponto final da titulao pode ser feita com maior facilidade pelo exame da curva de titulao (grfico da variao do pH em funo do volume de titulante adicionado), que em geral uma curva segnide conforme est ilustrado na Figura 1. O segmento central da curva onde se localiza o ponto final; na realidade o ponto final est no ponto de inflexo da curva. Pode-se obter um valor aproximado do ponto final localizando-se o meio caminho do segmento ascendente da curva, quando a mesma, tiver muito evidente este segmento. Em geral, necessrio adotar um tratamento geomtrico para fixar, com exatido, o ponto final. Para isto, pode ser adotado o mtodo das tangentes paralelas. A exatido dos resultados deste mtodo depender da habilidade com que o grfico da curva de titulao for desenhada a partir das observaes experimentais. Por isso usualmente prefervel empregar mtodos analticos para localizar o ponto final. Nestes mtodos se determina a curva da primeira derivada ( pH/V vs V ) ou da segunda derivada ( 2pH/V2 vs V). A curva da primeira derivada tem um mximo no ponto de inflexo da curva de titulao, isto , no ponto final. A curva da segunda derivada ( 2pH/V2) nula no ponto em que a curva de pH/V for mxima. Este procedimento ilustrado nos grficos a seguir:
- Potencimetro - papel absorvente - frasco lavador - tampo de pH 4,01 - tampo de pH 7,1 - soluo de NaOH (4g/L) - soluo padro de HNO3
Dados de uma titulao potenciomtrica de soluo de HAc por soluo de NaOH 0,10mol/ . V (m ) 0 5 10 15 17 19 20 20.4 20.8 21.2 21.6 22 22.4 22.8 23.2 23.6 24 25 27 29 pH) 2.55 3.92 4.4 4.85 5.09 5.47 5.71 5.91 6.22 6.73 9.1 9.89 10.49 10.96 11.3 11.5 11.64 11.96 12.16 12.32 V (m ) 2.5 7.5 12.5 16 18 19.5 20.2 20.6 21 21.4 21.8 22.2 22.6 23 23.4 23.8 24.5 26 28 pH/V 0.274 0.096 0.09 0.12 0.19 0.24 0.5 0.775 1.275 5.925 1.975 1.5 1.175 0.85 0.5 0.35 0.32 0.1 0.08 V (m ) 2pH/V2
5 10 14.25 17 18.75 19.85 20.4 20.8 21.2 21.6 22 22.4 22.8 23.2 23.6 24.15 25.25 27
-0.0356 -0.0012 0.0086 0.035 0.0033 0.3714 0.6875 1.25 11.625 -9.875 -1.1875 -0.8125 -0.8125 -0.875 -0.375 -0.0428 -0.1467 -0.01
Grficos obtidos a partir dos dados da tabela
14
6
12
5
10
4
8
pH/ V
pH
3 2
6 4
1
2
0
0 0 5 10 15 20 25 30
10
15
20
25
30
V / ml
15
V / ml
10
pH/V
-5
-10 5 10 15 20 25 30
V / ml
OBJETIVO:
Determinar o grau de pureza do NaOH em uma soluo de soda castica, atravs da titulao potenciomtrica com HNO3 fatorado.
METODOLOGIA:
1) Calibrao do potenciometro
a) Calibrar o potencimetro, conforme a tcnica das aulas anteriores, com o padro 7,1 e depois o padro 4,01. 2) Titulao potenciomtrica do NaOH a) Pipetar 20m da amostra de NaOH 4,0 g/L em um copo de Bquer de 50m . b) Com cuidado, introduzir o eletrodo do potencimetro, j calibrado e determinar o pH. c) Montar uma tabela de pH versus Volume de HNO3 adicionado. d) Com a bureta, adicionar 2m de HNO3 na soluo de NaOH e verificar o pH da soluo de NaOH e anotar na tabela. e) Repetir a operao do item "e" de 2m em 2m de HNO3 at mais ou menos 8,0 m alm (mais umas 4 adices) da variao brusca do pH, que indica que houve a neutralizao. f) Lavar todo o sistema. g) Repetir a operao do item "b". h) Adicionar o HNO3 e fazer a "medio" do pH, mas agora, de 0,2m em 0,2m a partir de um volume prximo ao volume da mudana brusca de pH observada no item "f"; at a mudana brusca do pH. i) Construir os grficos de pH vs Volume de HNO3 adicionado (V), da primeira derivada (pH/V vs V) e/ou da segunda derivada (2pH/V2 vs V). j) Analisando as curvas do item i indique o volume preciso de HNO3 gasto na neutralizao, o pH de neutralizao e a concentrao do NaOH e o grau de pureza do mesmo. k) Consulte a tabela de indicadores cido-base e indique 3 ou 4 indicadores que poderiam ser usados nesta experincia.
INDICADORES CIDO-BSICOS
INDICADOR Sol. cida COLORAO Sol. Bsica ZONA DE SOLVENTE TRANSIO
g/100mL
Azul de Timol (A) Tropeolina OO (B) 2,4-Dinitrofenol (A) Amarelo de metila (B) Alaranjado de metila (B) Azul de bromofenol (A) Alizarinossulfonato de sdio Vermelho de -naftila (B) -Etoxicrisoldina (B) Verde de bromocresol (A) Vermelho de metila (A) Prpura de bromocresol (A) Vermelho de clorofenol (A) Azul de bromotimol (A) -Nitrofenol (A) Azolitmina Vermelho de fenol (A) Vermelho neutro (B) cido roslico (A) Vermelho de cresol (A) -naftolftalena (A) Tropeolina OOO (B) Azul de Timol (A) Fenolftalena (A) -Naftolbenzena (A) Timolftalena (A) Azul do Nilo Amarelo de Alizarina (A) Amarelo de Salicil (A) Diazovioleta Tropeolina O (B) Nitramina (B) Azul de Porier cido Trinitrobenzico
vermelho vermelho incolor vermelho vermelho amarelo amarelo vermelho vermelho amarelo vermelho amarelo amarelo amarelo incolor vermelho amarelo vermelho amarelo amarelo rseo amarelo amarelo incolor amarelo incolor azul amarelo amarelo amarelo amarelo incolor azul incolor
Amarelo Amarelo Amarelo Amarelo Amarelo azul-violeta Violeta Amarelo Amarelo Azul Amarelo Prpura Vermelho Azul Amarelo Azul Vermelho Amarelo Vermelho Vermelho Verde rseo-vermelho Azul Vermelho Azul Azul Vermelho Lils Alaranjado-marrom Violeta Alaranjado-marrom Alaranjado-marron Violeta-vermelho Alaranj.-vermelho
1,2 1,3 2,4 2,9 3,1 3,0 3,7 3,7 3,5 4,0 4,0 5,2 5,4 6,0 5,0 5,0 6,4 6,8 6,8 7,2 7,3 7,6 8,0 8,0 9,0 9,4 10,1 10,0 10,0 10,1 11,0 11,0 11,0 12,0
2,8 3,2 4,0 4,0 4,4 4,6 5,2 5,0 5,5 5,6 6,2 6,8 6,8 7,6 7,0 8,0 8,0 8,0 8,0 8,8 8,7 8,9 9,6 10,0 11,0 10,6 11,1 12,0 12,0 12,0 13,0 13,0 13,0 13,4
gua (*) gua etanol 50% etanol 90% gua gua (*) gua etanol 50% etanol 90% gua (*) gua (*) gua (*) gua (*) gua (*) gua gua gua (*) etanol 70% etanol 90% gua (*) etanol 70% gua gua (*) etanol 70% etanol 90% etanol 90% gua gua etanol 90% gua gua etanol 70% gua gua
0,1 1,0 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,5 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1
A: indicador cido; B: indicador bsico; (*) solvel em gua em presena de hidrxido de sdio.
Você também pode gostar
- Roteiro QUIB36 2018 2Documento15 páginasRoteiro QUIB36 2018 2Nicholas MontenegroAinda não há avaliações
- Titulac - A - o Potenciometrica Da GlicinaDocumento15 páginasTitulac - A - o Potenciometrica Da GlicinaCarla Nogueira0% (1)
- Trab 2 Acido BaseDocumento12 páginasTrab 2 Acido BaselipikinitaAinda não há avaliações
- Relatório Da Atividade Laboratorial 1.6 - Funcionamento de Um Sistema TampãoDocumento5 páginasRelatório Da Atividade Laboratorial 1.6 - Funcionamento de Um Sistema TampãoleonorAinda não há avaliações
- Relatório Análise Do Hidróxido de Magnésio MG (OH) 2 em Leite de Magnésia TradicionalDocumento7 páginasRelatório Análise Do Hidróxido de Magnésio MG (OH) 2 em Leite de Magnésia TradicionalLuiz Carlos SantanaAinda não há avaliações
- Relatório de Anin I - pHMetria IFRJDocumento8 páginasRelatório de Anin I - pHMetria IFRJLucas MoreiraAinda não há avaliações
- Relatório Experimento I: Titulação de Ácidos PolipróticosDocumento8 páginasRelatório Experimento I: Titulação de Ácidos PolipróticosMarcoAinda não há avaliações
- Relatório (01) - Medida de PHDocumento13 páginasRelatório (01) - Medida de PHJamile De Souza Silva100% (1)
- PotenciometriaDocumento4 páginasPotenciometriaAlexandre Sâmio0% (1)
- PotenciometriaDocumento12 páginasPotenciometriaMaria MadrugaAinda não há avaliações
- Roteiro EletroanalíticaDocumento3 páginasRoteiro EletroanalíticaSidney MagalhãesAinda não há avaliações
- Relatório 7Documento14 páginasRelatório 7Milena LimaAinda não há avaliações
- Determinacao de H3po4 Na CocaCola - Tem Grafico e CalculoDocumento9 páginasDeterminacao de H3po4 Na CocaCola - Tem Grafico e CalculoKiany SirleyAinda não há avaliações
- Coca ColaDocumento12 páginasCoca ColaHellen MacêdoAinda não há avaliações
- Titulacao PotenciometricaDocumento2 páginasTitulacao PotenciometricaMarco AlmeidaAinda não há avaliações
- AnaliticaDocumento12 páginasAnaliticaMaria MadrugaAinda não há avaliações
- Experimento 11 - Giovana Jabur Teixeira e Cleidiane Aparecida AraújoDocumento6 páginasExperimento 11 - Giovana Jabur Teixeira e Cleidiane Aparecida AraújoGiovana JaburAinda não há avaliações
- Relatorio de Quimica AnaliticaDocumento11 páginasRelatorio de Quimica AnaliticaCamila MoraisAinda não há avaliações
- RELATORIO 4 - Dosagem Do Ácido Acetilsalicílico (AAS) em Medicamentos Por Potenciometria IndiretaDocumento12 páginasRELATORIO 4 - Dosagem Do Ácido Acetilsalicílico (AAS) em Medicamentos Por Potenciometria IndiretaRaphael Brigagão100% (1)
- Potenciometria de NeutralizaçãoDocumento12 páginasPotenciometria de NeutralizaçãoFlavia MelloAinda não há avaliações
- Experimento 5 Titulação Potenciometrica Ácido BaseDocumento2 páginasExperimento 5 Titulação Potenciometrica Ácido BaseGeilson SilvaAinda não há avaliações
- Titulacao Acido Base ProfessorDocumento3 páginasTitulacao Acido Base ProfessorMatilde HenriqueAinda não há avaliações
- Trabalho 1 QuimicaDocumento4 páginasTrabalho 1 QuimicaCristianaRamosAinda não há avaliações
- Seminário - Prática 1 e 2Documento34 páginasSeminário - Prática 1 e 2viniciusromeroAinda não há avaliações
- Determinação de Ácido Acético em Vinagre Através de Titulação Potenciométrica VfinalDocumento11 páginasDeterminação de Ácido Acético em Vinagre Através de Titulação Potenciométrica VfinalLarissa PereiraAinda não há avaliações
- Potenciometria - Quimica AnaliticaDocumento15 páginasPotenciometria - Quimica AnaliticaSuh21Ainda não há avaliações
- Relatório AASDocumento9 páginasRelatório AASAna Luiza EmerencianoAinda não há avaliações
- R06 - InstrumentalDocumento10 páginasR06 - InstrumentalGabriela FontolanAinda não há avaliações
- Experimento Química Condutividade e PHDocumento12 páginasExperimento Química Condutividade e PHGabriela AndradeAinda não há avaliações
- 07 - Curva de PHDocumento3 páginas07 - Curva de PHJuliano15rockAinda não há avaliações
- Relatorio PHDocumento11 páginasRelatorio PHGiovana AdrieleAinda não há avaliações
- FQ Experimental - Experimento 2Documento7 páginasFQ Experimental - Experimento 2angiegelainAinda não há avaliações
- Apostila Bioquimica Aplicada 2011Documento32 páginasApostila Bioquimica Aplicada 2011Vanessa NeresAinda não há avaliações
- Relatorio PotenciometriaDocumento7 páginasRelatorio PotenciometriaRerison JustoAinda não há avaliações
- Metodologias Lab de FrutosDocumento59 páginasMetodologias Lab de FrutosFabiano Tavares de MouraAinda não há avaliações
- Zap CleanDocumento15 páginasZap CleanMariAinda não há avaliações
- 1 Lista de Exercícios - Volumetria Ácido BaseDocumento7 páginas1 Lista de Exercícios - Volumetria Ácido BasePaulinha Paula PaulinoAinda não há avaliações
- Atividade Laboratorial 2.2Documento8 páginasAtividade Laboratorial 2.2João BarbosaAinda não há avaliações
- Relatorio Apl 2.1 - AcidooubaseDocumento6 páginasRelatorio Apl 2.1 - Acidooubaserebordosa4Ainda não há avaliações
- Titulacao Acido Base Aluno PDFDocumento3 páginasTitulacao Acido Base Aluno PDFManuel BarataAinda não há avaliações
- DETERMINAÇÃO DE NITRITOS EM ÁGUAS - Química - UTFPR - 2010Documento14 páginasDETERMINAÇÃO DE NITRITOS EM ÁGUAS - Química - UTFPR - 2010joaomarcoslsAinda não há avaliações
- Relatorio de Quimica - TAMPAODocumento11 páginasRelatorio de Quimica - TAMPAOFilipa MendesAinda não há avaliações
- Relatório Titulação de NeutralizaçãoDocumento7 páginasRelatório Titulação de NeutralizaçãoLuiz Carlos SantanaAinda não há avaliações
- Relatorio 10 - Equilibrio Ácido - BaseDocumento11 páginasRelatorio 10 - Equilibrio Ácido - BaseGustavo Rossoni RuyAinda não há avaliações
- Analisadores de PHDocumento40 páginasAnalisadores de PHPedro FelixAinda não há avaliações
- Erro No Tratamento Do Caldo D..Documento15 páginasErro No Tratamento Do Caldo D..Márcio Cardoso Proj IndAinda não há avaliações
- Relatório Potenciometria Indireta (Precipitação)Documento8 páginasRelatório Potenciometria Indireta (Precipitação)gabinhasmo0% (1)
- Relatorio 2 Quimica GeralDocumento18 páginasRelatorio 2 Quimica GeralEmily RufinoAinda não há avaliações
- Relatório de Química Analítica - Barbarah e ItaloDocumento7 páginasRelatório de Química Analítica - Barbarah e ItaloItalo SoaresAinda não há avaliações
- E7 EquilibrioDocumento2 páginasE7 EquilibrioWestrup01Ainda não há avaliações
- Relatório Da Pratica de Titulação PotenciometricaDocumento16 páginasRelatório Da Pratica de Titulação PotenciometricaRoger YankolowiskAinda não há avaliações
- TitulaçãoDocumento19 páginasTitulaçãoClara RoqueAinda não há avaliações
- AULA IV - Volumetria de NeutralizaçãoDocumento8 páginasAULA IV - Volumetria de Neutralizaçãouma pessoaAinda não há avaliações
- Relatório - Análise e Comportamentos de IndicadoresDocumento9 páginasRelatório - Análise e Comportamentos de IndicadoresVerónica GonçalvesAinda não há avaliações
- Relatório de Bioquímica - EnzimasDocumento9 páginasRelatório de Bioquímica - EnzimasJuliana WerglesAinda não há avaliações
- Relatório de ExperimentaçãoDocumento6 páginasRelatório de ExperimentaçãoItalo SoaresAinda não há avaliações
- Projetos Em Clp Ladder Baseado No Twidosuite Parte XiiNo EverandProjetos Em Clp Ladder Baseado No Twidosuite Parte XiiAinda não há avaliações
- Projetos Com Esp8266 Programado Em Lua - Parte XxiNo EverandProjetos Com Esp8266 Programado Em Lua - Parte XxiAinda não há avaliações
- 03 Elevado Cimento Polimérico Com Fibras ReservatorioDocumento10 páginas03 Elevado Cimento Polimérico Com Fibras ReservatorioVinicius CunhaAinda não há avaliações
- DF 01-2017 Relatório Sintético de Composições de Custos PDFDocumento102 páginasDF 01-2017 Relatório Sintético de Composições de Custos PDFThaís LealAinda não há avaliações
- Produção de IsoporDocumento6 páginasProdução de IsoporKaique Ribeiro chrdrAinda não há avaliações
- Tipos de GramposDocumento9 páginasTipos de Gramposandrecarneiro11100% (1)
- Trab prm2 2 PDFDocumento6 páginasTrab prm2 2 PDFLucas GomesAinda não há avaliações
- Ciencias Naturais 7º Ano MineraisDocumento2 páginasCiencias Naturais 7º Ano MineraisMarta Alves100% (1)
- Natural e SinteticoDocumento2 páginasNatural e SinteticoAna Maria Gonçalves Ramos100% (1)
- Formulário de Pedido Atual Das Unidades Básicas de Saúde PSF I e PSF II 2017Documento12 páginasFormulário de Pedido Atual Das Unidades Básicas de Saúde PSF I e PSF II 2017Claudiony AzevêdoAinda não há avaliações
- DWDocumento99 páginasDWDaniAinda não há avaliações
- Compósitos Poliméricos Reforçados Com Fibras AramidasDocumento10 páginasCompósitos Poliméricos Reforçados Com Fibras AramidasDouglas FontouraAinda não há avaliações
- Materiais Compósitos 2Documento66 páginasMateriais Compósitos 2Felipe FrizonAinda não há avaliações
- Curso de Corte e CosturaDocumento50 páginasCurso de Corte e CosturaCamila MarquesAinda não há avaliações
- A ResinaDocumento4 páginasA ResinaWwmm WMAinda não há avaliações
- Polímeros Naturais e SintéticosDocumento21 páginasPolímeros Naturais e SintéticosCláudia Honara Da Rosa WaisczikAinda não há avaliações
- Ficha Técnica 13000 Sikaflex UniversalDocumento4 páginasFicha Técnica 13000 Sikaflex UniversalJúnior FerreiraAinda não há avaliações
- Guia de Codigos NFPADocumento36 páginasGuia de Codigos NFPApaulo_schneiderAinda não há avaliações
- TexiglassDocumento36 páginasTexiglassA. RaulinoAinda não há avaliações
- Entelagem - Traduzido PDFDocumento27 páginasEntelagem - Traduzido PDFdejascotonAinda não há avaliações
- 3 Funcao Oxigenadas NitrogenadasDocumento65 páginas3 Funcao Oxigenadas NitrogenadasGleison Paulino GonçalvesAinda não há avaliações
- Estudando Sobre CabelosDocumento2 páginasEstudando Sobre CabelosItamar Magrini UlianaAinda não há avaliações
- Materiais PoliméricosDocumento59 páginasMateriais PoliméricosClara FerreiraAinda não há avaliações
- Mapeamento de EPI X Função - Laboratórios VGR PICO 04-01-2023Documento39 páginasMapeamento de EPI X Função - Laboratórios VGR PICO 04-01-2023Gleice MagalhãesAinda não há avaliações
- Hipertek Catalogo 11-FINALDocumento18 páginasHipertek Catalogo 11-FINALEwerton Rodrigues AlvesAinda não há avaliações
- BS 01 Fibras Artificiais e Sintéticas - PDocumento13 páginasBS 01 Fibras Artificiais e Sintéticas - PMarcus ViniciusAinda não há avaliações
- 02 QS 0908Documento9 páginas02 QS 0908mauroqmcAinda não há avaliações
- Os Têxteis e A TECELAGEMDocumento24 páginasOs Têxteis e A TECELAGEMJanina SilvaAinda não há avaliações
- HexPro - Catalogo - Maio23LCF COSTADocumento44 páginasHexPro - Catalogo - Maio23LCF COSTAAgenildo Alves SoaresAinda não há avaliações
- PolímerosDocumento35 páginasPolímerosRenatoAinda não há avaliações
- Vestimentas MotosserristasDocumento5 páginasVestimentas MotosserristasEng.Químico SCAinda não há avaliações
- Cadeiras Suspensas em Cabo de Aço e CordaDocumento20 páginasCadeiras Suspensas em Cabo de Aço e CordaEdson De O. RamosAinda não há avaliações