100% acharam este documento útil (1 voto)
2K visualizações8 páginasPropriedades Quimicas Das Bases
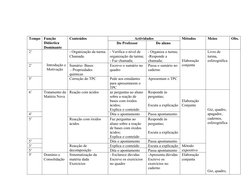
Este documento descreve uma lição sobre as propriedades químicas das bases, incluindo suas reações com ácidos e óxidos ácidos, bem como decomposição térmica. Exemplos de equações de reação são fornecidos e exercícios são dados para os alunos praticarem.
Enviado por
Albino José JoaquimDireitos autorais
© © All Rights Reserved
Levamos muito a sério os direitos de conteúdo. Se você suspeita que este conteúdo é seu, reivindique-o aqui.
Formatos disponíveis
Baixe no formato DOCX, PDF, TXT ou leia on-line no Scribd
100% acharam este documento útil (1 voto)
2K visualizações8 páginasPropriedades Quimicas Das Bases
Este documento descreve uma lição sobre as propriedades químicas das bases, incluindo suas reações com ácidos e óxidos ácidos, bem como decomposição térmica. Exemplos de equações de reação são fornecidos e exercícios são dados para os alunos praticarem.
Enviado por
Albino José JoaquimDireitos autorais
© © All Rights Reserved
Levamos muito a sério os direitos de conteúdo. Se você suspeita que este conteúdo é seu, reivindique-o aqui.
Formatos disponíveis
Baixe no formato DOCX, PDF, TXT ou leia on-line no Scribd