Escolar Documentos
Profissional Documentos
Cultura Documentos
FGB 2º Ano SD 1 Soluções 2 Parte
Enviado por
Gustavo Vermeule0 notas0% acharam este documento útil (0 voto)
7 visualizações7 páginasO documento discute coeficientes de solubilidade, curvas de solubilidade e como elas variam com a temperatura. Essas curvas caracterizam cada substância e indicam se soluções são saturadas, não saturadas ou supersaturadas. A solubilidade depende se a dissolução é endotérmica ou exotérmica.
Descrição original:
Crime
Título original
FGB 2º ano SD 1 Soluções 2ª parte (3)
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoO documento discute coeficientes de solubilidade, curvas de solubilidade e como elas variam com a temperatura. Essas curvas caracterizam cada substância e indicam se soluções são saturadas, não saturadas ou supersaturadas. A solubilidade depende se a dissolução é endotérmica ou exotérmica.
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
7 visualizações7 páginasFGB 2º Ano SD 1 Soluções 2 Parte
Enviado por
Gustavo VermeuleO documento discute coeficientes de solubilidade, curvas de solubilidade e como elas variam com a temperatura. Essas curvas caracterizam cada substância e indicam se soluções são saturadas, não saturadas ou supersaturadas. A solubilidade depende se a dissolução é endotérmica ou exotérmica.
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
Você está na página 1de 7
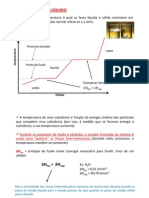
✓ O coeficiente de solubilidade (CS) é a quantidade máxima de uma substância
que se dissolve numa quantidade padrão de solvente em determinadas
condições de temperatura e pressão.
✓ As curvas de solubilidade são gráficos que apresentam a variação dos
coeficientes de solubilidade das substâncias em função da temperatura.
✓ Essas curvas são de grande importância prática, pois caracteriza cada
substância.
Duas substâncias podem ter a mesma solubilidade numa dada
temperatura, mas nunca terão a mesma curva de solubilidade.
✓ No gráfico nota-se que, a 20 °C, o
ponto X representa uma solução
não saturada (insaturada); Y, uma
solução saturada; Z, uma solução
supersaturada.
✓ Na prática, só poderemos usar as
soluções que estão “abaixo” da
curva de solubilidade, pois acima
dessa curva as soluções seriam
supersaturadas e, portanto, todo o
excesso do soluto tenderia a
precipitar.
✓ Solutos que possuem dissolução
endotérmica apresentam curvas
de solubilidade ascendentes, ou
seja, a solubilidade aumenta com
o aumento de temperatura.
✓ Solutos que possuem dissolução
exotérmica apresentam curvas
de solubilidade descendentes, ou
seja, a solubilidade diminui com o
aumento de temperatura.
✓ Certas substâncias apresentam curvas de solubilidade com mudanças bruscas
chamadas pontos de inflexão, indicando uma mudança da estrutura do soluto.
Lei de Henry
Em temperatura constante, a
solubilidade de um gás em um
líquido é diretamente proporcional
à pressão sobre o gás.
✓ Os gases são, em geral, pouco solúveis em líquidos.
✓ Aumentando-se a temperatura, a solubilidade do gás diminui.
ª
Você também pode gostar
- SOLUÇÕESDocumento21 páginasSOLUÇÕESliineesoouzaaAinda não há avaliações
- Alunos Material Complementar de Química - 2 A - Solubilidade - 4° BIMESTREDocumento13 páginasAlunos Material Complementar de Química - 2 A - Solubilidade - 4° BIMESTREMagnólia Viana SalgadoAinda não há avaliações
- Relatório Da Aula Prática Da Disciplina de Físico-Química Experimental Sobre Temperatura e Solubilidade.Documento7 páginasRelatório Da Aula Prática Da Disciplina de Físico-Química Experimental Sobre Temperatura e Solubilidade.Willka BezerraAinda não há avaliações
- SOLUÇÕESDocumento20 páginasSOLUÇÕESmarcellebrunamartelliAinda não há avaliações
- Material - SoluçõesDocumento2 páginasMaterial - SoluçõesMatheus HenriqueAinda não há avaliações
- Quimica 18Documento29 páginasQuimica 18ascatanho100% (1)
- Aula 2 - SoluçõesDocumento9 páginasAula 2 - Soluçõesluciano.moncao2007Ainda não há avaliações
- Química - Pré-Vestibular Impacto - SolubilidadeDocumento2 páginasQuímica - Pré-Vestibular Impacto - SolubilidadeQuímica Qui80% (5)
- Misturas e Soluções-Texto ComplementarDocumento6 páginasMisturas e Soluções-Texto ComplementarcaoAinda não há avaliações
- Memorex Quimica - Solucoes IDocumento1 páginaMemorex Quimica - Solucoes Icon_seguirAinda não há avaliações
- SoluçõesDocumento5 páginasSoluçõesThiago DiosAinda não há avaliações
- ESTUDO DAS SOLUÇÕES - Slide 2º AnoDocumento19 páginasESTUDO DAS SOLUÇÕES - Slide 2º AnoAlberio Rocha100% (1)
- VOD Química SolubilidadeDocumento13 páginasVOD Química SolubilidadeSr. Van Hastra do CarmoAinda não há avaliações
- Aula de Química Básica-SoluçõesDocumento11 páginasAula de Química Básica-SoluçõesHellen PatriciaAinda não há avaliações
- Dispersões: É Um Processo de Mistura de Substâncias, No Qual Classificamos Como: Homogêneas Ou HeterogêneasDocumento12 páginasDispersões: É Um Processo de Mistura de Substâncias, No Qual Classificamos Como: Homogêneas Ou HeterogêneasbarbypratesAinda não há avaliações
- Soluções - Parte 1 - Classificação de SoluçõesDocumento2 páginasSoluções - Parte 1 - Classificação de SoluçõesLyeniferAinda não há avaliações
- QUMICADocumento2 páginasQUMICAGuilherme MartinsAinda não há avaliações
- Aula Experimental Coeficiente de SolubilidadeDocumento2 páginasAula Experimental Coeficiente de SolubilidadeAstronáuta AstroAinda não há avaliações
- Soluções Químicas ÉDocumento3 páginasSoluções Químicas ÉSAMIR SANTOSAinda não há avaliações
- Aula03-BasesAnalíticas AlunosDocumento27 páginasAula03-BasesAnalíticas AlunosbernardoAinda não há avaliações
- Resumo Sobre SoluçõesDocumento19 páginasResumo Sobre SoluçõesFabíola FelixAinda não há avaliações
- Adolf Quimica 1Documento11 páginasAdolf Quimica 1MustaquimAinda não há avaliações
- Aula 1 - FQ - FISICO QUÍMICA Parte IDocumento16 páginasAula 1 - FQ - FISICO QUÍMICA Parte IjmessiasbrtAinda não há avaliações
- Quimica Aula 9Documento12 páginasQuimica Aula 9Martinõ MarcellAinda não há avaliações
- Módulo II - Reações Químicas em Solução AquosaDocumento13 páginasMódulo II - Reações Químicas em Solução AquosaELMAR JUNIORAinda não há avaliações
- INTRODUÇÃO AquosaDocumento8 páginasINTRODUÇÃO AquosaMauro ErnestoAinda não há avaliações
- Dissolução de Sais e de Gases Da Atmosfera Na ÁguaDocumento3 páginasDissolução de Sais e de Gases Da Atmosfera Na Águavieiramaria2006Ainda não há avaliações
- Erick Leal Dos Santos Souza - NOTAS de AULA 1 Soluções 5 UnidadeDocumento6 páginasErick Leal Dos Santos Souza - NOTAS de AULA 1 Soluções 5 UnidadeNyxAinda não há avaliações
- Resumo 02 FQDocumento3 páginasResumo 02 FQAlexandre MagnoAinda não há avaliações
- Matriz - SolubilidadeDocumento3 páginasMatriz - SolubilidadeEtiene Pereira de AndradeAinda não há avaliações
- Equilibrios Heterogéneos - ResumoDocumento7 páginasEquilibrios Heterogéneos - ResumoLaura MonteiroAinda não há avaliações
- Soluções PDFDocumento14 páginasSoluções PDFMario SantanaAinda não há avaliações
- Apostila Físico-Química1Documento29 páginasApostila Físico-Química1Diego E MarinaAinda não há avaliações
- 02 Quimica Aula 22 04Documento6 páginas02 Quimica Aula 22 04juliocezarfranciscomartinsinfaAinda não há avaliações
- Aula 6 - SoluesDocumento40 páginasAula 6 - Soluesryan ferreiraAinda não há avaliações
- 01 - SoluçõesDocumento5 páginas01 - SoluçõesJaque SoaresAinda não há avaliações
- 2 AnoDocumento32 páginas2 Anoestrela_black_02Ainda não há avaliações
- Exercício - SolubilidadeDocumento2 páginasExercício - SolubilidadeJoão PauloAinda não há avaliações
- Prática I CriosDocumento3 páginasPrática I CriosBreno MacielAinda não há avaliações
- Solution OdpDocumento57 páginasSolution OdpAntonio Da Costa FreireAinda não há avaliações
- SoluesDocumento12 páginasSoluesMarceloCardosoAinda não há avaliações
- Aprovar Ano05 Livro16 005Documento1 páginaAprovar Ano05 Livro16 005Aprovar UEA ApostilasAinda não há avaliações
- Relatório de Verificação Do Efeito Da Temperatura Na Solubilidade Do Nitrato de Potássio em ÁguaDocumento6 páginasRelatório de Verificação Do Efeito Da Temperatura Na Solubilidade Do Nitrato de Potássio em ÁguaAquilasAinda não há avaliações
- Apostila Quimica2Documento33 páginasApostila Quimica2resolvidos0% (1)
- Aula 10 - Misturas Simples - 18 10 2021Documento26 páginasAula 10 - Misturas Simples - 18 10 2021Leandro FortunatoAinda não há avaliações
- Pré-Lab 2 - CriosDocumento4 páginasPré-Lab 2 - CriosMayconAinda não há avaliações
- 1 SoluçõesDocumento24 páginas1 SoluçõesProf. Anderson OliveiraAinda não há avaliações
- Aula04 QA SoluçõesDocumento27 páginasAula04 QA SoluçõesIzabelli de Castro BaptistaAinda não há avaliações
- Aula04 - Substância PuraDocumento21 páginasAula04 - Substância PuraIsaque Julião ChagasAinda não há avaliações
- BALC - Aula 5 - Soluções e DisperssõesDocumento16 páginasBALC - Aula 5 - Soluções e DisperssõesBruna CostaAinda não há avaliações
- A Solução Ideal e Propriedades - EARTDocumento15 páginasA Solução Ideal e Propriedades - EARTLucas LiraAinda não há avaliações
- SoluçõesDocumento24 páginasSoluçõesGabriel CamposAinda não há avaliações
- Trabalho de QuimicaDocumento5 páginasTrabalho de Quimicamaycon riosAinda não há avaliações
- Química Lista 02 - Propriedades ColigativasDocumento14 páginasQuímica Lista 02 - Propriedades ColigativasHugo CimehrioAinda não há avaliações
- Slides Sobre Dissertação e Projeto de Texto (7) YttreetgDocumento32 páginasSlides Sobre Dissertação e Projeto de Texto (7) YttreetgGustavo VermeuleAinda não há avaliações
- 2º Ano M MATEMÁTICA Ativ. 08 MatrizesDocumento10 páginas2º Ano M MATEMÁTICA Ativ. 08 MatrizesGustavo VermeuleAinda não há avaliações
- Exercícios de Apoio 1 - História Da Biologia e Método CientíficoDocumento1 páginaExercícios de Apoio 1 - História Da Biologia e Método CientíficoGustavo VermeuleAinda não há avaliações
- Exercícios de Apoio 03 - Composição Química Dos Seres VivosDocumento1 páginaExercícios de Apoio 03 - Composição Química Dos Seres VivosGustavo VermeuleAinda não há avaliações
- Dissertação Aula 1 Do 1º Ano E.M SLIDESDocumento6 páginasDissertação Aula 1 Do 1º Ano E.M SLIDESGustavo VermeuleAinda não há avaliações
- Aula em PDF Sobre Vírus e Doenças Virais PDFDocumento78 páginasAula em PDF Sobre Vírus e Doenças Virais PDFGustavo VermeuleAinda não há avaliações
- Aula PDF Sobre Classificação Biológica e Regras de NomenclaturaDocumento64 páginasAula PDF Sobre Classificação Biológica e Regras de NomenclaturaGustavo VermeuleAinda não há avaliações
- Sem Título6ureDocumento2 páginasSem Título6ureGustavo VermeuleAinda não há avaliações
- Gabarito Lista1 PA PDFDocumento1 páginaGabarito Lista1 PA PDFGustavo VermeuleAinda não há avaliações
- 1 - Revoluções Inglesas (1640-1688) - PDFDocumento12 páginas1 - Revoluções Inglesas (1640-1688) - PDFGustavo VermeuleAinda não há avaliações
- PLATÃO Historia Da Filosofia Volume 1 Giovanni Reale Dario Antiseri PDFDocumento28 páginasPLATÃO Historia Da Filosofia Volume 1 Giovanni Reale Dario Antiseri PDFGustavo VermeuleAinda não há avaliações
- Lista 3 - MatrizDocumento2 páginasLista 3 - MatrizGustavo VermeuleAinda não há avaliações
- Platão PDFDocumento18 páginasPlatão PDFGustavo VermeuleAinda não há avaliações