Escolar Documentos
Profissional Documentos
Cultura Documentos
Principio de Le Chatelier (Síntese Industrial Do NH3)
Enviado por
Rman03 MKGTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Principio de Le Chatelier (Síntese Industrial Do NH3)
Enviado por
Rman03 MKGDireitos autorais:
Formatos disponíveis
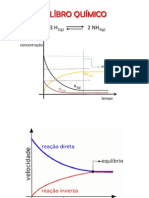
EQUILÍBRIO QUÍMICO: Princípio de Le Châtelier [CDDS QUÍMICA 11º ANO]
Síntese industrial do amoníaco, NH3
exo
3 H2 (g) + N2 (g) ⇌ 2 NH3 (g) ; ΔH < 0
endo
As condições experimentais, usadas no processo industrial para a síntese do amoníaco, são:
• Aumento da concentração de N2 no sistema (reagente mais barato)
→ favorece a reação direta, de acordo com o Princípio de Le Châtelier
→ aumenta a concentração de NH3
→ aumenta o rendimento da reação
• Diminuição da concentração de NH3 no sistema (recolha do produto)
→ favorece a reação direta, de acordo com o Princípio de Le Châtelier
→ aumenta o rendimento da reação
• Pressão do sistema elevada (20 MPa)
→ favorece a reação direta (diminuição da quantidade de gases), de acordo com o Princípio de Le
Châtelier
→ aumenta a concentração de NH3
→ aumenta o rendimento da reação
• Temperaturas elevadas (T = 450 °C)
Dado que a reação de síntese do NH3 é exotérmica, esta é favorecida a baixas temperaturas. No
entanto, a baixas temperaturas a reação é muito lenta. Assim, a síntese é conduzida a
temperatura elevada para aumentar a velocidade da reação.
• Adição de catalisador
A adição da catalisadores ao sistema reacional em equilíbrio, não afeta/altera o equilíbrio, mas
caso seja adicionado ao sistema inicial, apenas contribui para que o equilíbrio seja atingido mais
rapidamente. O rendimento da reação também não é alterado quando se adiciona um catalisador,
o que acontece é que se consegue o mesmo rendimento, mas em menos tempo.
Reação de síntese do amoníaco, NH3
3 H2 (g) + N2 (g) ⇌ 2 NH3 (g) ; ΔH < 0
Gráfico do valor de Kc em função da temperatura, T, para a reação de síntese do NH3:
NH 2
Kc = 3 e
H N
2
3
e 2 e
Colégio de Dom Diogo de Sousa Página 1 de 2
Reação de síntese do amoníaco, NH3
Aprendizagens do 10º ano
3 H2 (g) + N2 (g) ⇌ 2 NH3 (g) ; ΔH < 0
Reação exotérmica
Ocorre libertação de energia (balanço energético global)
Diagrama de energia
Variação de entalpia de uma reação, ΔH
ΔH corresponde a um balanço energético global calculado a partir da energia absorvida na rutura das
ligações nas moléculas de reagentes e da energia libertada na formação das novas ligações que se
estabelecem aquando da formação dos produtos da reação.
ΔH = E absorvida na rutura das ligações nos REAGENTES – E libertada na formação das novas ligações nos PRODUTOS
ΔH = 3 × EH-H + 1 × EN≡N - 6 × EN-H
ΔH = - 92 kJ ou ΔH = - 92 kJ mol-1
Significa que, são libertados 92 kJ de energia, por calor, por cada 3 mol de H2 e 1 mol de N2 que reagem e por
cada 2 mol de NH3 que se formam.
Se ∆H ˂ 0 então:
E absorvida – E libertada ˂ 0 e por isso E absorvida ˂ E libertada
Na reação de síntese do amoníaco, a energia absorvida na rutura das ligações nos reagentes é inferior à
energia libertada na formação das novas ligações aquando da formação dos produtos da reação.
Colégio de Dom Diogo de Sousa Página 2 de 2
Você também pode gostar
- Portfolio 1 Preparação Física Geral Eviston RA 8067565Documento8 páginasPortfolio 1 Preparação Física Geral Eviston RA 8067565SilveMasterAinda não há avaliações
- Psicofisiologia - Mariana Peixoto VianaDocumento145 páginasPsicofisiologia - Mariana Peixoto VianaCamila Beppler67% (3)
- FISIOLOGIADocumento94 páginasFISIOLOGIAThayanie Oliveira Pereira100% (2)
- Cinetica QuimicaDocumento25 páginasCinetica QuimicaSaulo Luis CapimAinda não há avaliações
- 22 - Termoquimica Resumo para o DecisãoDocumento5 páginas22 - Termoquimica Resumo para o DecisãoKarolinny GomesAinda não há avaliações
- 6 ConstanteEquilibrioDocumento20 páginas6 ConstanteEquilibrioRute FidalgoAinda não há avaliações
- Enunciado ExemplosDocumento32 páginasEnunciado ExemplosGleison Alexandre Rufino dos SantosAinda não há avaliações
- Ae q11 Fich Form 1Documento5 páginasAe q11 Fich Form 1carla50% (2)
- Equilibrio Quimico CompletoDocumento56 páginasEquilibrio Quimico CompletoEvisson de S. TavaresAinda não há avaliações
- 40-Cálculos de EquilíbrioDocumento4 páginas40-Cálculos de Equilíbrionv77vnmAinda não há avaliações
- 6 - Equilíbrio Químico - Química Geral - 2011Documento36 páginas6 - Equilíbrio Químico - Química Geral - 2011jwpsAinda não há avaliações
- Quimica - 002 TermoquimicaDocumento6 páginasQuimica - 002 Termoquimicacon_seguirAinda não há avaliações
- 11FQA Ficha Trab Ini Q1.2 - N.º 2Documento4 páginas11FQA Ficha Trab Ini Q1.2 - N.º 2carlosAinda não há avaliações
- Capitulo 8 Termoquimica PDFDocumento13 páginasCapitulo 8 Termoquimica PDFDenis AlmAinda não há avaliações
- Questões Objetivas CinéticaDocumento10 páginasQuestões Objetivas CinéticaMônica Cecato100% (1)
- Velocidade Das Reações - ÍtaloDocumento8 páginasVelocidade Das Reações - ÍtaloItalo PiresAinda não há avaliações
- Turmadeagosto Química Termoquímica 07 10 2022Documento19 páginasTurmadeagosto Química Termoquímica 07 10 2022Sr. Van Hastra do CarmoAinda não há avaliações
- FQ - Equilíbrio Químico - Revisão 2019Documento21 páginasFQ - Equilíbrio Químico - Revisão 2019Caio LimmaAinda não há avaliações
- Aula 2 AnaliticaDocumento110 páginasAula 2 Analiticamarcieli karina rodriguesAinda não há avaliações
- Equilíbrio QuímicoDocumento7 páginasEquilíbrio QuímicoVânia Maria SantosAinda não há avaliações
- FIcha - Equlibrio Quimico-2Documento3 páginasFIcha - Equlibrio Quimico-2Alda Maria Dinis Ginja100% (1)
- 22 TermoquimicaDocumento5 páginas22 TermoquimicaLuma MagnagoAinda não há avaliações
- Aula 4 - TermoquímicaDocumento38 páginasAula 4 - TermoquímicaPEDIGOTO ffAinda não há avaliações
- Equilíbrio QuímicoDocumento2 páginasEquilíbrio QuímicoGerson SilvaAinda não há avaliações
- 2305154041termoquimica - Prof. David LunaDocumento36 páginas2305154041termoquimica - Prof. David LunamellaoAinda não há avaliações
- 11FQA Ficha Trab Ini Q1.2 - N.º 2Documento4 páginas11FQA Ficha Trab Ini Q1.2 - N.º 2Andrei GalanAinda não há avaliações
- Cálculo EstequiométricoDocumento21 páginasCálculo EstequiométricoMauro PioAinda não há avaliações
- MATERIAL de APOIO - Química - Físico-Química - João VictorDocumento123 páginasMATERIAL de APOIO - Química - Físico-Química - João Victorgustavoluisf10Ainda não há avaliações
- Aula 6 (Termoquímica) - Físico-Química PDFDocumento27 páginasAula 6 (Termoquímica) - Físico-Química PDFlourencojrAinda não há avaliações
- Quimica 11º AnoDocumento32 páginasQuimica 11º Anocriartecentro0% (1)
- 1a FichaDocumento4 páginas1a FichaAlexandre DiazAinda não há avaliações
- Ficha 2 - Equilíbrio QuímicoDocumento5 páginasFicha 2 - Equilíbrio QuímicoBeatriz AmorimAinda não há avaliações
- LISTA 6 - @casalquimica - TERMOQUIMICADocumento9 páginasLISTA 6 - @casalquimica - TERMOQUIMICAAlice AlmeidaAinda não há avaliações
- Quimica 11 AnoDocumento34 páginasQuimica 11 AnoRosa GasparAinda não há avaliações
- Equilíbrio Químico-Lq2Documento49 páginasEquilíbrio Químico-Lq2Pedro H. FassarellaAinda não há avaliações
- Exercícios Das Aulas 23, 24, 25 e 26Documento6 páginasExercícios Das Aulas 23, 24, 25 e 26hanaAinda não há avaliações
- Termoquc 3 AdmicaDocumento30 páginasTermoquc 3 AdmicaEricson SousaAinda não há avaliações
- Lista de Exercc3adcios 3c2ba ColegialDocumento8 páginasLista de Exercc3adcios 3c2ba ColegialLuana CuccaroloAinda não há avaliações
- Termoquimica 1Documento22 páginasTermoquimica 1Leila RodriguesAinda não há avaliações
- 5 - Termoquimica - AlunoDocumento43 páginas5 - Termoquimica - AlunoQuimica Mais FrancisAinda não há avaliações
- Ficha de Trabalho 7 - Aspetos Quantitativos Das RQ e Equilíbrio Químico e Extensão Das RQDocumento4 páginasFicha de Trabalho 7 - Aspetos Quantitativos Das RQ e Equilíbrio Químico e Extensão Das RQFranciscaAinda não há avaliações
- 135Documento4 páginas135mailas33Ainda não há avaliações
- Ficha de Trabalho Global - EquilíbrioDocumento2 páginasFicha de Trabalho Global - EquilíbrioDiogo NunesAinda não há avaliações
- Prova de Quimica, Do CSGG.Documento4 páginasProva de Quimica, Do CSGG.sebottendorfAinda não há avaliações
- TERMOQUÍMICA - 2 Ano E. MédioDocumento5 páginasTERMOQUÍMICA - 2 Ano E. Médiomariabela.bb17Ainda não há avaliações
- 5 - Equilíbrio QuímicoDocumento40 páginas5 - Equilíbrio QuímicoAdemir PereiraAinda não há avaliações
- Equilíbrio QuímicoDocumento17 páginasEquilíbrio QuímicojulioAinda não há avaliações
- Exercicio de Revisao Termoquimica - 2311Documento3 páginasExercicio de Revisao Termoquimica - 2311Guaracyara Ribas AugustoAinda não há avaliações
- EXERCICIOS CINÉTICA EQUIL Isct 12 CLASSE PDFDocumento5 páginasEXERCICIOS CINÉTICA EQUIL Isct 12 CLASSE PDFKeila Jessica SamsonAinda não há avaliações
- Quimica Geral II - Aula2 - 2Documento19 páginasQuimica Geral II - Aula2 - 2Fellipe EloyAinda não há avaliações
- Equi Lib Rio CompletoDocumento50 páginasEqui Lib Rio CompletoLeonardo JunglesAinda não há avaliações
- Teste 4 v1Documento5 páginasTeste 4 v1André MatosAinda não há avaliações
- Equilibrio QuimicoDocumento32 páginasEquilibrio Quimicoelizael01020305Ainda não há avaliações
- Teste 1 (2019) - QuímicaDocumento6 páginasTeste 1 (2019) - QuímicaLuis VarelaAinda não há avaliações
- FCMMG 2007 Resumo Prova Medicina e GabaritoDocumento74 páginasFCMMG 2007 Resumo Prova Medicina e GabaritoNovo BeagaAinda não há avaliações
- Ae q11 Fich Form 1Documento6 páginasAe q11 Fich Form 1sandraimartins0% (1)
- 3 Balancos Energeticos Parte 3Documento6 páginas3 Balancos Energeticos Parte 3Julia CellaAinda não há avaliações
- Apostila Química Orgânica: Carbono, Dienos E AromáticosNo EverandApostila Química Orgânica: Carbono, Dienos E AromáticosAinda não há avaliações
- Tratamento de Lodos de Estações de Tratamento de ÁguaNo EverandTratamento de Lodos de Estações de Tratamento de ÁguaAinda não há avaliações
- Reação Reversível e Estado de EquilíbrioDocumento2 páginasReação Reversível e Estado de EquilíbrioRman03 MKGAinda não há avaliações
- Constante de EquilíbrioDocumento2 páginasConstante de EquilíbrioRman03 MKGAinda não há avaliações
- PH e Escala de PHDocumento2 páginasPH e Escala de PHRman03 MKGAinda não há avaliações
- Conceito Ácido e BaseDocumento2 páginasConceito Ácido e BaseRman03 MKGAinda não há avaliações
- B.1.1 - Ficha de Trabalho - Níveis Estruturais Do Corpo Humano PDFDocumento4 páginasB.1.1 - Ficha de Trabalho - Níveis Estruturais Do Corpo Humano PDFAida Almeida CunhaAinda não há avaliações
- Introduçao A Fisiologia e Homeostasia 1Documento44 páginasIntroduçao A Fisiologia e Homeostasia 1Cristiano LimaAinda não há avaliações
- AulaInicial ContratoPedagógico 2022.2 MoocaMatutinoDocumento36 páginasAulaInicial ContratoPedagógico 2022.2 MoocaMatutinoGabriel DornelasAinda não há avaliações
- Pragmática Da Comunicação HumanaDocumento140 páginasPragmática Da Comunicação HumanaPedro Gontijo Xavante Bororo50% (2)
- UntitledDocumento1 páginaUntitledAna Carolina Machado SoaresAinda não há avaliações
- Teoria Das Necessidades Humanas BásicasDocumento5 páginasTeoria Das Necessidades Humanas BásicasMD VendasAinda não há avaliações
- 01 Visao GlobalDocumento7 páginas01 Visao GlobalDaniela ChucreAinda não há avaliações
- Medicina Vibracional, Uma Medicina para O Futuro - Richard GerberDocumento884 páginasMedicina Vibracional, Uma Medicina para O Futuro - Richard GerberMarcelo Squier100% (1)
- Ficha de Avaliação Nº1 - 20 - 21Documento5 páginasFicha de Avaliação Nº1 - 20 - 21Isabel CarneiroAinda não há avaliações
- Resposta Ao Estresse - Homeostase e Teoria Da AlostaseDocumento5 páginasResposta Ao Estresse - Homeostase e Teoria Da AlostaseDuana GalanteAinda não há avaliações
- Mappa Uc4 CNT 15Documento116 páginasMappa Uc4 CNT 15Marcos VasconcelosAinda não há avaliações
- Biologia e Geologia - 10º Ano - Regulação Nos Seres VivosDocumento72 páginasBiologia e Geologia - 10º Ano - Regulação Nos Seres VivosHugo Martins100% (7)
- Novo Amanhecer-Novos CaminhosDocumento149 páginasNovo Amanhecer-Novos CaminhosEduardo B. AraujoAinda não há avaliações
- Fisiologia Humana Aula 02Documento19 páginasFisiologia Humana Aula 02Gerardo Marcílio Pinto LimaAinda não há avaliações
- Organização e Controle Do Corpo HumanoDocumento27 páginasOrganização e Controle Do Corpo HumanoMarta AlvesAinda não há avaliações
- Resumo: Teorias de EnfermagemDocumento2 páginasResumo: Teorias de EnfermagemFlavioEllert78% (18)
- Fisiologia Do Exercício Físico: Trabalho Realizado Por: Diogo Marchão, Nilton Veloso, JoãoDocumento15 páginasFisiologia Do Exercício Físico: Trabalho Realizado Por: Diogo Marchão, Nilton Veloso, JoãoDiogo MarchãoAinda não há avaliações
- Medicina Alternativa No Diagnostico e Tratamento de Enfermidades Dos CaesDocumento46 páginasMedicina Alternativa No Diagnostico e Tratamento de Enfermidades Dos CaesPedroLesnecAinda não há avaliações
- I Organizações Como Sistemas AbertosDocumento15 páginasI Organizações Como Sistemas AbertosVitor BorgesAinda não há avaliações
- Ecologia Geral e UrbanaDocumento300 páginasEcologia Geral e UrbanaThiago Laurindo 2Ainda não há avaliações
- Eduardo Romanzini - Métodos Avançados de Treinamento para HipertrofiaDocumento41 páginasEduardo Romanzini - Métodos Avançados de Treinamento para HipertrofiaJosé Felipe Macedo100% (1)
- Hist Da Fisiol Da Antig Ao Séc XxiDocumento26 páginasHist Da Fisiol Da Antig Ao Séc XxiVitoria OliveiraAinda não há avaliações
- 5 Reposição de Aula, Data 31-10Documento3 páginas5 Reposição de Aula, Data 31-10Adri AnnaAinda não há avaliações
- Aviacao Estresse Saude ProfissionaisDocumento55 páginasAviacao Estresse Saude ProfissionaisLeomar BritoAinda não há avaliações
- TSI - Aula 5 (Pt.2)Documento17 páginasTSI - Aula 5 (Pt.2)teste 123Ainda não há avaliações
- Aula 5 - Transformação Do Músculo em CarneDocumento24 páginasAula 5 - Transformação Do Músculo em CarneLuana MacêdoAinda não há avaliações
- Osmorregulação em Meio Aquático (11.jun.13)Documento22 páginasOsmorregulação em Meio Aquático (11.jun.13)Sara GonçalvesAinda não há avaliações