Escolar Documentos
Profissional Documentos
Cultura Documentos
Electroquimia
Enviado por
Carla Grosso0 notas0% acharam este documento útil (0 voto)
11 visualizações14 páginasTrabalho sobre eletroquímica
Título original
Electroquimia (2)
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
PPTX, PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoTrabalho sobre eletroquímica
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PPTX, PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
11 visualizações14 páginasElectroquimia
Enviado por
Carla GrossoTrabalho sobre eletroquímica
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PPTX, PDF, TXT ou leia online no Scribd
Você está na página 1de 14
UFCD 7O41 Química analítica
ELETROQUÍMICA
A eletroquímica é a parte da ciência que trata da relação entre
correntes elétricas e reações químicas e da transformação de
energia química em elétrica e vice-versa.
A eletroquímica é estudo das reações químicas que produzem
efeitos elétricos e do fenómeno químico causado pela ação de
correntes elétricas..
A energia elétrica é uma forma de energia baseada na geração de
diferença de potencial elétrico entre dois pontos que permitem
estabelecer uma corrente elétrica entre ambos.
ENERGIA ELÉTRICA
• Energia elétrica é uma forma de energia gerada através
de uma diferença de potencial elétrico. Define a
capacidade de trabalho de uma corrente elétrica,
conhecida como eletricidade
• Energia elétrica é a principal fonte de energia em todo o
mundo. É produzida através da diferença de potencial
elétrico entre dois pontos de um condutor, o que permite
a geração das correntes elétricas. A energia elétrica não
pode ser encontrada naturalmente. Por isso é preciso
extraí-la de outras fontes de energia, como a eólica, a
solar, a nuclear, a hidráulica ou a térmica.
A ENERGIA ELÉTRICA.
NOSSO COTIDIANO
• Eletroquímica está presente na nossa vida mais do imagina. Basta
olhar para o relógio de parede, celulares, computadores e para seu
próprio automóvel e lá está ela.
• A eletroquímica encontra-se disponível em pilhas, baterias, enfim, em
todos estes dispositivos que dão vida a tantos utensílios que usamos
em casa, no trabalho e nas horas de lazer. Eletroquímica presente:
• Na medicina - no marca-passo, por pacientes com problemas
cardíacos.
• Na Indústria - a galvanoplastia - processo usado para cromar peças de
automóveis (para-choques, por exemplo) e fabricação de semijoias.
• Em casa - brinquedos infantis, lanternas, controles de TVs, portões e
etc.
PILHAS E BATERIA
• São dispositivos em que ocorre uma
reação de oxidorredução que produz
corrente elétrica. Isso significa que há
uma conversão de energia química em
energia elétrica. Esse processo é
espontâneo.
ELECTROLICE
• A eletrólise é o processo inverso das pilhas e
baterias, isto é, uma corrente elétrica gera uma
reação química de oxidorredução. A eletrólise é um
processo não espontâneo que transforma energia
elétrica em energia química.
Existem dois tipos de eletrólises:
• * Eletrólise ígnea: é feita com ausência de água. A
corrente elétrica passa pela substância iônica na
fase líquida (fundida). Um exemplo é a eletrólise do
cloreto de sódio (sal de cozinha) fundido, que
produz o gás cloro e o sódio metálico.
ELETRÓLISE EM MEIO AQUOSO
• Eletrólise em meio aquoso: nesse caso temos íons
fornecidos pela substância dissolvida na água. Um
exemplo da utilização da eletrólise é no revestimento
de peças com metais que se oxidam mais facilmente
que o metal constituinte da peça, protegendo-o contra
a corrosão. O nome desse processo
é eletrodeposição e pode se dar de duas maneiras
principais: por eletrólise de purificação e também
por galvanoplastia.
• No exemplo abaixo, temos a cobreação de uma chave,
ou seja, por meio da eletrólise de uma solução aquosa
de sulfato de cobre, a chave será revestida de cobre:
PILHA ALCALINA E PILHA ALCALINA SECA
Composição: Pilha alcolina composta por uma mistura
eletrolítica: pasta básica de NaOH a pilha seca comum
contém cloreto de amônio NH4Cl e recebe a classificação
de ácida.
Aplicação: pilha seca é usada para produzir correntes
pequenas em serviços contínuos, indicada para rádios
portáteis, telefones, campainhas, lanternas, serviços de
sinalização, etc. A pilha alcalina para equipamentos que
requerem descargas de energia rápidas e fortes, como
brinquedos, câmeras fotográficas digitais, MP3 players,
etc.
Durabilidade: as pilhas alcalinas duram cerca de cinco
vezes mais que as ácidas.
BATERIA DE CHUMBO/ÁCIDO
• Trata-se de uma bateria que apresenta, no ânodo, o metal
chumbo, e, no cátodo, o dióxido de chumbo (PbO2), ambos
imersos em uma solução aquosa com ácido sulfúrico (H2SO4).
• No ânodo: o metal chumbo sofre oxidação (perde elétrons) e
interage com ânions sulfato (SO4-2, oriundos do ácido), formando
o sal sulfato de chumbo II:
• Pb + SO4-2 → PbSO4 + 2 e
• No cátodo: o dióxido de chumbo sofre redução e interage com os
íons H+ e SO4-2 do ácido, formando água e sulfato de chumbo II:
• PbO2 + 4H+ + SO4-2 → PbSO4 + 2H2O + 2 e
CELULA DE ZINCO E PRATA
• Considere o desenho que apresenta uma pilha
galvânica constituída de um cátodo de prata metálica e
de um ânodo de zinco metálico. As semi-reações de
oxidorredução que ocorrem na superfície dos eletrodos
são:
• I. Ag+ + e– → Ag
• II. Zn2+ + 2 e– → Zn
• III. Zn2+ + Ag+ + 3e– → Zn + Ag
• IV. Ag → Ag+ + e– V. Zn → Zn2+ + 2 e–
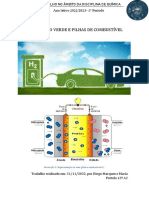
CÉLULA DE COMBUSTÍVEL
• É dispositivo que converte hidrogénio e oxigénio em
eletricidade através de uma reação eletroquímica.
• Ppossui dois elétrodos (o ânodo e o cátodo) e um eletrólito.
• Este dispositivo pode ser utilizado, por exemplo, em
veículos elétricos e híbridos, na geração estacionária em
indústrias e residências, e na geração portátil como
potência para telemóveis e computadores portáteis.
• Numa célula de combustível o hidrogénio atua como
combustível e o oxigénio, como agente oxidante.
CÉLULA DE COMBUSTÍVEL
• A célula de combustível não precisa de ser recarregada e capaz de
produzir energia desde que há o combustível.
• O hidrogénio é alimentado no ânodo e o oxigénio entra na através do
cátodo.
• Através da ação de um catalisador, os átomos de hidrogénio são
decompostos em prótons e elétrons, que seguem caminhos diferentes
para o cátodo.
• Os prótons são conduzidos através do eletrólito para o cátodo e os
elétrons criam uma corrente elétrica externa que é utilizada para a
geração de energia elétrica antes de regressar ao cátodo, na qual é
reunida com os íons positivos de hidrogénio e oxigénio que formam água
e calor.
CARROS MOVIDOS A HIDROGÉNIO
• No carro existe um conjunto de fuel cells (que formam a pilha de
combustível) montadas que juntam o hidrogénio presente no
tanque de abastecimento do carro e o oxigénio retirado do
exterior, originando uma reação química.
• Desta reação química resulta energia eléctrica, que por sua
vez alimenta o motor elétrico para assim mover o carro.
• Carros a hidrogénio são totalmente elétricos. Como tal, não
emitem qualquer tipo de gás poluente para a atmosfera. Além
desta característica, esta tecnologia tem uma particularidade
bastante interessante: ação purificadora.
• Ação purificadora : da reação entre o hidrogénio e o oxigénio
forma-se vapor de água. Este vapor de água é libertado para o
meio ambiente à medida que o carro circula.
Você também pode gostar
- Parte elétrica e dispositivos elétricos da NR 12: conceitos básicos e fundamentais para a compreensão da normaNo EverandParte elétrica e dispositivos elétricos da NR 12: conceitos básicos e fundamentais para a compreensão da normaNota: 5 de 5 estrelas5/5 (3)
- TQ Que Envolvem Energia ElétricaDocumento34 páginasTQ Que Envolvem Energia ElétricaEclipse 77Ainda não há avaliações
- Usinas hidrelétricas e centrais elétricas a diesel: exercícios práticos e comentadosNo EverandUsinas hidrelétricas e centrais elétricas a diesel: exercícios práticos e comentadosAinda não há avaliações
- Pilha e EletroliseDocumento10 páginasPilha e EletrolisethaynagmorenoAinda não há avaliações
- Eletroquímica e EletróliseDocumento10 páginasEletroquímica e EletróliseGustavo Nicolas nunes de camposAinda não há avaliações
- EletroquímicaDocumento7 páginasEletroquímicaDionísio AndréAinda não há avaliações
- EletroquímicaDocumento4 páginasEletroquímicaZiNAinda não há avaliações
- PilhasDocumento11 páginasPilhassamAinda não há avaliações
- Aula - Eletroquímica - EletróliseDocumento16 páginasAula - Eletroquímica - EletróliseAndré Mauricio de OliveiraAinda não há avaliações
- QuímicaDocumento16 páginasQuímicaAnna Clara Alves SáAinda não há avaliações
- Trabalho QuimicaDocumento7 páginasTrabalho QuimicaIsabelly SemanAinda não há avaliações
- Química: ÍgneaDocumento2 páginasQuímica: ÍgneajamesjorgezadaAinda não há avaliações
- Pilhas e BateriasDocumento15 páginasPilhas e Bateriasfloridamargarida10Ainda não há avaliações
- Introducción a la electroquímica: pilas, acumuladores y aplicaciones en medicinaDocumento6 páginasIntroducción a la electroquímica: pilas, acumuladores y aplicaciones en medicinaMonkeyCopy CorpAinda não há avaliações
- Eletroquímica: Transformações Químicas e EletricidadeDocumento10 páginasEletroquímica: Transformações Químicas e EletricidadeMÁRCIA PÁDUAAinda não há avaliações
- ELETROQUÍMICADocumento18 páginasELETROQUÍMICAFrank GuidioneAinda não há avaliações
- Dispositivos eletroquímicos: pilhas, baterias e células de combustívelDocumento8 páginasDispositivos eletroquímicos: pilhas, baterias e células de combustívelRafael AraujoAinda não há avaliações
- 27 - Eletroquímica - PilhasDocumento45 páginas27 - Eletroquímica - PilhasMarcelo Almeida SilvaAinda não há avaliações
- EletroquimicaDocumento25 páginasEletroquimicaMARCIA FERREIRA BINIAinda não há avaliações
- Pilha de Daniell: história, funcionamento e aplicaçõesDocumento3 páginasPilha de Daniell: história, funcionamento e aplicaçõesNatália FerreiraAinda não há avaliações
- Eletrólise de Soluções AquosasDocumento17 páginasEletrólise de Soluções AquosasVanessa RibeiroAinda não há avaliações
- Apostila 6 - Eletroqu MicaDocumento21 páginasApostila 6 - Eletroqu MicaPaulo SérgioAinda não há avaliações
- Eletroquímica SeminarioDocumento10 páginasEletroquímica SeminarioIB GetsêmaniAinda não há avaliações
- INTODUÇÃO Pilhas e AcumuladoresDocumento9 páginasINTODUÇÃO Pilhas e AcumuladoresMauro ErnestoAinda não há avaliações
- Trabalho de Quimica Valendo 30Documento63 páginasTrabalho de Quimica Valendo 30ISAAC EMANUEL BEZERRA FIRINOAinda não há avaliações
- Enem Lista de Exercícios Sobre Eletrólise - Brasil EscolaDocumento1 páginaEnem Lista de Exercícios Sobre Eletrólise - Brasil Escola54yqfjb7fkAinda não há avaliações
- Trabalho de Química 2023 Pilhas e BateriasDocumento9 páginasTrabalho de Química 2023 Pilhas e BateriasstuartgouveiaAinda não há avaliações
- 2a QuimicaDocumento19 páginas2a QuimicaPENHAAinda não há avaliações
- ACUM - CAP6a - Baterias Convencionais PDFDocumento61 páginasACUM - CAP6a - Baterias Convencionais PDFFelipe Weschenfelder GuimarãesAinda não há avaliações
- Escola Estadual Magalhães Carneiro e seu Plano de Estudos Tutorados de QuímicaDocumento59 páginasEscola Estadual Magalhães Carneiro e seu Plano de Estudos Tutorados de QuímicaAna Elisa Teixeira AlcobaAinda não há avaliações
- Tipos de Pilhas e suas Aplicações emDocumento20 páginasTipos de Pilhas e suas Aplicações emJoão TomásAinda não há avaliações
- Eletroquímica Mr. PaundeDocumento13 páginasEletroquímica Mr. PaundeSamuel VilanculoAinda não há avaliações
- Eletroquímica: Células, Eletrodeposição e OxirreduçãoDocumento52 páginasEletroquímica: Células, Eletrodeposição e OxirreduçãoRoger GimenesAinda não há avaliações
- Aplicacaocao Tecnica de Eletrolise 2_124028Documento17 páginasAplicacaocao Tecnica de Eletrolise 2_124028mensagensgenuinasAinda não há avaliações
- Eletrólise Ígnea - Processo de decomposição por corrente elétricaDocumento4 páginasEletrólise Ígnea - Processo de decomposição por corrente elétricaJulia DieringsAinda não há avaliações
- Trabalho de Química 2023 Pilhas e BateriasDocumento9 páginasTrabalho de Química 2023 Pilhas e BateriasstuartgouveiaAinda não há avaliações
- TesteDocumento7 páginasTesteMateus FrancoAinda não há avaliações
- Pré Relatório 6 FQDocumento14 páginasPré Relatório 6 FQGuilherme Bueno Pereira AfonsoAinda não há avaliações
- trabalho RutherfordDocumento9 páginastrabalho Rutherfordvn57704Ainda não há avaliações
- Pilhas e eletrólise: fundamentos e experiênciasDocumento11 páginasPilhas e eletrólise: fundamentos e experiênciasManuel José MathoiAinda não há avaliações
- Eletrólise - Processo e AplicaçõesDocumento12 páginasEletrólise - Processo e AplicaçõesNei SilvaAinda não há avaliações
- AulasDocumento12 páginasAulasigorAinda não há avaliações
- Relatório Química Experimental 8Documento9 páginasRelatório Química Experimental 8Geider MeloAinda não há avaliações
- Eletroquímica: conceitos básicos e aplicaçõesDocumento26 páginasEletroquímica: conceitos básicos e aplicaçõesAndré Mauricio de OliveiraAinda não há avaliações
- UFF Eletroquímica PráticaDocumento6 páginasUFF Eletroquímica Práticaelisa souzaAinda não há avaliações
- Atividades 2ºano Pilhas e EletroquímicaDocumento3 páginasAtividades 2ºano Pilhas e EletroquímicaRodrigo de Souza RochaAinda não há avaliações
- Eletrólise Do OuroDocumento10 páginasEletrólise Do OuroKlaus AntônioAinda não há avaliações
- @.cinética Química Eletroquímica e Introdução A Química Orgânica 2ºSEM 2023.2 AdilDocumento9 páginas@.cinética Química Eletroquímica e Introdução A Química Orgânica 2ºSEM 2023.2 AdilThiago Araujo SagaroAinda não há avaliações
- Relatório Pilhas e EletróliseDocumento13 páginasRelatório Pilhas e EletróliseNayara ArgoloAinda não há avaliações
- 26 E28093 Eletroquimica IIDocumento10 páginas26 E28093 Eletroquimica IIGabriel GomesAinda não há avaliações
- Pilha de LatinhaDocumento2 páginasPilha de LatinhaGabriel AraújoAinda não há avaliações
- Pilhas e EletróliseDocumento2 páginasPilhas e EletróliseIgor TeixeiraAinda não há avaliações
- Pilhas e Baterias e Formas de DescarteDocumento2 páginasPilhas e Baterias e Formas de DescarteBrenda DiasAinda não há avaliações
- Eletroquímica - Exercícios resolvidos sobre pilhas, baterias e células a combustívelDocumento6 páginasEletroquímica - Exercícios resolvidos sobre pilhas, baterias e células a combustívelKimberly LimaAinda não há avaliações
- Documento Sem NomeDocumento2 páginasDocumento Sem NomeMiguelito Gamer16Ainda não há avaliações
- Sistema de Eletrólise Na Indústria Do PetróleoDocumento15 páginasSistema de Eletrólise Na Indústria Do PetróleoSergio SachtAinda não há avaliações
- Pilha de LítioDocumento4 páginasPilha de Lítiok4rd050Ainda não há avaliações
- Pilhas e baterias: tipos e descarteDocumento15 páginasPilhas e baterias: tipos e descartekirlanianoAinda não há avaliações
- Pesquisa de QuímicaDocumento4 páginasPesquisa de QuímicaAna Laura Mendes SousaAinda não há avaliações
- 599 Lista Ime Ita Eletroquimica Rumo Ao Ita PDFDocumento9 páginas599 Lista Ime Ita Eletroquimica Rumo Ao Ita PDFNilo SanchezAinda não há avaliações
- Classificação de cadeias carbônicasDocumento9 páginasClassificação de cadeias carbônicascarineboniAinda não há avaliações
- 1º Ano QuimicaDocumento11 páginas1º Ano QuimicaFLAVIO MENEZESAinda não há avaliações
- Compostos Orgânicos, Hidridizacão e HidrocarbonetosDocumento85 páginasCompostos Orgânicos, Hidridizacão e HidrocarbonetosMessiasAinda não há avaliações
- Adalto Lourenço - A Diversidade Das AlgasDocumento109 páginasAdalto Lourenço - A Diversidade Das AlgasJose KiihlAinda não há avaliações
- Importância da água para as plantas e conceito de potencial hídricoDocumento13 páginasImportância da água para as plantas e conceito de potencial hídricoManuela LopesAinda não há avaliações
- Reações químicas inorgânicasDocumento12 páginasReações químicas inorgânicasPhellipe LimaAinda não há avaliações
- QuimicaDocumento10 páginasQuimicaDiogo MarquesAinda não há avaliações
- Tabela Detalhada Das Absorções Das Ligações em Moléculas OrgânicasDocumento3 páginasTabela Detalhada Das Absorções Das Ligações em Moléculas OrgânicasVinicius SilvaAinda não há avaliações
- Controle de qualidade em manutenção com reparos em tubulaçãoDocumento13 páginasControle de qualidade em manutenção com reparos em tubulaçãoMarcos PaivaAinda não há avaliações
- Douglas Traduzido - Capítulo 1Documento9 páginasDouglas Traduzido - Capítulo 1Sylvia LempekAinda não há avaliações
- Ficha de Segurança Gel DecapanteDocumento8 páginasFicha de Segurança Gel Decapanteevertonlmc33% (3)
- COMENTÁRIOS DA PROVA DE QUÍMICADocumento9 páginasCOMENTÁRIOS DA PROVA DE QUÍMICAquihuAinda não há avaliações
- 3ano 1bimestreDocumento44 páginas3ano 1bimestreClaudio JS Jr.Ainda não há avaliações
- Isomeria de Função e CadeiaDocumento35 páginasIsomeria de Função e CadeiaprigeraldoAinda não há avaliações
- FISPQ Formamida Perigos QuímicosDocumento8 páginasFISPQ Formamida Perigos QuímicosLuiz Rodrigues AlvesAinda não há avaliações
- Análise Das Classificações Relativas Ao Comportamento Ao Fogo Das Espumas Elastoméricas K-Flex ST - Rev VDocumento18 páginasAnálise Das Classificações Relativas Ao Comportamento Ao Fogo Das Espumas Elastoméricas K-Flex ST - Rev VAndre DickertAinda não há avaliações
- Introdução À Química OrgânicaDocumento26 páginasIntrodução À Química OrgânicaLucineia SilvaAinda não há avaliações
- Como Fazer Peróxido de AcetonaDocumento8 páginasComo Fazer Peróxido de AcetonaNuno de Almeida100% (8)
- Química Orgânica AvaliativaDocumento3 páginasQuímica Orgânica AvaliativaMouraci RibeiroAinda não há avaliações
- Evolução da matéria quintessenciada à consciência universalDocumento10 páginasEvolução da matéria quintessenciada à consciência universalLeonardo Lara RibeiroAinda não há avaliações
- Prova Subsequente Quimica-IfPEDocumento14 páginasProva Subsequente Quimica-IfPERobson GomesAinda não há avaliações
- 1 Aula 3 Ano - Introducao Aos Compostos de CarbonoDocumento5 páginas1 Aula 3 Ano - Introducao Aos Compostos de CarbonoArison SantosAinda não há avaliações
- 2 Exercicios QUIMICA 9 AnoDocumento2 páginas2 Exercicios QUIMICA 9 AnoRaquel alyne drumondAinda não há avaliações
- Lista GasesDocumento3 páginasLista Gasesmarta santosAinda não há avaliações
- Cálculo QuímicoDocumento20 páginasCálculo QuímicocarolinecpetilloAinda não há avaliações
- Termoquímica: TESTES e EXERCÍCIOSDocumento9 páginasTermoquímica: TESTES e EXERCÍCIOSAnderson Canesso SilvaAinda não há avaliações
- Classificação Periódica, Propriedades e Ligação QuímicaDocumento4 páginasClassificação Periódica, Propriedades e Ligação QuímicaThiago SáAinda não há avaliações
- Guia completo sobre escova progressivaDocumento9 páginasGuia completo sobre escova progressivaLívia FerreiraAinda não há avaliações
- KESHE Saúde Com Terapias Com GANSDocumento1 páginaKESHE Saúde Com Terapias Com GANSカルバリオエジソンAinda não há avaliações
- Treinamento cerebral: Compreendendo inteligência emocional, atenção e muito maisNo EverandTreinamento cerebral: Compreendendo inteligência emocional, atenção e muito maisNota: 4.5 de 5 estrelas4.5/5 (169)
- Biomecânica Básica dos Exercícios: Membros InferioresNo EverandBiomecânica Básica dos Exercícios: Membros InferioresNota: 3.5 de 5 estrelas3.5/5 (8)
- Inteligência artificial: O guia completo para iniciantes sobre o futuro da IANo EverandInteligência artificial: O guia completo para iniciantes sobre o futuro da IANota: 5 de 5 estrelas5/5 (6)
- 365 Ideias De Posts Para Ter Um Instagram De Sucesso!No Everand365 Ideias De Posts Para Ter Um Instagram De Sucesso!Ainda não há avaliações
- Inteligência artificial: Como aprendizado de máquina, robótica e automação moldaram nossa sociedadeNo EverandInteligência artificial: Como aprendizado de máquina, robótica e automação moldaram nossa sociedadeNota: 5 de 5 estrelas5/5 (3)
- Dieta Anti-inflamatória EstratégicaNo EverandDieta Anti-inflamatória EstratégicaNota: 5 de 5 estrelas5/5 (2)