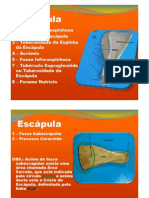
Escolar Documentos
Profissional Documentos
Cultura Documentos
Histologia e Embriologia
Enviado por
adrienerosceli100%(3)100% acharam este documento útil (3 votos)
29K visualizações45 páginasArquivo PDF com resumo sobre os principais tópicos da Histologia Básica
Direitos autorais
© Attribution Non-Commercial (BY-NC)
Formatos disponíveis
PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoArquivo PDF com resumo sobre os principais tópicos da Histologia Básica
Direitos autorais:
Attribution Non-Commercial (BY-NC)
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
100%(3)100% acharam este documento útil (3 votos)
29K visualizações45 páginasHistologia e Embriologia
Enviado por
adrienerosceliArquivo PDF com resumo sobre os principais tópicos da Histologia Básica
Direitos autorais:
Attribution Non-Commercial (BY-NC)
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
Você está na página 1de 45
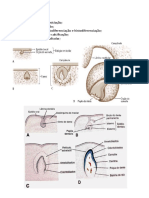
Embriologia
Capítulo 2 – Fecundação: iniciando um novo organismo
Fecundação é o processo no qual duas células sexuais se fundem para criar um
novo individuo com potencial genético derivado de ambos os pais. A fecundação
realiza, então, duas atividades independentes: sexual (combinação dos genes) e
reprodutiva (criação de novos organismos). Os principais eventos da fecundação são:
• Contato e reconhecimento entre espermatozóide e óvulo;
• Regulação da entrada do espermatozóide no óvulo;
• Fusão do material genético do óvulo e do espermatozóide;
• Ativação do metabolismo do óvulo para iniciar o desenvolvimento.
Estrutura dos gametas – Espermatozóide: Leeuwenhoek acreditava primeiro que os
espermatozóides eram parasitas que viviam no sêmen humano, depois pensou que eram
sementes e a mulher apenas forneciam o “solo”. Hartsoeker desenhou o “homunculus”,
porém essa crença de que o espermatozóide continha um embrião inteiro, nunca foi
muito aceita, pois implicava um enorme desperdício de vida em potencial. Spallazani
demonstrou que filtrado, o sêmen de rã sem espermatozóide, não fecundava os
óvulos(???). Prevost e Dumas descobriram que os espermatozóides não eram parasitas,
mas sim agentes ativos da fecundação (“existe uma íntima relação entre sua presença
nos órgãos e a capacidade fecundante do animal”). Eles propuseram que o
espermatozóide realmente entrava no óvulo e contribuía concretamente para a próxima
geração.
A. von Kolliker descreveu a formação do espermatozóide a partir de células
testiculares, desmentiu que havia algum contato físico entre o espermatozóide e o óvulo
e acreditava que o espermatozóide excitava o óvulo a se desenvolver. Hertwig e Fol
demonstraram a penetração do espermatozóide no óvulo e a união dos núcleos destas
células. Hertwig usou o ouriço-do-mar do mediterrâneo, não apenas por ser comum
nesta região ou por se apresentar sexualmente maduro uma boa parte do ano, mas
também pela grande quantidade de ovos disponíveis. Ele observou que apenas um
espermatozóide podia ser visto penetrando em cada óvulo e que todos os núcleos do
embrião eram derivados daqueles núcleos fundidos durante a fecundação. A fecundação
foi finalmente reconhecida como a união do espermatozóide com o óvulo. Cada
espermatozóide possui um núcleo haplóide, um sistema de propulsão para mover o
núcleo e um saco de enzimas que torna o núcleo apto a penetrar no óvulo. Durante o
processo de maturação o núcleo se torna aerodinâmico e seu DNA firmemente
comprimido. À frente está a vesícula acrossômica que é derivado do complexo de Golgi
e contém enzimas que digerem proteínas e açucares complexos e são usadas para digerir
os envoltórios ovulares.
A principal porção motora do flagelo é denominada AXONEMA, que é formado
por microtúbulos originados do centríolo localizado na base do núcleo do
espermatozóide. O centro do axonema é constituído por dois microtúbulos centrais
rodeados por uma fileira de nove duplas de microtúbulos e são constituídos de uma
proteína chamada tubulina. A dineína está ligada aos microtúbulos, ela pode hidrolizar
moléculas de ATP e converter a energia química em energia mecânica que impulsiona o
espermatozóide. A energia para mover o flagelo é proveniente dos anéis de mitocôndria
localizados na região da peça intermediaria do espermatozóide.
Óvulo: todo o material necessário para iniciar o crescimento e desenvolvimento
deve estar estocado no óvulo maduro. O espermatozóide elimina a maior parte do seu
citoplasma, o óvulo em desenvolvimento não só conserva o seu material como está
ativamente envolvido em acumular mais. Ele tanto sintetiza como absorve proteínas,
como o vitelo, por exemplo, que constitui reserva de alimento para o embrião em
desenvolvimento. Este rico citoplasma inclui:
• Proteínas: são suficientes até o embrião estar pronto pra se alimentar pos si só,
muitas destas proteínas do vitelo são produzidas pelos órgãos da mãe e
transportadas para o óvulo;
• Ribossomos e tRNA: há uma repentina síntese protéica logo após a fecundação
efetuada pelos ribossomos e tRNA que já existem no óvulo. O óvulo em
desenvolvimento tem mecanismos especiais para sintetizar ribossomos;
• RNA mensageiro: as mensagens para a síntese de proteínas, utilizadas durante o
inicio do desenvolvimento, já estão empacotadas no ovócito;
• Fatores morfogênicos: moléculas que dirigem a diferenciação das células em
determinados tipos celulares.
Sobre a membrana plasmática está o envoltório vitelínico. Esta membrana
glicoprotéica é essencial para a ligação espécie-específica do espermatozóide. Em
mamíferos o envoltório é bastante espesso, sendo chamado de zona pelúcida. O óvulo
de mamíferos está também rodeado por uma camada de células, as células do cumulus,
que representam as células foliculares ovarianas que nutrem o óvulo quando este deixa
o ovário. O espermatozóide deverá passar por estas células para fecundar o óvulo.
Abaixo da membrana plasmática há o córtex. O citoplasma dessa região é mais
gelatinoso por causa das altas concentrações de moléculas globulares de actina que
durante a fecundação polimerizam para formar longos fios de actina conhecidos como
microfilamentos. Presentes também no córtex estão os grânulos corticais que são
organelas derivadas do complexo de golgi que contêm enzimas proteolíticas,
mucopolissacarídeos e proteína hialina. As enzimas e os mucopolissacarídeos são ativos
na prevenção da entrada de outro espermatozóide no óvulo, depois que o primeiro tenha
entrado e moléculas de proteína hialina rodeiam o embrião jovem dando-lhe suporte
durante o estagio de clivagem dos blastômeros.
Reconhecimento entre espermatozóide e óvulo: na fecundação externa: (1) como
podem o espermatozóide e o óvulo se encontrarem em concentrações tão baixas?; (2)
que mecanismo impede o espermatozóide da estrela-do-mar de tentar fecundar o óvulo
do ouriço-do-mar?
Ovos secretam um fator quimiotático que atrai o espermatozóide e regulam
também o momento no qual esse fator será liberado (resacina). A fusão da vesícula
acrossômica é causada pela fusão, mediada pelo cálcio, da membrana acrossômica com
a membrana plasmática adjacente do espermatozóide. Além de causar a extensão do
processo acrossômico, este significante aumento do pH é também responsável pela
ativação da dineína ATPase, localizada no pescoço do espermatozóide. Esta ativação
causa uma rápida utilização do ATP e um aumento de 50% na respiração mitocondrial.
A geléia do ovo pode promover um reconhecimento do tipo espécie-específico em
algumas espécies mas não em outras. O processo acrossômico do espermatozóide
contata a camada externa do envoltório vitelínico do óvulo, esse é o principal passo do
reconhecimento espécie-específico e a proteína mediadora é a bindina. Bindinas de
espécies muito próximas são de fato diferentes. Esta descoberta implica na existência de
receptores espécie-específicos para bindina, no envoltório vitelínico.
Mamíferos – reconhecimento e ligação dos gametas – capacitação:
espermatozóides recém-ejaculados são incapazes de sofrer a reação acrossômica sem
que tenham permanecido por um certo tempo no trato reprodutivo feminino. Este pré-
requisito para capacitação varia de espécie para espécie e pode ser mimetizado in vitro.
Ligação primaria do espermatozóide à zona pelúcida: a camada mais externa é
composta pelas células do cummulus e sua matriz, rica em ácido hialurônico. Estas
células do cummulus são remanescentes das células da granulosa do folículo ovariano e
acompanham o óvulo durante a ovulação. Em algumas espécies as células do cummulus
não estão presentes no momento da fecundação, mas elas não constituem barreira para o
espermatozóide mesmo quando estão presentes. A especificidade da ligação do
espermatozóide à zona é relativa, mas não absolutame4nte espécie-específica (em
fecundações internas especificidade desse tipo não deveria ser um grande problema) e a
ligação do espermatozóide de camundongo à zona pelúcida de camundongo pode ser
inibida por uma incubação previa do espermatozóide com glicoproteínas da zona
pelúcida. ZP1 e ZP2 não competem pela ligação com o espermatozóide.
Um conjunto de proteínas no espermatozóide, capazes de reconhecer um
carboidrato especifico e regiões da proteína ZP3 da zona pelúcida do óvulo, parece ser a
hipótese mais provável para a ligação entre os gametas de mamíferos. Existem três
proteínas, no espermatozóide, que são capazes de se ligar à zona pelúcida. (1) proteína
que se liga aos resíduos de galactose da ZP3; (2) enzima presente na membrana celular
do espermatozóide; (3) protease.
Indução da reação acrossômica pela ZP3: a aglutinação dos receptores de
espermatozóides para ZP3 é necessária para a reação acrossômica. A ZP3 poderia
provocar uma liberação de íons cálcio dentro do espermatozóide. O receptor está
acoplado à proteína de ligação ao GTP (proteína- G) que é ativada quando o receptor se
liga ao seu sítio ativo específico. A proteína-G ativada, ativa uma enzima que quebra
um lipídio de membrana e é capaz de liberar íons cálcio ligados a compartimentos da
membrana. Tal proteína-G foi descoberta em espermatozóides de mamíferos e parece
ser ativada pela ligação com ZP3. Além disso, se a ativação da proteína-G é inibida, o
espermatozóide pode se ligar a ZP3, mas não sofre a reação acrossômica.
Ligação secundária do espermatozóide à zona pelúcida: a porção anterior da membrana
plasmática do espermatozóide é desprendida dele. Aí estão localizadas as proteínas de
ligação à ZP3. Porém, o espermatozóide precisa permanecer ligado à zona pelúcida para
lisar um caminho através dela. Esta ligação secundaria à zona é completada por
proteínas na membrana acrossômica interna que se ligam à ZP2. O acrossomo intacto
não poderá se ligar à glicoproteína ZP2, mas o acrossoma do espermatozóide que já
reagiu o fará. A estrutura da zona é constituída por unidades repetidas de ZP3 e ZP2,
ocasionalmente, ligadas pela ZP1. Parece que o acrossoma que já reagiu transfere suas
ligações de ZP3 para ZP2 adjacente. Após a entrada do espermatozóide no óvulo seus
grânulos corticais liberam seu conteúdo e uma dessas proteínas é uma protease que
altera especificamente ZP2. Esta inibiria o espermatozóide que já sofreu reação
acrossômica de entrar mais profundamente no óvulo. Em suínos a proacrosina é uma
proteína que se liga à fucose que mantém a conexão entre o espermatozóide cujo
acrossomo que já reagiu e a zona pelúcida.
Contracepção pelos anticorpos: se animais machos e fêmeas são injetados com
extratos de espermatozóides, muitos produzirão anticorpos e se tornarão inférteis.
Primakoff descobriu uma proteína do espermatozóide de cobaia que poderia induzir este
tipo de esterilidade. O soro desses animais continha altas concentrações de anticorpos
conta a proteína PH-20m que está presente tanto na membrana plasmática como na
membrana interna do acrossomo do espermatozóide de cobaia. Outra forma de
contracepção imunológica por longos períodos foi conseguida produzindo-se anticorpos
contra a zona pelúcida (ZP3).
Fusão dos gametas e prevenção da poliespermia: o reconhecimento é seguido pela
lise de uma porção do envoltório que contata a cabeça do espermatozóide. Esta lise é
seguida pela fusão da membrana celular do espermatozóide com a membrana celular do
óvulo. A fusão espermatozóide-óvulo parece causar a polimerização da actina e
extensão de muitas microvilosidades do óvulo, para formar o cone de fecundação. As
membranas do óvulo e do espermatozóide se fundem e o material da membrana celular
do espermatozóide pode, mais tarde, ser encontrado na membrana do óvulo. Nem todos
os componentes da membrana do espermatozóide podem se misturar com a do óvulo.
Algum material parece estar localizado no ponto de entrada do espermatozóide.
Suspeitam que essa localização dos componentes do espermatozóide em uma área
restrita provoca uma assimetria celular, que auxilia diretamente o plano da primeira
clivagem e os movimentos citoplasmáticos dentro do ovo. Fusão é um processo ativo,
frequentemente mediado por proteínas “fusogênicas” específicas.
A entrada de múltiplos espermatozóides – poliespermia – traz, para a maioria dos
organismos, conseqüências desastrosas. O núcleo triplóide e o par extra de centríolos
causam a distribuição desigual dos cromossomos. Algumas células poderiam receber
cópias extras de certos cromossomos os quais faltariam em outras células. O modo mais
comum é prevenir a entrada de mais de um espermatozóide no óvulo. Existem dois
mecanismos principais para prevenir a poliespermia: uma reação rápida, alcançada
através de uma alteração elétrica na membrana plasmática do óvulo e uma reação mais
lenta, provocada pela exocitose dos grânulos corticais. O bloqueio rápido à
poliespermia: alcança seu objetivo mudando o potencial elétrico da membrana do óvulo.
A concentração iônica do óvulo é deferente da do ambiente, e isso é especialmente
diferente para os íons potássio e sódio. No caso do ouriço-do-mar, a água do mar tem
uma concentração particularmente alta de íons sódio, enquanto que o citoplasma do
óvulo tem relativamente pouco sódio livre. Com os íons potássio acontece o inverso.
Essa condição é mantida pela membrana celular, o potencial de membrana em repouso é
-70mV. De 1 a 3 segundos após a ligação do primeiro espermatozóide, o potencial de
membrana se desloca para um nível positivo. Um pequeno influxo de íons sódio para
dentro do óvulo é permitido, elevando assim a diferença de potencial para +20mV. O
espermatozóide não pode se fundir com membranas que têm uma ddp positiva. A
abertura dos canais de sódio no óvulo parece ser causada pela ligação do
espermatozóide ao óvulo. O bloqueio elétrico à poliespermia provavelmente não ocorre
na maioria dos mamíferos e só é efetivo quando o espermatozóide possui um
componente que é sensível à diferenças de voltagem. Bloqueio lento da poliespermia: a
poliespermia pode ainda ocorrer se os espermatozóides ligados ao envoltório vitelino
não são de alguma forma removidos. Esta remoção é efetivada pela reação dos grânulos
corticais. Estas vesículas contêm a proteína hialina, proteases, uma peroxidase e
mucopolissacarídeos. Após a entrada do espermatozóide, estes grânulos corticais se
fundem com a membrana plasmática do óvulo liberando seu conteúdo na área entre a
membrana e o envoltório vitelínico. As proteínas que ligam o envoltório vitelínico ao
óvulo são dissolvidas pelas enzimas proteolíticas liberadas e os mucopolissacarídeos,
recém liberados, produzem um gradiente osmótico que permite a entrada de água no
espaço entre a membrana celular e o envoltório vitelínico, que é então elevado e passa a
ser denominado membrana de fecundação. Primeiro, as proteases modificam ou
removem o receptor de bindina e algum espermatozóide ligado a ele. Segundo, a
peroxidase endurece a membrana de fecundação pela ligação de resíduos de tirosina às
proteínas adjacentes. A membrana de fecundação começa a se formar no local da
entrada do espermatozóide e se expande ao redor do óvulo. Tão logo o envoltório de
fecundação se forma a proteína hialina é estocada nos grânulos corticais, forma uma
cobertura ao redor do óvulo. A célula estende microvilosidades longas cujas
extremidades se ligam à camada hialina. Este envoltório hialino constitui suporte para
os blastômeros durante a clivagem. Em mamíferos a reação dos grânulos corticais não
produz uma membrana de fecundação, mas o efeito é o mesmo. A liberação de enzimas
modifica os receptores dos espermatozóides na zona pelúcida de tal forma que eles não
podem mais se ligar aos espermatozóides (reação de zona) em seguida à fusão dos
grânulos corticais próximos ao ponto de entrada do espermatozóide, uma onda de
exocitose dos grânulos corticais se propaga ao redor do córtex em direção ao lado
oposto do ovo. Íons de cálcio são diretamente responsáveis pela propagação da reação
cortical e estão estocados no próprio óvulo, dentro do reticulo endoplasmático.
Variações nas estratégias que previnem a poliespermia estão amplamente distribuídas na
natureza.
Fusão do material genético: após a fusão das membranas do espermatozóide e do
óvulo, o núcleo e o centríolo do primeiro se separam das mitocôndrias e do flagelo,
sendo que esses se desintegram dentro do óvulo. O núcleo do óvulo, ainda haplóide, é
denominado pronúcleo feminino. Dentro do citoplasma do óvulo, o núcleo do
espermatozóide de descondensa para formar o pronúcleo masculino. As proteínas
ligadas à cromatina do espermatozóide, em seu estado condensado e inativo, são
trocadas por proteínas semelhantes, derivadas do óvulo. Esta troca permite a
descondensação da cromatina do espermatozóide. Pedaços remanescentes do envoltório
nuclear original do espermatozóide são transportados pela cromatina. Rapidamente
novas vesículas membranosas se agregam ao longo da periferia da massa de cromatina e
se conectam com os fragmentos do velho envoltório para produzir a nova membrana do
pronúcleo masculino. Esse sofre uma rotação de 180º, de tal forma que o centríolo do
espermatozóide fica entre os dois pronúcleos. Os microtúbulos do centríolo do
pronúcleo masculino se estendem e conectam o pronúcleo feminino e ambos migram
para se encontrarem. A fusão forma o núcleo zigótico diplóide. O início da síntese de
DNA pode ocorrer ainda na fase de pronúcleo ou após a formação do núcleo zigótico. O
pronúcleo masculino de mamíferos aumenta em tamanho enquanto o núcleo do ovócito
completa sua segunda divisão de meiose. Então, cada pronúcleo migra para se encontrar
com o outro, replicando seu DNA enquanto viaja. No encontro, os dois envoltórios
nucleares se tocam e rompem. Contudo, em vez de produzir um núcleo zigótico comum,
a cromatina se condensa em cromossomos que se orientam para um fuso mitótico
comum. Então podem ser vistos verdadeiros núcleos diplóides em mamíferos, não no
zigoto, mas na fase de duas células.
A não equivalência dos pronúcleos de mamíferos: os pronúcleos masculino e
feminino e mamíferos são geneticamente equivalentes, porém podem ser
funcionalmente diferentes. A mola hidatiforme é um tumor que se desenvolve a partir
de um espermatozóide haplóide que fecunda um óvulo cujo pronúcleo feminino está
ausente. O desenvolvimento não ocorre nesse caso. Estas diferenças podem estar em
modificações do DNA que são diferentes nos núcleos dos óvulos e dos
espermatozóides.
Ativação do metabolismo do óvulo: o óvulo maduro é uma célula inerte, que é
reativada pela entrada do espermatozóide. Esta ativação é meramente um estímulo,
contudo, transforma em ação um conjunto de eventos metabólicos pré-programados.
As respostas do óvulo ao espermatozóide podem ser: (1) respostas imediatas – muitos
experimentos demonstram que esta liberação de cálcio é essencial para a ativação do
desenvolvimento do embrião. A liberação de cálcio é responsável pela ativação de uma
serie de reações metabólicas. Uma delas é a ativação da enzima NAD+ quinase, que
converte NAD+ em NADP+. Esta mudança deve ter importantes conseqüências para o
metabolismo da célula. Uma delas envolve o metabolismo dos lipídios. Assim, a
mudança de NAD+ para NADP+ pode ser importante na construção de muitos
componentes das novas membranas celulares. Um outro efeito desta mudança envolve o
consumo de oxigênio. Uma súbita redução do oxigênio é verificada durante a
fecundação. A enzima responsável pela redução do oxigênio é dependente de NADPH.
(2) respostas tardias – acoplado ao aumento intracelular de cálcio livre está um aumento
do pH intracelular. Esse aumento inicia-se com um segundo influxo de íons sódio,
causando a troca de um íon sódio que entra novo por um íon de hidrogênio que vai para
a água do mar. Esta perda de íons de hidrogênio provoca uma alteração no pH que
aumenta de 6,8 para 7,2 e traz enormes mudanças na fisiologia do ovo. Ainda que se
acredite que esta mudança seja causada por uma reação mediada por cálcio, tem sido
verificado que independente da causa, o aumento do pH intracelular pode iniciar muitas
das respostas tardias, essas incluem a ativação da síntese de DNA e da síntese protéica,
para a qual são suados mRNA’s já presentes no citoplasma do ovócito. Agentes que
bloqueiam o aumento do pH também bloqueiam esses eventos tardios da fecundação.
A bioquímica da ativação do óvulo: a ativação do óvulo é causada por uma onda de
liberação de cálcio de compartimentos internos da célula. A ligação do espermatozóide
à membrana celular do óvulo provoca uma serie de reações envolvendo enzimas da
membrana que sintetizam “mensageiros secundários” (inositol 1,4,5 – trifosfato {IP3}
pode liberar íons cálcio). O IP3 liberado nesta reação se liga a uma proteína no reticulo
que libera íons cálcio. A proteína-G está envolvida na liberação dos íons cálcio ligados
e na exocitose dos grânulos corticais. Parece que a mesma química que permite ao
óvulo ativar o espermatozóide também permite ao espermatozóide ativar o óvulo.
Rearranjo do citoplasma do óvulo: a fecundação pode também iniciar o deslocamento
radical do material citoplasmático. Estes arranjos do citoplasma do ovócito são
frequentemente cruciais para a diferenciação celular durante o desenvolvimento. O
citoplasma de óvulo freqüentemente contém determinantes morfogênicos que se
segregam em células específicas durante a clivagem. Esses determinantes conduzem à
ativação ou à repressão de genes específicos e consequentemente conferem certas
propriedades às células que os incorporam. O arranjo espacial correto destes
determinantes é crucial para o desenvolvimento normal. O crescente amarelo, que se
estende do pólo vegetal ao equador traz o plasma amarelo para a área onde futuramente
os músculos serão formados na larva do tunicado. O movimento destas regiões
citoplasmáticas é dependente de microtúbulos que provavelmente são gerados pelo
centríolo do espermatozóide. O citoplasma subjacente, localizado próximo ao equador,
do lado exatamente oposto ao ponto de entrada do espermatozóide é o crescente
cinzento, que marca a região onde a gastrulação é iniciada em embriões de anfíbios. O
motor desses movimentos citoplasmáticos em ovos de anfíbios parece ser o arranjo
paralelo dos microtúbulos que se situam entre o citoplasma cortical e o citoplasma
interno do hemisfério vegetal. A orientação dos microtúbulos é paralela à direção da
rotação do citoplasma. Os microtúbulos paralelos são originários do óvulo, mas parece
que o áster do espermatozóide dá a orientação aos microtúbulos. Esses movimentos
citoplasmáticos iniciam uma cascata de eventos que determinam o eixo dorso-ventral.
Preparação para clivagem: o aumento intracelular de íons cálcio livres também
movimenta a aparelhagem da divisão celular. Os mecanismos através dos quais a
clivagem é iniciada, provavelmente diferem entre as espécies. O ritmo das divisões
celulares é regulado pela síntese e degradação da ciclina, que mantém a célula em
metáfase e a quebra da ciclina permite à célula retornar à interfase. Clivagem, o evento
que separa a fecundação da embriogênese. A posição da primeira clivagem não é ao
acaso, mas, tende a ser determinada pelo ponto de entrada do espermatozóide e a
subseqüente rotação do citoplasma do ovo. A coordenação do plano de clivagem e os
rearranjos do citoplasma são provavelmente mediados pelos microtúbulos do áster do
espermatozóide.
Histologia básica
1 – A histologia e seus métodos de estudo
A histologia estuda as células e o material extracelular que constituem os tecidos
do corpo. O ME que é 1000 vezes mais potente que o MO ampliou bastante o campo de
estudo da histologia, assim como outros instrumentos e técnicas de estudo como a
cultura de células, as técnicas de radioautografia e de imuno-histoquímica.
Como são feitas as lâminas histológicas: o que se deseja é levar ao microscópio um
preparado no qual os tecidos estejam perfeitamente preservados, apresentando a mesma
estrutura e composição química que possuíam quando vivos.
A fixação estabiliza os tecidos: para que a célula não se destrua (autólise), ou bactérias
não a destruam, os tecidos devem ser tratados imediatamente após sua retirada. Esse
tratamento é denominado fixação, cuja principal função é insolubilizar as proteínas do
tecido. Um dos melhores fixadores para o MO é o formaldeído a 4% em solução
tamponada. No ME são usadas duas fixações, primeiro em solução tamponada de
aldeído glutárico, e em seguida, em solução também tamponada, de tetróxido de ósmio.
Etapas Finalidades Durações
1. Fixação em fixador simples Preservar a morfologia e a Cerca de 12 hs,
ou em mistura fixadora composição dos tecidos. dependendo do fixador
(liquido de Bouin, Helly etc.). do tamanho da peça.
2. Desidratação em álcool Remover a água dos tecidos. 6 a 24hs, dependendo
etílico de concentrações do tamanho da peça.
crescentes, começando com
álcool a 70% e terminando
com álcool absoluto.
3. Clareamento ou Embeber a peça em substancia 1 a 6hs, dependendo o
diafanização em benzol, xilol miscível com a parafina. tamanho da peça.
ou toluol, solventes do álcool
e da parafina.
4. Impregnação pela parafina A parafina penetra nos vasos, 30 min a 6hs,
fundida, geralmente realizada nos espaços intercelulares e dependendo do
em estufa a 60ºC. mesmo no interior das células, tamanho da peça.
impregnando o tecido e
tornando mais fácil a obtenção
dos cortes no micrótomo.
5. Inclusão: a peça é colocada Obtenção do bloco de parafina
num molde retangular de forma regular, para ser
contendo parafina fundida. cortado no micrótomo.
Após a fixação os tecidos são impregnados com parafina ou resinas sintéticas a fim
de que possam ser cortados em fatias finas: para a obtenção dos cortes os tecidos tem
que ser embebido e envolvidos em substancias de consistência firme (parafinas ou
resinas plásticas). Há uma série de tratamentos que o tecido deve sofrer antes da
impregnação. Na primeira etapa, a desidratação, a água é extraída dos tecidos pela
passagem dos mesmos em banhos de concentrações crescentes de etanol, geralmente de
70% até o etanol absoluto (ou puro ou 100%). Em seguida, o etanol é substituído por
um liquido miscível como meio de inclusão. Para a inclusão em parafina usa-se o xilol
ou benzol. Os tecidos embebidos nessas substancias tornam-se translúcidos, por isso
essa etapa é chamada diafanização ou clareamento. Mergulha-se o tecido em parafina a
60ºC. Devido ao calor o xilol ou benzol evaporam e os espaços anteriormente ocupados
por eles são ocupados pela parafina. Em seguida coloca-se o tecido num recipiente
contendo um pouco de parafina fundida e deixa solidificar em temperatura ambiente
formando um bloco de parafina como tecido no seu interior, que é seccionado pela
navalha de aço do micrótomo, obtendo-se cortes de 6 a 8 µm de espessura. Esses cortes
são estirados em água quente e colocados nas lâminas. A imersão dos tecidos em etanol
e xilol ou benzol retira os lipídios, quando são eles que se quer estudar usa-se o
micrótomo de congelação.
A coloração facilita a visualização dos componentes teciduais: a maioria dos tecidos
é incolor. A maioria dos corantes utilizados em histologia comporta-se como ácido ou
base e tende a formar ligações salinas com radicais ionizáveis presentes nos tecidos. Os
componentes basófilos têm caráter ácido e se ligam aos corantes com caráter básico, já
os acidófilos têm caráter básico e se ligam aos corantes com caráter ácido. Azul-de-
toluidina, azul-de-metileno e a hematoxilina são corantes básicos, enquanto orange G,
eosina e fucsina ácida são corantes ácidos. O núcleo celular é basófilo e o citoplasma é
quase sempre acidófilo. A coloração dupla pela hematoxilina e a eosina (HE) é a mais
utilizada na rotina em histologia, porem muitos outros corantes são usados. Além dos
corantes usa-se também a impregnação metálica com sais de prata e ouro.
Técnicas Constituintes Núcleos Citoplasma Fibras Fibras Fibras
colágenas elásticas reticulares
HE Hemalúmen Azul ---- ---- Irregular ----
(hematoxilina)
Eosina ---- Róseo Róseo Irregular ----
Hematoxilina Preto ---- ---- ---- ----
férrica
Tricrômico Fucsina ácida ---- Vermelho ---- ---- ----
de Masson e ponceau de
xilidina
Verde-luz ---- ---- Verde ---- ----
Fucsina- Fucsina- ---- ---- ---- Púrpura ----
resorcina de resorcina
Weigert
Impregnação Soluções de ---- ---- Castanho- ---- Preto
argêntica sais de prata escuro
para fibras
reticulares
O microscópio óptico não permite o estudo de detalhes com menos de 0,2µm: a
parte óptica do microscópio consiste em três sistemas de lentes: condensador, objetiva e
ocular. A ampliação total dada pelo MO é igual ao aumento da objetiva multiplicado
pelo aumento da ocular. O fator mais significativo para uma boa imagem é a resolução,
que é a menor distancia para que duas partículas apareçam como objetos separados. O
limite da resolução dos melhores MO é 0,2µm e ele depende essencialmente da
objetiva, a ocular apenas aumenta de tamanho a imagem projetada de foco pela objetiva.
Os microscópios de contraste de fase facilitam a visualização das células e tecidos
vivos: o estudo de tecidos vivos é difícil, pois a maioria dos seus componentes são
incolores e transparentes. O microscópio de contraste permite o estudo de muitos
detalhes celulares in vivo. A velocidade com que a luz atravessa um corpo transparente
depende da quantidade de matéria presente e determina o índice de refração desse
corpo. Quanto maior a densidade, maior o índice de refração e menor a velocidade da
luz no corpo. Como as diversas estruturas celulares têm índices diferentes, causam
atrasos diferentes nas ondas luminosas dando origem a diferenças de fase entre as ondas
luminosas emergentes, mas essas diferenças ao são visíveis. No microscópio de
contraste de fase existem dispositivos especiais que transformam essas diferenças de
fase em diferenças de amplitude, dando diferenças de intensidade luminosa, para as
quais a retina é sensível.
Cortes ópticos podem ser obtidos com o microscópio confocal: este tipo de
microscópio utiliza raios laser e gera imagens de planos ópticos do tecido em exame.
Isto torna possível imagens muito nítidas porque o material situado abaixo do plano de
foco não contribui para a formação da imagem e, assim, não compromete sua nitidez.
O microscópio de polarização revela a presença de moléculas alongadas e
orientadas: ao atravessar um filtro polariode a luz torna-se polarizada. Colocando-se
um segundo filtro no microscópio, acima do primeiro e com seu eixo perpendicular, a
luz não atravessa o conjunto. O primeiro filtro é colocado no condensador e recebe o
nome de polarizador. O segundo filtro, ou analisador, é colocado entre a objetiva e a
ocular. Quando o polarizador e o analisador estão com seus eixos perpendiculares, o
campo do microscópio aparece escuro, mas se entre os dois filtros existirem estruturas
contendo moléculas orientadas (anisotrópicas ou birrefringentes, modificam o eixo da
luz recebida do polarizador), estas estruturas aparecerão brilhantes contra um fundo
escuro.
Microscopia de fluorescência: quando excitadas por certos comprimentos de onda,
algumas substâncias absorvem energia e emitem luz de maior comprimento de onda.
Em microscopia utiliza-se a citação com radiação ultravioleta, para que a radiação
emitida caia na faixa de luz visível. As substancias fluorescentes aparecem como
substancias brilhantes contra um fundo escuro.
Microscopia eletrônica: os elétrons são produzidos graças ao aquecimento no vácuo de
um filamento que então emite elétrons. Essas partículas são aceleradas devido a uma
ddp de 60 a 100 kV existente entre o filamento e o anodo. Devido ao fato de serem
elétrons facilmente desviados pelo objeto, torna-se necessário utilizar cortes muito finos
de tecido (20 a 100 nm de espessura). Para isso foi necessário desenvolver métodos
especiais de microtomia, os cortes são feitos em um ultramicrótmo, nos quais são
utilizadas navalhas de vidro ou diamante. Enquanto no MO a luz é absorvia pelas
estruturas coradas, no ME os elétrons são desviados por porções do objeto que
contenham átomos de elevado peso atômico. O resultado é que as estruturas que
desviam elétrons aparecem escuras na tela fluorescente e são chamadas de elétron-
densas. A capacidade de desviar os elétrons depende do numero atômico, por isso se
costuma impregnar os cortes de tecidos com metais pesados a fim de aumentar o
contraste, resultando assim uma imagem nítida e bem visível.
A analise dos elétrons refletidos permite o estudo da superfície de células e tecidos
especialmente preparados: alem do ME já descrito, chamado de transmissão, existe
outro tipo, denominado microscópio de varredura aqui, entre lente eletromagnética e o
objeto é interposta uma bobina de varredura que provoca um desvio no feixe de
elétrons, de tal modo que o mesmo vai incidir sobe o objeto ponto por ponto, numa
seqüência determinada. O objeto não se deixa atravessar pelo feixe eletrônico, devido a
sua espessura e a uma cobertura feita por evaporação de metal pesado sobre a sua
superfície. Desse modo, o feixe de elétrons que incide sobre o objeto (feixe primário)
sofre reflexões, originando elétrons secundários, os quais são captados por detectores
especiais que geram um sinal elétrico, transferido para um tubo de vídeo.
O uso combinado de moléculas radioativas e suspensões de brometo de prata em
gelatina (emulsões fotográficas) é a base da técnica radioautográfica: essa técnica
torna possível a localização de substancias radioativas nos tecidos. Cristais de brometo
de prata agem como microdetectores da radioatividade, pois atingidos pela radiação,
depois de revelados, transformam-se em grãos de prata metálica, que aparecem negros
ao microscópio, denunciando a presença de radioatividade nas estruturas com as quais
estão em contato. Esse método tem sido utilizado para o estudo de fenômenos
biológicos. Por exemplo, a síntese de proteínas pode ser estudada pela injeção de
aminoácidos marcados com carbono 14 e hidrogênio 3, as moléculas que se formarem
serão radioativas e poderão ser encontradas pela radioautografia.
A separação , em quantidade, dos componentes celulares é possível pela técnica de
centrifugação fracionada: é um processo físico que aplica a força centrifuga para
separar organelas celulares, de acordo como coeficiente de sedimentação de cada uma,
esse depende do tamanho, forma e densidade da partícula e da densidade e viscosidade
do meio. Submetendo-se uma célula à ação de uma força centrifuga adequada, suas
organelas se distribuirão em diferentes camadas. Utilizando essa técnica pode-se isolar
qualquer organela celular, determinar sua composição química e estudar suas funções in
vitro. Após a homogeneização, inicia-se a centrifugação d sobrenadante, utilizando-se
forças centrífugas cada vez maiores. As partículas mais densas sedimentam primeiro. O
sobrenadante de cada centrifugação é submetido a uma força centrífuga maior, obtendo-
se, desse modo, a separação dos diversos componentes celulares.
Histoquímica e citoquímica: esses termos são usados para indicar os métodos para a
localização de diferentes substancias nos cortes de tecido e eles têm por base reações
químicas especificas, ou a interação macromolecular de alta afinidade. Nos dois casos, o
resultado final é a produção de compostos insolúveis, coados, ou eletrón-densos, que
possibilitam a localização de sustâncias específicas nos cortes de tecidos através do uso
do MO ou ME. Para os lipídios os corantes mais usados são: o Sudan IV e o Sudan
negro, que coram os lipídios respectivamente em vermelho e preto; para os ácidos
nucléicos: a reação de Feulgen; para o RNA: azul-de-toluidina ou azul-de-metileno
(precisa de lâmina controle com ribonuclease); para polissacarídeos: PAS (reação do
acido periódico de Schiff, precisa de lâmina controle com amilase); para enzimas:
produzir um precipitado fortemente corado ou elétron-denso no local da atividade
enzimática.
Interações de alta afinidade entre macromoléculas servem para a realização de
técnicas importantes como a imunocitoquímica, a citoquímica com lectinas e a
hibridização in situ: essas interações são muito especificas, localizando as moléculas
com muita precisão, o exemplo mais bem estudado é a interação antígeno-anticorpo. A
técnica da imunocitoquímica baseia-se no seguinte fato: quando uma macromolécula
estranha denominada antígeno é introduzida em um organismo, este reage produzindo
uma proteína chamada anticorpo, que por sua vez combina-se especificamente com o
antígeno. A técnica consiste em acoplar sustâncias marcadoras a anticorpos sem que
estes percam a capacidade de se combinar como antígeno. Isto é utilizado de duas
maneiras, denominadas técnicas direta e indireta de imunocitoquímica. Três métodos
são muito utilizados para marcar os anticorpos: (1) conjugação com composto
fluorescente; (2) conjugação com uma enzima e (3) conjugação com uma substancia que
não se deixa atravessar pela luz e que dispersa elétrons. TÉCNICA DIRETA: para um
antígeno x tirado de um animal é feito um anticorpo em outro animal, que depois de
purificado e acoplado com um composto fluorescente volta para o animal que tinha o
antígeno X e se liga a ele formando uma estrutura acoplada fluorescente, ficando visível
a localização do antígeno X. TÉCNICA INDIRETA: na primeira etapa faz-se a imersão
do corte histológico em solução com anticorpo não marcado, obtido do sangue de um
animal no qual foi injetado o antígeno cuja localização se deseja determinar. O
anticorpo fixa-se ao antígeno, mas isso não pode ser observado ao microscópio, por isso
o anticorpo não está marcado. Na segunda etapa, imerge-se o preparado em solução
com antigamaglobulina marcada. Esta ultima é, portanto, um anticorpo. A
antigamaglobulina marcada fixa-se à gamaglobulina que já está ligada ao antígeno,
revelando a localização dele. TÉCNICAS DE HIBRIDIZAÇÃO IN SITU: para
entender como a célula funciona é necessário entender o fluxo de informações entre o
DNA e as proteínas sintetizadas na célula. Dentre as técnicas com essa finalidade
encontra-se a técnica de análise Southern, que possibilita caracterizar e quantificar o
DNA de um gene; análise Northern, que identifica e quantifica um RNAm mesmo na
presença dos numerosos outros RNA’s; e a análise Western, para detecção de uma
proteína especifica, dentre as que existem numa célula ou tecido. As análises Southern e
Northern se baseiam na alta afinidade que existe entre segmentos complementares de
ácidos nucléicos, o que torna possível a hibridização. A análise Western se baseia na
alta afinidade e especificidade entre antígenos e respectivos anticorpos.
HISTOQUÍMICA COM LECTINAS: as lectinas são proteínas obtidas de sementes de
vegetais, que se ligam com alta afinidade e especificidade a carboidratos da superfície
celular. As diferentes lectinas ligam-se a segmentos específicos de certos hidratos de
carbono. Caracterizam moléculas da membrana que contêm certos carboidratos, e
geralmente, é marcada com peroxidase, para tornar possível sua localização através da
técnica histoquímica para peroxidase.
Histologia básica
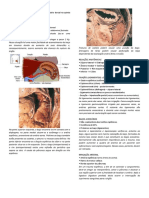
2 – Tecido epitelial
Os tecidos que constituem os diversos órgãos do corpo são constituídos por
células mais a matriz extracelular, que é produzida pelas células. Existem quatro tipos
básicos de tecido: epitelial, conjuntivo, muscular e nervoso.
Os epitélios são constituídos por células, geralmente, poliédricas, justapostas,
entre as quais se encontra pouca substância extracelular. As células epiteliais aderem
firmemente umas às outras, formando camadas celulares contínuas que revestem a
superfície externa e as cavidades do corpo. Além dos epitélios de revestimento, existem
também os epitélios glandulares, formados por células especializadas na produção de
secreção. Há ainda epitélios especializados na captação de estímulos provenientes do
ambiente, são os neuroepitélios.
Geralmente a forma do núcleo acompanha a forma da célula: células cúbicas
apresentam núcleo esférico, ao passo que células prismáticas têm núcleo elíptico. O eixo
maior dos núcleos acompanha o eixo maior das células.
O glicocálice é uma delgada camada glicoprotéica que reveste as células epiteliais
(e outras células também): as glicoproteínas tomam parte nos processos celulares de
pinocitose, de adesão entre as células, em fenômenos imunológicos e em outros
processos vitais.
A lâmina basal separa e prende o epitélio ao tecido conjuntivo adjacente,
permitindo porem a passagem de diversas moléculas: os epitélios apresentam na sua
superfície de contato com o tecido conjuntivo, uma estrutura chamada lâmina basal, que
tem espessura de 20 a 100 nm, é formada principalmente, por colágeno tipo IV, uma
glicoproteína denominada laminina e proteoglicanas, sendo sintetizada pelas células
epiteliais.
Em determinadas regiões do organismo, verifica-se, em continuação à lâmina
basal, um acúmulo de fibras reticulares e complexos de proteínas e glicoproteínas,
formando um conjunto que e visíveis ao microscópio óptico. A associação da lâmina
basal com essa estrutura chama-se membrana basal.
Nos epitélios sujeitos a atritos fortes, a lâmina basal fixa-se ao tecido conjuntivo
subjacente por meio de finas fibrilas de colágeno tipo VII, chamadas fibrilas de
ancoragem.
Quando as células migram para suas localizações corretas, no desenvolvimento
embrionário, apoiando-se nas lâminas basais, as mutações que modificam as proteínas
normais da lâmina basal afetam gravemente a organogênese.
Estruturas diversas, principalmente os desmossomos, asseguram forte coesão entre
as células epiteliais: da aderência das células epiteliais participam proteínas da família
das caderinas, que são proteínas transmembrana, com a função de prender as
membranas de células contíguas. As caderinas perdem sua adesividade na ausência de
Ca+.
As junções celulares servem para a aderência e também para vedar o espaço
intercelular. Certas junções formam canais de comunicação entre as células adjacentes.
Nos epitélios prismáticos com uma única camada de células, frequentemente, as junções
se apresentam numa ordem definida da parte apical para a parte basal da célula.
Nessas células, as zônulas de oclusão são as junções mais apicais. Todas as
zônulas são estruturas em forma de faixa, formando um cinturão em volta da célula. As
zônulas de oclusão são caracterizadas pela íntima justaposição periódica das membranas
celulares das células vizinhas, com fusão dos folhetos externos das membranas e forma
uma barreira que impede a passagem de moléculas por entre as células epiteliais, ou
seja, ela tem um efeito soldador, contribuindo para a formação de compartimentos
funcionais delimitados por células epiteliais.
A junção encontrada a seguir é a zônula de adesão, que circunda toda a volta da
célula e contribui para a aderência entre células vizinhas. Aqui há uma discreta
separação entre as membranas celulares e um pequeno acúmulo de material elétron-
denso na superfície interna dessas membranas. No material elétron-denso se inserem
componentes da trama terminal, uma estrutura localizada no pólo apical das células e
que contém a proteína espectrina, filamentos de actina e filamentos intermediários.
Admite-se que a trama terminal reforça o citoplasma do ápice da célula.
O conjunto formado pelas zônulas de oclusão e de adesão constitui o complexo
unitivo e é responsável por uma estrutura a muito conhecida como rede terminal.
A junção comunicante (gap junction) ou néxus pode ocorrem em qualquer
posição nas membranas laterais das células epiteliais. São encontradas também nos
outros tecidos, menos no muscular estriado esquelético. Caracteriza-se pela aposição
das membranas de células adjacentes, após criofratura observam-se agregados de
partículas formando placas circulares nas membranas. As junções comunicantes são
formadas de hexâmeros protéicos, cada um com um poro hidrofílico central de 1,5 nm.
Cada hexâmero se alinha como da célula adjacente e forma um canal hidrofílico entre as
duas células, esses canais permitem a passagem de moléculas informacionais como
AMP cíclico, GMP, íons etc., e podem propagar informações entre células vizinhas
integrando as funções celulares nos tecidos.
As junções comunicantes se formam rapidamente entre células previamente
isoladas. O fato de inibidores metabólicos, especialmente os que bloqueiam a oxidação
fosforilativa, impedirem a formação dessas comunicações e também promoverem a
desagregação das existentes mostra que elas se mantêm graças a um processo que
consome energia. Como as novas junções comunicantes se formam mesmo que a síntese
protéica seja interrompida, admite-se que elas podem se formar pela aproximação das
moléculas protéicas (unidades do hexâmero) preexistentes e dispersas na membrana
celular.
O desmossomo ou mácula de adesão está relacionado com a aderência
intercelular, ele é uma estrutura complexa, em forma de disco constituído pela
membrana de duas células contíguas. Na região do desmossomo as membranas celulares
se afastam. Desmossomos apresentam rigidez. Proteínas da família das caderinas
participam da aderência proporcionada pelos desmossomos. Na face citoplasmática de
cada membrana existe uma placa circular constituída de ao menos 12 proteínas na qual
se prendem filamentos intermediários de queratina (tonofilamentos).
Na zona de contato entre algumas células epiteliais e a lamina basal,
frequentemente, existem hemidesmossomos. Eles auxiliam a fixação da célula epitelial
à lâmina basal subjacente e são mais freqüentes onde o epitélio está sujeito a atritos
fortes. Aqui a aderência é devido à proteínas da família das integrinas.
As junções intercelulares podem ter três funções: (1) junções de adesão (zônula
de adesão, desmossomos e hemidesmossomos), (2) junções impermeáveis (zônulas de
oclusão) e (3) junções de comunicação (junções comunicantes).
OBS.: a adesão entre as células pode ser aumentada pela grande quantidade de
interdigitacões observadas nas membranas das paredes laterais das células epiteliais
vizinhas.
As células epiteliais geralmente são polarizadas: a maioria das células epiteliais
possui uma estrutura diferente, conforme a extremidade do citoplasma que é observada.
Organelas, vesículas de secreção, material de deposito (inclusões) não se distribuem de
modo uniforme no citoplasma. Certas estruturas predominam num pólo, conforme a
atividade funcional da célula. O pólo basal é aquele em contato com a lâmina basal e o
pólo apical é a direção oposta. A polaridade celular não é exclusiva das células
epiteliais.
As células epiteliais apresentam estruturas para aumentar a superfície ou
movimentar partículas: MICROVILOS: as células epiteliais com função de absorção
apresentam na superfície livre milhares de microvilos (formados por filamentos de
actina). Frequentemente, nos microvilos, o revestimento glicoprotéico (glicocálice)
apresenta-se mais denso. ESTEREOCÍLIOS: são estruturas imóveis, de distribuição
restrita, encontradas na região apical das células de revestimento do epidídimo e do
canal deferente. São constituídos por longos prolongamentos citoplasmáticos, que
podem sofrer anastomose. Aumentam a superfície celular, facilitando o transito de
moléculas para dentro e fora das células. Apesar do nome tem semelhança com os
microvilos e não com os cílios. CÍLIOS E FLAGELOS: os cílios apresentam forma
cilíndrica, revestidos pela membrana celular, contendo no centro um par de
microtúbulos isolados e, na periferia, nove pares de microtúbulos fundidos dois a dois e
dispostos circularmente. Os cílios se inserem nos corpúsculos basais. O movimento
celular é coordenado, provocando uma corrente de fluido em uma só direção. Os
movimentos ciliares resultam da atividade dos microtúbulos, que utilizam a energia
fornecida por moléculas de ATP. Os flagelos, que no organismo humano existem
apenas nos espermatozóides, têm estrutura semelhante à dos cílios, porem são muito
mais longos e, normalmente, cada espermatozóide tem apenas um flagelo.
As funções básicas dos epitélios são de revestir, separando compartimentos, e
secretar: os epitélios estão classificados em dois grandes grupos: de revestimento e
glandulares.
De acordo com as condições funcionais locais, os epitélios de revestimento podem
ter uma ou mais camadas de células: são tecidos cujas células se dispõem em
camadas, recobrindo a superfície externa ou as cavidades do corpo. Estão sempre
apoiados numa camada de tecido conjuntivo que contem os vasos sanguíneos cujo
sangue nutre o epitélio. São classificados tendo em vista o numero de camadas
constituintes e a forma das células na camada mais superficial. Pelo primeiro critério, os
epitélios podem ser simples ou estratificados. Os epitélios simples subdividem-se em
pavimentosos, cúbicos e prismáticos ou cilíndricos. Nos epitélios estratificados, a
classificação baseia-se na forma das células da camada mais superficial do epitélio. O
epitélio estratificado, chamado de transição, que reveste a bexiga, caracteriza-se pelo
fato de suas células superficiais não serem nem pavimentosas nem prismáticas, mas
globosas. Nesse epitélio, o número de camadas e a forma das células superficiais variam
conforme o órgão esteja distendido ou não.
Chama-se mucosa o conjunto constituído por epitélio mais tecido conjuntivo,
que reveste cavidades úmidas, como boca, bexiga, intestino. O conjuntivo das mucosas
recebe o nome de lâmina própria ou córion.
Com raras exceções, os vasos sanguíneos não penetram no epitélio, de modo que
a nutrição é feita por difusão através do tecido conjuntivo.
O tecido epitelial, geralmente, apresenta fibras nervosas sensoriais, que acabam
em terminações nervosas livres, constituindo, às vezes, uma rica rede intra-epitelial,
conferindo grande sensibilidade ao epitélio.
As células epiteliais glandulares se especializam na produção de vários tipos de
secreção: quase sempre os produtos elaborados pelas células glandulares são
acumulados temporariamente no citoplasma, sob a forma de pequenas partículas
envolvidas por membrana, as vesículas ou grânulos de secreção. Os epitélios
glandulares formam órgãos denominados glândulas. Quando cada célula secretora
aparece isolada, a glândula é unicelular. A maioria das glândulas, porém, é pluricelular.
As glândulas originam-se pela proliferação das células de epitélios de revestimento,
com invasão do tecido conjuntivo subjacente e posterior diferenciação.
As glândulas são órgãos envolvidos por uma cápsula de tecido conjuntivo que
emite septos, dividindo-as em lobos e lóbulos. Vasos sanguíneos e nervos penetram na
glândula dentro dos septos, fornecendo nutrientes e estímulo nervoso para as funções
glandulares.
De acordo coma maneira pela qual o produto de secreção sai das células, as
glândulas podem ser merócrinas (só saem os produtos de secreção – pâncreas e
glândulas salivares), holócrinas (a célula toda se destaca da glândula, arrastando consigo
o produto de secreção – sebácea) e apócrinas (são intermediárias, o produto de secreção
é eliminado com uma parte do citoplasma apical – sudoríparas).
Glândulas endócrinas:
- tipo cordonal (adrenal, hipófise e paratireóide): células se dispõem em cordões
maciços que sofrem anastomose e ficam separados por capilares sanguíneos, que
recolhem os produtos elaborados pela glândula.
- tipo vesicular (tireóide): células se agrupam formando vesículas, constituídas por uma
só camada de células, limitando o espaço onde a secreção se acumula temporariamente.
Glândulas exócrinas: existe uma porção secretora e o ducto excretor. Quando a
glândula tem um único ducto que não se divide, é uma simples. Quando os ductos se
dividem, a glândula é chamada composta. A forma da porção secretora permite separar
as glândulas em acinosas e tubulosas. Os ácinos de luz ampla são por vezes chamados
de alvéolos. A associação das partes secretoras mencionadas forma as glândulas
tubuloacinosas e as tubuloalveolares. Quanto à parte secretora, as glândulas podem ser
ramificadas ou não.
Renovação das células epiteliais: há uma renovação constante das células graças a
uma atividade mitótica continua.
Metaplasia é a transformação patológica de um tecido em outro: em condições
patológicas, certas células podem sofrer alterações e dar origem a um novo tipo de
tecido. Exemplos: o epitélio pseudo-estratificado da taqueia e dos brônquios, em
fumantes crônicos sob a ação irritante do fumo, pode transformar-se em epitélio
estratificado pavimentoso; na deficiência crônica de vitamina A, o epitélio dos
brônquios, o epitélio de transição da bexiga e vários outros são substituídos por epitélio
estratificado pavimentoso queratinizado.
As glândulas são controladas por mecanismos nervosos e hormonais mediados por
mensageiros químicos: geralmente um fator predomina sobre o outro no controle da
atividade glandular. Tanto o controle nervoso como o hormonal se exercem através de
substancias chamadas mensageiros químicos. Os mensageiros químicos são chamados
neurotransmissores, e os produzidos pelas glândulas endócrinas são os hormônios.
OBS.: a partir de ATP ou GTP formam-se AMP ou GMP cíclicos, pela ação da enzima
adenilato ciclase ativada pelo primeiro mensageiro. A adenilato ciclase está localizada
na membrana e a ela se associa um receptor para o primeiro mensageiro. Os segundos
mensageiros, cAMP ou cGMP, formam-se dentro da célula, enquanto o primeiro
mensageiro permanece na face externa da membrana. Os efeitos de muitos
neurotransmissores e hormônios são mediados por cAMP ou cGMP. A especificidade
dos primeiros mensageiros sobre os diferentes tipos celulares depende dos receptores
específicos.
Os mensageiros químicos agem através de dois mecanismos. No primeiro caso,
o mensageiro penetra na célula, combina-se com receptores intracelulares e o complexo
do mensageiro com o receptor liga-se ao DNA ativando um ou mais genes, iniciando a
produção de proteínas específicas. Os hormônios esteróides que atravessam facilmente a
membrana plasmática, graças a sua grande solubilidade nos lipídios, agem desta
maneira.
O segundo mecanismo depende da interação do mensageiro com receptores
localizados na superfície externa da membrana da célula glandular. Essa molécula
mensageira, chamada primeiro mensageiro, induz o aparecimento dos mensageiros
intracelulares, que iniciam uma serie de eventos culminando com a ativação da
secreção. Os hormônios polipeptídicos e os neurotransmissores, que não são solúveis
nos lipídios e portanto não atravessam facilmente a membrana celular, atuam através
dos mensageiros intracelulares.
O transporte ativo de íons é facilitado pelo aumento da superfície celular e
consome muita energia: nos mamíferos, a concentração de Na+ no liquido extracelular
é de 140 mmol/L, enquanto a concentração intracelular desse íon é de apenas 5 – 15
mmol/L. Acresce que o interior da célula é eletricamente negativo em relação ao meio
extracelular. Nessas condições o íon sódio eletricamente positivo, tende a penetrar na
célula, a favor de um gradiente de concentração e elétrico. A célula usa a energia
acumulada em ATP para expelir Na+ por meio de um sistema conhecido como bomba
de sódio, mantendo assim baixa a concentração de sódio no meio intracelular.
Em muitos epitélios simples pavimentosos é intenso o transporte através de
vesículas de pinocitose: as células utilizam pinocitose para transportar
macromoléculas. Essa atividade observa-se nos epitélios simples dos endotélios e
mesotélios, caracterizados pela forma pavimentosa, presença de grande numero de
vesículas pinocitóticas na membrana e no citoplasma e relativa escassez de organelas. O
material captado por pinocitose numa face da célula atravessa o citoplasma no interior
das vesículas de pinocitose e é descarregado na face oposta da célula.
As células que secretam proteínas são ricas em reticulo endoplasmático rugoso:
todas as células sintetizam proteínas continuamente, para substituir as moléculas gastas
nos processos metabólicos normais. Mas algumas são especializadas, pela
diferenciação, para a produção de grandes quantidades de proteínas. Em células que
produzem enzimas digestivas, como o pâncreas, os grânulos que ficam no ápice da
célula, são chamados de grânulos de zimogênio.
Células epiteliais com função endócrina e parácrina, de localização difusa: muitas
células do sistema secretor difuso, encontrado no revestimento epitelial do estômago e
dos intestinos, são capazes de captar precursores das aminas e de promover a
descarboxilação destes precursores. Por estas razões, estas células secretoras foram
denominadas células APUD (Amine Precursors Uptake and Decarboxylation).
A secreção mucosa contém glicoproteínas complexas, hidrofílicas, viscosas e de
função lubrificante e protetora: a célula caliciforme é um exemplo desse tipo de
célula. Apresentam muitos grânulos de secreção glicoprotéica, grandes e pouco elétron-
densos no seu pólo apical. O núcleo é geralmente achatado e deslocado para a base da
célula. Esta região é rica em REG, o aparelho de Golgi é bem desenvolvido e localizado
logo acima do núcleo. Quando as glicoproteínas são liberadas da célula, tornam-se
muito hidratadas e formam um gel viscoso e elástico chamado muco, que protege e
lubrifica a superfície do epitélio.
Células serosas e mucosas: o termo seroso provém do fato do produto de secreção
dessas células ser um fluido claro, pouco viscoso, rico em proteínas, parecidas como
soro sanguíneo. As células mucosas caracterizam-se pela presença de grânulos de
secreção grandes e pouco corados, que ocupam a maior parte do citoplasma, deslocando
o núcleo, eu é achatado, para a base da célula. As células serosas apresentam núcleo
arredondado e claro, basofilia citoplasmática (REG) localizada principalmente no terço
basal da célula e numerosos grânulos de secreção acidófilos, facilmente visíveis na parte
apical da célula.
As células que secretam hormônios esteróides são ricas em REL e em mitocôndrias
contendo cristas tubulares: essas células são encontradas nos testículos, nos ovários, e
nas glândulas adrenais. Elas distinguem-se pelas seguintes características: são células
poliédricas ou arredondadas, com núcleo central e citoplasma geralmente com
numerosas gotículas de lipídios; o REL é muito desenvolvido; apresentam mitocôndrias
grandes, geralmente esféricas ou ligeiramente alongadas, que contêm parte das enzimas
necessárias para a síntese dos hormônios esteróides. Esta síntese resulta da colaboração
entre o REL e as mitocôndrias.
As células mioepiteliais, contráteis, envolvem ácinos e participam da expulsão da
secreção: em várias glândulas (sudoríparas, mamarias, salivares e lacrimais),
encontram-se células contrateis denominadas mioepiteliais, que se localizam entre a
lâmina basal e as células secretoras. Aumentam o fluxo do produto de secreção das
glândulas através da compressão das unidades secretoras. O citoplasma apresenta
numerosos filamentos de actina e contém também miosina. Apresentam ainda
filamentos intermediários de queratina, o que confirma sua origem epitelial.
Tumores derivados do tecido epitelial: os tumores malignos são os carcinomas,
quando derivados de um epitélio glandular, devem ser denominados adenocarcinomas.
Os tumores malignos são constituídos por células que se proliferam de modo
descontrolado e são capazes de atacar e perfurar a lâmina basal, para se espalharem pelo
organismo, formando as metástases. Como nos tumores dos outros tecidos, também nos
tumores de origem epitelial o grau de diferenciação das células tumorais é variável.
Quanto mais indiferenciado o tumor, maior sua malignidade. Muitas vezes é difícil
identificar a origem dos tumores muito indiferenciados. Como geralmente as células dos
tumores do tecido epitelial contêm proteínas da família das queratinas, a identificação
dessas proteínas, por meio de técnicas imunocitoquímicas, auxilia no diagnostico e no
planejamento do tratamento.
Histologia básica
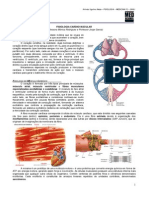
3 – Tecido conjuntivo
Apresenta diversos tipos de células separadas por abundante material
extracelular, sintetizado por elas. Esse material é representado por uma parte com
estrutura microscópica bem definida, as fibras do conjuntivo, e pela matriz extracelular
ou substância fundamental, um gel viscoso de macromoléculas alongadas
(glicosaminoglicanas, proteoglicanas e glicoproteínas adesivas) muito hidratadas, que
formam um arcabouço entrelaçado e ligado às fibras e a receptores celulares
denominados integrinas. As fibras do conjuntivo são de três tipos principais: colágenas,
reticulares e elásticas. Os tecidos conjuntivos originam-se do mesênquima. As células
mesenquimais possuem núcleos ovóides, com a cromatina fina. O mesênquima deriva,
principalmente, do mesoderma e suas células migram no embrião, envolvendo os órgãos
em formação e neles penetrando.
As fibras do conjuntivo são constituídas por proteínas que se polimerizam
formando estruturas alongadas: os três tipos de fibra se distribuem desigualmente
entre as variedades de tecido conjuntivo. Muitas vezes as fibras predominantes são
responsáveis por certas propriedades do tecido. Como as fibras colágenas e as
reticulares são constituídas por proteínas da família dos colágenos, existem na realidade
dois sistemas de fibras: o sistema colágeno e o sistema elástico.
O colágeno constitui uma família de proteínas que se diferenciaram durante a
evolução, para exercer funções diversificadas: o colágeno é a proteína mais
abundante do corpo humano. Essa família de proteínas é produzida por diversos tipos
celulares e se distingue pela composição bioquímica, características morfológicas,
distribuição, funções e patologia. De acordo com sua estrutura e funções, o colágeno
pode ser classificado em grupos, como descrito a seguir:
• Colágenos que formam fibrilas: as moléculas desse colágeno se agregam sem
gasto de energia, para formar fibrilas bem visíveis no ME. Pertencem a esse
grupo os colágenos I, II, III, V e XI. O tipo I é o mais abundante no corpo
humano, fazendo parte de muitos tecidos, onde ocorre como estruturas que
correspondem ao que classicamente se denomina fibras colágenas.
• Colágenos associados a fibrilas: suas moléculas constituem estruturas pequenas
que ligam as fibrilas colágenas umas às outras e também a outros componentes
da matriz extracelular. Compõem este grupo os colágenos tipos IX e XII.
• Colágenos que forma rede: suas moléculas se associam para formar um feltro ou
rede tridimensional é o tipo IV.
• Colágeno de ancoragem: é o tipo VII, que está presente nas fibrilas de
ancoragem que prendem as fibras colágenas às lâminas basais.
Tipos de Distribuição Célula Interações com Principal Organização
colágenos produtora glicosaminoglicanas função molecular
I Derme, tendão, Fibroblastos, Fraca, com sulfato Resistência a Forma fibrilas
osso, odontoblastos, de dermatana trações
fibrocartilagem osteoblastos,
condroblastos
II Cartilagem Condroblastos Forte, com sulfato Resistência à Forma fibrilas
hialina, disco de condroitina pressão
intervertebral
III Músculo liso, Células Média, com sulfato Manutenção Forma fibrilas
tecido musculares, de heparana da estrutura
conjuntivo células de tecidos
reticular reticulares, delicados e
células de expansíveis
Schwann
IV Lâminas basais Células Médio, com sulfato Suporte de Forma rede
endoteliais, de heparana estruturas tridimensional
epiteliais, e de delicadas, (feltro)
Schwann filtração
V Derme, tendão, Fibroblastos Participa das Forma fibrilas
osso, funções do
fibrocartilagem colágeno tipo
I
VII Derme Une células Colágeno de
ao tecido ancoragem
conjuntivo
IX Cartilagem Condroblastos Associação Colágeno
hialina lateral das associado a
fibrilas fibrilas
XI Cartilagem Condroblastos Participa das Forma fibrilas
hialina, disco funções do
intervertebral colágeno tipo
II
XII Tendão, Fibroblastos Associação Colágeno
ligamentos lateral de associado a
fibrilas fibrilas
Os principais aminoácidos encontrados no colágeno são glicina (33,5%), prolina
(12%) e hidroxiprolina (10%). Os AA característicos desta proteína são hidroxiprolina e
hidroxilisina.
A unidade protéica que se polimeriza para formar fibrilas colágenas é uma
molécula alongada denominada tropocolágeno, que consiste em três cadeias
polipeptídicas dispostas em hélice. As diferenças nas estruturas químicas dessas cadeias
são responsáveis pelos vários tipos de colágeno.
Nos colágenos dos tipos I, II e III, as moléculas de tropocolágeno se agregam em
unidade microfibrilares que se juntam para formar fibrilas. Pontes de hidrogênio e
interações hidrofóbicas são importantes para a união dessas unidades que,
posteriormente, são reforçadas por ligações covalentes, catalisadas pela atividade da
enzima extracelular lisil-oxidase, que oxida moléculas do aminoácido lisina,
estabelecendo pontes entre elas.
Nos colágenos tipos I e III as fibrilas formam fibras e no tipo I as fibras podem
formar feixes. O colágenos tipo II, presente nas cartilagens forma fibrilas mas não
forma fibras. O colágeno tipo IV, característico das lâminas basais, não forma fibrilas
nem fibras e, provavelmente, ocorre sob a forma de moléculas de tropocolágeno não
polimerizadas ou muito fracamente polimerizadas.
Fibras colágenas tipo I: as fibra colágenas clássicas são as mais freqüentes. No estado
fresco são brancas. Essas fibras são birrefringentes, pois são constituídas por moléculas
alongadas e paralelas. Desse modo, quando examinadas ao microscópio de polarização,
entre os filtros polaróides cruzados, as fibras colágenas aparecem brilhantes, contra um
fundo escuro. Em muitos tecidos essas fibras aparecem formando feixes. Fibras
colágenas são acidófilas e mostram estriação lateral.
Biossíntese do colágeno tipo I: ocorre de acordo com as seguintes etapas:
• De acordo com a codificação do mRNA, polirribossomos ligados ao REG
sintetizam cadeias polipeptídicas, que crescem para o interior das cisternas.
• À medida que essas cadeias (alfa) se formam, ocorre a hidroxilação da prolina e
da lisina. Hidroxiprolina e hidroxilisina livres não são incorporadas às cadeias
protéicas. A hidroxilação começa com a cadeia ainda presa aos polirribossomos,
mas continua após sua liberação nas cisternas. No processo tomam parte duas
enzimas, a prolina hidroxilase e a lisina hidroxilase.
• Quando a hidroxilisina se forma começa sua glicosilação. Todas as cadeias
colágenas têm galactose ou glicosilgalactose ligadas à hidroxilisina.
• Cada cadeia alfa é sintetizada com dois peptídeos de registro, um em cada
extremidade. Esses peptídeos determinam o alinhamento das cadeias protéicas
em grupos de três, facilitando a combinação dessas cadeias pra formar a
molécula de procolágeno, que é precursora, porém maior que o tropocolágeno.
Outra função dos peptídeos de registro é impedir a formação de fibrilas
colágenas no interior das células, pois as moléculas de procolágeno são solúveis
e não se agregam, como acontece como tropocolágeno.
• No meio extracelular, os peptídeos de registro são separados das cadeias alfa
pela ação das enzimas procolágeno peptidases, que aparentemente são
produzidas pelas mesmas células que sintetizam colágeno. Originam-se, então,
as moléculas de tropocolágeno, que se polimerizam para formar as fibrilas
colágenas. Os resíduos de hidroxiprolina formam pontes de hidrogênio entre as
três cadeias alfa, contribuindo para a estabilidade da hélice tripla do
tropocolágeno.
• Nos colágenos tipos I e III, as fibrilas se agregam espontaneamente, para formar
fibras. Certas proteoglicanas e glicoproteínas estruturais desempenham papel
importante na agregação do tropocolágeno para formar fibrilas e na agregação
da fibrilas para formar fibras.
• A estrutura fibrilar é reforçada para a formação de ligações covalentes entre as
moléculas de tropocolágeno. Este processo é catalisado pela enzima extracelular
lisil-oxidase (enzima que oxida a lisina).
OBS.: a renovação do colágeno é,em geral, muito lenta, e em muitos órgãos, como os
tendões e ligamentos, ele é praticamente estável. A degradação, para renovação, é
iniciada por enzimas específicas, as colagenases. Essas enzimas quebram a molécula em
dois pedaços que são suscetíveis ao ataque das proteases (enzimas que digerem
proteínas) não específicas.
As fibras reticulares são constituídas principalmente de colágeno do tipo II:
formam uma rede extensa em certos órgãos, geralmente apoiando as células. Em virtude
de sua afinidade pelos sais de prata, são chamadas também de fibras argirófilas. São
formadas pelo colágeno tipo III associado a elevado teor de glicoproteínas e
proteoglicanas. As ME exibem estriação transversal típica das fibrilas colágenas.
Constituem o arcabouço de sustentação das células dos órgãos hemocitopoéticos
(baço, linfonodos, medula óssea) das células musculares e das células de muitos órgãos
epiteliais, como o fígado, os rins e as glândulas endócrinas. O pequeno diâmetro dessas
fibras e sua disposição em rede criam um suporte adaptado às necessidades dos órgãos
que sofrem modificações fisiológicas de forma e de volume.
O sistema elástico: fibras elásticas, elaunínicas e oxitalânicas: as fibras elásticas são
facilmente distinguidas por serem mais delgadas que a fibras colágenas e não
apresentarem estriação longitudinal. Ramificam-se e ligam-se umas às outras, formando
uma trama de malhas muito irregulares. Têm coloração amarelada. Cedem facilmente,
mesmo a trações mínimas, porem retornam a sua forma inicial tão logo cessem as forças
deformantes.
Pela técnica HE, as fibras elásticas coram-se mal e irregularmente. O principal
componente das fibras elásticas é a glicoproteína estrutural elastina, que é resistente a
diversas enzimas, mas pode ser digerida pela elastase secretada pelo pâncreas.
As fibras elásticas são formadas por microfibrilas (aparecem primeiro) com 10
nm de espessura, envolvendo uma parte central, amorfa. A elastina constitui o material
amorfo dessas fibras, sendo as microfibrilas formadas por várias glicoproteínas,
incluindo uma cuja molécula é muito grane denominada fibrilina.
OBS.: defeito no gene responsável pela codificação da fibrilina, localizado no
cromossomo 15, resulta na síndrome de Marfan na qual ocorre hiperextensibilidade das
articulações, deslocamento do cristalino e dilatação da aorta.
Alem das fibras elásticas típicas, nas quais existe grande abundancia de elastina
e uma quantidade muito menor de microfibrilas, descreve-se ainda no sistema elástico
as fibras elaunínicas e as oxitalânicas (só possuem microfibrilas, não têm elastina),
encontradas com menor freqüência. As primeiras foram observadas na pele e as
segundas no ligamento periodontal e nos tendões.
As principais células produtoras de elastina são os fibroblastos e as células
musculares lisas dos vasos sanguíneos. Inicialmente, é sintetizada uma molécula de
proelastina que, no espaço extracelular, polimeriza-se para formar elastina. A elastina
contém dois aminoácidos típicos, desmosina e isodesmosina, formados por ligações
covalentes entre resíduos de lisina.
Células do tecido conjuntivo: algumas se originam localmente, enquanto outras, como
os leucócitos, vêm de outros locais e são habitantes temporários desse tecido. As células
do tecido conjuntivo são: fibroblastos, macrófagos, mastócitos, plasmócitos, células
adiposas e leucócitos.
Tipo celular Localização Funções principais
Monócito Sangue Precursor dos macrófagos
Macrófago Tecido conjuntivo, órgãos Secreção de citocinas,
linfáticos, pulmão fatores quimiotáticos e
diversas outras moléculas
que participam do processo
defensivo da inflamação
Célula de Kupffer Fígado A mesma dos macrófagos
Célula da micróglia Tecido nervoso do SNC A mesma dos macrófagos
Célula de Langerhans Pele Apresentação de antígenos
Osteoclasto Tecido ósseo Digestão da matriz óssea
Célula gigante Tecido conjuntivo (fusão Digestão ou segregação de
multinucleada de diversos macrófagos) corpos estranhos
O fibroblasto sintetiza colágeno, elastina, proteoglicanas e glicoproteínas
estruturais: a célula em intensa atividade sintética, tem morfologia diferente do
fibroblasto que já sintetizou muito e que se situa entre as fibras por ele fabricadas. O
fibroblasto tem prolongamentos citoplasmáticos irregulares, seu núcleo é claro, com
cromatina fina e nucléolo evidente. O citoplasma é rico em REG e o aparelho de Golgi é
bem desenvolvido. O fibrócito é uma célula menor, fusiforme, e com menor numero de
prolongamentos. Tem núcleo menor, alongado, e mais escuro, apresentando o
citoplasma acidófilo. Ao ME chama a atenção a deficiência em REG e aparelho de
Golgi.
OBS.: havendo um estímulo adequado, como na cicatrização, o fibrócito pode voltar a
sintetizar fibras, reassumindo a estrutura de fibroblasto.
Os fibroblastos sintetizam as fibras colágenas, reticulares e elásticas, e as
glicoproteínas e proteoglicanas da matriz extracelular. No tecido conjuntivo do adulto
os fibroblastos não se dividem com freqüência, entrando em mitose apenas quando
ocorre uma solicitação.
Macrófago e sistema mononuclear fagocitário: o macrófago é uma célula muito ativa
na movimentação amebóide, com grande capacidade de fagocitose, morfologia variável
conforme seu estado funcional e sua localização, núcleo ovóide ou em forma de rim,
com cromatina condensada, seu citoplasma contém muitos lisossomos que derramam
suas enzimas nos vacúolos que contêm material englobado, formando-se, assim, os
fagossomos, onde se processa a digestão do material fagocitado. Os macrófagos atuam
como elementos de defesa. Fagocitam restos de células, material extracelular alterado,
células cancerosas, bactérias e partículas inertes que penetram no organismo, e secretam
diversas substancias que têm papel importante nos processos imunitários de defesa.
Alem disso, atuam como células apresentadoras de antígenos. Quando encontram
corpos estranhos de grandes dimensões, os macrófagos fundem-se uns com os outros,
constituindo células muito grandes, com 100 ou mais núcleos: as células gigantes
multinucleadas.
Os macrófagos são originários dos monócitos, que são produzidos na medula
óssea. Os monócitos atravessam a parede das vênulas e capilares, penetrando no tecido
conjuntivo, onde adquirem o aspecto morfológico do macrófago. Durante esse processo
de transformação há um aumento da síntese protéica, do tamanho da célula, do tamanho
do aparelho de Golgi e do numero de lisossomos, microtúbulos e microfilamentos. O
conjunto das células da medula óssea que são precursoras dos monócitos, mais os
próprios monócitos e os macrófagos, denomina-se sistema fagocitário mononuclear.
Mastócito participa da inflamação e tem um papel central na alergia: é uma célula
globosa, grande e com o citoplasma carregado de grânulos basófilos que se coram
intensamente, seu núcleo é esférico e central, mas frequentemente não pode ser visto
por estar coberto pelos grânulos citoplasmáticos. São difíceis de serem observados nas
lâminas coradas com HE, porém com azul-de-toluidina os grânulos são corados de
vermelho. A capacidade de modificar a coloração do corante chama-se metacromasia e
é devida à presença de numerosos radicais ácidos nas estruturas. Os grânulos dos
mastócitos são metacromáticos por conterem heparina ou então sulfato de condroitina,
glicosaminoglicanas sulfatadas, eles contêm ainda histamina e o fator quimiotático dos
eosinófilos na anafilaxia, mais conhecido pela sigla ECF-A (Eosinophil Chemotactic
Factor of Anaphylaxis), que atrai eosinófilos. Mastócitos secretam também alguns
leucotrienos (C4, D4 e E4) ou SRS-A (Slow Reacting Substance of Anaphylasis), porém
esses compostos não existem pré-formados na célula. Produzem lentas contrações no
músculo liso. As moléculas produzidas pelo mastócito atuam localmente, caracterizando
uma secreção parácrina.
Embora com a mesma morfologia, há ao menos duas populações diferentes de
mastócitos. Numa delas, encontrada no tecido conjuntivo em geral, os grânulos contêm
heparina, uma substância anticoagulante. Na outra população, presente nas mucosas, os
grânulos contêm sulfato de condroitina.
A superfície do mastócito contém receptores específicos para a imunoglobulina
E (IgE), produzida pelos plasmócitos.
OBS.: a liberação dos mediadores químicos armazenados nos mastócitos promove as
reações alérgicas denominadas reações de sensibilidade imediata. Admite-se que na
anafilaxia ocorra o seguinte: na primeira injeção forma-se IgE que se prende à
membrana dos mastócitos. Numa injeção subseqüente, isto é, na que provoca o choque,
o medicamento reage com as moléculas de IgE presas aos mastócitos, provocando a
extrusão maciça dos grânulos e a liberação de histamina, leucotrienos e ECF-A.
O plasmócito se origina do linfócito B ativado e produz anticorpos: são pouco
numerosos no conjuntivo normal, exceto nos locais sujeitos à penetração de bactérias e
proteínas estranhas, mas aparecem em grande quantidade nas inflamações crônicas. Os
plasmócitos são células ovóides, com citoplasma muito basófilo, graças a sua riqueza
em REG. A área onde está o aparelho de Golgi aparece clara. O núcleo do plasmócito é
esférico com a cromatina em grumos compactos e grosseiros, que se alternam com áreas
claras, o que lhe confere o aspecto de uma roda de carroça. Eles sintetizam e secretam
anticorpos, proteínas específicas também denominadas imunoglobulinas, fabricadas em
resposta ao antígeno. Os efeitos da reação antígeno-anticorpo são variados, podendo
neutralizar as ações prejudiciais que o antígeno teria sobre o organismo.
Células adiposas: é especializada no armazenamento de energia, sob a forma de
triglicerídeos.
O conjuntivo normal contém leucócitos vindos do sangue por diapedese: a
diapedese aumenta muito nas invasões locais de microorganismos, pois os leucócitos
são células cuja função é defesa. Os leucócitos mais freqüentes no tecido conjuntivo
são: neutrófilos, eosinófilos e os linfócitos. Exceto os linfócitos, que circulam essas
células não retornam ao sangue depois que penetram no tecido conjuntivo, onde
permanecem por um período variável e morrem pelo processo de apoptose.
A matriz extracelular é muito hidratada e constituída principalmente de
proteoglicanas e glicoproteínas adesivas: a matriz é formada por proteoglicanas e
glicoproteínas adesivas assim chamadas porque participam da aderência entre as
células, fibras e macromoléculas de matriz extracelular. As proteoglicanas são
compostos macromoleculares, constituídos por glicosaminoglicanas sulfatadas ligadas
por covalência a proteínas. Uma molécula de proteoglicana parece uma escova de
limpar frascos, com uma parte central protéica (cerne protéico) e as glicosaminoglicanas
como os pêlos da escova.
Glicosaminoglicanas (GAGs) são polímeros lineares (não ramificados) de peso
molecular elevado, formados por unidades dissacarídicas constituídas por um ácido
urônico e uma hexosamina. As GAGs eram chamadas mucopolissacarídeos, hoje não
são mais, porém as doenças resultantes de defeitos no metabolismo da GAGs ainda são
chamadas mucopolissacaridoses. O ácido urônico das GAGs é quase sempre o ácido
glicurônico e as hexosaminas são a glicosamina ou a galactosamina. As principais
GAGs são o ácido hialurônico e o dermatansulfato (também chamados sulfato de
dermatana, sulfato de queratana, sulfato de condroitina e sulfato de heparana). A única
GAG não sulfatada é o ácido hialurônico, que apresenta a peculiaridade de não se ligar
por covalência a proteínas, embora possa participar de agregados dos quais participam
moléculas protéicas. Possuindo numerosos grupos carboxila e sulfato em suas
moléculas, as GAGs são poliânions, ligando-se por eletro valência a elevado numero de
cátions, que atraem grande quantidade de moléculas de água. Por sua hidratação, as
moléculas de proteoglicanas ocupam enorme espaço, tornando-se muito eficientes para
resistir a forças de compressão, enquanto as fibras colágenas são muito resistentes a
forças de distensão. Algumas proteoglicanas servem como locais de ancoragem para o
fator do crescimento fibroblástico e para outras proteínas que estimulam a proliferação
celular.
As moléculas das glicoproteínas adesivas contêm uma parte protéica que se
associa a glicídios. Porém, ao contrário das proteoglicanas, há uma predominância da
parte protéica, e as glicoproteínas não apresentam os polissacarídeos lineares. Nas
glicoproteínas a parte glicídica é uma estrutura ramificada. As moléculas dessas
glicoproteínas possuem regiões que aderem a receptores celulares e fibras do
conjuntivo, promovendo a ligação entre esses elementos. A fibronectina e a laminina
são glicoproteínas adesivas. A primeira representa uma família de glicoproteínas, com
sítios de aderência para células, colágeno e glicosaminoglicanas, essa aderência torna
possível a migração das células, que só pode ser feita sobre um substrato, e a fixação
das células em locais determinados. A glicoproteína laminina é encontrada nas lâminas
basais, onde participa da aderência dessas estruturas às células e influencia a filtração de
moléculas através das lâminas basais.
O edema é causado pelo acumulo de água no meio extracelular (excesso de entrada
ou dificuldade de drenagem): há duas forças que atuam sobre a água contida nos
capilares: pressão hidrostática do sangue (pressão arterial – conseqüência da contração
cardíaca) e pressão osmótica do plasma sanguíneo (que atrai água para dentro dos
capilares – deve-se às proteínas do plasma).
Em condições normais, ocorre uma passagem de água para fora dos capilares na
porção arterial deles, pelo fato de que aí a pressão hidrostática vence a pressão
osmótica. Mas a pressão hidrostática decresce ao longo do capilar, sendo mínima na sua
extremidade venosa. Enquanto a hidrostática cai, a osmótica aumenta, em conseqüência
da saída de água. O aumento da concentração de proteínas e a queda da pressão
hidrostática fazem com que, na parte venosa do capilar, a pressão osmótica prevaleça,
atraindo água para o interior do capilar. A quantidade de água que volta aos capilares é
menor do que a que saiu deles. A água que resta na matriz extracelular do conjuntivo
retorna ao sangue por meio dos vasos linfáticos. A linfa movimenta-se em direção ao
sangue, pois os vasos linfáticos desembocam em veias onde toda a linfa é lançada. Os
capilares linfáticos são estruturas em fundo de saco, que drenam o excesso de água
existente no conjuntivo.
Variedades de tecido conjuntivo: os nomes dados aos diferentes tipos refletem o
componente predominante ou a organização estrutural do tecido. São comuns os tecidos
cuja estrutura é intermediaria entre duas variedades típicas da classificação adiante
mencionada.
Tecido
conjuntivo
Tecido Tecido Tecido Tecido
conjuntivo conjuntivo de cartilaginoso
propriamente propriedades ósseo
dito especiais
Frouxo Denso Tecido Tecido Tecido Tecido
adiposo elástico reticular mucoso
Modelado Não-
modelado
O tecido conjuntivo frouxo sustenta estruturas normalmente sujeitas a pressão e
atrito pequenos: preenche espaços entre as fibras e feixes musculares, serve de apoio
para os epitélios e forma uma camada em torno dos vasos sangüíneos e linfáticos. Aqui
não há predomínio acentuado de qualquer um dos componentes. As células mais
comuns são os fibroblastos e os macrófagos, mas todos os outros tipos descritos estão
presentes. Esse tecido é de consistência delicada, flexível e pouco resistente às trações.
O tecido conjuntivo denso é adaptado para oferecer resistência e proteção: formado
pelos mesmos elementos encontrados no tecido frouxo, havendo predominância
acentuada das fibras colágenas. Menos flexível que o frouxo e muito mais resistente às
trações. Quando as fibras colágenas se dispõem em feixes arranjados sem orientação
fixa, o tecido chama-se denso não-modelado, aqui os feixes colágenos formam uma
trama tridimensional, que confere ao tecido resistência à tração exercida em qualquer
direção.
O denso modelado apresenta feixes colágenos paralelos uns aos outros. Trata-se
de um conjuntivo que formou suas fibras colágenas em resposta a trações exercidas num
determinado sentido. Entre os feixes paralelos de fibras colágenas existe pequena
quantidade de substancia fundamental. Seus fibroblastos têm núcleo alongados,
paralelos às fibras, e citoplasma delgado com prolongamentos que tendem a envolver os
feixes colágenos. os feixes colágenos do tendão (feixes primários) formam conjuntos
(feixes secundários) envolvidos por tecido conjuntivo frouxo que contém vasos
sangüíneos e nervos. Finalmente, o tendão é envolvido externamente por uma bainha de
conjuntivo denso. Em alguns tendões essa bainha é dividida em duas camadas: uma
presa ao tendão e a outra ligada às estruturas vizinhas. Forma-se, assim, uma cavidade
revestida por células achatadas e de origem mesenquimatosa, que encera um liquido
viscoso semelhante ao liquido sinovial das articulações, o qual contém água, proteínas,
GAGs, glicoproteínas e íons. Este líquido é lubrificante e facilita o deslocamento do
tendão dentro da sua bainha.
Tecido elástico: formado por feixes paralelos de fibras elásticas grossas. O espaço entre
estas fibras é ocupado por fibras colágenas e fibroblastos achatados. Um tecido rico
nessas fibras tem cor amarela e grande elasticidade, porém ele é pouco freqüente, sendo
encontrado nos ligamentos amarelos da coluna vertebral e no ligamento suspensor do
pênis.
O tecido reticular, muito delicado, forma uma rede tridimensional para
sustentação celular: constituído por fibras reticulares em intima associação com
fibroblastos especializados chamados células reticulares. Encontra-se nos órgãos
formadores de células do sangue (medula óssea hematógena e órgãos linfáticos).
O tecido mucoso é encontrado principalmente no cordão umbilical: tem
consistência gelatinosa e apresenta predomínio da matriz extracelular, constituída
principalmente por ácido hialurônico. Contém poucas fibras colágenas e raras fibras
elásticas e reticulares. As células são principalmente fibroblastos. O tecido mucoso é o
principal componente do cordão umbilical, onde é chamado de gelatina de Wharton,
sendo encontrado também na polpa dental jovem.
HISTOFISIOLOGIA: o tecido conjuntivo desempenha as funções de: sustentação,
preenchimento, armazenamento, transporte, defesa e reparação.
O conjuntivo integra o sistema imunitário de defesa contra proteínas estranhas
presentes nas bactérias, vírus, células tumorais etc.: esse tecido contém células
fagocitárias e células produtoras de anticorpos. O material extracelular, sendo um gel
viscoso, representa uma barreira à penetração da bactérias e partículas inertes. Por isso,
as bactérias que produzem hialuronidase têm acentuado poder invasivo.
Na inflamação, os leucócitos passam em grande quantidade do sangue para
conjuntivo atravessando, por movimento amebóide, a parede das vênulas e capilares,
atraídos por diversas substâncias que se formam na inflamação. As células que se
acumulam na área inflamada fagocitam microorganismos, restos de células e fibras
alteradas pela inflamação e produzem anticorpos contra os invasores.
Células do conjuntivo têm a capacidade de se multiplicar para regenerar o tecido
destruído: esse tipo de tecido é dotado de grande capacidade de regeneração, o que é
muito importante, também, quando ocorre destruição de outros tecidos, pois o espaço é
preenchido pelo conjuntivo, formando as cicatrizes.
O conjuntivo é muito sensível à hidrocortisona e aos hormônios da tireóide:
diversos hormônios influem sobre o metabolismo do tecido conjuntivo. Um exemplo é o
cortisol ou hidrocortisona (córtex da adrenal) que impede a síntese das fibras do
conjuntivo. O hormônio adrenocorticotrófico (ACTH), produzido pela adenoipófise,
tem o mesmo efeito porque estimula a produção de cortisol. Injeções desses hormônios
dificultam a cicatrização e atenuam a resposta inflamatória. A deficiência em hormônio
da tireóide causa um acúmulo excessivo de proteoglicanas no tecido conjuntivo. Por
isso, o hipotireoidismo do adulto é chamado de mixedema, o que significa edema de
muco.
A renovação normal do colágeno varia conforme o tecido, mas em geral é lenta: o
colágeno é uma proteína estável, sendo sua renovação, portanto, um tanto lenta. A
deficiência de vitamina C impede a síntese de colágeno pelos fibroblastos, de modo que
as fibras removidas não podem ser substituídas. A conseqüência é uma degeneração
generalizada do tecido conjuntivo (escoburto), mais acentuada onde a renovação do
colágeno é, mas acelerada.
A destruição fisiológica do colágeno para sua renovação é iniciada pela ação da
enzima específica colagenase, produzida por células do tecido conjuntivo.
Histologia básica
4 – Tecido adiposo
É um tipo especial de conjuntivo onde se observa predominância de células
adiposas (adipócitos), que podem ser encontradas isoladas ou em pequenos grupos no
tecido conjuntivo comum, porém a maioria delas se agrupa no tecido adiposo espalhado
pelo corpo. O tecido adiposo é o maior depósito de energia (sob forma de triglicerídeos)
do corpo. As células hepáticas e o músculo esquelético também acumulam energia, mas
sob forma de glicogênio. Os triglicerídeos são mais eficientes como reserva de energia
porque fornecem 9,3 kcal/ g contra apenas 4,1 kcal/ g do glicogênio. Outra função do
tecido adiposo é que ele forma coxins absorventes de choques, principalmente na planta
dos pés e na palma das mãos. Como as gorduras são, mas condutoras de calor, o tecido
adiposo contribui para o isolamento térmico do organismo. Alem disso preenche
espaços entre outros tecidos e auxilia a manter certos órgãos em suas posições normais.
Há duas variações de tecido adiposo que apresentam distribuições no corpo,
estrutura, fisiologia e patologia diferentes. Existe o tecido adiposo comum, amarelo ou
unilocular (células com apenas uma gota de gordura) e o tecido adiposo pardo ou
multilocular (células com numerosas gotículas lipídicas e muitas mitocôndrias).
O tecido adiposo unilocular apresenta-se distribuído no corpo humano de acordo
como biótipo, sexo, idade, e constitui reserva de energia contra o frio: a coloração
do tecido adiposo deve-se principalmente, ao acúmulo de carotenóides dissolvidos nas
gorduras. Praticamente todo o tecido adiposo presente no homem adulto é unilocular,
que se distribui por todo o corpo e seu acúmulo em certos locais depende do sexo e da
idade. Esse tecido forma o panículo adiposo, camada disposta sob a pele e que é de
espessura uniforme por todo o corpo do recém-nascido. Com a idade, o panículo
adiposo tende a desaparecer de certas áreas e desenvolver em outras. Essa deposição
seletiva de gordura é regulada pelos hormônios sexuais e os adrenocorticais.
Todas as gotículas das células, independente do tamanho são desprovidas de
membranas envolventes, mas são envoltas por uma rede de filamentos intermediários.
Cada célula adiposa é envolvida por uma lâmina basal. O tecido unilocular apresenta
septos de conjuntivo, que contêm vasos e nervos. Desses septos partem fibras
reticulares que vão sustentar as células adiposas. A vascularização do tecido adiposo é
muito abundante, quando se considera a pequena quantidade de citoplasma funcionante.
Histofisiologia do tecido unilocular: os triglicerídeos existentes originam-se da
seguinte maneira: absorvidos da alimentação e trazidos até as células adiposas como
triglicerídeos dos quilomícrons; oriundos do fígado e transportados até o tecido adiposo,
sob a forma de triglicerídeos constituintes das lipoproteínas de pequeno peso molecular
ou VLDL (Very Low Density Lipoproteins); da síntese nas próprias células adiposas, a
partir da glicose.
Quando é necessária a hidrolise dos triglicerídeos é desencadeada por estímulos
neurogênicos e humorais que promovem a liberação de ácidos graxos e glicerol, os
quais passam para o sangue. A enzima lípase sensível a hormônio é ativada pela adenil-
ciclase, quando o tecido adiposo é estimulado pela noradrenalina. A membrana dos
adipócitos possui receptores para diversos hormônios, e o metabolismo do tecido
adiposo é complexo, nele intervindo o hormônio do crescimento, os glicocorticóides, a
insulina, o hormônio da tireóide e a prolactina.
O tecido adiposo unilocular e o multilocular são inervados por fibras simpáticas
do SN Autônomo. No tecido unilocular as terminações são encontradas somente nas
paredes dos vasos sanguíneos, já no multilocular as terminações nervosas simpáticas
atingem diretamente as células adiposas.
As células adiposas se originam no embrião, a partir de células derivadas do
mesênquima, os lipoblastos. São parecidas com os fibroblastos, porém logo acumulam
gordura no seu citoplasma.
Em humanos o tecido multilocular está presente no recém-nascido, localizado na
porção dorsal do tronco: a cor parda desse tecido é devida à vascularização abundante
e às numerosas mitocôndrias presentes em suas células. O tecido adiposo pardo
apresenta-se abundante nos animais que hibernam e, devido a isso, recebeu o nome
pouco próprio de glândula hibernante. Esse tecido não cresce, por isso no adulto é
extremamente reduzido. No tecido adiposo multilocular as células tomam um arranjo
epitelióide, formando massas compactes em associação com capilares sanguíneos,
lembrando as glândulas endócrinas.
A principal função do tecido adiposo multilocular é produzir calor: esse tecido é
especializado na produção de calor, tendo papel importante nos mamíferos que
hibernam. Na espécie humana, a quantidade deste tecido só é significativa no recém-
nascido, com função auxiliar na termorregulação. Ao ser estimulado pela liberação de
noradrenalina nas terminações nervosas abundantes em torno das suas células, o tecido
adiposo multilocular acelera sua lipólise e oxidação dos ácidos graxos. A oxidação dos
AG produz calor e não ATP, porque as mitocôndrias do tecido multilocular apresentam,
nas suas membranas internas, uma proteína transmembrana chamada termogenina. Esta
proteína permite a volta para a matriz mitocondrial dos prótons transportados para o
espaço intermembranoso, sem que eles passem pelo sistema de ATP sintetase existente
nos corpúsculos elementares das mitocôndrias. Em conseqüência, a energia gerada pelo
fluxo de prótons não é usada para sintetizar ATP, sendo dissipada como calor. O calor
aquece o sangue contido na extensa rede capilar presente no tecido multilocular e é
distribuído para todo o corpo, aquecendo os diversos órgãos.
Nas espécies que hibernam o despertar da hibernação é devido à ação dos
estímulos nervosos sobre o tecido multilocular, que funciona como um acendedor dos
outros tecidos, por distribuir para esses sangue aquecido.
A histogênese do tecido multilocular: sua formação é diferente da do tecido
unilocular. As células mesenquimatosa que vão formar o tecido multilocular tornam-se
epitelióides, adquirindo um aspecto de glândula endócrina cordonal antes de
acumularem gordura. Não há neoformação de tecido adiposo multilocular após o
nascimento nem ocorre transformação de um tipo de tecido adiposo no outro.
Histologia básica
5 – Tecido cartilaginoso
É uma forma especializada de tecido conjuntivo de consistência rígida.
Desempenha função de suporte de tecidos moles, reveste superfícies articulares onde
absorve choques e facilita o deslocamento, e é essencial para a formação e o
crescimento dos ossos longos. Como os demais tecidos do conjuntivo, o tecido
cartilaginoso contém células, os condrócitos, e abundante material extracelular, que
constitui a matriz. As cavidades da matriz ocupadas pelos condrócitos são chamadas
lacunas.
As funções do tecido cartilaginoso dependem principalmente da estrutura da
matriz, que é constituída por colágeno ou colágeno mais elastina em associação com
macromoléculas de proteoglicanas e glicoproteínas adesivas. Como colágeno e a
elastina são flexíveis, a consistência firme das cartilagens, se deve, principalmente, às
ligações eletrostáticas entre as GAGs sulfatadas e o colágeno, e à grande quantidade de
moléculas de água presa a essas GAGs (água de solvatação), o que confere turgidez à
matriz.
O tecido cartilaginoso não possui vasos sanguíneos, sendo nutrido pelos
capilares do conjuntivo envolvente (pericôndrio) ou através do líquido sinovial das
cavidades articulares. O tecido cartilaginoso é desprovido de vasos linfáticos e nervos.
Existem três tipos de cartilagem: (1) cartilagem hialina, que é a mais comum e
cuja matriz possui delicadas fibrilas constituídas principalmente de colágeno tipo II; (2)
cartilagem elástica, que possui poucas fibrilas de colágeno tipo II e abundantes fibras
elásticas; (3) cartilagem fibrosa), que apresenta matriz constituída por fibras de
colágeno tipo I. As cartilagens (exceto as articulares e a fibrosa) são envolvidas por uma
bainha conjuntiva que recebe o nome de pericôndrio.
Cartilagem hialina: é o tipo mais frequentemente encontrado no corpo humano, tem
cor branco-azulada e é translúcida. Forma o primeiro esqueleto do embrião, que
posteriormente, é substituído por esqueleto ósseo. Entre a diáfise e a epífise dos ossos
longos em crescimento observa-se o disco epifisário, de cartilagem hialina, que é
responsável pelo crescimento do osso em extensão. É encontrada: na parede das fossas
nasais, traquéia, brônquios, extremidade ventrais das costelas e recobrindo as
superfícies articulares dos ossos longos.
A matriz da cartilagem hialina contém fibrilas colágenas, proteoglicanas e
glicoproteínas: a cartilagem hialina é formada, em 40% do seu peso seco, por fibrilas
de colágeno tipo II associadas à proteoglicanas muito hidratadas e a glicoproteínas
adesivas. Em adição ao colágeno, a matriz contém GAGs combinadas por covalência
com proteínas, formando proteoglicanas. Ate 200 proteoglicanas podem estabelecer
ligações não covalentes com uma única molécula de ácido hialurônico, que é uma
glicosamina não sulfatada e de alto peso molecular, para formar uma molécula enorme
de agrecana, que é um agregado muito importante para manter a rigidez da matriz
cartilaginosa, interage com as fibrilas colágenas.
O alto conteúdo de água de solvatação das moléculas de GAGs atua como um
sistema de absorção de choques mecânicos, ou mola biomecânica, de grande significado
funcional, principalmente nas cartilagens articulares.
Outro componente importante da matriz da cartilagem hialina é a glicoproteína
adesiva condronectina, uma macromolécula com sítios de ligação para condrócitos,
fibrilas colágenas e GAGs.
Histologia básica
10 – Tecido muscular
É responsável pelos movimentos corporais. Constituído por células alongadas
caracterizadas pela presença de grande quantidade de filamentos citoplasmáticos
responsáveis pela contração. Têm origem mesodérmica. Pode se distinguir em três
tipos:
• Músculo liso: células fusiformes que não possuem estrias transversais. O
processo de contração é lento e não está sujeito ao controle voluntário.
• Músculo estriado esquelético: feixes de células cilíndricas muito longas e
multinucleares, com estrias transversais. Têm contração rápida, vigorosa e
sujeita ao controle voluntário.
• Músculo estriado cardíaco: apresenta estrias transversais, é formado por células
alongadas e ramificadas, que se unem entre si por meio dos discos intercalares.
Apresentam contração involuntária, vigorosa e rítmica.
Numa célula muscular a membrana é chamada sarcolema, o citoplasma é o
sarcoplasma, o RE é o retículo sarcoplasmático e as mitocôndrias são sarcosomas.
O músculo esquelético é constituído de fibras musculares envoltas por camadas
gradualmente mais complexas de tecido conjuntivo: o endomísio, o perimísio e o
epimísio: as fibras musculares se originam no embrião através da fusão de células
alongadas, os mioblastos. Num músculo, os feixes de fibras não estão agrupados ao
acaso, mas organizados em feixes envolvidos por uma membrana externa de tecido
conjuntivo, chamada epimísio. Dele partem septos muito finos de tecido conjuntivo, que
se dirigem para o interior do músculo, dividindo-o em feixes, esses septos constituem o
perimísio. Cada fibra muscular é envolvida por uma camada muito fina constituída pela
lamina basal da fibra muscular e por fibras reticulares do endomísio.
O tecido conjuntivo permite que a força de contração gerada por cada fibra atue
sobre o músculo inteiro. Este papel tem grande significado funcional, porque na maioria
das vezes as fibras não se estendem de uma extremidade do músculo até a outra. É ainda
por intermédio do tecido conjuntivo que a força de contração do músculo se transmite a
outras estruturas como tendões, ligamentos e ossos.
Cada fibra muscular apresenta perto do seu centro uma terminação nervosa
motora, chamada placa motora. O citoplasma da fibra muscular apresenta-se preenchido
principalmente por fibrilas paralelas - as miofibrilas.
Cada miofibrila é formada de unidades morfofuncionais – os sarcômeros: as
estriações aparecem pela alternância de faixas claras e escuras, ou seja, pela repetição
de unidades iguais, chamadas sarcômeros. Um sarcômero é formado por uma banda A
(anisotrópica) escura, com uma banda H clara no meio dela, duas semibandas I
(isotrópicas) claras e duas linhas Z. Da linha Z partem filamentos finos (actina) que
correm até o bordo externo da banda H. os filamentos grossos de miosina ocupam a
região central do sarcômero. Na região lateral da banda A, os filamentos finos e grossos
se interdigitam, num arranjo hexagonal como filamento grosso no meio.
Os filamentos grossos são formados de miosina e os filamentos finos têm actina,
tropomiosina e troponina.
• Actina: polímeros longos (actina F) formados por duas cadeias de monômeros
globulares (actina G) torcidas uma sobre a outra em hélice dupla. Uma
característica importante das moléculas de actina G é sua assimetria estrutural.
Cada monômero globular de actina G possui uma região que interage com a
miosina. Os filamentos de actina ancorados perpendicularmente em cada lado da
linha Z exibem polaridades opostas em cada lado dessa linha.
• Tropomiosina: é uma molécula longa e fina com duas cadeias polipeptídicas,
uma enrolada na outra. Elas se unem pela extremidade para formar filamentos
longos que se localizam ao longo do sulco existente entre os dois filamentos de
actina F.
• Troponina: é um complexo de três subunidades: TnT, que se liga à
tropomiosina; TnC, que tem grande afinidade pelos íons cálcio; e TnI, que cobre
o sitio ativo da actina onde ocorre a interação entre a actina e a miosina. Cada
molécula de tropomiosina tem um local específico onde se prende um complexo
de troponina.
• Miosina: é formada por dois peptídeos enrolados em hélice. Numa de suas
extremidades a miosina apresenta uma saliência globular ou cabeça, que possui
locais específicos para a combinação com ATP e é dotada de atividade
ATPásica. É nesta parte da molécula que tem lugar todas as reações relacionadas
com a hidrólise do ATP. Nesta parte também se encontra o local de combinação
com a actina. Quando submetida à ligeira proteólise, a molécula de miosina
pode ser dividida em dois fragmentos; meromiosina leve e meromiosina pesada.
As moléculas de miosina são dispostas nos filamentos grossos de tal maneira
que suas pares em bastão se sobrepõem e as cabeças situam-se pra fora.
Histologia básica
12 – Células do sangue
O sangue é a massa líquida contida no aparelho circulatório, que a mantém em
movimento regular e unidirecional. É formado de duas fases: os glóbulos sanguíneos e o
plasma, fase líquida na qual os primeiros estão suspensos. Os corantes para o sangue
são: Leishman, Wrigth e Giemsa, que são misturas do tipo Romanowsky. Os glóbulos
sanguíneos são os eritrócitos ou hemácias, as plaquetas e diversos tipos de leucócitos.
Esses últimos são esféricos quando suspensos no sangue e classificados em dois grupos:
os granulócitos ou polimorfonucleares e os agranulócitos. Os granulócitos têm núcleo
de forma irregular e mostram no citoplasma grânulos específicos. De acordo com a
afinidade tintorial de seus grânulos citoplasmáticos, distinguem-se três tipos de
granulócitos: neutrófilos, eosinófilos e basófilos, que vivem pouco e morrem por
apoptose. O núcleo dos agranulócitos tem forma mais regular e o citoplasma não possui
granulações especificas, podendo, porém, apresentar grânulos azurófilos inespecíficos,
presentes também em outros tipos celulares. Há dois tipos de agranulócitos: os
linfócitos e os monócitos. As plaquetas são anucleadas e constituídas por fragmentos do
citoplasma de células gigantes da medula óssea, os megacariócitos. O resultado obtido
na centrifugação do sangue (sedimentação) chama-se hematócrito. Os glóbulos
sedimentam em duas camadas: a inferior formada pelas hemácias, a imediatamente
superior (papa leucocitária), que contém os leucócitos e sobre esta repousa delgada
camada de plaquetas, não distinguíveis a olho nu.
Funções do sangue: o sangue é principalmente um meio de transporte. Por seu
intermédio, os leucócitos, dos quais alguns são fagocitários e representam uma das
primeiras barreiras contra a infecção, percorrem todo o corpo e podem concentrar-se
rapidamente nos tecidos atingidos por infecção. O sangue transporta oxigênio e gás
carbônico, o primeiro ligado à hemoglobina dos eritrócitos e o segundo ou ligado à
hemoglobina ou dissolvido no plasma sob a forma de bicarbonato. O plasma também
transporta nutrientes e metabólitos dos locais de absorção ou síntese, distribuindo-os
pelo organismo. Transporta, ainda, escorias do metabolismo que são removidas do
sangue pelos órgãos de excreção. O sangue, sendo o veiculo de distribuição dos
hormônios, permite a troca de mensagens químicas entre órgãos distantes. Tem ainda
papel regulador na distribuição d calor, do equilíbrio ácido-básico e do equilíbrio
osmótico.
Composição do plasma: o plasma é uma solução aquosa contendo componentes de
pequeno e grande peso molecular. As proteínas plasmática correspondem a 7%, os sais
inorgânicos a 0,9%, sendo o restante formado por compostos orgânicos diversos, tais
como AA, vitaminas, hormônios, lipoproteínas e glicose. Os componentes de baixo
peso molecular do plasma estão em equilíbrio, através das paredes dos capilares e das
vênulas, com o líquido intersticial dos tecidos. Por isso, a composição do plasma é um
indicador da composição do líquido extracelular. As principais proteínas do plasma são
as albuminas, as alfa e beta e gamaglobulinas, e o fibrinogênio. As albuminas
desempenham um papel fundamental na manutenção da pressão osmótica. As
gamaglobulinas são anticorpos, por isso, chamadas imunoglobulinas. O fibrinogênio é
necessário para a formação de fibrina, na coagulação do sangue. Diversas substâncias,
que são insolúveis em água, podem ser transportadas no plasma combinadas com as
albuminas ou com as alfa e betaglobulinas.
Os eritrócitos são glóbulos anucleados e bicôncavos contendo hemoglobina: a forma
bicôncava proporciona grande superfície em relação ao volume, o que facilita as trocas
de gases. As hemácias são flexíveis, passando facilmente pelas bifurcações dos
capilares mais finos, sem se romperem. As que têm mais de 8µm e menos de 6µm de
diâmetro são denominadas macrócitos e micrócitos. Quando o sangue contém muitas
hemácias com dimensões anormais, diz-se que existe anisocitose. As anemias são
doenças caracterizadas por baixa concentração de hemoglobinas no sangue. Muitas
vezes a anemia é uma conseqüência de uma diminuição do numero de eritrócitos. No
entanto, este pode ser normal, mas cada hemácia pode conter pouca hemoglobina
(anemia hipocrômica). As anemias pode ser causadas por: (1) hemorragia; (2) produção
insuficiente de hemácias pela medula óssea; (3) produção de eritrócitos com
hemoglobina insuficiente, por deficiência de ferro na alimentação; e (4) destruição
acelerada dos eritrócitos. Devido à sua riqueza em hemoglobina, uma proteína básica,
os eritrócitos são acidófilos, corando-se peã eosina. A forma bicôncava é mantida pelas
proteínas contrácteis ligadas à membrana da hemácia, que usam energia derivada da
glicose. Ao penetrarem na corrente sanguínea, vindos da medula óssea vermelha, onde
são formados, os glóbulos vermelhos contêm ainda certa quantidade de ribossomos.
Quando corados esses corpúsculos apresentam uma coloração azulada, devido à
basofilia do RNA, que quando é precipitado forma uma rede de corpúsculos chamados
reticulócitos. A molécula hemoglobina é formada por quatro subunidades, cada uma
contendo um grupo heme ligado a um polipeptídeo. O grupo heme é um derivado
porfirínico contendo Fe+. Devido às variações das cadeias polipeptídicas distinguem-se
vários tipos de hemoglobinas, dos quais três são considerados normais – as
hemoglobinas A1 (Hb A1 – 97%), A2 (Hb A2 – 2%) e F (Hb F – 100% da hemoglobina
do feto, que é muito ávida pelo oxigênio, tendo importante papel na vida fetal, pois o
feto não tem acesso ao ar, e obtém oxigênio dos eritrócitos do sangue materno, através
da placenta). Cada molécula de hemoglobina se comina com quatro moléculas de O2,
formando-se a oxi-hemoglobina. Esta combinação é reversível e o oxigênio
transportado pela hemoglobina é transferido para os tecidos, onde a pressão de O2 é
baixa. A combinação da hemoglobina com CO2 também é reversível e constitui a
carbamino-hemoglobina. Mas a maior parte do CO2 é transportada, dos tecidos para os
pulmões, dissolvida no plasma. O eritrócito falciforme não tem flexibilidade, é frágil e
tem vida curta. O sangue se torna mais viscoso, o fluxo sanguíneo nos capilares é
prejudicado, levando os tecidos a uma deficiência em oxigênio. O monóxido de carbono
(CO) reage com a hemoglobina, para formar a carbo-hemoglobina. A finidade entre eles
é maior que a Hb com o O2. O CO aspirado desloca o O2 e impede seu transporte pela
Hb, determinando uma deficiência na oxigenação dos tecidos, eu pode levar À morte.
Durante a maturação na medula óssea, o eritrócito perde o núcleo e as outras organelas,
ao tendo, portanto, a possibilidade de renovar suas moléculas. Ao cabo de 120 dias, as
enzimas já estão em nível crítico, o rendimento dos ciclos metabólicos geradores de
energia é insuficiente e o corpúsculo é digerido pelos macrófagos, principalmente no
baço.
Os leucócitos são células especializadas na defesa do organismo: os leucócitos
deixam os capilares por diapedese, passando entre as células epiteliais, para penetrar no
tecido conjuntivo. Quando os tecidos são invadidos por microrganismos os leucócitos
são atraídos por quimiotaxia. Chama-se leucocitose o aumento e leucopenia a
diminuição do numero de leucócitos no sangue.
Os neutrófilos contêm grânulos específicos muito pequenos: os neutrófilos têm
núcleos formados por dois a cinco lóbulos, a célula muito jovem tem núcleo não
segmentado em lóbulos, sendo chamada de neutrófilo com núcleo em bastonete ou só
bastonete. Nos núcleos dos neutrófilos de pessoas do sexo feminino aparece um
apêndice que contém a cromatina sexual. Os grânulos azurófilos ou primários são
produzidos antes dos grânulos específicos ou secundários. Esses últimos são menores
do que os azurófilos e sua composição química os diferencia dos lisossomos. Eles
contêm tipos de moléculas dotadas de poder bactericida ou bacteriostático. Os
neutrófilos constituem importante defesa celular contra a invasão de microrganismos.
No sangue, não fagocitam, mas se tornam amebóides e fagocitários tão logo toquem um
substrato sólido sobre o qual possam emitir pseudópodos. A bactéria invasora é rodeada
por pseudópodos, que se fundem em trono dela. Assim, a bactéria finalmente ocupa um
vacúolo (fagossomo) delimitado por uma membrana derivada da superfície do
neutrófilo. Logo a seguir, os grânulos específicos se fundem com o fagossomo e
esvaziam seu conteúdo no interior dele. Bombas de prótons localizados na membrana
do fagossomo acidificam o interior deste vacúolo. O pH ácido pode matar bactérias e
constitui ambiente adequado à atividade das hidrolases dos grânulos azurófilos. Durante
a fagocitose há um aumento brusco e acentuado no consumo de oxigênio, devido à
produção de peróxido de hidrogênio (H2O2) e ânion superóxido (O2-), ambos oxidantes
energéticos são provavelmente os principais responsáveis pela morte das bactérias
fagocitadas. Morto o microrganismo, as enzimas lisossômicas promovem sua hidrólise
em moléculas pequena que se difundem para fora do vacúolo. Como nem todas as
bactérias são digeridas e nem todos os neutrófilos sobrevivem à ação bacteriana, pode
aparecer pus.
O núcleo dos eosinófilos é geralmente bilobulado e seus grânulos citoplasmáticos
específicos são lisossomos: presença de granulações ovóides que se coram pela eosina,
que são maiores que as dos neutrófilos. Paralelamente ao eixo maior do granulo,
encontra-se um cristalóide ou internum alongado, elétron-denso, cuja principal proteína
é rica em arginina. A camada que envolve o internum é menos densa aos elétrons, rica
em fosfatase ácida e denomina-se externum ou matriz. Essas células fagocitam e
eliminam complexos de antígenos com anticorpos que aparecem em casos de alergia.
São atraídos para as áreas de inflamação alérgica pela histamina, produzida
principalmente por basófilos e mastócitos. Eosinófilos produzem moléculas que
inativam leucotrienos e histamina, assim modulando a inflamação. Eosinófilos
participam da defesa contra parasitas, não são células especializadas para a fagocitose
de microrganismos. Sua atividade defensiva é realizada pela liberação do conteúdo de
seus grânulos para o meio extracelular e pela fagocitose de complexos antígeno-
anticorpo. Os corticosteróides induzem uma queda imediata na concentração dos
eosinófilos do sangue e nos locais de inflamação. Esses hormônios interferem na
passagem dos eosinófilos da medula óssea, onde são produzidos, para a corrente
sanguínea.
Os basófilos participam dos processo alérgicos e possuem receptores para
imunoglobulina E (IgE): o basófilo tem núcleo volumoso, com forma de S, seu
citoplasma é carregado de grânulos maiores do que os dos outros granulócitos, os quais
muitas vezes obscurecem o núcleo, e contêm histamina, fatores quimiotáticos para
eosinófilos e neutrófilos, e heparansulfato, que é responsável pela metacromasia. A
membrana plasmática dos basófilos também possui receptores para a imunoglobulina E
(IgE). Eles liberam seus grânulos para o meio extracelular, sob ação dos mesmos
estímulos que promovem a expulsão dos grânulos dos mastócitos.
Embora morfologicamente semelhantes, existem diversos tipos de linfócitos
identificáveis por técnicas imunológicas: o citoplasma do linfócito pequeno é muito
escasso, apresenta basofilia discreta e por vezes não é visível. Pode conter grânulos
azurófilos, que não são exclusivos dos linfócitos e mostra-se pobre em organelas.
Embora os linfócitos tenham morfologia semelhante, dependendo das moléculas
localizadas em sua superfície, podem ser separados em dois tipos principais, linfócito B
e T, com diversos subtipos. Ao contrário dos outros leucócitos que não retornam ao
sangue depois de migrarem para os tecidos, os linfócitos voltam dos tecidos para o
sangue, recirculando continuamente.
Depois de saírem do sangue, por diapedese, os monócitos se transformam em
macrófagos: os monócitos do sangue representam uma fase na maturação da célula
mononuclear fagocitária originada na medula óssea. Esta célula passa para o sangue,
onde permanece apenas alguns dias, e, atravessando a parede dos capilares e vênulas,
penetra em alguns órgãos, transformando-se em macrófagos, que constituem uma fase
mais avançada na vida da célula mononuclear fagocitária.
As plaquetas, resultantes da fragmentação do citoplasma dos megacariócitos da
medula óssea, desempenham importantes funções na coagulação do sangue: as
plaquetas são corpúsculos anucleados que promovem a coagulação do sangue,
auxiliando a reparação da parede dos vasos sanguíneos e evitando hemorragia. Elas
apresentam uma parte transparente, o hialômero, o qual contém grânulos corados em
púrpura, que constituem o cromômero, além de microfilamentos de actina e moléculas
de miosina, responsáveis pela formação de filopódios e pela contração das plaquetas. O
granulômero possui uma variedade de grânulos delimitados por membrana, algumas
mitocôndrias e grânulos de glicogênio. Os grânulos densos ou delta armazenam ADP,
ATP e serotonina; os grânulos alfa contêm fibrinogênio e fator de crescimento
plaquetário; e os grânulos lambda são lisossomos carregados com as enzimas usuais
dessas organelas.
Quando um vaso sanguíneo sofre lesão inicia-se a hemostasia (que visa impedir
a hemorragia), que envolve a musculatura lisa do vaso lesado, as plaquetas e diversos
fatores do plasma sanguíneo, que promovem a coagulação do sangue. A contração do
músculo liso é estimulada pela serotonina liberada pelas plaquetas. A participação das
plaquetas na coagulação do sangue pode ser resumida da maneira que segue: (1)
agregação primária: as plaquetas também aderem ao colágeno formando um tampão
plaquetário; (2) agregação secundária: as plaquetas do tampão liberam ADP, que é um
potente indutor da agregação plaquetária, fazendo aumentar o número de plaquetas do
tampão; (3) coagulação do sangue: fatores do plasma sanguíneo, dos vasos lesados e das
plaquetas promovem a interação seqüencial de cerca de 13 proteínas plasmáticas, dando
origem a um polímero, a fibrina, e formando uma rede fibrosa tridimensional, que
aprisiona eritrócitos, leucócitos e plaquetas. Forma-se assim o coágulo sanguíneo, mais
consistente e firme do que o tampão plaquetário; (4) retração do coágulo: se contrai
graças à ação da actina, miosina e ATP das plaquetas; e (5) remoção do coágulo:
protegida pelo coágulo, a parede do vaso se restaura pela formação de tecido novo.
Então o coágulo é removido principalmente pela enzima plasmina.
Histologia básica
13 – Hemocitopoese
As células do sangue têm vida curta e são constantemente renovadas pela
proliferação mitótica de células localizadas nos órgãos hemocitopoéticos. As primeiras
células sanguíneas do embrião surgem muito precocemente, no mesoderma do saco
vitelino. Posteriormente, o fígado e o baço funcionam como órgãos hemocitopoéticos
temporários, porém, no segundo mês de vida intra-uterina a clavícula já começou a se
ossificar e inicia a formação de medula óssea hematógena em seu interior. Na vida pós-
natal, a medula óssea origina todas as células do sangue (eritropoese, granulocitopoese,
linfocitopoese, monocitopoese e megacitopoese).
Células fonte, fatores de crescimento e diferenciação: (1) células fonte: originam
células filhas que seguem dois destinos: umas permanecem como células fonte e outras
se diferenciam em outros tipos celulares com características especificas. O pool de lulas
fonte se mantém constante porque as que se diferenciam são substituídas por células
filhas que se mantêm no pool. As células do estroma da medula óssea sintetizam
glicoproteínas estimulantes das células hemocitopoéticas. Essas glicoproteínas ficam
integradas na membrana das células do estroma, de modo que só atuam por contato,
estimulando as células hemocitopoéticas; (2) células fonte pluripotentes: todas as
células do sangue derivam de um único tipo celular da medula óssea, essas células se
proliferam e formam duas linhagens: a das células linfóides, que vai formar linfócitos, e
a as células mielóides, que origina os granulócitos, eritrócitos, monócitos e plaquetas.
Os linfócitos são transportados pelo sangue para os linfonodos, timo, baço e outros
órgãos linfáticos onde completam sua maturação; (3) células progenitoras e células
precursoras: a proliferação das células fonte pluripotentes origina células filhas com
potencialidade menor. Estas células filhas são as células progenitoras uni ou bipotentes
que produzem as células precursoras (blastos). É nas células precursoras que as
características morfológicas diferenciais das linhagens aparecem pela primeira vez. As
células progenitoras, quando se dividem, podem originar outras células progenitoras e
também células precursoras, mas as precursoras só originam células sanguíneas
maduras. A hemocitopoese resulta da proliferação e diferenciação simultâneas de
células fonte que, à medida que se diferenciam, vão reduzindo sua potencialidade. A
hemocitopoese depende do microambiente adequado e da presença de fatores de
crescimento ou fatores estimuladores de colônias (CSF), que estimulam a proliferação e
a diferenciação das células imaturas e a atividade funcional da células maduras. Na
hemocitopoese o potencial de diferenciação e a capacidade de auto-renovação
diminuem gradualmente e a resposta mitótica ao fatores de crescimento aumenta. A
capacidade de estimular mitoses, promover a diferenciação e acelerar as atividade
funcionais da células freqüentemente estão presentes no mesmo fator de crescimento,
mas estas três propriedades podem variar de intensidade de acordo como fator de
crescimento considerado. A medula óssea é encontrada no canal medular dos ossos
longos e nas cavidades dos ossos esponjosos. Distinguem-se a medula óssea vermelha,
hematógena, que deve sua cor à presença de numerosos eritrócitos em diversos estágios
de maturação, e a medula óssea amarela, rica em células adiposas e que não produz
células sanguíneas. No recém-nascido, toda a medula óssea é vermelha e, portanto, ativa
na produção de células do sangue. Com o avançar da idade, porém, a maior parte da
medula óssea transforma-se na variedade amarela, existindo a medula vermelha no
adulto apenas no esterno, vértebras, costelas, díploe dos ossos do crânio e, no adulto
jovem, nas epífises proximais do fêmur e do úmero. Em certos casos, a medula amarela
pode voltar a produzir células do sangue, transformando-se em medula vermelha.
A hemocitopoese ocorre na medula óssea vermelha, em microrregiões contendo
diversos estágios de uma mesma linhagem celular: a medula óssea vermelha, como
todo tecido hemocitopoético, é constituída por células reticulares, associadas a fibras
reticulares. Esses elementos formam uma esponja percorrida por numerosos capilares
sinusóides. Entre as células reticulares existe um número variável de macrófagos,
células adiposas e muitas células hemopoéticas. A matriz extracelular possui colágeno
tipos I e III, fibronectina e laminina (que junto com a hemonectina interagem com
receptores celulares, fixando temporariamente as células), além das proteoglicanas.
Além e produzir as células do sangue, a medula óssea armazena ferro sob a forma de
ferritina (ferro + apoferritina) e hemossiderina (ferro + apoferritina + outras proteínas +
glicídios + lipídios + outras moléculas) no citoplasma das células reticulares, células
endoteliais dos sinusóides e macrófagos. A liberação de células maduras da medula para
o sangue é controlada pelos fatores de liberação, moléculas produzidas em resposta às
necessidades do organismo, tais como o componente C3 do complemento, hormônios
como os glicocorticóides e os andrógenos, e certas toxinas bacterianas.
Maturação dos eritrócitos: de acordo com o grau de maturação, as células eritrócitas
são chamadas de: proeritroblastos (as proteínas sintetizadas por ele destinam-se
principalmente a aumentar seu próprio protoplasma, pois esta célula s divide ativamente
e há também síntese de hemoglobina), eritroblastos basófilos (menor que a anterior),
eritroblastos policromatófilos (menor ainda que a precedente, contém hemoglobina em
quantidade suficiente para aparecer uma acidofilia citoplasmática), eritroblastos
ortocromáticos (ou acidófilos ou normoblastos – núcleo se torna picnótico, por sua
riqueza em hemoglobina o citoplasma é acidófilo, em certo momento essa célula
começa a emitir uma série de saliências citoplasmáticas, uma delas contendo o núcleo,
que é expelido levando ao seu redor uma delgada camada de citoplasma), reticulócitos
(parte anucleada que sobra após a expulsão do núcleo da célula anterior) e hemácias. O
processo básico da maturação é a síntese da hemoglobina e a formação de um
corpúsculo pequeno e que oferece o máximo de superfície para as trocas de oxigênio.
Durante a maturação ocorre o seguinte: (1) o volume das células diminui; (2) a
cromatina torna-se cada vez mais densa, até que o núcleo se apresenta picnótico e
finalmente é expulso da célula; (3) os núcleos diminuem de tamanho e depois se tornam
invisíveis no esfregaço; (4) há uma diminuição dos polirribossomos (basofilia) e um
aumento da hemoglobina (acidofilia) no citoplasma; e (5) a quantidade de mitocôndrias
diminui. O ferro é trazido para os pro e os outros eritroblastos pela transferrina, uma
proteína plasmática transportadora de ferro. Os núcleos como resto do citoplasma,
separados dos normoblastos, são fagocitados pelos macrófagos da medula óssea.
Erítron: chama-se erítron ao conjunto formado pelos eritrócitos mais as células
precursoras desses corpúsculos. Função: suprir o meio interno com oxigênio necessário
ao metabolismo dos tecidos. Pode ser dividido em dois compartimentos funcionais: (1)
o compartimento circulante ou sanguíneo representado pelas hemácias e reticulócitos do
sangue, e (2) o compartimento medular, onde ocorre a formação dos elementos do
erítron. O compartimento medular praticamente ao contém eritrócitos, sendo constituído
por elementos nucleados (proeritroblastos, eritroblastos, normoblastos) e u número
relativamente pequeno de reticulócitos. Como o erítron não tem um compartimento de
reserva, a concentração de eritrócitos no sangue traduz o nível de produção medular. A
deficiência em oxigênio nos tecidos aumenta o teor sanguíneo do hormônio
glicoprotéico eritropoetina, que estimula o compartimento medular a produzir maior
número de eritrócitos (85% da eritropoetina é sintetizado nos rins e 15% no fígado).
Numerosas substâncias são essenciais para o bom funcionamento do erítron, entre elas,
o hormônio eritropoetina, ferro, vitamina B12 e ácido fólico.
Maturação dos granulócitos: o mieloblasto é a célula mais imatura, já determinada
para formar exclusivamente os três tipos de granulócitos. Quando nela surgem
granulações citoplasmáticas especificas, essa célula passa a ser chamada de
promielócito neutrófilo, eosinófilo e basófilo, conforme o tipo de granulação presente.
Os estágios seguintes de maturação são: mielócito, metamielócito, o granulócito com
núcleo em bastão e o granulócito maduro (neutrófilo, eosinófilo e basófilo).
Mieloblasto: rico em grânulos azurófilos. Promielócito: menor que o mieloblasto e
contém alguns grânulos específicos (promielócitos, neutrófilos, eosinófilos e basófilos)
ao lado das granulações azurófilas. Mielócito: desaparece a basofilia citoplasmática e
aumenta a quantidade de grânulos específicos. Metamielócito: possui núcleo com uma
chanfradura profunda, o basófilo não costuma ser descrito. Antes de tomar a forma
lobulada típica da célula madura, o granulócito neutrófilo passa por uma fase
intermediária, chamada neutrófilo com núcleo em bastonete.
Os neutrófilos encontram-se localizados nos compartimentos de formação, de
reserva, circulante e de marginação: (1) compartimento medular de formação: onde
novos neutrófilos são produzidos e amadurecem; (2) compartimento medular de reserva:
contém neutrófilos maduros; (3) compartimento circulante: neutrófilos suspensos no
plasma e circulando nos vasos sanguíneos; (4) compartimento de marginação:
neutrófilos que, embora contidos nos vasos sanguíneos, não circulam. Estes neutrófilos
estão: (a) nos capilares colocados temporariamente fora de circulação, por
vasoconstrição, e (b) ligados ao endotélio dos vasos, não sendo levados pela corrente
sanguínea. Há uma troca constante de células entre compartimento circulante e o de
marginação.
Maturação dos linfócitos e monócitos: linfoblasto (citoplasma basófilo, sem
granulações azurófilas, apresenta dois ou três núcleos) forma o prolinfócito (menor que
a anterior, citoplasma basófilo, podendo conter granulações azurófilas, dá origem ao
linfócito circulante). Ao contrário dos granulócitos, que são células diferenciadas e
terminais, que não mais se dividem, os monócitos são células intermediárias, destinadas
a formar os macrófagos dos tecidos. A célula mais jovem da linhagem é o promonócito
(numerosos grânulos azurófilos finos, que são lisossomos), encontrado somente na
medula óssea, se dividem duas vezes e se transformam em monócitos que passam para o
sangue, depois migram para os tecidos, e se diferenciam em macrófagos.
Origem das plaquetas: a primeira célula é o megacarioblasto (núcleo poliplóide ?;
citoplasma homogêneo e intensamente basófilo), depois vem o megacariócito (núcleo
irregularmente lobulado, citoplasma abundante e levemente basófilo e com numerosas
granulações que ocupam sua maior parte – essas granulações vão formar os cromômeros
das plaquetas). Durante a maturação do megacariócito aparecem grânulos
citoplasmáticos, delimitados por membranas, que são precursores do hialômero das
plaquetas.
As primeiras células do sangue se formam nas ilhotas sanguíneas do saco vitelino
do embrião, e este processo é gradualmente transferido para outros órgãos: fígado,
baço, timo, medula óssea e linfonodos: todos os glóbulos sanguíneos são os de origem
mesenquimatosa. Em órgãos de origem embrionária dupla, como o fígado e o timo, as
células originadas do mesoderma são as responsáveis pela hemocitopoese. A
hemocitopoese intra-uterina passa por três períodos mal definidos, quando um período
se inicia, os processos que predominavam no anterior ainda persistem por algum tempo,
os períodos são: (1) período primordial ou pré-hepático: primeiras células do sangue
aparece no mesoderma do saco vitelino. Aí surgem ilhotas sanguíneas, que são
aglomerados alongados de células mesenquimatosas. As células mais superficiais de
cada ilhota dão origem ao endotélio dos primeiros vasos, enquanto as mais internas
tornam-se esféricas e se diferenciam nas primeiras células sanguíneas. Pela união do
endotélio de ilhotas contíguas, formam-se vasos sanguíneos que se comunicam com os
do corpo do embrião, das células sanguíneas formadas no saco vitelino, que divide.-se
no interior dos vasos e formam eritroblastos primitivos (eritropoese megaloblástica),
que não chegam a perder seus núcleos. Durante o período primordial, o sangue possui
apenas os elementos já mencionados. Não contém leucócitos nem plaquetas. (2) período
hepatoesplênico-tímico: (segundo mês) hemocitopoese no fígado e baço, em seguida, o
timo começa a produzir linfócitos. No mesênquima que invade o esboço endodérmico
do fígado, aparecem células precursoras dos granulócitos, megacariócitos e eritroblastos
definitivos (sem perder os núcleos). Durante este período predomina a síntese de HbF.
O baço produz principalmente células da série vermelha e, em menor quantidade,
granulócitos e plaquetas. (3) período medular-linfóide: a clavícula é o primeiro osso a
mostrar atividade hemocitopoética. Sua medula óssea começa a funcionar entre o
segundo e o terceiro mês de vida fetal. A medula óssea mostra grande atividade
eritrocítica, granulocítica e megacariocítica. Forma também linfócitos e monócitos.
Nesse período, e próximo ao nascimento, entram em atividade os linfonodos, que, desde
o início da sua existência, são órgãos produtores de linfócitos.
Histologia básica
14 – Sistema imunitário e órgãos linfáticos
Sua principal função é defender o organismo contra microrganismos e moléculas
estranhas. As células desse sistema têm a capacidade de identificar as moléculas que são
próprias do corpo e as moléculas estranhas, quer estejam isoladas, quer façam parte de
um vírus, bactéria, fungo, célula maligna ou protozoário. Após identificar os agressores,
o sistema imunitário coordena a inativação ou a destruição do invasor. O sistema
imunitário compreende estruturas individualizadas (linfonodos e baço) e células livres
(linfócitos, granulócitos e células do sistema mononuclear fagocitário). Outro
componente importante desse sistema são as células apresentadoras de antígenos,
encontradas no tecido linfático, na pele etc. As células desse sistema se comunicam
entre si e com células de outros sistemas através de moléculas protéicas denominadas
citocinas.
Órgãos linfáticos: as principais estruturas são: timo, baço, linfonodos e nódulos
linfáticos (localizados na mucosa do aparelho digestivo – tonsilas, placas de Peyer do
íleo, e apêndice; do aparelho respiratório e do aparelho urinário, formando um conjunto
conhecido como MALT {Mucosa-Associated Lymphoid Tissue}). Todos os linfócitos se
originam na medula óssea, mas os linfócitos T completam sua maturação no timo,
enquanto os linfócitos B saem da medula já como células maduras. Por esse motivo o
timo e a medula óssea são chamados de órgãos linfáticos centrais. Os linfócitos migram
dos órgãos centrais, através do sangue e da linfa, para os órgãos linfáticos periféricos
(baço, linfonodos, nódulos linfáticos isolados, tonsilas, apêndice e placas de Peyer do
íleo), onde eles proliferam e completam a diferenciação.
Tipos básicos de resposta imunitária: existem dois mecanismos básicos: (1)
imunidade celular, pela qual células imunocompetentes reagem e matam células que
exibem na superfície moléculas estranhas, essa resposta imunitária celular é mediada
principalmente pelos linfócitos T; e (2) imunidade humoral, depende de glicoproteínas
circulantes no sangue e outros líquidos, chamados anticorpos (plasmócitos - linfócitos
B), que neutralizam moléculas estranhas e participam da destruição das células que
contêm essas moléculas.
Imunógenos e antígenos: as moléculas estranhas são os imunógenos. Antígeno é uma
molécula que reage com um anticorpo, mesmo que não seja capaz de desencadear uma
resposta imune. Geralmente, todo imunógeno é antígeno também. Na resposta humoral
(linfócitos B) a parte da molécula antigênica que determina a resposta imunitária é
chamada determinante antigênico ou epitopo. A resposta celular (linfócitos T) é
determinada por pequenos peptídeos associados às moléculas MHC localizadas na
membrana das células apresentadoras de antígenos.
Anticorpos: são glicoproteínas plasmáticas circulantes, do tipo gamaglobulinas,
também chamadas imunoglobulinas (Ig). Cada um interage especificamente como
determinante antigênico que promoveu sua formação. Uma importante função do
anticorpo é combinar especificamente com o epitopo que ele reconhece e, então,
provocar o aparecimento de sinais químicos iniciando a presença do invasor aos outros
componentes do sistema imunitário. Alguns anticorpos podem aglutinas células e
precipitar antígenos solúveis, a primeira facilita a fagocitose e a segunda pode torná-las
inócuas. Os neutrófilos e macrófagos têm receptores para a região Fc do complexo
antígeno-IgG, e, dessa maneira, IgG prende o complexo antígeno-anticorpo à superfície
dessas células, o que facilita a fagocitose. A imunoglobulina mais abundante no plasma
sanguíneo é a IgG, que consistem em duas cadeias leves idênticas e duas cadeias
pesadas, também idênticas. Os quatro segmentos da extremidade amínica constituem os
fragmentos Fab da imunoglobulina. A seqüência de AA do segmento Fab é muito
variável, sendo responsável pela especificidade da resposta imune. IgG é a única que
atravessa a barreira placentária humana e penetra no sangue fetal, contribuindo para a
defesa do recém-nascido. IgA aparece em pequena quantidade no sangue (é encontrado:
lágrima, leite, saliva, secreção nasal, bronquial, intestino delgado, próstata, líquido que
umedece a vagina). IgM existe sob a forma de pentâmero, predomina no início das
respostas imunitárias, junto com IgD, é a principal Ig encontrada na superfície do
linfócito B, onde funcionam como receptores para antígenos específicos. IgE, está sob a
forma de monômero e tem grande afinidade para receptores localizados na membrana
dos mastócitos e basófilos. Quando o antígeno que provocou a produção de IgE é
novamente encontrado, o complexo antígeno-IgE que se forma na superfície dos
mastócitos e basófilos determina a produção e a liberação de diversas substâncias
biologicamente ativas como histamina, heparina e leucotrienos.
Linfócitos B e T: a diferenciação em células imunocompetentes tem lugar na medula
óssea e no timo (órgãos linfáticos primários ou centrais). A bursa de Fabricius é uma
massa de tecido linfático localizada próximo da cloaca em aves, sem essa estrutura a
ave não é capaz de produzir Ig, portanto a imunidade humoral é prejudicada. A remoção
do timo resulta numa deficiência profunda nas respostas imunitárias de base celular. Os
linfócitos B originados na medula óssea são transportados pelo sangue e vão se instalar
nas estruturas linfáticas não-tímicas, onde, quando ativados, proliferam e se diferenciam
em plasmócitos, que são as células produtoras de anticorpos. Alguns linfócitos B
ativados não se diferenciam em plasmócitos, formando as células B da memória
imunitária. Os precursores dos linfócitos T se originam na medula óssea, penetram no
sangue, são retidos no timo onde proliferam e se diferenciam em linfócitos T que,
novamente carregados pelo sangue, vão ocupar áreas definidas nos outros órgãos
linfáticos. No timo os linfócitos T se diferenciam nas subpopulações das células T –
helper (estimula a transformação de linfócitos B em plasmócitos), T – supressora
(inibem a resposta humoral e celular e apressam o termino da resposta imunitária) e T –
citotóxica (perforinas provocam a lise celular; indução à apoptose). Em outros locais se
podem formar as células T da memória. As células T – helper são mortas pelo retrovírus
HIV que causa AIDS, que paralisa o sistema imune do paciente, tornando-o muito
susceptível ao ataque de microrganismos, mesmo os que, usualmente não causam
doenças.a diferenciação entre essas células e também seus subtipos torna-se possível
porque elas possuem proteínas integrais em suas membranas que são especificas e
podem ser identificas por técnicas imunocitoquímicas. Quando estimuladas por
antígenos, as células B e T produzem células grandes e de citoplasma basófilo,
chamadas imunoblastos, os que derivam da célula B produzem plasmócitos, enquanto
os derivados das células T continuam com muitos polirribossomos não ligados ao RE. O
linfócito NK (natural killer) não apresenta em sua superfície nem os marcadores da
células B nem os das células T, eles atacam células cancerosas e células infectadas por
vírus, sem necessidade de estimulo prévio.
Células apresentadoras de antígenos: são células dendríticas, macrófagos, células de
Langerhans da epiderme, linfócitos B e células epiteliais reticulares do timo. No
processamento de antígenos as células digerem parcialmente as proteínas,
transformando-as em pequenos peptídeos. O processamento é essencial para a ativação
do linfócito T, pois ela não reconhece moléculas antigênicas nativas, só reconhecem
peptídeos e outro antígenos quando associados a moléculas MHC, enquanto as células B
reconhecem diretamente certas substâncias. CÉLULAS DENDRÍTICAS: se originam
de precursores provenientes da medula óssea, na pele recebem o nome de células de
Langerhans, são imunoestimuladoras, pois além de apresentarem os antígenos às células
T, elas são capazes de estimular células T que ainda não entraram em contato com
qualquer antígeno. São levadas pelo sangue para muitos órgãos linfáticos, onde elas se
alojam, ainda numa forma imatura. Essas células dendríticas imaturas se caracterizam
por sua grande capacidade de capturar e processar antígenos, porém têm pequena
capacidade de estimular células T. A inflamação induz a maturação das células
dendríticas que, então, migram pelo sangue ou pela linfa, indo para os órgãos linfáticos
periféricos. Nesse estagio, elas perdem a capacidade de capturar antígenos e adquirem
capacidade de ativar células T. centros germinativos dos linfonodos baço e outros
órgãos linfáticos têm células denominadas células foliculares dendríticas que não
derivam da medula óssea, não são capazes de englobar no citoplasma antígenos por
endocitose, nem são capazes de processar antígenos. São eficiente na captação do
complexo antígeno-anticorpo e de fatores do complemento, retendo antígenos em sua
superfície por longos períodos de tempo, onde os antígenos são reconhecidos por
linfócitos B.
Complexos de histocompatibilidade: o sistema imune distingue as moléculas próprias
do organismo das moléculas estranhas, por meio da presença na superfície celular do
complexo MHC, também conhecido como HLA. O MHC I está presente em todas as
células, enquanto o MHC II è de distribuição mais restrita, sendo encontrado nas células
apresentadoras de antígenos. Os MHC’s têm uma estrutura que é única para cada
pessoa, e esse é o principal motivo pelo qual enxertos e transplantes de órgãos são
rejeitados, exceto quando feitos entre irmãos univitelinos. A rejeição deve-se
principalmente à atividade dos linfócitos NK e citotóxicos, que penetram o transplante e
destroem suas células.
Citocinas na resposta imunitária: coletivamente, são chamadas citocinas e as
produzidas pelos linfócitos são as linfocinas. Algumas citocinas são mediadoras entre
leucócitos e são chamadas interleucinas. Certas citocinas são fatores estimuladores de
colônias sintetizados por linfócitos T e que atuam sobre células dos órgãos linfáticos e
hemocitopoéticos. Outras citocinas, como os fatores alfa e beta da necrose tumoral, e o
fator beta de transformação e crescimento, estão relacionadas com a inflamação, defesa
contra tumores, crescimento celular e cicatrização da feridas.
Timo: não apresenta nódulos, cada lóbulo é formado por uma zona cortical e uma zona
medular, onde podem ser encontrados corpúsculos de Hassall, constituídos por células
reticulares epiteliais achatadas, em arranjo concêntrico. O timo tem origem embrionária
dupla, seus linfócitos formam-se a partir de células mesenquimatosas, que invadem um
esboço epitelial derivado do endoderma. Além dos linfócitos T e da células reticulares
epiteliais, o timo possui macrófagos, principalmente na cortical. As células reticulares
epiteliais formam uma camada por dentro do tecido conjuntivo da cápsula e septos;
formam o retículo da cortical e da medular, onde se multiplicam e diferenciam os
linfócitos T; formam uma camada em torno dos vasos sanguíneos do parênquima
tímico; e constituem os corpúsculos de Hassall.
Após a puberdade o timo entra em involução, mas não desaparece: a cortical pouco
a pouco se torna mais delgada. As células reticulares epiteliais e os corpúsculos de
Hassall são mais resistentes à involução do que os linfócitos.
Vascularização e barreira hematotímica: os capilares do timo possuem endotélio sem
poros e lâmina basal muito espessa. As células endoteliais possuem prolongamentos
finos que perfuram a lâmina basal e podem entrar em contato com as células reticulares
epiteliais. Estas células envolvem, externamente, os capilares, contribuindo para a
formação da barreira hematotímica, cujos outros componentes são lâmina basal das
células reticulares e as células endoteliais não fenestradas da parede capilar. A barreira,
que só existe na zona cortical, impede que antígenos circulantes penetrem na cortical do
timo, onde se estão formando os linfócitos T. não existe tal barreira na medular.
O timo é responsável pela diferenciação dos linfócitos T e produz hormônios que
estimulam outros órgãos linfáticos: células fonte migram continuamente da medula
óssea através do sangue, e vão para o timo, onde proliferam e se diferenciam em
linfócitos T. Elas formam uma população localizada na zona cortical do timo. Essas
células imaturas, ou timócitos, já expressam certas moléculas em suas superfícies, como
os marcadores CD1 e CD4. O primeiro rearranjo gênico de receptor da célula T tem
lugar nesse estagio. A seleção positiva envolve a interação de timócitos duplamente
positivos com complexos de MHC com autopeptídeos, esses sobreviverão e irão se
proliferar, a seleção negativa envolve a interação de timócitos duplamente positivos
com complexos de autopeptídeos localizados nas células apresentadoras de antígenos do
timo, o que leva esses timócitos à morte por apoptose. À medida que s timócitos
sobreviventes se diferenciam, eles migram para a zona medular e tornam-se células
helper CD4+ ou células citotóxicas CD8+. Ao contrario da células T, cuja
especificidade é adquirida exclusivamente no timo, as células B adquirem suas
especificidades não somente na medula óssea, mas também nos órgãos periféricos, por
um processo de maturação por afinidade, que modifica a afinidade e pode até modificar
a especificidade do receptor da célula B. após atravessarem a parede das vênulas pós-
capilares e saírem do timo, pelo sangue, os linfócitos T vão se estabelecer em certas
áreas de outros órgãos linfoides, denominados secundários ou periféricos. Essas áreas
são, portanto, timo-dependentes e estão representadas pela zona paracortical dos
linfonodos, pelas bainhas periarteriais da polpa branca do baço e pelo tecido linfóide
frouxo situado entre os nódulos linfático das placas de Peyer e das tonsilas. O resto do
tecido linfóide contém linfócitos B e é timo-independente. O timo, provavelmente por
suas células reticulares epiteliais, produz vários fatores de crescimento protéicos que
estimulam a proliferação e a diferenciação de linfócitos T, atuando localmente por
secreção parácrina. O hormônio adrenocorticotrófico (ACTH) e os hormônios sexuais
aceleram a involução do timo, e a castração tem efeito oposto.
Linfonodos: são órgãos encapsulados constituídos por tecido linfóide e que aparecem
espalhados pelo corpo. O parênquima do órgão é sustentado por um arcabouço de
células reticulares e fibras reticulares, sintetizadas por essas células. A circulação da
linfa é unidirecional. O parênquima do linfonodo apresenta a região cortical e a região
medular, entre elas há a região paracortical. A região cortical superficial (predominância
de linfócitos B) é constituída nódulos linfáticos suja área central, contém imunoblastos
em divisão mitótica e é chamada de centro germinativo. A região medular também é
formada principalmente por linfócitos B.
Histofisiologia: os linfonodos são filtros da linfa, removendo partículas celulares
estranhas, antes eu a linfa retorne ao sistema circulatório sanguíneo. A passagem da
linfa pelo linfonodo remove, por fagocitose pelos macrófagos, cerca de 99% da
moléculas, microrganismos e células estranhas. Infecções e estímulos antigênicos
provocam a divisão mitótica de imunoblastos, responsáveis pelo aparecimento de áreas
menos coradas no centro dos nódulos linfáticos denominados centros germinativos.
Recirculação de linfócitos: um sistema de comunicação: os linfócitos deixam os
linfonodos pelos vasos linfáticos eferentes, que confluem com outros vasos linfáticos,
até se formarem os grandes linfáticos, que desembocam em veias. Pelo sangue, os
linfócitos retornam aos linfonodos através de vênulas de endotélio alto, presentes na
região paracortical. Os linfócitos possuem em suas membranas glicoproteínas para as
quais há receptores nessas células endoteliais, eles migram, por diapedese, passando por
entre as células endoteliais. Após atravessarem as vênulas, os linfócitos caem no tecido
linfático e finalmente saem do linfonodo pelo vaso linfático eferente. O significado
funcional da recirculação parece residir no fato de que os linfócitos estimulados poderão
partir para informar outros órgãos linfáticos, contribuindo para que o organismo prepare
uma resposta imunitária mais geral e mais eficiente contra a infecção. A recirculação de
linfócitos constitui num sistema de monitorização constante de todas as partes do corpo.
Baço: é o maior acúmulo de tecido linfóide do organismo, é um importante órgão de
defesa contra microrganismos e é o principal órgão destruídos de eritrócitos desgastados
pelo uso. Por sua localização na corrente sanguínea, o baço responde com rapidez aos
antígenos que invadem o sangue, sendo um importante filtro fagocitário e imunológico
para o sangue e grande produtor de anticorpos.
Circulação sanguínea: ao deixarem as trabéculas para penetrarem no parênquima, as
artérias são imediatamente envolvidas por uma bainha de linfócitos, chamada bainha
linfática periarterial. Esses vasos são chamados de artérias centrais ou artérias da polpa
branca. Ao longo do seu trajeto a bainha fagocitária, que é parte da polpa branca, se
espessa diversas vezes, formando nódulos linfáticos, nos quais o vaso (agora uma
arteríola) ocupa posição excêntrica. Depois de deixar a polpa branca, as arteríolas se
subdividem, formando as arteríolas peniciladas. Alguns amos da arteríola penicilada
apresentam, próximo à sua terminação, um espessamento, o elipsóide, constituído por
macrófagos, células reticulares e linfócitos. Aos elipsóides seguem-se capilares arteriais
que levam sangue para os sinusóides ou seios da polpa vermelha.
Polpa branca: constituída pelo tecido linfático que constitui as bainhas periarteriais e
pelos nódulos linfáticos que se formam por espessamentos dessas bainhas (linfócitos T).
Predominam os linfócitos B nos nódulos. Entre a polpa branca e a vermelha existe uma
faixa mal determinada, denominada zona marginal que contém muitos antígenos
trazidos pelo sangue e desempenha um importante papel na função imunitária do baço
(filtragem).
Polpa vermelha: formada por cordões esplênicos separados por sinusóides. Esses
cordões são contínuos e de espessura variável, constituídos por uma rede frouxa de
células reticulares e fibras reticulares (colágeno tipo III) que contêm outras células
como macrófagos, linfócitos B e T, plasmócitos, monócitos, granulócitos, além de
plaquetas e eritrócitos.
Histofisiologia: as funções mais conhecidas do baço são: a formação de linfócitos, a
destruição de eritrócitos desgastados (hemocaterese), a defesa do organismo contra
invasores e o armazenamento de sangue. A polpa branca do baço produz linfócitos, que
migram para a polpa vermelha e atingem a luz dos sinusóides, incorporando-se ao
sangue aí contido. As hemácias fagocitadas são digeridas pelos lisossomos do
macrófagos e a hemoglobina é desdobrada em diversos fragmentos, dando origem a um
pigmento sem ferro, a bilirrubina. Esta é devolvida ao sangue, captada pelas células
hepáticas e por estas excretada como um dos constituintes da bile. O ferro formado pelo
desdobramento da hemoglobina pode ser imediatamente armazenado sob a forma de
ferritina, ou passar para o sangue, onde se combinará com a transferrina. DEFESA:
contendo linfócitos T e B e macrófagos, o baço é um órgão de defesa importante. Do
mesmo modo que os linfonodos filtram a linfa, o baço atua como um filtro para o
sangue. De todos os macrófagos do organismo, os do baço são os mais ativos na
fagocitose de partículas vivas e inertes que penetram no sangue.
Tonsilas: estão localizadas em posição estratégica para defender o organismo contra
antígenos transportados pelo ar e pelos alimentos, iniciando uma resposta imunitária.
Existem as tonsilas: palatinas, faringianas e linguais.
Você também pode gostar
- Dna e RnaDocumento10 páginasDna e RnaCarina Oliveira100% (1)
- Inspeção Pescado 40Documento22 páginasInspeção Pescado 40adrienerosceli100% (1)
- Genética Dos Grupos Sanguíneos FARMDocumento11 páginasGenética Dos Grupos Sanguíneos FARMGabriel Isaac BelliniAinda não há avaliações
- Resumo Bioquímica Ciclo Da UreiaDocumento4 páginasResumo Bioquímica Ciclo Da UreiaRaíssa XimenesAinda não há avaliações
- Anatomia Óssea Equinos e RuminantesDocumento32 páginasAnatomia Óssea Equinos e Ruminantesadrienerosceli93% (27)
- Genética Médica para Médicos e Estudantes de Medicina: OncologiaNo EverandGenética Médica para Médicos e Estudantes de Medicina: OncologiaAinda não há avaliações
- Toxicologia VeterináriaDocumento43 páginasToxicologia Veterináriaadrienerosceli100% (5)
- Embriologia e Histologia: Formação dos Gametas e FecundaçãoDocumento11 páginasEmbriologia e Histologia: Formação dos Gametas e FecundaçãoLuciene BarretoAinda não há avaliações
- Funções do Sistema Nervoso e do Córtex CerebralDocumento66 páginasFunções do Sistema Nervoso e do Córtex CerebralAna Camila100% (1)
- Avanços da biologia celular e da genética molecularNo EverandAvanços da biologia celular e da genética molecularAinda não há avaliações
- Sindrome NavicularDocumento42 páginasSindrome Navicularadrienerosceli100% (4)
- Glicólise - BQM IIDocumento5 páginasGlicólise - BQM IIJAQUELINE AGUIARAinda não há avaliações
- Doenças Avestruzes e EmasDocumento108 páginasDoenças Avestruzes e Emasadrienerosceli100% (4)
- Sebenta de Bioquímica IIDocumento92 páginasSebenta de Bioquímica IIJoao teixeira100% (3)
- 10-Aula Histoligia AV2Documento26 páginas10-Aula Histoligia AV2Gilberto ConstantinoAinda não há avaliações
- MormoDocumento43 páginasMormoadrienerosceli100% (2)
- Geracao e Conducao de Potenciais de AcaoDocumento53 páginasGeracao e Conducao de Potenciais de AcaoLhana Lorena Melo AtanasioAinda não há avaliações
- Odontogênese e erupção dentáriaDocumento16 páginasOdontogênese e erupção dentáriaSérgio Henrique Ferreira dos ReisAinda não há avaliações
- Ficha Avaliação 6º Ano - Ar e Sistema Respiratório PDFDocumento4 páginasFicha Avaliação 6º Ano - Ar e Sistema Respiratório PDFprof_filipe82% (17)
- Teníase e CisticercoseDocumento40 páginasTeníase e CisticercoseadrienerosceliAinda não há avaliações
- Pintainhos de Um Dia - Incubatórios e NascedourosDocumento26 páginasPintainhos de Um Dia - Incubatórios e NascedourosadrienerosceliAinda não há avaliações
- Apostila Sistema Circulatório2016Documento28 páginasApostila Sistema Circulatório2016Simoni CamposAinda não há avaliações
- Estudo Dirigido - Glicólise PDFDocumento2 páginasEstudo Dirigido - Glicólise PDFCatarina Rodrigues50% (2)
- Gabarito Estudo Dirigido de Trascricao e TraducaoDocumento6 páginasGabarito Estudo Dirigido de Trascricao e TraducaoNelson Jardim FilhoAinda não há avaliações
- Reprodução de TilápiasDocumento40 páginasReprodução de Tilápiasadrienerosceli100% (6)
- Cirurgia Do BaçoDocumento5 páginasCirurgia Do BaçoSolanoAinda não há avaliações
- Propriedades das respostas imunes veterináriasDocumento5 páginasPropriedades das respostas imunes veterináriasLara BorgesAinda não há avaliações
- Cromoterapia Cores e Suas Funções Rene NunesDocumento26 páginasCromoterapia Cores e Suas Funções Rene Nunesmine_allyAinda não há avaliações
- Glicólise: a via metabólica para produção de energia a partir da glicoseDocumento62 páginasGlicólise: a via metabólica para produção de energia a partir da glicoseCaio VictorAinda não há avaliações
- Resumo sobre aminoácidos e estruturas de proteínasDocumento13 páginasResumo sobre aminoácidos e estruturas de proteínasIvanilda MedAinda não há avaliações
- SEBENTA FisiologiaDocumento51 páginasSEBENTA FisiologiaAlina Ardel MartinsAinda não há avaliações
- Roteiro de Estudo EmbriologiaDocumento8 páginasRoteiro de Estudo EmbriologiaMarcos Marzano100% (1)
- Transferência de EmbriõesDocumento46 páginasTransferência de EmbriõesadrienerosceliAinda não há avaliações
- Displasia Coxofemoral em CãesDocumento49 páginasDisplasia Coxofemoral em CãesadrienerosceliAinda não há avaliações
- Laboratório de MorfofuncionalDocumento8 páginasLaboratório de MorfofuncionalpauloAinda não há avaliações
- Patologia - Resumo Robbins 1 - Adaptação, Dano e Morte CelularDocumento11 páginasPatologia - Resumo Robbins 1 - Adaptação, Dano e Morte Celularwiller cassiano100% (2)
- Fisiologia cardiovascular e contração muscular cardíacaDocumento18 páginasFisiologia cardiovascular e contração muscular cardíacaJairo Azevedo100% (2)
- Tema 7 - Transcrição Do Dna - Versão Final PDFDocumento50 páginasTema 7 - Transcrição Do Dna - Versão Final PDFPedro SilvaAinda não há avaliações
- REVISÃO TECIDOS MUSCULARES E NERVOSODocumento14 páginasREVISÃO TECIDOS MUSCULARES E NERVOSOAndrezza CristinaAinda não há avaliações
- Aula 01 DNA, RNA, História Da Genética. Genomas.Documento58 páginasAula 01 DNA, RNA, História Da Genética. Genomas.Davi ÁlefeAinda não há avaliações
- Sistema imune: respostas inata e adaptativaDocumento8 páginasSistema imune: respostas inata e adaptativamarcial_pinazoAinda não há avaliações
- Processamento de RNA mensageiro em eucariotasDocumento3 páginasProcessamento de RNA mensageiro em eucariotasairton barrosAinda não há avaliações
- Estudo Dirigido - FisiologiaDocumento6 páginasEstudo Dirigido - FisiologiaFelipe AssunçãoAinda não há avaliações
- Lista EndocrinoDocumento23 páginasLista EndocrinoFabio Dias MagalhãesAinda não há avaliações
- Sistema circulatório e componentes do sangueDocumento50 páginasSistema circulatório e componentes do sangueCarlos Renato NogueiraAinda não há avaliações
- Fisiologia GastrointestinalDocumento16 páginasFisiologia GastrointestinalPedro SalzanoAinda não há avaliações
- Resumo Guyton (Cap. 45)Documento4 páginasResumo Guyton (Cap. 45)Vinicius VieiraAinda não há avaliações
- (IMUNO) Imunologia Antígeno-Anticorpo - RESUMODocumento9 páginas(IMUNO) Imunologia Antígeno-Anticorpo - RESUMOSamara SantosAinda não há avaliações
- Estudo Dirigido de Imunologia para P1Documento2 páginasEstudo Dirigido de Imunologia para P1Vanessa Suely Campos100% (2)
- O Sistema Nervoso Autônomo e a Medula AdrenalDocumento3 páginasO Sistema Nervoso Autônomo e a Medula AdrenalJomar BorgesAinda não há avaliações
- Estudo dos tecidos do corpo humanoDocumento42 páginasEstudo dos tecidos do corpo humanoMedicina I UnilaAinda não há avaliações
- Fisiologia Renal II - FMUPDocumento48 páginasFisiologia Renal II - FMUPJessica FernandesAinda não há avaliações
- Resumo Anatomia Locomotora Crânio AV1 EstácioDocumento6 páginasResumo Anatomia Locomotora Crânio AV1 EstácioLeonardo Siqueira RamosAinda não há avaliações
- MiologiaDocumento141 páginasMiologiaArthur Sacramento100% (10)
- Slides Aula Desenvolvimento Da Face Full VDocumento66 páginasSlides Aula Desenvolvimento Da Face Full VEmiliana WeissAinda não há avaliações
- INFLAMAÇÃO E RESPOSTA IMUNEDocumento5 páginasINFLAMAÇÃO E RESPOSTA IMUNEmarisademouraAinda não há avaliações
- Neuroanatomia Faculdade Lisboa 2007/2008Documento343 páginasNeuroanatomia Faculdade Lisboa 2007/2008Joao Jose R100% (1)
- Potencial Elétrico ResumoDocumento2 páginasPotencial Elétrico ResumoIasmim MaiaraAinda não há avaliações
- Lista de estruturas anatómicas do coração, pulmões e cabeçaDocumento23 páginasLista de estruturas anatómicas do coração, pulmões e cabeçaalrsdias6108Ainda não há avaliações
- Introdução à Histologia VeterináriaDocumento81 páginasIntrodução à Histologia VeterináriaCarla Nogueira0% (1)
- Biosíntese Do ColágenoDocumento3 páginasBiosíntese Do ColágenoGlendse PinheiroAinda não há avaliações
- Sistema sensorial humanoDocumento43 páginasSistema sensorial humanoJuliana CristinaAinda não há avaliações
- Anemia Falciforme e Stress OxidativoDocumento110 páginasAnemia Falciforme e Stress OxidativoBruno PenedoAinda não há avaliações
- Tecido nervoso e suas característicasDocumento14 páginasTecido nervoso e suas característicashaugustwAinda não há avaliações
- Exercícios FisiologiaDocumento13 páginasExercícios FisiologiabpulgaAinda não há avaliações
- Perguntas FIDocumento12 páginasPerguntas FIapi-26429188Ainda não há avaliações
- Contração muscular: mecanismos e tiposDocumento37 páginasContração muscular: mecanismos e tiposNaillyne GalvãoAinda não há avaliações
- Hemocitopoese - ResumoDocumento7 páginasHemocitopoese - ResumoRichardson Oliveira50% (2)
- Estudo Dirigido 02-Bioquímica MetabólicaDocumento2 páginasEstudo Dirigido 02-Bioquímica MetabólicaMarcio Chao0% (1)
- No caminho certo após uma cirurgia cardíaca: Um guia completo com orientações e recomendações para o pós-operatórioNo EverandNo caminho certo após uma cirurgia cardíaca: Um guia completo com orientações e recomendações para o pós-operatórioAinda não há avaliações
- Da Antiguidade à Redescoberta das Leis de MendelNo EverandDa Antiguidade à Redescoberta das Leis de MendelAinda não há avaliações
- Fungos de interesse médico: classificação, patogenia e propriedadesDocumento18 páginasFungos de interesse médico: classificação, patogenia e propriedadesadrienerosceliAinda não há avaliações
- Papel Do Manipulador Na ContaminaçãoDocumento35 páginasPapel Do Manipulador Na ContaminaçãoadrienerosceliAinda não há avaliações
- LEITE UAT - PPSXDocumento24 páginasLEITE UAT - PPSXadrienerosceliAinda não há avaliações
- Seminário IDocumento28 páginasSeminário IadrienerosceliAinda não há avaliações
- Relatório - Controle de Qualidade em Indústria de PescadoDocumento29 páginasRelatório - Controle de Qualidade em Indústria de Pescadoadrienerosceli100% (1)
- A Importância Do Manejo HigiênicoDocumento2 páginasA Importância Do Manejo HigiênicoadrienerosceliAinda não há avaliações
- DengueDocumento61 páginasDengueadrienerosceliAinda não há avaliações
- Cavalo ÁrabeDocumento19 páginasCavalo ÁrabeadrienerosceliAinda não há avaliações
- Cavalo BretãoDocumento27 páginasCavalo Bretãoadrienerosceli100% (1)
- Tuberculose e SalmoneloseDocumento29 páginasTuberculose e SalmoneloseadrienerosceliAinda não há avaliações
- Forragicultura MorfologiaDocumento25 páginasForragicultura Morfologiaadrienerosceli100% (4)
- Leishmaniose Visceral Chega As Cidades Revista Fapesp Set 2Documento6 páginasLeishmaniose Visceral Chega As Cidades Revista Fapesp Set 2adrienerosceliAinda não há avaliações
- Histologia Do Sistema CardiovascularDocumento18 páginasHistologia Do Sistema CardiovascularadrienerosceliAinda não há avaliações
- Extração ADN células eucarióticasDocumento1 páginaExtração ADN células eucarióticasFrancisca Maria Ferreira Pereira 2021-2022.10CT2Ainda não há avaliações
- Bioquímica clínica: proteínas e albuminaDocumento55 páginasBioquímica clínica: proteínas e albuminaArianne Lopes80% (5)
- Normas de Referência para Análises de LamasDocumento23 páginasNormas de Referência para Análises de LamasAntónio OliveiraAinda não há avaliações
- Concepcao Educacao Paulo Freire paraDocumento9 páginasConcepcao Educacao Paulo Freire paraWashington SilvaAinda não há avaliações
- Processos Proliferativos Não NeoplásicosDocumento54 páginasProcessos Proliferativos Não NeoplásicosMarcos Vinicius MirandaAinda não há avaliações
- Aula Sistema Articular 1º ANO MEDICINA 31-03-2016Documento17 páginasAula Sistema Articular 1º ANO MEDICINA 31-03-2016dom padroAinda não há avaliações
- Chatterton, o Rei Do SuicídioDocumento7 páginasChatterton, o Rei Do SuicídiolesfatAinda não há avaliações
- Riscos físicos no trabalho: ruídoDocumento73 páginasRiscos físicos no trabalho: ruídoSwenny SilvaAinda não há avaliações
- Exercícios 3º Ano - Origem Da Vida e Teorias EvolucionistasDocumento4 páginasExercícios 3º Ano - Origem Da Vida e Teorias EvolucionistasNivaldo Pacchiella Dos Santos AndradeAinda não há avaliações
- Embriologia de ArtrópodesDocumento16 páginasEmbriologia de ArtrópodesLuiza LeseAinda não há avaliações
- Peróxido de Hidrogênio - Importância e DeterminaçãoDocumento8 páginasPeróxido de Hidrogênio - Importância e DeterminaçãoicraoAinda não há avaliações
- Qui MicaDocumento7 páginasQui MicaLeonardo SoaresAinda não há avaliações
- Chakras 1 PDFDocumento5 páginasChakras 1 PDFJackson Maia KujakiAinda não há avaliações
- Arquitetura têxtil: solução sustentável e funcionalDocumento20 páginasArquitetura têxtil: solução sustentável e funcionalCássio EndoAinda não há avaliações
- Centro de Estudo e Manejo de Animais Silvestres em Unai e Regiao - Juliana MoriDocumento37 páginasCentro de Estudo e Manejo de Animais Silvestres em Unai e Regiao - Juliana MoriMurilo Real HeidrichAinda não há avaliações
- Questões VegetaçãoDocumento175 páginasQuestões VegetaçãoErica Souza100% (1)
- HIPERTIREOIDISMODocumento2 páginasHIPERTIREOIDISMOThaís OliveiraAinda não há avaliações
- Tradução, Notas e Comentários Ao Isagoge de Porfírio by Mário Ferreira Dos SantosDocumento71 páginasTradução, Notas e Comentários Ao Isagoge de Porfírio by Mário Ferreira Dos SantosRicardo GusmaoAinda não há avaliações
- Caracterização das cianobactérias fotossintéticasDocumento35 páginasCaracterização das cianobactérias fotossintéticasLeonardo LealAinda não há avaliações
- Trabalho de Nutrição e DietéticaDocumento8 páginasTrabalho de Nutrição e DietéticaJullyanne GilAinda não há avaliações
- Organelas celulares: estruturas intracelulares envolvidas por membranaDocumento13 páginasOrganelas celulares: estruturas intracelulares envolvidas por membranagustavo silvaAinda não há avaliações
- Mecanismos de TransporteDocumento9 páginasMecanismos de Transporteisa057Ainda não há avaliações
- Intoxicação Por Fenilbutazona em EquinoDocumento6 páginasIntoxicação Por Fenilbutazona em EquinoLucasAinda não há avaliações
- Amadurecimento Natural e Artificial Da Banana Prata_20240401_082429_0000Documento30 páginasAmadurecimento Natural e Artificial Da Banana Prata_20240401_082429_0000gilianevieiraAinda não há avaliações