Escolar Documentos
Profissional Documentos
Cultura Documentos
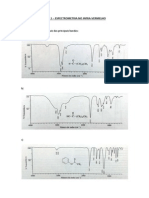
3-O-b-Apiofuranosil - (1-2) Galactopiranosil Quercetina Galactopiranosil Quercetina Arabinopiranosil Quercetina Ramnopiranosil Quercetina em DMSO
Enviado por
Nathalia LuccaTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
3-O-b-Apiofuranosil - (1-2) Galactopiranosil Quercetina Galactopiranosil Quercetina Arabinopiranosil Quercetina Ramnopiranosil Quercetina em DMSO
Enviado por
Nathalia LuccaDireitos autorais:
Formatos disponíveis
Recebido em 25/02/05.
Aceito em 18/10/05
Flavonides O-glicosilados de Croton campestris St. Hill.
(Euphorbiaceae)
Paula M.L. dos Santos1*, Jan Schripsema2, Ricardo M. Kuster1
Ncleo de Pesquisas de Produtos Naturais, Bloco H, Centro de Cincias da Sade, Universidade Federal do Rio de
Janeiro, Ilha do Fundo, 21949-900, Rio de Janeiro, RJ, Brasil,
2
Laboratrio de Cincias Qumicas, Centro de Cincia e Tecnologia, Universidade Estadual do Norte Fluminense,
28015-620, Campos dos Goytacazes, RJ, Brasil
Artigo
Revista Brasileira de Farmacognosia
Brazilian Journal of Pharmacognosy
15(4): 321-325, Out./Dez. 2005
RESUMO: Do extrato butanlico de Croton campestris St. Hill. (Euphorbiaceae) foram isolados
quatro flavonides, todos O-glicosdeos da quercetina. Estas substncias foram identificadas como
3-O--D-apiofuranosil-(12)-galactopiranosil quercetina (1), 3-O--D-galactopiranosil quercetina
(hiperina) (2), 3-O--L-arabinopiranosil quercetina (guaijaverina) (3) e 3-O--L-ramnopiranosil
quercetina (quercitrina) (4).O presente trabalho relata a presena destas substncias pela primeira
vez para esta espcie de Croton, cuja elucidao estrutural deu-se por espectroscopia em UV, EM e
RMN, incluindo as tcnicas bidimensionais: 1H-1H (2D NOESY, 2D COSY), 1H-13C (2D HETCOR)
e 13C (APT), alm de comparaes com os dados da literatura.
Unitermos: Croton campestris, Euphorbiaceae, flavonides O-glicosilados, quercetina.
ABSTRACT: Glycosyl flavonoids from Croton campestris St. Hill. (Euphorbiaceae). Four
flavonoids were isolated from the butanolic extract of the aerial parts of Croton campestris St.
Hill. (Euphorbiaceae). These compounds were identified as 3-O--D-apiofuranosyl-(12)galactopyranoside quercetin (1), 3-O--D-galactopyranoside quercetin (hyperin) (2), 3-O--Larabinopyranoside quercetin (guaijaverin) (3) and 3-O--L-ramnopyranoside quercetin (quercitrin)
(4). They have been isolated for the first time from Croton campestris. Their structures were
elucidated by UV, MS and NMR experiments including 1H-1H (2D NOESY, 2D COSY), 1H-13C (2D
HETCOR), 13C (APT) and by comparison of the spectral data with those reported in the literature.
Keywords: Croton campestris, Euphorbiaceae, flavonoids, quercetin glycosides.
INTRODUO
A famlia Euforbicea possui cerca de 317
gneros e 7500 espcies. O gnero Croton, que possui
700 espcies, largamente distribudo em regies quentes
da Terra, menos freqentemente em regies temperadas
e raramente em regies frias (Heluani et al., 2000). A
espcie Croton campestris, popularmente conhecida
como velame-do-campo, um arbusto de 1-2 metros
de altura originrio do Brasil, ocorrendo principalmente
nas regies sudeste e nordeste (Corra, 1975), possuindo
largo emprego popular como poderoso depurativo, usado
no combate escrofulose, doenas venreas, impingens,
tumores, molstias de pele, reumatismo, lcera do tero,
diarria e artritismo (Cruz, 1982).
O gnero Croton uma fonte rica em diterpenos,
principalmente os do tipo clerodano (Puebla et al., 2002).
Das razes desta espcie foram isolados anteriormente
trs diterpenos: velamolona, velamona e acetato de
velamolona (Babili et al., 1998). Entretanto, alguns
trabalhos relatam a presena de flavonides em algumas
espcies do gnero como em Croton zambezicus onde
cinco flavonides C-glicosilados foram isolados (Wagner
et al., 1970), dois derivados de quercetina eterificados
isolados de Croton schiedeanus (Guerrero et al., 2002) e
tilirosideo de Croton gnaphalii (Lencina et al., 2001).
Este artigo descreve a identificao de quatro
flavonides O-glicosilados encontrados em Croton
campestris, todos descritos pele primeira vez para esta
espcie vegetal.
MATERIAL E MTODOS
Procedimentos experimentais gerais
Os espectros de RMN foram obtidos em
espectrmetro JEOL Eclipse a 400 MHz (1H) e 100 MHz
(13C), sendo as amostras solubilizadas em DMSO-d6. Os
espectros de massas foram obtidos por insero direta
em aparelho CLAE/EM Micromass ZMD pela tcnica
electrospray ionization-ESI. As cromatografias em
camada delgada (CCD) foram feitas em cromatofolhas de
gel de slica 60F254 (Merck), utilizando-se como reagentes
cromognicos o NP (diphenylboric acid 2-aminoethyl
ester) da Spectrum e PEG (poliethylenoglycol) da Vetec.
A cromatografia em coluna de mdia presso (CLMP)
* E-mail: kuster@nppn.ufrj.br, Tel. + 55-21-25626791, Fax + 55-21-22702683
ISSN 0102-695X
321
Paula M.L. dos Santos, Jan Schripsema, Ricardo M. Kuster
HO
10
HO
OH
''
6
4'
2
3
HO
HO
2 ''
''
5 '''
4 '''
OH
HO
'''
2 ''
''
5
3
HO
10
OH
''
'
'
'
OH
HO
6
''
1
''
OH
'' 5''
''
HO
4''
6'
'
1''
OH
OH
4'
O
3''
'
10
H3C
OH
2
'
5
OH
3'
1'
''
OH 3
OH
OH
'
3
1''
OH
OH
1'
O
5
''
OH
5'
6'
O
O
C H 2O H
''
4
'''
1
3 '''
10
OH
6''
HO
C H2OH
3 ''
4'
1'
6
1
OH
3'
2'
5 ''
OH
5'
'
6
C H2 O H
4 ''
'
'
1
OH
3'
2''
OH
Figura 1. Flavonides O-glicosilados de Croton campestris: 3-O--D-apiofuranosil-(12)-galactopiranosil quercetina
(1), 3-O--D-galactopiranosil quecetina (hyperina) (2), 3-O--L-arabinopiranosil quercetina (guaijaverina) (3) e 3-O-L-ramnopiranosil quercetina (quercitrina) (4).
foi feita em coluna SR 10/50 utilizando-se como fase
estacionria a resina Toyopearl HW-40C. A cromatografia
lquida de alta eficincia (CALAE) foi feita em aparelho
Shimadzu CBN 10 A com bomba LC-10 e detector
Diodearray SPD-M10A, coluna Lichrospher 100 RP-18
(5m) Merck.
Material vegetal
As partes areas de Croton campestris (1 Kg)
foram fornecidas pela empresa Flora Medicinal J. Monteiro
da Silva Ltda, cuja identificao foi realizada pelo Dr.
Ricardo Lainetti do Laboratrio de Farmacobotnica,
Faculdade de Farmcia, UFRJ, RJ. O referencial da
espcie encontra-se depositado no Herbrio do Jardim
Botnico do Rio de Janeiro (n 208978).
322
Rev. Bras. Farmacogn.
Braz J. Pharmacogn.
15(4):out/dez. 2005
Extrao, purificao e identificao das substncias
O material j seco e modo (1 Kg), foi
macerado em metanol por uma semana. O filtrado foi
concentrado presso reduzida obtendo-se 22,7 g do
extrato bruto (EB). O EB foi submetido partio em
hexano, diclorometano, acetato de etila e gua em funil
de separao. O fracionamento foi direcionado para
o isolamento de flavonides glicosilados, portanto, as
fraes em acetato de etila e em gua foram submetidas
CCD analtica em gel de slica e reveladas com uma
soluo de aminoetilfenilborato a 1% em etanol (NP) e
polietilenoglicol a 5% em etanol (PEG) para a deteco
de flavonides. A frao aquosa apresentou grande
concentrao de flavonides e foi novamente particionada
em butanol. A frao butanlica foi analisada por CCD de
gel de slica onde foi detectada a presena de flavonides.
Flavonides O-glicosilados de Croton campestris St. Hill. (Euphorbiaceae)
OH
3'
HO
1
O
1'
OH
4'
2'
5'
6'
6
10
OH
6''
HOH2 C
5''
HO
4''
3''
HO
H
1'' H
2''
6'''
CH 2OH
O
4'''
3'''
OH
H
1'''
2'''
OH
Figura 2. Correlaes H-H pela tcnica NOESY para a
substncia 1.
O solvente foi evaporado presso reduzida, obtendose 4,12 g de extrato. O concentrado foi dissolvido em
metanol:gua (3:7) e filtrado. O filtrado foi concentrado
presso reduzida, resultando em 3,15 g de extrato que foi
aplicado em coluna de mdia presso (CLMP), utilizandose como fase mvel MeOH:H2O (3:7), MeOH:H2O (1:1),
MeOH:H2O (7:3) e MeOH puro. As 87 fraes recolhidas
da coluna foram cromatografadas em CCD de gel de
slica para serem reunidas por semelhana, utilizandose como eluente o sistema AcOEt:AcOH:HCOOH:H2O
(100:11:11:27) para a eluio de 1-25 e AcOEt:MeOH:
H2O (8:1,5:0,5) de 26 em diante. Das fraes 30-31
isolou-se a substncia 1 (33,4 mg), de 44-48 a substncia
2 (87,7 mg) e de 54-55 a mistura de 3 e 4 (25 mg). As
substncias isoladas assim como as fraes acetato de
etila e butanlica, foram analisadas por CLAE acoplada
a detector de UV em solues de 1 mg/mL preparadas
antes da anlise. Os dados cromatogrficos foram obtidos
em aparelho Shimadzu CBN 10 A com bomba LC-10
AD a um fluxo de 1 mL/min em coluna Lichrosper 100
RP-18 (5m) Merck. A anlise cromatogrfica deuse em gradiente decrescente de polaridade na seguinte
programao: cido trifluoroactico 0,05% em gua
(solvente A) e acetonitrila (solvente B): 1-10 min, 10%
B linear; 10-40 min 70% B linear. Os dados de UV foram
obtidos pelo detector Diodearray SPD-M10A. Para a
determinao do peso molecular das substncias utilizouse a tcnica electrospray ionization (EM-ESI), adequada
para substncias no-volteis (Crews et al., 1988). Por
tratar-se de polifenis, a obteno do on molecular deuse sob condies de on negativo (M-H)-.
Dados espectroscpicos das substncias
3-O--D-Apiofuranosil-(12)-galactopiranosil
quercetina (1). P amarelo. UV max 354, 259. RMN1H
(400 MHz, DMSO-d6) (ppm) (ver Tabela 2). RMN13C
(100 MHz, DMSO-d6) (ppm) (ver Tabela 1). EM m/z
(%): [M-H]- 595 (100).
3-O--D-Galactopiranosl quercetina (hiperina)
(2). P amarelo. UV max/nm 354, 259. RMN1H (400
MHz, DMSO-d6) (ppm) (ver Tabela 2). RMN13C (100
MHz, DMSO-d6) (ppm) (ver Tabela 1). EM m/z (%):
[M-H]- 463 (100).
3-O--L-Arabinopiranosl
quercetina
(guaijaverina) (3). P amarelo. UV max/nm 354, 256.
RMN1H (400 MHz, DMSO-D6) (ppm) (ver Tabela 2).
RMN13C (100 MHz, DMSO-d6) (ppm) (ver Tabela 1).
EM m/z (%): 300 (96), 301 (92), [M-H]- 433 (29).
3-O--L-Ramnopiranosl
quercetina
(quercitrina) (4). P amarelo. UV max/nm 348, 259.
RMN1H (400 MHz, DMSO-d6) (ppm) (ver Tabela 2).
RMN13C (100 MHz, DMSO-d6) (ppm) (ver Tabela 1).
EM m/z (%): 300 (96), 301 (92), [M-H]- 447 (100).
RESULTADOS
As substncias 1-4 (Figura 1) foram identificadas
pela anlise dos espectros de UV, EM e RMN (incluindo
as tcnicas APT, COSY, HETCOR e NOESY) e em
comparao com os dados da literatura como 3-O-D-apiofuranosil-(12)-galactopiranosil
quercetina
(1) (Hamburger e Hostettmann, 1985; Takahashi et al.,
2001), 3-O--D-galactopiranosil quecetina (hyperina) (2)
(Yasukawa e Takido, 1987), 3-O--L-arabinopiranosil
quercetina (guaijaverina) (3) (Webby e Markhan, 1994;
Fraisse et al., 2000) e 3-O--L-ramnopiranosil quercetina
(quercitrina) (4) (Markhan et al., 1978; Mendez et al.,
1995).
DISCUSSO
O espectro de UV de cada uma das substncias
mostrou-se caracterstico para flavonis, apresentando
dois mximos de absoro, um entre 256-259 nm relativo
ao anel A e outro entre 348-354 nm relativo ao anel B,
onde este ltimo, pela substituio em C-3 (na quercetina
a absoro de 370 nm), sofre efeito hipsocrmco
(Zuanazzi, 2000).
Dos espectros de massas de 1 e 2 obteve-se os
ons a m/z 595 (100%) e m/z 463 (100%) respectivamente,
fornecendo um peso molecular de 596 u para a substncia
1 e 464 u para a substncia 2. Do espectro de massas da
mistura 3 e 4 obteve-se os ons a m/z 433 (29%) e 447
(100%) respectivamente, fornecendo um peso molecular
de 434 u para a substncia 3 e 478 u para a substncia 4.
O espectro de 3 e 4 apresentou duas fragmentaes, m/z
300 (96%) e m/z 301 (92%), que podem ser atribudas a
fragmentaes da ligao acetal entre a quercetina (m/z
301) e o acar.
Atravs dos dados de RMN foi possvel definir a
configurao dos H anomricos, onde, para a substncia
1, H-H vicinal J1-2 = 7,6 Hz, indicou a configurao
para o carbono anomrico C-1 (Wald et al., 1986), como
comum aos flavonides ligados a glicose e galactose
Rev. Bras. Farmacogn.
Braz J. Pharmacogn.
15(4):out/dez. 2005
323
Paula M.L. dos Santos, Jan Schripsema, Ricardo M. Kuster
Tabela 1. Dados de RMN 13C (DMSO-d6, 100 MHz) das substncias 1, 2, 3 e 4
C
2
3
4
5
6
7
8
9
10
1
2
3
4
5
6
1
2
3
4
5
6
1
2
3
4
5
1
156,73
133,69
177,86
161,80
99,20
164,84
93,96
156,08
104,34
121,68
116,05
145,48
149,03
115,73
122,91
99,48
75,34
74,33
68,85
76,21
60,59
109,29
76,69
79,78
74,46
64,91
2
156,86
134,01
178,00
161,74
99,28
164,88
94,09
156,75
104,34
121,61
116,50
145,38
149,03
115,63
122,50
102,37
71,75
73,73
68,46
76,27
60,46
(Markhan et al., 1978). Atravs da tcnica NOESY foi
possvel correlacionar as interaes entre os hidrognios
espacialmente prximos (Figura 2), definindo a seqncia
da ligao entre os acares e a aglicona. A ligao entre
a quercetina e a galactose foi observada pela interao
de H-6 da aglicona com os hidrognios H-1 e H-2 da
galactose, alm da interao de H-2 com H-2. A ligao
da galactose na posio 2 com a apiose na posio 1,
foi evidenciada pela interao entre H-1, H-2 e H-1.
As correlaes C-H foram obtidas pela tcnica HETCOR
onde foi possvel confirmar a regio dos hidrognios dos
acares entre 5,6 e 3,3. Para a substncia 2, J = 7,5
Hz indicou a configurao para o carbono anomrico
C-1 (Yasukawa e Takido, 1987), para a ligao seria
em torno de 3 Hz (Rocha, 1995). O espectro de HETCOR
mostrou a regio dos hidrognios dos acares entre 5,4
e 3,2 atravs da correlao com os respectivos carbonos.
A anlise do espectro da mistura de 3 e 4 foi possvel
com o uso da tcnica NOESY onde diferenciou-se o H5 da arabinose em 3 do H-5 da ramnose em 4. Para a
substncia 3, a constante de acoplamento J = 5,1 Hz e
5,26 para H-1, indicou a configurao para o carbono
anomrico C-1 (Mendez et al., Rocha, 1995; Fraisse et
324
Rev. Bras. Farmacogn.
Braz J. Pharmacogn.
15(4):out/dez. 2005
3
156,78
134,29
178,01
161,72
99,30
164,94
94,11
157,82
104,37
121,41
116,20
145,52
149,16
115,91
122,56
101,96
72,20
71,27
66,65
64,88
4
156,84
134,72
178,24
161,81
99,30
164,94
94,23
157,01
104,54
121,25
116,16
145,74
149,00
116,00
121,66
102,35
70,59
71,71
71,12
70,88
18,02
al., 2000), para a ligao teria J = 3,4 Hz e em torno
de 3,98 (Bergeron et al., 1998). O espectro de HETCOR
mostrou a regio dos hidrognios dos acares entre
5,3 e 3,2 atravs da correlao com os respectivos
carbonos. Os dados da literatura para C-3 ( 70,8) e C5 ( 64) (Markhan et al., 1978; Rocha, 1995), indicam
a forma piranosdica para a arabinose. Por ltimo, a
substncia 4, apresentou J = 1,4 Hz para H-1 e 5,28
em DMSO-d6, que tambm foi obtida em metanol-d3
5,37, correspondendo configurao para o carbono
anomrico (Azen e Horowitz, 1977; Mendez et al., 1995;
Rocha, 1995). O espectro de NOESY contribuiu para
estabelecer a correlao entre os hidrognios aromticos
H-6 e H-5 da aglicona e entre os hidrognios H-6 e H4 da ramnose.
AGRADECIMENTOS
CAPES pela bolsa de P.M.L.S., Dr Ana
Cludia Amaral (FIOCRUZ) pelos espectros de massas
e ao Prof. Dr. Jos Paz Parente (NPPN/UFRJ) pelas
valiosas sugestes.
Flavonides O-glicosilados de Croton campestris St. Hill. (Euphorbiaceae)
Tabela 2. Dados de 1H (DMSO-d6, 400 MHz) das substncias 1, 2, 3 e 4
H
6
8
2
5
6
1
2
3
4
5
6
1
2
4
5
1
6,17 d (1,8)
6,38 d (1,8)
7,49 d (2,2)
6,79 d (8,4)
7,78 dd (2,2;8,4)
5,58 d (7,6)
3,83 m
3,53 m
3,65 m
3,33 m
3,43 e 3,47 m
5,31 s
3,80 m
3,79 m
3,37 m
2
6,20 d (1,8)
6,41 d (1,8)
7,54 d (2,2)
6,82 d (8,4)
7,66 dd (2,2;8,8)
5,37 d (7,5)
3,57 m
3,38 m
3,66 m
3,34 m
3,31 e 3,46 m
REFERNCIAS
Asen S, Horowitz RM 1977. 2-O-acetylquercitrin from azalea
flowers. Phytochemistry 16: 147-148.
Babili FE, Moulis C, Bom M, Respaud MJ, Fourast I 1998.
Three furano diterpenes from the bark of Croton
campestris. Phytochemistry 48: 165-169.
Bergeron C, Martson A, Antus S, Gauthier R, Hostettmann
K 1998. Flavonids from Pyrola elliptica.
Phytochemistry 49: 233-236.
Corra MP 1975. Dicionrio das plantas teis do Brasil. Rio
de Janeiro: Ministrio da Agricultura/Instituto
Brasileiro de Desenvolvimento Florestal.
Crews P, Rodriguez J, Jaspars M 1988. Core techniques of
mass spectrometry: interpretation and use of data.
In: Organic structure Analisys. New York: Oxford
University Press, p. 281-315.
Cruz GL 1982. Dicionrio das plantas teis do Brasil. 2 ed.
Rio de Janeiro: Ed. EDEL.
Fraisse D, Heitz A, Carnat A, Carnat AP, Lamaison JL 2000.
Quercetin 3-arabinopyranoside, a major flavonoid
compound
from
Alchemilla
xanthochlora.
Fitoterapia 71: 463-464.
Guerrero MF, Puebla P, Carrn R, Martin ML, Romn LS
2002. Quercetin 3,4-dimethyl ether: a vasorelaxant
flavonoid isolated from Croton schiedeanus
Schleacht. J Pharm Pharmacol 54: 1373-1378.
Hamburger M, Gupta M, Hostettmann K 1985. Flavonol
glycosides
from
Securidaca
diversifolia.
Phytochemistry 24: 2689-2692.
Heluani CS, Catalan CAN, Hernndez LR, Tapia EB, Natan
PJ 2000. Three new diterpenoids based on novel
sarcopetalene skeleton from Croton sarcopetalus. J
Nat Prod 63: 222-225.
Lencina C, Pires VS, Gosmann G, Taketa ATC, Schenkel EP
2001. Tilirosdeo em Croton gnaphalii Bail. Rev
Bras Farmacogn 11: 89-94.
Markhan KR, Ternai B, Stanley R, Geiger H, Mabry TJ 1978.
Carbon-13 NMR studies of flavonoids-III naturally
occurring flavonoid glycosides and their acetylated
3
6,20 d (1,8)
6,40 d (1,8)
7,52 d (2,2)
6,89 d (8,4)
7,60 dd (2,2;8,4)
5,26 d (5,1)
3,52 m
3,77 m
3,67 m
3,24 e 3,58 m
4
6,20 d (2,2)
6,38 d (2,2)
7,29 d (2,2)
6,88 d (8,0)
7,25 dd (2,2;8,0)
5,28 d (1,4)
3,98 m
3,75 m
3,21 m
3,50 m
0,80 s
derivatives. Tetrahedron 34: 1389-1397.
Mendez J, Bilia AR, Morelli I 1995. Phytochemical investigations
of Licania genus. Flavonoids and triterpenoids from
Licania pittieri. Pharmaceutica Acta Helvetiae 70:
223-226.
Puebla P, Lpez JL, Guerrero M, Carrn R, Martn ML, Romn
LS, Feliciano AS 2003. Neo-clerodane diterpenoids
from Croton schiedeanus. Phytochemistry 62: 551555.
Rocha LM 1995. Investigation phytochimique de Hypericum
brasiliense (Gutiferae). Lausanne, 220 p.
These de Doctorat de Phytochemie, Institut de
Pharmacognosie et Phytochemie, Universit de
Lausanne.
Takahashi H, Hirata S, Minami H, Fukuyama Y 2001. Triterpene
and flavanone glycoside from Rhododendron simsii.
Phytochemistry 56: 875-879.
Wagner H, Hrhammer L, Kiraly IC 1970. Flavon-C-glykoside
in Croton zambezicus. Phytochemistry 9: 897.
Wald B, Galensa R, Herman C, Grotjahn L, Wray V, 1986.
Quercetin 3-O-[6-(3-hydroxy-3-methylglutaroyl)-galactoside] from blackberries. Phytochemistry
25: 2904-2905.
Webby RF, Markhan KR 1994. Isoswertiajaponin 2-O-arabinopyranoside and other flavone-C-glycosides
from the antartic grass Deschampsia Antarctica.
Phytochemistry 36: 1323-1326.
Yazukawa K, Takido M 1987. A flavonol glycoside from
Lysimanchia mauritana. Phytochemistry 26: 12241226.
Zuanazzi JAS 2000. Flavonides. In: Simes CMA, Schenkel
EP, Gosmann G, Mello JCP, Mentz LA, Petrovick
PR. Farmacognosia da planta ao medicamento. 2
ed. Porto Alegre: Ed. Universidade/UFRGS/Ed. da
UFSC, p. 489-516.
Rev. Bras. Farmacogn.
Braz J. Pharmacogn.
15(4):out/dez. 2005
325
Você também pode gostar
- E-Book Completo - Prescrições, Fórmulas e DosagensDocumento36 páginasE-Book Completo - Prescrições, Fórmulas e DosagensRosina100% (2)
- Ar Condicionado Split Samsung Virus Doctor ManualDocumento3 páginasAr Condicionado Split Samsung Virus Doctor ManualIgor Paiva50% (4)
- Apostila Florais de Minas PDFDocumento48 páginasApostila Florais de Minas PDFElizeu Burgos da Silva100% (3)
- Citologia Clínica: Constituintes Do Esfregaço Cervical NormalDocumento50 páginasCitologia Clínica: Constituintes Do Esfregaço Cervical NormalTaynná CruzAinda não há avaliações
- Relatório Biologia MolecularDocumento14 páginasRelatório Biologia MolecularCamila Volponi100% (1)
- CHECK - Avaliação ErgonomicaDocumento33 páginasCHECK - Avaliação ErgonomicaClelma SantiagoAinda não há avaliações
- Separação de Pigmentos Por Cromatografia em PapelDocumento6 páginasSeparação de Pigmentos Por Cromatografia em Papelramiromescias100% (1)
- Anexo Vii - Veterinaria - Modelo de Elaboracao de PopsDocumento4 páginasAnexo Vii - Veterinaria - Modelo de Elaboracao de PopsEquilibrio Pet0% (2)
- Lya Luft - FelicidadeDocumento2 páginasLya Luft - FelicidadeRoger Willian CabralAinda não há avaliações
- Análise Crítica Do Poema Vozes D'áfricaDocumento7 páginasAnálise Crítica Do Poema Vozes D'áfricaPirro Corisco0% (1)
- Separação de Pigmentos de Couve Por Cromatografia em PapelDocumento9 páginasSeparação de Pigmentos de Couve Por Cromatografia em PapelMariAinda não há avaliações
- Lista de Exercicios 2 EstereoquimicaDocumento4 páginasLista de Exercicios 2 EstereoquimicaFelipe Morgan0% (1)
- E Book Educa MangueDocumento35 páginasE Book Educa MangueEvandro PalmieriAinda não há avaliações
- Aula 08 Ciclo Do FósforoDocumento53 páginasAula 08 Ciclo Do FósforotomcefetAinda não há avaliações
- A07v12s1 - Flavonóides de Cissus Verticillata e A Atividade Hipoglicemiante Do Chá de Suas FolhasDocumento3 páginasA07v12s1 - Flavonóides de Cissus Verticillata e A Atividade Hipoglicemiante Do Chá de Suas FolhasaraujoalcaAinda não há avaliações
- Biosintese Da Escopoletina e Escopolina em Mandioca Deterioração OkDocumento43 páginasBiosintese Da Escopoletina e Escopolina em Mandioca Deterioração OkInaiara CasapulaAinda não há avaliações
- I-074 Determinacao de Clorofila Pelo Met PDFDocumento13 páginasI-074 Determinacao de Clorofila Pelo Met PDFBruno PereiraAinda não há avaliações
- GRUPO 13alcaloides Indólicos de Cascas de Aspidosperma Vargasii E. A. DesmanthumDocumento6 páginasGRUPO 13alcaloides Indólicos de Cascas de Aspidosperma Vargasii E. A. DesmanthumfranciscoAinda não há avaliações
- Estudo Sobre A Espécie Verbena MinutifloraDocumento4 páginasEstudo Sobre A Espécie Verbena MinutifloraAna Clara RodriguesAinda não há avaliações
- Lista EstereoquímicaDocumento4 páginasLista EstereoquímicaGiovanni MunizAinda não há avaliações
- Acetogeninas de Anonáceas Bioativas Isoladas Das Sementes de Annona Cornifolia A. ST - Hil.Documento4 páginasAcetogeninas de Anonáceas Bioativas Isoladas Das Sementes de Annona Cornifolia A. ST - Hil.Sadao MatsumotoAinda não há avaliações
- Relatório 8 Cromatografia CCDDocumento6 páginasRelatório 8 Cromatografia CCDGuilherme MarquesAinda não há avaliações
- Artigo CLFDocumento1 páginaArtigo CLFDiego FrancaAinda não há avaliações
- Ca 04274Documento3 páginasCa 04274Andy MoreiraAinda não há avaliações
- Terpenoids and Coumarins From Jatropha Ribifolia PDocumento6 páginasTerpenoids and Coumarins From Jatropha Ribifolia PAldo RodarteAinda não há avaliações
- Cariotipo Da Albacora AzuulDocumento16 páginasCariotipo Da Albacora AzuulA B N E R G A M A L I E LAinda não há avaliações
- Biosintese Da Escopoletina e Escopolina em Mandioca Deterioração CertoDocumento41 páginasBiosintese Da Escopoletina e Escopolina em Mandioca Deterioração CertoInaiara CasapulaAinda não há avaliações
- Livro de Resumos Da 25 SEMIC UERJ - 2016Documento1.323 páginasLivro de Resumos Da 25 SEMIC UERJ - 2016B.L.AAinda não há avaliações
- Oswaldojunior, Gerente Da Revista, 15847-57934-1-CEDocumento12 páginasOswaldojunior, Gerente Da Revista, 15847-57934-1-CENitro NhacutoneAinda não há avaliações
- Intoxicação Veneno de Sapo Bufo PDFDocumento3 páginasIntoxicação Veneno de Sapo Bufo PDFBritto FilhoAinda não há avaliações
- ExtraçaoantocianinasDocumento2 páginasExtraçaoantocianinasMarcia BayAinda não há avaliações
- Qualidade de Luz e Produção de Pigmentos Fotossintéticos em Plantas in Vitro de Phyllanthus Tenellus RoxbDocumento3 páginasQualidade de Luz e Produção de Pigmentos Fotossintéticos em Plantas in Vitro de Phyllanthus Tenellus RoxbJefferson Bittencourt VenâncioAinda não há avaliações
- Aula AntimalaricosDocumento17 páginasAula AntimalaricosdanvipiAinda não há avaliações
- PaseudobDocumento7 páginasPaseudobcristianeAinda não há avaliações
- Composição Química de Cinco Espécies de Eucaliptos PDFDocumento6 páginasComposição Química de Cinco Espécies de Eucaliptos PDFRicardo CézareAinda não há avaliações
- Origem Dos FármacosDocumento32 páginasOrigem Dos FármacosCharlesAinda não há avaliações
- Relatório Analitica FerroDocumento14 páginasRelatório Analitica FerroGeise Mezzari0% (1)
- Análise de PH, Condutividade, Turbidez e Oxigênio Dissolvido em Amostra de Água Do Córrego Riacho Fundo - Distrito FederalDocumento12 páginasAnálise de PH, Condutividade, Turbidez e Oxigênio Dissolvido em Amostra de Água Do Córrego Riacho Fundo - Distrito FederalMárcio CunhaAinda não há avaliações
- Isolamento e Caracterizaçao de Produtos Bioativos Extraidos de UlomoidesDocumento4 páginasIsolamento e Caracterizaçao de Produtos Bioativos Extraidos de UlomoidesPAMALA GERMANO DO NASCIMENTOAinda não há avaliações
- POP - ThalitaDocumento5 páginasPOP - ThalitaThalita ManocchiAinda não há avaliações
- Chemical Analysis and Evaluation of Antioxidant...Documento7 páginasChemical Analysis and Evaluation of Antioxidant...Douglas SampaioAinda não há avaliações
- Lista de Exercicios 3 PDFDocumento3 páginasLista de Exercicios 3 PDFSamuca LustosaAinda não há avaliações
- PariparobaDocumento5 páginasPariparobacelmorcelliAinda não há avaliações
- Apostila de FluorescenciaDocumento34 páginasApostila de FluorescenciaCleber JadoskiAinda não há avaliações
- Abfh Actaea SpicataDocumento2 páginasAbfh Actaea SpicataJuliana BossanAinda não há avaliações
- Clorofila METODOLOGIADocumento21 páginasClorofila METODOLOGIALiana Maia0% (1)
- Cynara ScolymusDocumento32 páginasCynara ScolymusMichele De Carli100% (1)
- Desenvolvimento e Validação de Um Método Multiresíduo para Determinação deDocumento4 páginasDesenvolvimento e Validação de Um Método Multiresíduo para Determinação deNataliSchioAinda não há avaliações
- Seminario Cloroplastos ApresentarDocumento44 páginasSeminario Cloroplastos ApresentarDaniel ArrudaAinda não há avaliações
- 2017-MODIFICAÇÃO QUÍMICA DA PECTINA DO MELÃO CAIPIRA (Cucumis Melo VAR. ACIDULUS)Documento7 páginas2017-MODIFICAÇÃO QUÍMICA DA PECTINA DO MELÃO CAIPIRA (Cucumis Melo VAR. ACIDULUS)Laboratorio y Control de Calidad Planta ProAinda não há avaliações
- Alelopatia - Principios Basicos e Aspectos GeraisDocumento257 páginasAlelopatia - Principios Basicos e Aspectos Geraiswillian.silva9619Ainda não há avaliações
- ARTIGO 4 TraduçãoDocumento14 páginasARTIGO 4 TraduçãoEva Ferreira LopesAinda não há avaliações
- Pop - Líquido CefalorraquidianoDocumento13 páginasPop - Líquido Cefalorraquidianodanilo004060Ainda não há avaliações
- UNIFESP 2003 3dia PDFDocumento27 páginasUNIFESP 2003 3dia PDFMarcus Vinicius Alves da SilvaAinda não há avaliações
- Relatorio Da Aula Pratica II de BioquimiDocumento13 páginasRelatorio Da Aula Pratica II de BioquimimiguelleitevieiraAinda não há avaliações
- DescargaDocumento8 páginasDescargaMauricio SilvestriAinda não há avaliações
- ,Documento10 páginas,ESTERPHANE TEIXEIRA PIRESAinda não há avaliações
- Prática AgrotóxicosDocumento2 páginasPrática AgrotóxicosceloferriAinda não há avaliações
- Ajuda, Henriques. Toxicologia 2021, Caso Intox.Documento8 páginasAjuda, Henriques. Toxicologia 2021, Caso Intox.HenriquêsArturAjudaAinda não há avaliações
- Nucella LapillusDocumento12 páginasNucella LapillusJoão GilAinda não há avaliações
- Prova Conhecimentos Gerais UFTMDocumento28 páginasProva Conhecimentos Gerais UFTMSameri Rocon GuastiAinda não há avaliações
- Biologia Pl-PlotDocumento11 páginasBiologia Pl-PlotLara CardosoAinda não há avaliações
- Cromatografia de Papel Taninos PDFDocumento4 páginasCromatografia de Papel Taninos PDFSalazar JansemAinda não há avaliações
- Tese Completa DefinitivaDocumento128 páginasTese Completa Definitivaduarte ramosAinda não há avaliações
- Aula EcotoxDocumento31 páginasAula EcotoxMaria do Carmo Faria PaesAinda não há avaliações
- Prova 2018.1Documento2 páginasProva 2018.1ISRAEL DA LUZ RODRIGUESAinda não há avaliações
- Laurus Nobilis VFDocumento9 páginasLaurus Nobilis VFLuana Rodrigues GalvesAinda não há avaliações
- Aula 2 MTODOS DE ESTUDOS DE CLULAS-20.2-FARMDocumento52 páginasAula 2 MTODOS DE ESTUDOS DE CLULAS-20.2-FARMPersonal Trainer Rafael Cruz do NascimentoAinda não há avaliações
- Sistema Renina Angiotensina Aplicada A Reprodução Em CaprinosNo EverandSistema Renina Angiotensina Aplicada A Reprodução Em CaprinosAinda não há avaliações
- GnosiaDocumento8 páginasGnosiaNathalia LuccaAinda não há avaliações
- Farmacognosia Fatores de Cia de Metabolicos SecundariosDocumento8 páginasFarmacognosia Fatores de Cia de Metabolicos SecundariosPlinio PonteAinda não há avaliações
- CEDERJ-Biologia Celular I - AulaDocumento14 páginasCEDERJ-Biologia Celular I - Aulaapi-3800070Ainda não há avaliações
- ProtquinasesDocumento18 páginasProtquinasesNady ChavesAinda não há avaliações
- Carqueja PDFDocumento8 páginasCarqueja PDFAntenor LiottiAinda não há avaliações
- Análise Cromatográfica de FitoterápicosDocumento3 páginasAnálise Cromatográfica de FitoterápicosallanHFAinda não há avaliações
- I04 InfavaliacaoqualDocumento5 páginasI04 InfavaliacaoqualRobert HumphreyAinda não há avaliações
- Interações Ginkgo Ou GinsengDocumento10 páginasInterações Ginkgo Ou GinsengNathalia Lucca100% (1)
- Exercícios IsomeriaDocumento13 páginasExercícios IsomeriavieirasalesAinda não há avaliações
- Anestesiologia08 Anestesiainalatria Medresumosset 2011 120627021248 Phpapp01Documento10 páginasAnestesiologia08 Anestesiainalatria Medresumosset 2011 120627021248 Phpapp01Nathalia LuccaAinda não há avaliações
- Glicosídeos CardioativosDocumento3 páginasGlicosídeos CardioativosNathalia Lucca100% (1)
- Alzheimer 1Documento22 páginasAlzheimer 1Nathalia LuccaAinda não há avaliações
- Anestesiologia08 Anestesiainalatria Medresumosset 2011 120627021248 Phpapp01Documento10 páginasAnestesiologia08 Anestesiainalatria Medresumosset 2011 120627021248 Phpapp01Nathalia LuccaAinda não há avaliações
- Alzheimer 1Documento22 páginasAlzheimer 1Nathalia LuccaAinda não há avaliações
- Exercícios Lista 1 IVDocumento5 páginasExercícios Lista 1 IVNathalia LuccaAinda não há avaliações
- Abnt Ufmg 2014Documento31 páginasAbnt Ufmg 2014Nathalia LuccaAinda não há avaliações
- 1969 782Documento3 páginas1969 782Nathalia LuccaAinda não há avaliações
- MANUAL TCC 2014 - Manual - de - Normalizacao2014Documento142 páginasMANUAL TCC 2014 - Manual - de - Normalizacao2014GavResgateAinda não há avaliações
- Expressao de Genes Envolvidos Na Resposta Imune de Individuos Com Sindrome de Down Frente A Doenca PeriodontalDocumento107 páginasExpressao de Genes Envolvidos Na Resposta Imune de Individuos Com Sindrome de Down Frente A Doenca PeriodontalNathalia LuccaAinda não há avaliações
- Expressao de Genes Envolvidos Na Resposta Imune de Individuos Com Sindrome de Down Frente A Doenca PeriodontalDocumento107 páginasExpressao de Genes Envolvidos Na Resposta Imune de Individuos Com Sindrome de Down Frente A Doenca PeriodontalNathalia LuccaAinda não há avaliações
- 1969 782Documento3 páginas1969 782Nathalia LuccaAinda não há avaliações
- Caso Clinico 4Documento1 páginaCaso Clinico 4Nathalia LuccaAinda não há avaliações
- Relatorio Da 4º Aula Prática 2º Periodo.Documento12 páginasRelatorio Da 4º Aula Prática 2º Periodo.Nathalia LuccaAinda não há avaliações
- Tratamento Fitoterapico em Pessoas Da Zona RuralDocumento7 páginasTratamento Fitoterapico em Pessoas Da Zona RuralSilvia Cristian\Ainda não há avaliações
- Tratamento Fitoterapico em Pessoas Da Zona RuralDocumento7 páginasTratamento Fitoterapico em Pessoas Da Zona RuralSilvia Cristian\Ainda não há avaliações
- Casos ClinicosDocumento5 páginasCasos ClinicosNathalia LuccaAinda não há avaliações
- Casos ClinicosDocumento5 páginasCasos ClinicosNathalia LuccaAinda não há avaliações
- Biofis 5Documento43 páginasBiofis 5Nathalia LuccaAinda não há avaliações
- CLC 7 - Saberes FundamentaisDocumento2 páginasCLC 7 - Saberes FundamentaisCarlos FernandesAinda não há avaliações
- Instrução Suplementar - IsDocumento1.067 páginasInstrução Suplementar - IsAdriana CarvalhoAinda não há avaliações
- Introdução A FarmacognosiaDocumento27 páginasIntrodução A FarmacognosiaFabiana PaciuloAinda não há avaliações
- Puerperio Patológico em VacasDocumento54 páginasPuerperio Patológico em VacasRafael Leão100% (1)
- Iluminacao Aves de Postura Embrapa PDFDocumento8 páginasIluminacao Aves de Postura Embrapa PDFLucas SouzaAinda não há avaliações
- AGAMBEN O Homem Sem Conteudo Ebook Capitulo 8 1a ParteDocumento8 páginasAGAMBEN O Homem Sem Conteudo Ebook Capitulo 8 1a ParteTatiana CarvalhoAinda não há avaliações
- Estudo Dirigido AfDocumento4 páginasEstudo Dirigido AfÁvila BonfáAinda não há avaliações
- GenéticaDocumento3 páginasGenéticalol lolAinda não há avaliações
- MoluscosDocumento4 páginasMoluscosKaillany Pinheiro LunaAinda não há avaliações
- Relacionamentos Amorosos Na JuventudeDocumento20 páginasRelacionamentos Amorosos Na JuventudeEliezer BordinhãoAinda não há avaliações
- Intro Ao AyurvedaDocumento57 páginasIntro Ao AyurvedaAline AlmeidaAinda não há avaliações
- As Etapas Da Embriogênese ComparadaDocumento28 páginasAs Etapas Da Embriogênese ComparadaThales ツAinda não há avaliações
- Definição e Histórico Analise SensorialDocumento14 páginasDefinição e Histórico Analise Sensorialbhanny2Ainda não há avaliações
- Engenheiro Paulo de FrontinDocumento31 páginasEngenheiro Paulo de FrontinCarla AmaralAinda não há avaliações
- Escrituras Sangradas de Civone Medeiros, Livro2 - Ave de Arribaçã Ou A Propósito de Viena e Outros OndesDocumento134 páginasEscrituras Sangradas de Civone Medeiros, Livro2 - Ave de Arribaçã Ou A Propósito de Viena e Outros OndesCivone Medeiros0% (1)
- (TEO) - Princípios Científicos Do TreinamentoDocumento3 páginas(TEO) - Princípios Científicos Do Treinamentoapi-3695814Ainda não há avaliações
- Ciencias Naturais Teste de Avaliacao Sobre FosseisDocumento4 páginasCiencias Naturais Teste de Avaliacao Sobre Fosseisaliciahand5414Ainda não há avaliações
- Rinaldop, 223Documento3 páginasRinaldop, 223Francisco BrazAinda não há avaliações
- iNFRAVERMELHO LONGO E DLM NA CELULITE II E IIIDocumento4 páginasiNFRAVERMELHO LONGO E DLM NA CELULITE II E IIISuzan Magno Leão NoschangAinda não há avaliações
- Características Universais Das CélulasDocumento5 páginasCaracterísticas Universais Das CélulasBruno MunizAinda não há avaliações
- Defeitos PDFDocumento67 páginasDefeitos PDFEngenharia Unip Rio PardoAinda não há avaliações