Escolar Documentos
Profissional Documentos
Cultura Documentos
Aluminotermia 08 2018
Enviado por
hebsonbezerraDescrição original:
Título original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Aluminotermia 08 2018
Enviado por
hebsonbezerraDireitos autorais:
Formatos disponíveis
CENTRO FEDERAL DE EDUCAÇÃO TECNOLÓGICA DE MINAS GERAIS
CAMPUS TIMÓTEO
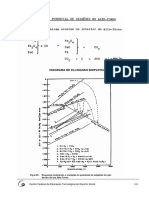
Aluminotermia - um alto-forno em miniatura.
Prof. Armin F. Isenmann
Áreas afins: Química Inorgânica; Processos Industriais
Duração do ensaio: cerca de 30 minutos (mais a secagem durante a noite).
Nível de dificuldade: baixo
Nível de periculosidade: médio
Parte teórica
Um alto-forno reduz o metal, a partir do seu minério oxídico, através de carbono ou monóxido
de carbono. Este processo se chama de “redução carbotérmica”. A combustão de carbono (que
está disponível em excesso) fornece a alta temperatura que for necessária para fundir o metal
e a escória, os dois produtos principais deste processo.
No passado não faltaram tentativas em achar um redutor alternativo ao carbono, já que o
subproduto CO2 é um dos responsáveis para o efeito estufa. Em larga escala aplicam-se,
portanto processos onde o aquecimento ocorre via arco elétrico. Os balanços, energético e de
matéria revelam, no entanto, que esta rota somente se justifica quando a geração da alta
quantidade de energia elétrica pode ser produzida de maneira "limpa", isto é, a base da força
da água, do vento ou do sol.
Em pequena escala, outros metais, por sua vez mais reativos frente o oxigênio do que o ferro,
podem ser empregados como redutores alternativos. Como as seguintes equações mostram,
eles liberam energias consideráveis:
Fe2O3 + 2 Al → 2 Fe + Al2O3 ΔHR (298°C) = – 416,7 kJ/mol Fe
(Óxido de Fe(III) tem uma temperatura de fusão/decomposição de 1.565 °C)
3 Fe3O4 + 8 Al → 9 Fe + 4 Al2O3 ΔHR (298°C) = – 372 kJ/mol Fe
(Óxido de Fe(II,III) tem uma temperatura de fusão de 1.538 °C)
Embora a última equação prediga o consumo de 8 moles de Al a cada 3 mols de Fe3O4, na
prática se aplica um leve déficit em redutor, para evitar a formação de liga Fe-Al.
Como essas reações decorrem em curto tempo e quase nenhum gás está sendo liberado que
poderia sequestrar o calor, elas provocam picos quentes dentro da mistura, entre 2.200 e 2.400
°C. Nestas temperaturas o co-produto da aluminotermia, o corúndio Al2O3, também funde
(Tfus=2050 °C) e bóia em forma de escória em cima do Fe. Para assegurar uma boa separação
da escória do metal, a mistura deve ser retida no reator por aproximadamente 2 minutos - o
que certamente não é trivial, pois a maioria dos materiais do reator igualmente funde sob estas
condições!
Sabemos que a temperatura ótima do processamento de Fe líquido fica em torno de 1.600 °C,
então precisamos de um aditivo que abaixa a temperatura desta mistura. Usa-se geralmente
sucata de ferro ou aço, de preferência a varredura da serralharia, onde grande parte é Fe metal
(sua fusão é endotérmica, então consome energia) e o tamanho dos grãos é < 1 mm.
Oferecem-se também aditivos que introduzem os metais de liga desejados (carbono,
manganês, níquel, cromo, molibdênio e vanádio, principalmente).
A aplicação principal da aluminotermia é a solda de trilhos de trem. Os trilhos devem ser pré-
aquecidos a 700 a 900 °C e se aplica em torno de 13 Kg de mistura de termita para uma solda
de qualidade.
Existem várias formas de ignição deste mini-alto-forno. Note que nem todas as misturas são
viáveis nesta prática, devido seu inerente perigo de explosão:
Fita de Mg (por sua vez, mais reativo ainda frente ao O2 do que Al)
Permanganato de potássio e glicerina (ca. 25 g de KMnO4 e 6 mL de glicerina)
Misturar cuidadosamente (explosivo!) 1 g de KClO3 com 1 g de açúcar, posicionar em
cima da mistura de termita e gotejar 1 gotinha de H2SO4 conc.
Misturar cuidadosamente (explosivo!) 10 g de peróxido de bário com 15 g de magnésio
em pó, sob exclusão rigorosa de umidade; posicionada em cima da termita essa mistura
pode ser acesa por uma fita de Mg de > 10 cm de comprimento. Um pavio alternativo é
uma fita de papel de filtro que foi mergulhado em KNO3 conc. e secado.
Enfiar duas "velas-estrelinha de festa" acesas;
Melhor do que a última funcionam as "velas especiais para aluminotermia" que são
comercialmente disponíveis.
Composição de uma vela estrelinha ("Sparkler"):
55% Ba(NO3)2, 5% Al em pó, 25% Fe em pó, 15% dextrina de aglutinante.
Composição de uma vela especial para aluminotermia (bem mais brisante!):
53% Ba(NO3)2, 15% Fe2O3 (= fonte adicional de oxigênio), 20% Al em pó, 12% dextrina.
Devido a esta composição a velinha reage semelhante à nossa mistura de termita.
As reações pirotécnicas principais são:
10 Al + 3 Ba(NO3)2 → 5 Al2O3 + 3 BaO + 3 N2
2 Al + Fe2O3 → Al2O3 + 2 Fe,
enquanto a parte orgânica queima conforme:
5 (C6H10O5)n.H2O + 12 n Ba(NO3)2 → 30n CO2 + (25n +5) H2O + 12 n BaO + 12 N2
Devido à instabilidade do CO2 a altas temperaturas deveríamos considerar também a seguinte
equação:
5 (C6H10O5)n.H2O + 6 n Ba(NO3)2 → 30n CO + (25n +5) H2O + 6 n BaO + 6 N2
Parte prática
a) Usaremos um pequeno vaso de barro (comprar na floricultura) e fechamos o buraco
em baixo com uma pequena moeda.
b) Misturam-se 100 g de minério de ferro (hematita) com 25 g de pó da serralharia e a
quantidade necessária de raspas de alumínio (observação: devido às impurezas
contidas nas raspas de Al, deve-se acrescentar 5% acima do calculado).
c) Todos os componentes desta reação devem ser secos (estufa a 200 °C, 24 h). A
mistura de termita está sendo usada enquanto estiver quente.
d) As raspas de Al contêm uma camada grossa de óxido que as protege da oxidação. Isso
pode acarretar certas dificuldades na hora da ignição.
e) Óculos de proteção são imprescindíveis, durante toda a prática!
f) Deve-se usar 25 g de KMnO4 (frio). Essa porção é colocada numa cavidade da mistura
de termita, até chegar numa profundidade de alguns centímetros. Em cima do KMnO 4
deve-se fazer uma pequena cavidade para a glicerina.
g) Usaremos cerca de 6 a 8 mL de glicerina (frio).
h) Despejar toda a glicerina na cavidade do KMnO4 e afastar-se rapidamente da mistura.
O tempo de indução é cerca de 10 segundos.
i) O ferro fundido pode ser resfriado por um jato de água, liberado da escória e pesado.
Questionário:
1. Calcule à base da equação geral da aluminotermia, a quantidade necessária de Al, para
transformar 100 g de Fe2O3 em ferro metálico.
2. Formule a reação redox devidamente equilibrada, de KMnO4 e glicerina (os produtos
podem ser MnO2 ou MnO; escolhe um).
3. Calcule o rendimento em ferro obtido (em % do valor teórico que se dá do peso do
minério da composição Fe2O3 e do ferro em pó da serralharia).
Você também pode gostar
- NBR ISO 55001 Requisitos PDFDocumento22 páginasNBR ISO 55001 Requisitos PDFhebsonbezerra100% (2)
- Apostila de SoldagemDocumento70 páginasApostila de SoldagemNatan Santana100% (4)
- 6-Alto Forno EspecializacaoDocumento40 páginas6-Alto Forno EspecializacaoGeraldo Magela PereiraAinda não há avaliações
- Calandra Piramidal - Cálculo Da Potência de AcionamentoDocumento3 páginasCalandra Piramidal - Cálculo Da Potência de Acionamentohebsonbezerra100% (7)
- Aços Inoxidáveis - Corrosão E Métodos Para DetecçãoNo EverandAços Inoxidáveis - Corrosão E Métodos Para DetecçãoAinda não há avaliações
- AduçãoDocumento71 páginasAduçãokaianeAinda não há avaliações
- Evolução e Organização Da Tabela PeriódicaDocumento21 páginasEvolução e Organização Da Tabela PeriódicaMatilde SilvaAinda não há avaliações
- Forno CubilôDocumento13 páginasForno Cubilôabelmil123Ainda não há avaliações
- 01 - Fundamentos Teóricos para Refratários de Contato Com Alumínio FundidoDocumento94 páginas01 - Fundamentos Teóricos para Refratários de Contato Com Alumínio FundidoMatheus Martini100% (1)
- Curso Refino Secundário 1Documento34 páginasCurso Refino Secundário 1Jeferson Alves100% (3)
- Seminário - Fornos Usados Na Fundição Dos MetaisDocumento14 páginasSeminário - Fornos Usados Na Fundição Dos MetaisAdriano Ruiz100% (1)
- FlangeDocumento10 páginasFlangehebsonbezerraAinda não há avaliações
- Oxicorte SegurançaDocumento12 páginasOxicorte SegurançaWagner Rogerio Domingos100% (2)
- 1a Lista de Exercícios de Química para A Turma IMEDocumento4 páginas1a Lista de Exercícios de Química para A Turma IMEDaniel VianaAinda não há avaliações
- Apresentação de Segurança para Trabalho A Quente Modulo de Atividades Com MaçaricoDocumento84 páginasApresentação de Segurança para Trabalho A Quente Modulo de Atividades Com Maçaricoigor teixeiraAinda não há avaliações
- Completação de Poços - Contenção de AreiaDocumento27 páginasCompletação de Poços - Contenção de AreiaThiago SaraivaAinda não há avaliações
- Capítulo 2: Soldagem Por OxigásDocumento11 páginasCapítulo 2: Soldagem Por Oxigáslmlmla02Ainda não há avaliações
- Processo Metalúrgica Pb.Documento77 páginasProcesso Metalúrgica Pb.Evandro CoelhoAinda não há avaliações
- Fabricacao de Tarugos para ExtrusaoDocumento163 páginasFabricacao de Tarugos para ExtrusaoEduardo DeakAinda não há avaliações
- SOLDAGEM Por OxigasDocumento10 páginasSOLDAGEM Por OxigasDionatas NascimentoAinda não há avaliações
- Aluminotermia CompletoDocumento48 páginasAluminotermia CompletoThiago Fernando Dos SantosAinda não há avaliações
- AlumitermiaDocumento14 páginasAlumitermiagarbazzaAinda não há avaliações
- Trabalho 1 de Processamento MineralDocumento7 páginasTrabalho 1 de Processamento MineralAntonio Elias Fobene100% (1)
- Cena Usp PiracicabaDocumento61 páginasCena Usp PiracicabaTháliaAinda não há avaliações
- AmôniaDocumento18 páginasAmôniaJoao MarcosAinda não há avaliações
- Tópicos em Termodinâmica Das InterfacesDocumento2 páginasTópicos em Termodinâmica Das InterfacesPauloHenriqueAinda não há avaliações
- Cópia de AcetilenDocumento14 páginasCópia de AcetilenEnfoq TécnicoAinda não há avaliações
- P1 Soldagem 1-2007 RespondidaDocumento2 páginasP1 Soldagem 1-2007 Respondidalmlmla02Ainda não há avaliações
- Combustão - TecnologiaDocumento4 páginasCombustão - TecnologiaEdson José SantosAinda não há avaliações
- Processo de Soldagem AluminotermicoDocumento7 páginasProcesso de Soldagem AluminotermicoRaphael LopesAinda não há avaliações
- Obtenção Do AlumínioDocumento5 páginasObtenção Do AlumínioThiago Souza100% (1)
- Fonte - 6 - Introdução Aos Processos de Soldadura Parte IDocumento60 páginasFonte - 6 - Introdução Aos Processos de Soldadura Parte ImanuelAinda não há avaliações
- Quimica 9 AoDocumento14 páginasQuimica 9 AoClaudio Silva da PazAinda não há avaliações
- ELETROQUÍMICADocumento9 páginasELETROQUÍMICAmreduardo2000Ainda não há avaliações
- Lista+de+exercícios QUÍMICA+GERAL RA1 Estequiometria+Documento3 páginasLista+de+exercícios QUÍMICA+GERAL RA1 Estequiometria+lucasparto1Ainda não há avaliações
- Produção Enxofre ResumoDocumento9 páginasProdução Enxofre ResumoDiogo HarduimAinda não há avaliações
- EstequiometriaDocumento38 páginasEstequiometriaAdalto Jovanira AlbuquerqueAinda não há avaliações
- Croma GemDocumento11 páginasCroma GemGeorge Ciro MarconiAinda não há avaliações
- Aula 2 TecMatDocumento46 páginasAula 2 TecMatSHEILAAinda não há avaliações
- Alumínio e Suas LigasDocumento15 páginasAlumínio e Suas LigasAirton SouzaAinda não há avaliações
- Micro 2Documento5 páginasMicro 2João Pedro AlvesAinda não há avaliações
- Granulação AusteniticaDocumento7 páginasGranulação AusteniticaSandro FerreiraAinda não há avaliações
- Diagrama de SensitizaçãoDocumento7 páginasDiagrama de SensitizaçãoAlmerindo JuniorAinda não há avaliações
- Artigo AmoniaDocumento5 páginasArtigo AmoniaStanischesk0% (1)
- Decomposição TérmicaDocumento2 páginasDecomposição TérmicaNatália XavierAinda não há avaliações
- Materias - Cap. 05Documento16 páginasMaterias - Cap. 05Jean Fermiano Barbosa SilvaAinda não há avaliações
- Alto Forno - Carvao VegetalDocumento16 páginasAlto Forno - Carvao VegetalÍcaro Cazé NunesAinda não há avaliações
- Resumo Materiais Deconstrução MecânicaDocumento5 páginasResumo Materiais Deconstrução MecânicaArtur PinheiroAinda não há avaliações
- Soldagem Na PráticaDocumento47 páginasSoldagem Na PráticaDaniel TrombimAinda não há avaliações
- Dds - Uso de MaçaricoDocumento2 páginasDds - Uso de MaçaricoWilliam FernandesAinda não há avaliações
- Aula 3 - Uff - Metalurgia Do Alumínio - Parte 2Documento29 páginasAula 3 - Uff - Metalurgia Do Alumínio - Parte 2Matheus LopesAinda não há avaliações
- Exercicios Termoq. 2anoDocumento3 páginasExercicios Termoq. 2anoValmir Vinicius de AlmeidaAinda não há avaliações
- Manual Sistema OxiDocumento14 páginasManual Sistema OxiEngenheiroBenevidesAinda não há avaliações
- Dds Perigos Com o MaçaricoDocumento3 páginasDds Perigos Com o MaçaricoRomulo Eduardo Lopes de AraújoAinda não há avaliações
- Grau de PurezaDocumento3 páginasGrau de Purezalaricampos58Ainda não há avaliações
- 1 - Determinação Da Constante de Faraday Por Método EletroquimicoDocumento5 páginas1 - Determinação Da Constante de Faraday Por Método EletroquimicoMariana ReisAinda não há avaliações
- P1 Questionário PMFDocumento6 páginasP1 Questionário PMFKarolina NetoAinda não há avaliações
- Fund Aula 07 - FornosDocumento44 páginasFund Aula 07 - FornosRaphael ConsAinda não há avaliações
- Unicamp2013 2fase 3diaDocumento30 páginasUnicamp2013 2fase 3diaBruna BorgesAinda não há avaliações
- Questionário AlumínioDocumento10 páginasQuestionário AlumínioDiogo Silva100% (1)
- Relatorio Da AmoniaDocumento17 páginasRelatorio Da AmoniaNayara SaldanAinda não há avaliações
- SIDERURGIA Da Mat Prima Ao Lam 102 202Documento101 páginasSIDERURGIA Da Mat Prima Ao Lam 102 202Antonio MarinhoAinda não há avaliações
- Proc Soldagem-OxigasDocumento12 páginasProc Soldagem-OxigasEduardo CavalcanteAinda não há avaliações
- Solubilização e TT Do AlumínioDocumento16 páginasSolubilização e TT Do AlumínioAmanda S. NunesAinda não há avaliações
- Aula 1 Atividades em Estudo Química III Cálculos EstequiométricosDocumento3 páginasAula 1 Atividades em Estudo Química III Cálculos EstequiométricosGabriel RossaAinda não há avaliações
- ÁcidoDocumento10 páginasÁcidoRoberval SilvaAinda não há avaliações
- Beneficiamento Do Ouro01Documento13 páginasBeneficiamento Do Ouro01hebsonbezerraAinda não há avaliações
- Linha Elástica - Aula 1Documento4 páginasLinha Elástica - Aula 1hebsonbezerraAinda não há avaliações
- 16 - Administração Moderna de Manutenção - ReferênciasDocumento6 páginas16 - Administração Moderna de Manutenção - ReferênciashebsonbezerraAinda não há avaliações
- Trocadores de CalorDocumento25 páginasTrocadores de Calorhebsonbezerra100% (1)
- Aula 2 - Projeto de Controle e AutomaçãoDocumento56 páginasAula 2 - Projeto de Controle e AutomaçãohebsonbezerraAinda não há avaliações
- Livro de Acompanhamento - BANANADocumento3 páginasLivro de Acompanhamento - BANANAAntonio Marcos Silva NevesAinda não há avaliações
- DNA 1 - Revisão Ácidos Nucleicos e ReplicaçãoDocumento3 páginasDNA 1 - Revisão Ácidos Nucleicos e ReplicaçãojogoalberAinda não há avaliações
- LAU QA 5672 - 2019.8367.01 - 06 - Depois Dos Ensaios DielétricosDocumento2 páginasLAU QA 5672 - 2019.8367.01 - 06 - Depois Dos Ensaios DielétricosPedro LombardoAinda não há avaliações
- Manual de Sistemas de Secagem Na Indústria de Cerâmica VermelhaDocumento46 páginasManual de Sistemas de Secagem Na Indústria de Cerâmica VermelhaEniclay NunesAinda não há avaliações
- Lista TermodinamicaDocumento5 páginasLista TermodinamicaLuciana MariaAinda não há avaliações
- Alun - ABSORCAO - Banco de Dados de MateriaisDocumento15 páginasAlun - ABSORCAO - Banco de Dados de MateriaisBruno CarvalhoAinda não há avaliações
- BOLETIM TECNICO HARDBOLT SS v.3 18.05.2017Documento3 páginasBOLETIM TECNICO HARDBOLT SS v.3 18.05.2017VitorAinda não há avaliações
- Texto ApoioDocumento2 páginasTexto Apoiotoby heheAinda não há avaliações
- Pós-Graduação em Controle Da Qualidade Na Indústria Química Unyleya - EAD de VerdadeDocumento1 páginaPós-Graduação em Controle Da Qualidade Na Indústria Química Unyleya - EAD de Verdadeyohanna lacerdaAinda não há avaliações
- Análise Caseira de SoloDocumento3 páginasAnálise Caseira de SoloJuarezdaSilva100% (1)
- Aula 3 - CA1 - Deformacoes e Acos para ArmaduraDocumento58 páginasAula 3 - CA1 - Deformacoes e Acos para ArmaduraFabiano PimentelAinda não há avaliações
- TCM2020Documento2 páginasTCM2020Emanuel MeloAinda não há avaliações
- Fenomenos II - Coeficiente ConvectivoDocumento4 páginasFenomenos II - Coeficiente ConvectivoMarcia LaytynherAinda não há avaliações
- Manual Tecnico Diesels-10 Assistencia Tecnica Petrobras PDFDocumento18 páginasManual Tecnico Diesels-10 Assistencia Tecnica Petrobras PDFAdan Farias de PinaAinda não há avaliações
- Relatorio de Volumetria de PrecipitaçãoDocumento2 páginasRelatorio de Volumetria de PrecipitaçãoGerson LimaAinda não há avaliações
- 8800 - Estrutura de AçoDocumento10 páginas8800 - Estrutura de AçoCipriano NetoAinda não há avaliações
- Apostila de Quimica Organica-1Documento56 páginasApostila de Quimica Organica-1rodrigoAinda não há avaliações
- História Da QuímicaDocumento3 páginasHistória Da QuímicaChristiane AlvesAinda não há avaliações
- en 10083 3 Acos para Tempera e Revenido PDFDocumento57 páginasen 10083 3 Acos para Tempera e Revenido PDFTiago CamposAinda não há avaliações
- Ficha de Trabalho - Quantidade Química e Massa MolarDocumento8 páginasFicha de Trabalho - Quantidade Química e Massa Molarrsantos173Ainda não há avaliações
- Caracterização Geometalúrgica Dos Principais Minérios de Ferro Brasileiros Fração Sinter FeedDocumento421 páginasCaracterização Geometalúrgica Dos Principais Minérios de Ferro Brasileiros Fração Sinter FeedArthur LemosAinda não há avaliações
- Cronograma de Onteúdos-KuadroDocumento36 páginasCronograma de Onteúdos-KuadroFelipe FerreiraAinda não há avaliações
- Relatório Diagrama de Fases TernárioDocumento8 páginasRelatório Diagrama de Fases TernárioLucas Francisquini Fernandes SilvaAinda não há avaliações
- 1 Lista de ExercíciosDocumento5 páginas1 Lista de ExercíciosBrunaLuízaAinda não há avaliações
- Petróleo e Gás-10a CalsseDocumento15 páginasPetróleo e Gás-10a CalsseLemos Carlos AiubaAinda não há avaliações
- Fichas Tecnicas HIT HY 200 A HITDocumento20 páginasFichas Tecnicas HIT HY 200 A HITcludioAinda não há avaliações