Escolar Documentos
Profissional Documentos
Cultura Documentos
Teste - Ácido Base
Enviado por
Vicente Batista CorreiaTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Teste - Ácido Base
Enviado por
Vicente Batista CorreiaDireitos autorais:
Formatos disponíveis
Teste 2
Duração: 90 a 100 min
NOME ______________________________________________ Turma_______ Número_______
Consulte a Tabela Periódica, a tabela de constantes e o formulário sempre que necessário.
Nos itens de escolha múltipla escreva a letra da única opção que permite obter uma afirmação correta ou que
responda corretamente à questão.
Nos itens de construção que envolvam cálculos é obrigatório apresentar todas as etapas de resolução.
Junto de cada item, entre parênteses, apresenta-se a respetiva cotação.
GRUPO I
As bases fortes mais conhecidas, como o hidróxido de sódio, NaOH, e o hidróxido de potássio, KOH,
são bases iónicas, que têm na sua estrutura o ião hidróxido, OH − . Quando dissolvidas em água,
libertam o ião hidróxido por dissociação. No caso do hidróxido de sódio isso traduz-se por:
NaOH (s) ⟶ Na+ (aq) + OH − (aq)
Por outro lado, as bases moleculares, de que o melhor exemplo é o amoníaco, NH3 , ionizam-se, ou
seja, reagem com a água quando nela são dissolvidas. No caso do amoníaco, esta ionização é traduzida
por:
NH3 (aq) + H2 O (ℓ) ⇌ NH4+ (aq) + OH − (aq)
A maioria das bases moleculares, isto é, das bases que se ionizam em água, são bases fracas, tal como
o amoníaco.
Um dos raros exemplos de bases moleculares fortes é a guanidina, cuja fórmula molecular é CH5 N3 .
1. (10p) Escreve a equação química que representa a ionização da guadinina em água.
2. (14p) Calcule o pH de uma solução aquosa de guadinina, cuja concentração é 0,265 g dm−3 .
Apresente todas as etapas de resolução.
3. (8p) Podemos afirmar que a guadinina sofre uma
(A) ionização completa.
(B) dissociação completa.
(C) dissociação incompleta.
(D) ionização incompleta.
Editável e fotocopiável © Texto | Novo 11Q 2021/2022 1
GRUPO II
A hidrazina é um composto com fórmula molecular N2 H4 , que apresenta uma constante de basicidade
igual a 1,8 × 10–7 , a 25 ℃. A hidrazina sofre ionização em água de acordo com:
N2 H4 (aq) + H2 O (ℓ) ⇌ N2 H5+ (aq) + OH − (aq)
1. (10p) Escreva a expressão da constante de basicidade da hidrazina.
2. (8p) Selecione a opção que apresenta um par conjugado ácido-base para esta reação.
(A) H2 O/N2 H4
(B) OH − /H2 O
(C) N2 H4 /N2 H5+
(D) N2 H5+ /N2 H4
3. (8p) O ião N2 H5+ , em solução aquosa,
(A) não sofre hidrólise pois é uma base forte.
(B) não sofre hidrólise pois é um ácido forte.
(C) sofre hidrólise pois é um ácido fraco.
(D) sofre hidrólise pois é uma base fraca.
4. (8p) Considerando que a espécie N2 H4 (aq) é uma base mais fraca do que a espécie OH − (aq),
então
(A) a espécie N2 H4 (aq) aceita iões H + com maior facilidade do que a espécie OH − (aq).
(B) a espécie OH − (aq) aceita iões H + com maior facilidade do que a espécie N2 H5+ (aq).
(C) a espécie OH − (aq) doa iões H + com maior facilidade do que a espécie N2 H5+ (aq).
(D) a espécie OH − (aq) cede iões H + com maior facilidade do que a espécie N2 H5+ (aq).
GRUPO III
A tabela seguinte mostra valores de produto iónico da água para diferentes temperaturas.
𝑻 (℃) 𝑲𝐰
25 1,0 × 10−14
50 5,5 × 10−14
100 51,3 × 10−14
Editável e fotocopiável © Texto | Novo 11Q 2021/2022 2
1. (8p) Os dados da tabela permitem concluir que a autoionização da água é uma reação
(A) pouco extensa e endotérmica.
(B) pouco extensa e exotérmica.
(C) muito extensa e endotérmica.
(D) muito extensa e exotérmica.
2. (14p) Uma solução tem pH igual a 6,7 a 50 ℃.
Conclua, justificando, se a referida solução é ácida, básica ou neutra.
3. (8p) Seleccione a opção que completa a frases corretamente.
Quando a temperatura aumenta, o pH da água pura ____ e a seu caráter neutro ____.
(A) aumenta … altera-se
(B) diminui … mantém-se
(C) diminui … altera-se
(D) aumenta … mantém-se
4. (12p) Mostre que a água é uma espécie anfotérica, recorrendo a pares conjugados ácido-base.
GRUPO IV
Os óxidos de nitrogénio, NOx , são gases poluentes emitidos, por exemplo, pelos veículos automóveis.
A dissolução de óxidos de nitrogénio em água origina, entre outros, o ácido nitroso, HNO2 . A ionização
do ácido nitroso em água pode ser traduzida por:
HNO2 (aq) + H2 O (ℓ) ⇌ NO− +
2 (aq) + H3 O (aq)
1. (14p) Calcule a constante de acidez do ácido nitroso, sabendo que uma solução de concentração
0,010 mol dm−3 deste ácido, a 25 ℃, tem pH igual a 2,70.
Apresente todas as etapas de resolução.
2. (8p) O ião NO−
2 (aq) hidroliza-se em água originando
(A) NO− −
2 (aq) + OH (aq)
(B) HNO2 (aq) + H3 O+ (aq)
(C) HNO2 (aq) + OH − (aq)
(D) NO− +
2 (aq) + H3 O (aq)
Editável e fotocopiável © Texto | Novo 11Q 2021/2022 3
3. (8p) A adição de algumas gotas de HCℓ (aq) concentrado a uma solução aquosa de ácido nitroso
em equilíbrio favorece a reação _____ e aumenta a _____ da solução.
(A) direta … acidez
(B) direta … basicidade
(C) inversa … basicidade
(D) inversa … acidez
4. (8p) A dissolução de óxidos de nitrogénio em água é responsável
(A) pela desflorestação.
(B) pelo fenómeno das chuvas ácidas.
(C) pelo aumento do efeito de estufa.
(D) pela destruição da camada de ozono.
5. (8p) Qual o nome do dispositivo que equipa os veículos automóveis com a finalidade de converter
os óxidos de nitrogénio em gases não poluentes?
GRUPO V
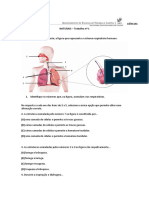
Um grupo de alunos realizou uma titulação potenciométrica de 15,00 mL de uma solução aquosa de
ácido clorídrico, HCℓ (aq), com uma solução-padrão de hidróxido de sódio, NaOH (aq), de
concentração 0,0500 mol dm−3 . Obtiveram a seguinte curva de titulação:
1. (8p) O aparelho de medição em que se encontra a solução titulante chama-se
(A) bureta e contém a solução de NaOH (aq).
(B) bureta e contém a solução de HCℓ (aq).
(C) pipeta e contém a solução de NaOH (aq).
(D) pipeta e contém a solução de HCℓ (aq).
Editável e fotocopiável © Texto | Novo 11Q 2021/2022 4
2. (8p) Selecione a equação química que traduz a reação de neutralização que ocorre.
(A) HCℓ (aq) + H2 O (ℓ) ⟶ HCℓ (aq) + H2 O (ℓ)
(B) NaOH (aq) + HCℓ (aq) ⟶ NaH (aq) + HCℓO (aq)
(C) NaOH (aq) + HCℓ (aq) ⟶ NaCℓ (aq) + H2 O (ℓ)
(D) NaOH (aq) ⟶ Na+ (aq) + OH − (aq)
3. (8p) A solução obtida no ponto de equivalência desta titulação será
(A) ácida.
(B) básica.
(C) alcalina.
(D) neutra.
4. A análise da curva de titulação permite determinar o volume de hidróxido de sódio no ponto de
equivalência e, a partir dele, a concentração do ácido clorídrico.
4.1 (8p) O volume de titulante no ponto de equivalência é
(A) 10,0 cm3 .
(B) 7,0 cm3 .
(C) 12,0 cm3 .
(D) 13,0 cm3 .
4.2 (14p) Calcule a concentração de cloreto de sódio na solução que se obtém no ponto de
equivalência desta titulação.
Comece por calcular a quantidade de matéria de hidróxido de sódio consumido até ao ponto
de equivalência.
Apresente todas as etapas de resolução.
Editável e fotocopiável © Texto | Novo 11Q 2021/2022 5
Critérios específicos de classificação do Teste 2
GRUPO I
1. CH5 N3 (aq) + H2 O (ℓ) ⟶ CH6 N3+ (aq) + OH − (aq) ------------------------------------------ 10 pontos
[em vez de CH6 N3+ também é aceitável HCH5 N3+ ou CH5 N3 H + ]
2. ------------------------------------------------------------------------------------------------------- (8 + 6) 14 pontos
Etapas de resolução:
A) Cálculo da concentração da solução de guadinina:
𝑀(CH5 N3 ) = 59,09 g/mol;
m 0,265
𝑛(CH5 N3 ) = ⇒𝑛= ⇔ 𝑛 = 4,48 × 10−3 mol;
M 59,09
𝑐(CH5 N3 ) = 4,48 × 10−3 mol/dm3
B) Cálculo do pH:
𝑐(OH − ) = 𝑐(CH5 N3 ) = 4,48 × 10−3 mol/dm3 ;
[OH − ] × [H3 O+ ] = 1,00 × 10−14 ⇒ [H3 O+ ] = 2,23 × 10−12 mol/dm3 ;
pH = 11,7
3. (A) ------------------------------------------------------------------------------------------------------------- 8 pontos
GRUPO II
[N2 H+ −
5 ] × [OH ]
1. 𝐾b = -------------------------------------------------------------------------------------- 10 pontos
[N2 H4 ]
2. (D) ------------------------------------------------------------------------------------------------------------- 8 pontos
3. (C) ------------------------------------------------------------------------------------------------------------- 8 pontos
4. (B) ------------------------------------------------------------------------------------------------------------- 8 pontos
GRUPO III
1. (A) ------------------------------------------------------------------------------------------------------------- 8 pontos
2. --------------------------------------------------------------------------------------------------- (4 + 5 + 5) 14 pontos
Tópicos de resposta:
A) A concentração de H3 O+ na referida solução é 2,00 × 10−7 mol dm−3 .
B) A concentração de OH − na mesma solução, a 50 ℃, é 2,75 × 10−7 mol dm−3 .
C) Como a concentração de [OH − ] > [H3 O+ ], conclui-se que a solução é básica.
3. (B) ------------------------------------------------------------------------------------------------------------- 8 pontos
Editável e fotocopiável © Texto | Novo 11Q 2021/2022 1
4. ------------------------------------------------------------------------------------------------------- (6 + 6) 12 pontos
Tópicos de resposta:
A) H3 O+ /H2 O
H2 O/OH −
B) No primeiro caso a água atua como base e no segundo caso atua como ácido.
GRUPO IV
1. -------------------------------------------------------------------------------------------------------- (8 + 6) 14 pontos
Etapas de resolução:
A) Cálculo das concentrações no equilíbrio:
[H3 O+ ] = 10−pH ⇒ [H3 O+ ] = 2,00 × 10−3 mol dm−3 ;
[NO− + −
2 ] = [H3 O ] ⇒ [NO2 ] = 2,00 × 10
−3
mol dm−3 ;
[HNO2 ] = 0,010 − 2,00 × 10−3 ⇔ [HNO2 ] = 8,00 × 10−3 mol dm−3
B) Cálculo da constante de equilíbrio:
[H3 O+ ] × [NO−
2] (2,00 × 10−3 )2
𝐾a = ⇒ 𝐾a = ⇔ 𝐾a = 5,0 × 10−4
[HNO2 ] 8,00 × 10−3
2. (C) ------------------------------------------------------------------------------------------------------------- 8 pontos
3. (D) ------------------------------------------------------------------------------------------------------------- 8 pontos
4. (B) ------------------------------------------------------------------------------------------------------------- 8 pontos
5. Catalisador [ou conversor catalítico]. ----------------------------------------------------------------- 8 pontos
GRUPO V
1. (A) --------------------------------------------------------------------------------------------------------------8 pontos
2. (C) ------------------------------------------------------------------------------------------------------------- 8 pontos
3. (D) ------------------------------------------------------------------------------------------------------------- 8 pontos
4.1 (C) ------------------------------------------------------------------------------------------------------------- 8 pontos
4.2 ------------------------------------------------------------------------------------------------------- (6 + 8) 14 pontos
Etapas de resolução:
A) Cálculo da quantidade de matéria gasta até ao ponto de equivalência:
𝑛(NaOH) = 𝑐 × 𝑉 ⇒ 𝑛(NaOH) = 0,0500 × 12,0 × 10−3 ⇔ 𝑛(NaOH) = 6,00 × 10−4 mol dm−3
B) Cálculo da concentração de cloreto de sódio na solução.
𝑛(NaOH) = 𝑛(NaCℓ) ⇒ 𝑛(NaCℓ) = 6,00 × 10−4 mol dm−3
𝑉final = 12,0 + 15,0 = 27,0 mL ⇒ 𝑉final = 27,0 × 10−3 dm3
𝑛 6,00 × 10−4
𝑐(NaCℓ) = ⇒ 𝑐(NaCℓ) = ⇔ 𝑐(NaCℓ) = 2,22 × 10−2 mol dm−3
𝑉 27,0 × 10−3
2 Editável e fotocopiável © Texto | Novo 11Q 2021/2022
Você também pode gostar
- 11 Ficha de Avaliacao Formativa 1Documento4 páginas11 Ficha de Avaliacao Formativa 1soniadmelo50% (2)
- ASA - Sentidos - Teste11 - Amor PerdiçãoDocumento7 páginasASA - Sentidos - Teste11 - Amor PerdiçãoMARIAJBEZERRA100% (2)
- Gramática 11º Ano Os Maias 2º Período 1Documento12 páginasGramática 11º Ano Os Maias 2º Período 1Mar MendesAinda não há avaliações
- Relatório Da Atividade Laboratorial 1.6 - Funcionamento de Um Sistema TampãoDocumento5 páginasRelatório Da Atividade Laboratorial 1.6 - Funcionamento de Um Sistema TampãoleonorAinda não há avaliações
- Construção de Uma Pilha Com Diferença de Potencial DeterminadaDocumento8 páginasConstrução de Uma Pilha Com Diferença de Potencial DeterminadaCristina MarquesAinda não há avaliações
- 50 Poemas - Tomas TranstromerDocumento12 páginas50 Poemas - Tomas TranstromerAnnaAinda não há avaliações
- Manuscritos da Dança em Santa Maria/RS: História e MemóriaNo EverandManuscritos da Dança em Santa Maria/RS: História e MemóriaAinda não há avaliações
- Amazon DynamoDBDocumento1.020 páginasAmazon DynamoDBAlexandre SayeghAinda não há avaliações
- Banco de DadosDocumento5 páginasBanco de Dadosrfldesa RafaAinda não há avaliações
- Teste 1Documento5 páginasTeste 1Tiago SalgueiroAinda não há avaliações
- Ficha Trabalho N.º 1: V V V VDocumento6 páginasFicha Trabalho N.º 1: V V V VRicardo CostaAinda não há avaliações
- Relatório FQDocumento8 páginasRelatório FQInes FerreiraAinda não há avaliações
- Aspeto VerbalDocumento6 páginasAspeto VerbalEstela Esteves100% (1)
- Edicoes ASA - 11 Ano 2019-20 - 4 Teste PDFDocumento9 páginasEdicoes ASA - 11 Ano 2019-20 - 4 Teste PDFrefúgio do saberAinda não há avaliações
- Resolução Teste Intermédio 11º Ano 2009Documento3 páginasResolução Teste Intermédio 11º Ano 2009AnabelaLeitãoAinda não há avaliações
- Queda PDFDocumento10 páginasQueda PDFMarco AlvesAinda não há avaliações
- Actividade Laboratorial 2.3Documento4 páginasActividade Laboratorial 2.3Jorge Alves CorreiaAinda não há avaliações
- Questão de Aula Comp LeitDocumento2 páginasQuestão de Aula Comp Leitmaria mendes100% (1)
- Ldia11 Ficha Ed Literaria Canticos RealismoDocumento3 páginasLdia11 Ficha Ed Literaria Canticos RealismoIara FernandesAinda não há avaliações
- Aspetos Ambientais Das Reações Ácido-BaseDocumento14 páginasAspetos Ambientais Das Reações Ácido-BaseRachel SousaAinda não há avaliações
- Modelo de Trabalho Poesia - 7 AnoDocumento8 páginasModelo de Trabalho Poesia - 7 AnoAna IldefonsoAinda não há avaliações
- AL 2.3 - Determinação Da Entalpia de Neutralização Da Reação NaOH (Aq) + HCL (Aq) - ContinuaçãoDocumento4 páginasAL 2.3 - Determinação Da Entalpia de Neutralização Da Reação NaOH (Aq) + HCL (Aq) - ContinuaçãoCristina Casquilho M. CastroAinda não há avaliações
- AL - 1.1-Física - 2021 Adriana, André, Inês M. e Inês R.Documento4 páginasAL - 1.1-Física - 2021 Adriana, André, Inês M. e Inês R.Ana Fernandes100% (1)
- Questões de Exame - Sistemática Dos Seres VivosDocumento6 páginasQuestões de Exame - Sistemática Dos Seres Vivossandrasilvestre702522Ainda não há avaliações
- Fichas FISICA 1 - Ficha 6 - Ondas EletromagnéticasDocumento7 páginasFichas FISICA 1 - Ficha 6 - Ondas EletromagnéticasMariliaPacAinda não há avaliações
- Mpag11 Teste Unidade 4Documento5 páginasMpag11 Teste Unidade 4Raúl SilvaAinda não há avaliações
- Alvaro de CamposDocumento2 páginasAlvaro de CamposSónia FariaAinda não há avaliações
- Química 12º Ano Unidade 1 APL 1 - Construção de Uma Pilha Com Diferença de Potencial Determinada (1.1 V)Documento10 páginasQuímica 12º Ano Unidade 1 APL 1 - Construção de Uma Pilha Com Diferença de Potencial Determinada (1.1 V)Magda RafaelAinda não há avaliações
- Apont. Os MaiasDocumento39 páginasApont. Os MaiasJohn CruzAinda não há avaliações
- Novo 11Q NL (Teste2 CC) Abr.2019Documento3 páginasNovo 11Q NL (Teste2 CC) Abr.2019Rui SantosAinda não há avaliações
- Atividade Laboratorial 1.1Documento8 páginasAtividade Laboratorial 1.1José JoséAinda não há avaliações
- Teste Do 10.º CTDocumento5 páginasTeste Do 10.º CTAna QuelhasAinda não há avaliações
- 12º - Preparar o Teste - PDFDocumento3 páginas12º - Preparar o Teste - PDFEuniceAinda não há avaliações
- Almograve-Sines - Ficha Ccvestremoz - SecundarioDocumento3 páginasAlmograve-Sines - Ficha Ccvestremoz - SecundarioVítor M. S. GuerreiroAinda não há avaliações
- AL 3.2 Capacidade Termica Sol Manual 2021Documento3 páginasAL 3.2 Capacidade Termica Sol Manual 2021lara felgueirasAinda não há avaliações
- Teste Modelo 1Documento7 páginasTeste Modelo 1Maria PereiraAinda não há avaliações
- Ldia11 Questao Aula Ed Lit Amor PerdicaoDocumento2 páginasLdia11 Questao Aula Ed Lit Amor PerdicaotesslimaAinda não há avaliações
- David Hume - A Resposta Empirista - Resumo de Filosofia 11ºanoDocumento12 páginasDavid Hume - A Resposta Empirista - Resumo de Filosofia 11ºanoJessica Lacerda Marques100% (1)
- Os MaiasDocumento8 páginasOs MaiasJoão PereiraAinda não há avaliações
- Resumo de Português - Amor de Perdição, de Camilo Castelo BrancoDocumento6 páginasResumo de Português - Amor de Perdição, de Camilo Castelo BrancoCarolina RochaAinda não há avaliações
- FichaDocumento9 páginasFichaMargarida AmorimAinda não há avaliações
- Resolução Dos Testes Sobre As ALDocumento3 páginasResolução Dos Testes Sobre As ALEdite BrandãoAinda não há avaliações
- Relatorio 2.2 Velocidade Do Som e Da LuzDocumento3 páginasRelatorio 2.2 Velocidade Do Som e Da LuzSofia FigueirasAinda não há avaliações
- Exercicios de BiologiaDocumento9 páginasExercicios de BiologiacarolAinda não há avaliações
- Banco de Questões - 11Documento18 páginasBanco de Questões - 11beatriz maria delgadoAinda não há avaliações
- Enunciado Provamodelo Mai2020Documento5 páginasEnunciado Provamodelo Mai2020capuchinhoguardenseAinda não há avaliações
- Ficha Amor de PerdiçãoDocumento3 páginasFicha Amor de PerdiçãoPedro CarvalhoAinda não há avaliações
- Combinatória ExercíciosDocumento6 páginasCombinatória ExercíciosAntonioAinda não há avaliações
- O Tempo em Os MaiasDocumento4 páginasO Tempo em Os MaiasOfélia Franco0% (1)
- No Tempo em Que Festejavam o Dia Dos Meus AnosDocumento4 páginasNo Tempo em Que Festejavam o Dia Dos Meus AnosAdelaide Eleuterio0% (1)
- Mil Vezes AdeusDocumento4 páginasMil Vezes Adeusjoana teixeiraAinda não há avaliações
- Resumo Global Da Materia de Biologia e Geologia 10o e 11o Anos Páginas 87 105Documento19 páginasResumo Global Da Materia de Biologia e Geologia 10o e 11o Anos Páginas 87 105rodrigo santosAinda não há avaliações
- Al2 2Documento4 páginasAl2 2Lourenço MarquesAinda não há avaliações
- Porto Editora - Maximo - 11 Ano 2020-21 - 2 TesteDocumento9 páginasPorto Editora - Maximo - 11 Ano 2020-21 - 2 TesteInês SaraivaAinda não há avaliações
- Respostas Manual - Sermão de Santo António Aos Peixes, Do Padre António VieiraDocumento9 páginasRespostas Manual - Sermão de Santo António Aos Peixes, Do Padre António VieiraLourenco Maurício100% (1)
- Teste 12º Unidade 0Documento7 páginasTeste 12º Unidade 0Rosa FernandesAinda não há avaliações
- Teste FQ 10anoDocumento4 páginasTeste FQ 10anoRita DimasAinda não há avaliações
- Os Maias, Crítica Social e AdultérioDocumento3 páginasOs Maias, Crítica Social e AdultérioJoão Soares0% (1)
- AL 10 ANO F 1.3 Capacidade Termica Massica PDFDocumento4 páginasAL 10 ANO F 1.3 Capacidade Termica Massica PDFOlá AdeusAinda não há avaliações
- Oexp12 Teste Diagnostico CorrecaoDocumento3 páginasOexp12 Teste Diagnostico CorrecaoAnonymous y7GA7Jza1Ainda não há avaliações
- 11q NL Teste 2-04-2022 Dominio Reacoes Acido Base Teste Texto Editores Disponibilizado Aos ProfessoresDocumento6 páginas11q NL Teste 2-04-2022 Dominio Reacoes Acido Base Teste Texto Editores Disponibilizado Aos ProfessoresMauro SantosAinda não há avaliações
- Novo 11Q NL (Teste2) Maio2021Documento6 páginasNovo 11Q NL (Teste2) Maio2021teresaAinda não há avaliações
- Teste 2 (2017-2018)Documento4 páginasTeste 2 (2017-2018)Rúben Cristiano Teixeira da Silva (a3412)Ainda não há avaliações
- FT Soluções Composição Quantitativa SoluçõesDocumento3 páginasFT Soluções Composição Quantitativa SoluçõesVicente Batista CorreiaAinda não há avaliações
- Ficha-Composição Quantitativa de Soluções - ResoluçãoDocumento4 páginasFicha-Composição Quantitativa de Soluções - ResoluçãoVicente Batista CorreiaAinda não há avaliações
- FT SoluçõesDocumento8 páginasFT SoluçõesVicente Batista CorreiaAinda não há avaliações
- FT Volume Molar Composição Quantitativa 2017Documento3 páginasFT Volume Molar Composição Quantitativa 2017Vicente Batista CorreiaAinda não há avaliações
- Teste Le ChatelierDocumento3 páginasTeste Le ChatelierVicente Batista CorreiaAinda não há avaliações
- Quadro Comparativo - REG - DitatoriaisDocumento2 páginasQuadro Comparativo - REG - DitatoriaisVicente Batista Correia0% (1)
- Questão de Aula 2 - Oxidação-ReduçãoDocumento2 páginasQuestão de Aula 2 - Oxidação-ReduçãoVicente Batista CorreiaAinda não há avaliações
- XXXXXXXXDocumento3 páginasXXXXXXXXVicente Batista CorreiaAinda não há avaliações
- Sistema Respiraçao PDFDocumento14 páginasSistema Respiraçao PDFSandra Cunha100% (1)
- Ficha de Revisões 1Documento7 páginasFicha de Revisões 1Vicente Batista CorreiaAinda não há avaliações
- Vida e Obra de Fernão LopesDocumento8 páginasVida e Obra de Fernão LopesVicente Batista CorreiaAinda não há avaliações
- Síntese Da Sequência 3Documento12 páginasSíntese Da Sequência 3Vicente Batista CorreiaAinda não há avaliações
- Plano Semanal - Tarefa 2Documento3 páginasPlano Semanal - Tarefa 2Vicente Batista CorreiaAinda não há avaliações
- MUSEU 9ºanoDocumento3 páginasMUSEU 9ºanoVicente Batista CorreiaAinda não há avaliações
- FichaccxxxxxDocumento2 páginasFichaccxxxxxVicente Batista CorreiaAinda não há avaliações
- ARTESANATO 9ºanoDocumento9 páginasARTESANATO 9ºanoVicente Batista CorreiaAinda não há avaliações
- Ficha de Trabalho ETDocumento2 páginasFicha de Trabalho ETVicente Batista CorreiaAinda não há avaliações
- Ficha de Trabalho 1Documento2 páginasFicha de Trabalho 1Vicente Batista CorreiaAinda não há avaliações
- Ficha de EVDocumento7 páginasFicha de EVVicente Batista CorreiaAinda não há avaliações
- 11F NL (Teste3)Documento6 páginas11F NL (Teste3)Vicente Batista CorreiaAinda não há avaliações
- Questões EvoluçãoDocumento1 páginaQuestões EvoluçãoVicente Batista CorreiaAinda não há avaliações
- Teste de Avaliação de Conhecimentos 5Documento6 páginasTeste de Avaliação de Conhecimentos 5Vicente Batista Correia0% (1)
- Ae p11 Teste Fev2017Documento6 páginasAe p11 Teste Fev2017Elisabete NunesAinda não há avaliações
- Catalogo Motoniveladora GR215Documento64 páginasCatalogo Motoniveladora GR215Julio Mees100% (1)
- NR 12 Bloqueio de Mquinas e EquipamentosDocumento23 páginasNR 12 Bloqueio de Mquinas e EquipamentosCPSSTAinda não há avaliações
- TAL439 Aula 6Documento29 páginasTAL439 Aula 6Ana Alice Z VenturinAinda não há avaliações
- AircraftDesign 9 EmpennageGeneralDesign - En.ptDocumento16 páginasAircraftDesign 9 EmpennageGeneralDesign - En.ptJucélia NascimentoAinda não há avaliações
- Transformação e Armazenamento de EnergiaDocumento40 páginasTransformação e Armazenamento de EnergiaFerdinando CajazeirasAinda não há avaliações
- Astra Especificacoes Tecnicas Manual Reparacao PDFDocumento72 páginasAstra Especificacoes Tecnicas Manual Reparacao PDFacs_spAinda não há avaliações
- Trabalho BioestatísticaDocumento24 páginasTrabalho BioestatísticaJoao Paulo SilvaAinda não há avaliações
- Máquina para Solda MIG/MAG Voonder MM 251Documento36 páginasMáquina para Solda MIG/MAG Voonder MM 251Alexandre S. CorrêaAinda não há avaliações
- Modelo Etiqueta Diamante HommelDocumento2 páginasModelo Etiqueta Diamante Hommel16504950% (2)
- GLT 21Documento9 páginasGLT 21Marcelo ProtzAinda não há avaliações
- MERCÚRIODocumento2 páginasMERCÚRIOCamila OliveiraAinda não há avaliações
- Apostila - 3 FaseDocumento75 páginasApostila - 3 FaseSilvane Waldow MedeirosAinda não há avaliações
- Guia para Iluminação Pública Vol. 1 - PUCRSDocumento46 páginasGuia para Iluminação Pública Vol. 1 - PUCRSWalber MoraisAinda não há avaliações
- Atv Avaliativa (Termodinâmica) - DefesaDocumento10 páginasAtv Avaliativa (Termodinâmica) - Defesavictor hugoAinda não há avaliações
- Avaliação Pesquisa - Autocad - 2D - Wellington - Anapolis - RosaDocumento3 páginasAvaliação Pesquisa - Autocad - 2D - Wellington - Anapolis - Rosawellingtonanapolis100% (1)
- BG10 VulcanismoDocumento52 páginasBG10 VulcanismomatldeAinda não há avaliações
- Aula 10 - Introdução À EletropneumáticaDocumento16 páginasAula 10 - Introdução À EletropneumáticaBruno FonsecaAinda não há avaliações
- 01 - RelatoriosDocumento72 páginas01 - RelatoriosDiego CarvalhoAinda não há avaliações
- Resumo Manual Jeep RenegadeDocumento6 páginasResumo Manual Jeep RenegadeJRicardoAinda não há avaliações
- Propriedades Periódicas e AperiódicasDocumento10 páginasPropriedades Periódicas e AperiódicasThalles RanniereAinda não há avaliações
- Atoi 9 Testes A BDocumento18 páginasAtoi 9 Testes A BSandra PereiraAinda não há avaliações
- Teste 6 Q 10 2016Documento5 páginasTeste 6 Q 10 2016Sérgio MarquesAinda não há avaliações
- Apostila Especialista VibracionalDocumento74 páginasApostila Especialista VibracionalMariluceGomesAinda não há avaliações
- Projeto 2 - ElétricoDocumento1 páginaProjeto 2 - ElétricoAlexandre Thomaz SedlacekAinda não há avaliações
- Calibração Pesos Padrão 1Documento4 páginasCalibração Pesos Padrão 1João Carlos Protz ProtzAinda não há avaliações
- Arte Depois Da FilosofiaDocumento17 páginasArte Depois Da FilosofiaRadael JuniorAinda não há avaliações
- Matemática Financeira Teoria PDFDocumento36 páginasMatemática Financeira Teoria PDFANDERJORAinda não há avaliações
- Equipamentos Visão Geral 2023Documento20 páginasEquipamentos Visão Geral 2023Carlosjr83Ainda não há avaliações