Escolar Documentos
Profissional Documentos
Cultura Documentos
Lista 03 - Princípio de Clausius
Enviado por
Arthur Ribeiro0 notas0% acharam este documento útil (0 voto)
10 visualizações1 páginaTítulo original
Lista 03 – Princípio de Clausius
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
10 visualizações1 páginaLista 03 - Princípio de Clausius
Enviado por
Arthur RibeiroDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
Você está na página 1de 1
Lista
de exercícios 03 – Princípio de Clausius-Gibbs
1. Determine CV ,C P ,κ T ,κ S e α de um gás ideal.
2. Determine a variação da entropia de um gás ideal ao longo de uma isocórica e de uma
isobárica a partir das capacidades térmicas isocórica e isobárica, respectivamente.
3. Determine a variação de entropia de um sistema quando um corpo quando é colocado
em contato térmico com um reservatório à temperatura T0. Suponha que inicialmente
o corpo esteja à temperatura T1 e que a capacidade térmica isocórica Cv do corpo seja
constante. Determine também, o máximo trabalho que se pode obter quando o corpo
passa do estado inicial ao estado de equilíbrio com o reservatório.
4. Dois corpos idênticos possuem temperaturas T1 e T2. Eles são colocados em contato
térmico e atingem o estado de equilíbrio. Determine a temperatura de equilíbrio e a
variação total da entropia ΔStotal . Mostre explicitamente que ΔStotal > 0. Ache em
seguida o máximo trabalho que se pode extrair desses corpos e determine, nesse caso
qual a temperatura final de equilíbrio. Qual das duas temperaturas de equilíbrio é
maior? Suponha que as capacidades térmicas isocóricas dos corpos sejam constantes.
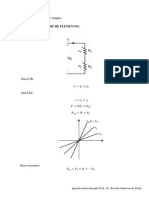
5. Use o princípio de mínima energia para mostrar que
1 𝜕!𝑈 ! 𝜕!𝑈 1 𝜕!𝑈 !
∆𝑆 + 2 ∆𝑆∆𝑉 + ∆𝑉 ≥ 0
2 𝜕𝑆 ! 𝜕𝑆𝜕𝑉 2 𝜕𝑉 !
"! # "! # "! # "! # "! #
A partir dessa desigualdade, demonstrar que "$ ! ≥ 0, "% ! ≥ 0 e "$ ! ∙ "% ! − 2 "$"% ≥ 0.
6. Use o princípio de máxima entropia para mostrar que
1 𝜕!𝑆 !
𝜕!𝑆 1 𝜕!𝑆
∆𝑈 + 2 ∆𝑈∆𝑉 + ∆𝑉 ! ≤ 0
2 𝜕𝑈 ! 𝜕𝑈𝜕𝑉 2 𝜕𝑉 !
"! $ "! $ "! $ "! $ "! $
A partir dessa desigualdade, demonstrar que "# ! ≤ 0, "% ! ≤ 0 e "# ! ∙ "% ! − 2 "$"% ≥ 0
GABARITO
1. Demonstrações feitas em sala.
⎛T ⎞ ⎛T ⎞
2. Isocórica: ΔS = Ncln ⎜ 2 ⎟ . Isobárica: ΔS = N(c + R)ln ⎜ 2 ⎟ .
⎝ T1 ⎠ ⎝ T1 ⎠
c(T1 −T0 ) T ⎛T ⎞
3. ΔST = + cln 0 > 0 Wmáx = cT0 ln ⎜ 0 ⎟ − c(T0 −T1 )
T0 T1 ⎝ T1 ⎠
T +T
2
(
2
) (
4. T0 = 1 2 e T1 −T2 > 0. Wmáx = c T1 +T2 − 2 T1T2
)
5. Fazer a expansão em 1ª e 2ª ordem.
6. Fazer a expansão em 1ª e 2ª ordem. J
Você também pode gostar
- Lista 1 EDODocumento5 páginasLista 1 EDOmillasiquAinda não há avaliações
- FÍSICADocumento4 páginasFÍSICABetão Petrucio Pethrus67% (3)
- Resolution Chapter2 Heat TransferDocumento40 páginasResolution Chapter2 Heat TransferMadalena LeandroAinda não há avaliações
- Lista 02 - Princípio de CarnotDocumento4 páginasLista 02 - Princípio de CarnotArthur RibeiroAinda não há avaliações
- Termodinâmica I - Exercícios de Propriedades de Substâncias PurasDocumento15 páginasTermodinâmica I - Exercícios de Propriedades de Substâncias PurasGabrielAinda não há avaliações
- Lista EDODocumento4 páginasLista EDOMagnaAinda não há avaliações
- 2o Teste 11 - ResolucaoDocumento6 páginas2o Teste 11 - ResolucaoBeatriz SantosAinda não há avaliações
- Lab 4 - Transiente 2-22Documento30 páginasLab 4 - Transiente 2-22Lucas FAinda não há avaliações
- Avaliao 3 2023.2Documento7 páginasAvaliao 3 2023.2João Vitor PivaAinda não há avaliações
- Aula Prob2 ImprimirDocumento10 páginasAula Prob2 ImprimirJohn OakAinda não há avaliações
- Fonons - 01Documento15 páginasFonons - 01Adilson Jesus de OliveiraAinda não há avaliações
- Lista-Extra 1Documento3 páginasLista-Extra 1Leticia Oliveira NascimentoAinda não há avaliações
- Ndw32cd3vfqe38d6u478fead93mjc4pdf 230502 143404Documento2 páginasNdw32cd3vfqe38d6u478fead93mjc4pdf 230502 143404William GusmãoAinda não há avaliações
- Soluções Lista 1Documento7 páginasSoluções Lista 1João Victor Paschoal PoletiAinda não há avaliações
- Lista EDODocumento5 páginasLista EDOthiagoogaihtAinda não há avaliações
- Lista 1 EDODocumento5 páginasLista 1 EDOBruna HaraAinda não há avaliações
- Aula 19Documento12 páginasAula 19Gabriel SilvaAinda não há avaliações
- L1 Cal2Documento4 páginasL1 Cal2José Henrique de Mattos DraegerAinda não há avaliações
- Lista Regra Da CadeiaDocumento2 páginasLista Regra Da CadeiaJonatan NeniAinda não há avaliações
- Exames de Mecânica UA + ResoluçãoDocumento103 páginasExames de Mecânica UA + ResoluçãoFilipa MotaAinda não há avaliações
- Tensões PrincipaisDocumento17 páginasTensões PrincipaisMRLeaoAinda não há avaliações
- Vibrações 22.02.21Documento5 páginasVibrações 22.02.21Farmando SatoshiAinda não há avaliações
- 0 - FicharevisoesiniciarDocumento2 páginas0 - FicharevisoesiniciarLuana AraújoAinda não há avaliações
- Potência em Regime Senoidal PermanenteDocumento39 páginasPotência em Regime Senoidal PermanentePedro HenriqueAinda não há avaliações
- Aula 3 - Transferência de CalorDocumento17 páginasAula 3 - Transferência de CalorleonardoAinda não há avaliações
- Equacoes SeparaveisDocumento10 páginasEquacoes Separaveishighmax_Ainda não há avaliações
- Conservação Da MassaDocumento8 páginasConservação Da MassaLucas Borba de MeloAinda não há avaliações
- 1 Teste 30nov2022Documento4 páginas1 Teste 30nov2022Guilherme PedrosaAinda não há avaliações
- 015-Matemática-1-EQUAÇÕES EXPONENCIAIS E 15 FUNÇÕES EXPONENCIAIS PDFDocumento6 páginas015-Matemática-1-EQUAÇÕES EXPONENCIAIS E 15 FUNÇÕES EXPONENCIAIS PDFDavid J.CAinda não há avaliações
- 1 C2 2 Circuitos CC 2Documento4 páginas1 C2 2 Circuitos CC 2Yadira Callisaya QuispeAinda não há avaliações
- Cálculo C - Lista 1Documento7 páginasCálculo C - Lista 1mailsonmoreiraAinda não há avaliações
- Exercício 1 - Flash-Operacoes-UnitariasDocumento2 páginasExercício 1 - Flash-Operacoes-UnitariasGuilherme FernandoAinda não há avaliações
- Questões - Comentadas - Engenharia CivilDocumento50 páginasQuestões - Comentadas - Engenharia CivilGaby Lorrany83% (6)
- Aula 04 - Permutações CaóticasDocumento5 páginasAula 04 - Permutações CaóticasRonniely CaldasAinda não há avaliações
- Trigonometria 64Documento7 páginasTrigonometria 64Wylson AlmeidaAinda não há avaliações
- Semana 06ap GabDocumento5 páginasSemana 06ap GabVitoria MirandaAinda não há avaliações
- Semana 07ap GabDocumento5 páginasSemana 07ap GabMateus S Y KikumoriAinda não há avaliações
- Formula RioDocumento5 páginasFormula RioAdr AdrianoAinda não há avaliações
- Lista 1 - Calc2 Eng - 2020-01Documento4 páginasLista 1 - Calc2 Eng - 2020-01fel198337Ainda não há avaliações
- Apresentação05 07 CapaDocumento29 páginasApresentação05 07 CapaGabriel FialhoAinda não há avaliações
- Lista Edo Ordem1 NaolinDocumento2 páginasLista Edo Ordem1 NaolinÍcaro AndréAinda não há avaliações
- LIsta de ExerciciosDocumento4 páginasLIsta de ExerciciosedwardsilvaAinda não há avaliações
- FísicaDocumento5 páginasFísicaMaria Fernanda YaminAinda não há avaliações
- Atividade Avaliativa 4Documento4 páginasAtividade Avaliativa 4Eduardo Teixeira de OliveiraAinda não há avaliações
- Lista 7Documento3 páginasLista 7Paulo SouzaAinda não há avaliações
- Lista 1 - Calc2 - 2020 - 1Documento4 páginasLista 1 - Calc2 - 2020 - 1Higor JhonsonAinda não há avaliações
- Vibrações Caixa D'águaDocumento3 páginasVibrações Caixa D'águaBruno NevesAinda não há avaliações
- CuviculacaoDocumento5 páginasCuviculacaoRenato Rj limaAinda não há avaliações
- Notas de Aula Osciladores Harmônicos QuânticosDocumento12 páginasNotas de Aula Osciladores Harmônicos QuânticosMarcel De Britto GonçalvesAinda não há avaliações
- 1 Avaliação - 2021.2Documento3 páginas1 Avaliação - 2021.2henriqueAinda não há avaliações
- 2 - Normas, Produtos Internos e MétricasDocumento5 páginas2 - Normas, Produtos Internos e MétricasMitchocenceAinda não há avaliações
- Lista 1 - EDODocumento4 páginasLista 1 - EDOTheMaxt74Ainda não há avaliações
- Tema 3 ME098 - Transformação Da Tensão IIDocumento14 páginasTema 3 ME098 - Transformação Da Tensão IIANTONIO RICARDO LIMA DE OLIVEIRA SOBRINHOAinda não há avaliações
- RadBiom20 21 Freq1-V1Documento2 páginasRadBiom20 21 Freq1-V1brunonaruto03Ainda não há avaliações
- 2024 Unidade 03Documento9 páginas2024 Unidade 03amandaAinda não há avaliações
- Lista 1Documento4 páginasLista 1糞 Viny FerrazAinda não há avaliações
- Aula 13 - 13-08 - TrigonometriaDocumento4 páginasAula 13 - 13-08 - TrigonometriaLucas MeirelesAinda não há avaliações
- AlgebraDocumento3 páginasAlgebraDiego SilvaAinda não há avaliações
- ListaBio6 CalorDocumento1 páginaListaBio6 CalorAlexandre Adriano ArroteiaAinda não há avaliações
- Detalhamento Do Processo TérmicoDocumento23 páginasDetalhamento Do Processo TérmicoAna Clara Miranda BatistaAinda não há avaliações
- 7 Encurvadura de BarrasDocumento20 páginas7 Encurvadura de BarrasTelma Nsai Messias Gomes DiasAinda não há avaliações
- Relatorio Bombas em ParaleloDocumento11 páginasRelatorio Bombas em ParaleloChrystian WallanceAinda não há avaliações
- Monopol I 10031266Documento132 páginasMonopol I 10031266Ramon da Silva GonçalvesAinda não há avaliações
- Stoecker and Jones - Refrigeração e Ar Condicionado PDFDocumento252 páginasStoecker and Jones - Refrigeração e Ar Condicionado PDFLamon Alves100% (3)
- Dimensionamento Laje NervuradaDocumento5 páginasDimensionamento Laje NervuradaGuilherme LangAinda não há avaliações
- 6 Projeto Reatores Nao IsotermicosDocumento27 páginas6 Projeto Reatores Nao IsotermicosDionéia BertolettiAinda não há avaliações
- Descrição Macroscópica de Um Gás IdealDocumento28 páginasDescrição Macroscópica de Um Gás IdealRair SantosAinda não há avaliações
- Formulario 2022Documento2 páginasFormulario 2022Rodrigo TadeuAinda não há avaliações
- CavitaçãoDocumento9 páginasCavitaçãoWilliamAinda não há avaliações
- Montagem-Análise Estática 1-16Documento3 páginasMontagem-Análise Estática 1-16clashAinda não há avaliações
- Catalogo FCTP Fan Coil Tosi Precisao1Documento207 páginasCatalogo FCTP Fan Coil Tosi Precisao1isaquesantos100% (1)
- Termodinâmica Prova 1 2011 02 C G Parcial 2013 02 Q1 Q3Documento4 páginasTermodinâmica Prova 1 2011 02 C G Parcial 2013 02 Q1 Q3gabriel0% (1)
- Projeto de HidráulicaDocumento15 páginasProjeto de HidráulicaEric Mansur0% (1)
- 12 - Altura Manométrica e Cálculo de NPSH - Parte IVDocumento26 páginas12 - Altura Manométrica e Cálculo de NPSH - Parte IVAlisson BeckerAinda não há avaliações
- Resumo Materiais DentáriosDocumento6 páginasResumo Materiais DentáriosFábio Vinícius100% (1)
- Projeto Final - Câmara FriaDocumento28 páginasProjeto Final - Câmara FriaAna Luiza Almeida100% (3)
- 24 GasesDocumento5 páginas24 GasesPaulo Rogério MancinoAinda não há avaliações
- Ees145 - Resistencia Dos Materiais IDocumento2 páginasEes145 - Resistencia Dos Materiais IMCapitolinaAinda não há avaliações
- PTV AnaliseEstruturas V1Documento233 páginasPTV AnaliseEstruturas V1ISADORA CARINE DA SILVA DUARTEAinda não há avaliações
- Relatório Prática 07Documento7 páginasRelatório Prática 07Mayke Cezar WippelAinda não há avaliações
- BIOF - 04 - Ondas, Som e BioacusticaDocumento23 páginasBIOF - 04 - Ondas, Som e BioacusticaHenrique BarrosAinda não há avaliações
- 01 - Cálculos GeraisDocumento6 páginas01 - Cálculos GeraisLucas GasperinAinda não há avaliações
- EsclerometroDocumento19 páginasEsclerometrosaurimoAinda não há avaliações
- Capitulo 3Documento12 páginasCapitulo 3tempblue88Ainda não há avaliações
- Física - Termofisica Questões de Vestibuar 2012Documento39 páginasFísica - Termofisica Questões de Vestibuar 2012japizzirani4064100% (1)
- Lista 3 Transmissão de CalorDocumento3 páginasLista 3 Transmissão de CalorVictor FariasAinda não há avaliações
- Acetatos 1Documento49 páginasAcetatos 1José GomesAinda não há avaliações