Escolar Documentos
Profissional Documentos
Cultura Documentos
Resumo Do Livro de Processos Industriais Inorgânicos
Enviado por
Pedro Navarro0 notas0% acharam este documento útil (0 voto)
8 visualizações3 páginasTítulo original
Resumo do Livro de Processos Industriais Inorgânicos
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
DOCX, PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato DOCX, PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
8 visualizações3 páginasResumo Do Livro de Processos Industriais Inorgânicos
Enviado por
Pedro NavarroDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato DOCX, PDF, TXT ou leia online no Scribd
Você está na página 1de 3
Resumo do Livro de Processos Industriais Inorgânicos
Unidade 1
Seção 1.1 – Ácido Sulfúrico
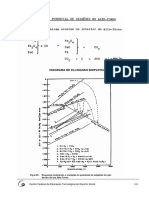
A primeira etapa na obtenção da matéria-prima para a fabricação do ácido
sulfúrico é a mineração do enxofre a partir de rochas localizadas no subsolo, a
uma profundidade de até 760 m. O método de exploração denomina-se Processo
Frasch.
O enxofre, por ser um elemento de baixo ponto de fusão, liquefaz-se em
contato com água quente. Por isso, água superaquecida é bombeada para o
subsolo por meio de um sistema de tubulações coaxiais (um tubo central com
outra tubulação ao seu redor, formando uma região anular e um terceiro tubo
exterior a ambos).
Uma vez que o enxofre é liquefeito, injeta-se ar comprimido no poço de
mineração. O ar comprimido cria um gradiente de pressão entre o fundo do poço
e a superfície, causando, dessa forma, a expulsão do enxofre líquido para o topo
do poço, onde se solidifica e é separado do ar e da água.
A mineração de rochas não é o único meio pelo qual as indústrias obtêm o
enxofre e compostos sulfurosos. O enxofre também se faz presente (na forma de
gás sulfídrico – H2S ) no gás natural, biogás, petróleo cru e no carvão, podendo
ser separado desses gases por processos adequados.
Por meio da combustão de tais materiais, óxidos tóxicos e poluentes são
liberados para o ambiente e podem causar severo desequilíbrio ambiental.
Atualmente, orientadas por interesses econômicos e ambientais, as indústrias
realizam a remoção do gás sulfídrico desses materiais e, com isso, obtêm o
enxofre elementar em detrimento da mineração de rochas.
Esse poder ácido e corrosivo tem origem na dissociação dos íons H+ presentes
no ácido quando em solução. Por isso, antes que os gases combustíveis (gás
natural, gás de síntese e biogás) sejam utilizados industrialmente, é necessário
remover o H2S de sua composição, pois, caso contrário, haveria danos severos
às linhas de processo e equipamentos, além dos problemas ambientais, riscos
aos trabalhadores e diversos outros.
As empresas obtêm o enxofre a partir da mineração de rochas subterrâneas ou
obtêm esse elemento unido ao hidrogênio pelo processo de dessulfurização. Além
desses dois métodos, o enxofre também pode ser recuperado dentro de um
mesmo processo industrial, na forma de sulfeto pelo processo denominado de
recuperação Claus.
De acordo com Shreve e Brink Jr. (1997), o processo Claus remove o sulfeto
de hidrogênio dos gases combustíveis, transformando-o em SO2, usado na
produção do ácido sulfúrico. Esse processo é uma reação exotérmica de oxidação
do sulfeto com o oxigênio. No entanto, pode-se modificar o processo industrial e
transformar o dióxido de enxofre em enxofre elementar por meio de uma segunda
etapa reacional catalisada pelo óxido de ferro III.
A primeira reação é exotérmica e produz vapor. É realizada em uma caldeira
alimentada com uma corrente de ar e outra de H2S. O produto da primeira reação
(corrente que sai pelo topo da caldeira) é misturado com a mesma alimentação de
sulfeto de hidrogênio que alimentou a caldeira, seguindo para um conversor onde
ocorrerá a segunda reação, que também é exotérmica.
Infelizmente, o processo Claus não é capaz de recuperar integralmente todo o
enxofre presente nos processos industriais. Por isso, uma pequena porcentagem
de enxofre e de seus compostos atingem, mais cedo ou mais tarde, os corpos
hídricos e a atmosfera. A fim de evitar uma grave contaminação ambiental, cada
país desenvolveu leis apropriadas com a finalidade de regulamentar as emissões
de enxofre e seus compostos no ambiente.
Uma vez que o ácido sulfúrico tenha sido comercializado e utilizado, ele não
pode ser descartado no ambiente devido à sua carga poluidora e toxicidade. É
comum reutilizar o ácido sulfúrico usado quando a contaminação do ácido usado
não é elevada e, para isso, ele pode ser novamente encaminhado para uma usina
de contato e reconcentrado em um concentrador a ar.
O ácido sulfúrico é utilizado em vários processos industriais e, devido à sua
ampla aplicabilidade, tornou-se uma substância inorgânica de significativa
importância na indústria e na economia. No passado, sua importância havia
crescido a tal ponto que seu consumo foi utilizado como parâmetro do
desenvolvimento industrial de um país. Porém, os processos industriais foram
sofrendo modificações a fim de, cada vez mais, recuperar maiores quantidades do
ácido e, também, alterações que substituíssem o seu emprego, como foi o caso,
por exemplo, do ácido clorídrico na decapagem do aço.
Industrialmente, o processo de síntese do ácido sulfúrico é denominado de
processo de contato. O ponto de partida para a produção desse ácido é o dióxido
de enxofre. Porém, ao invés de utilizar o dióxido de enxofre diretamente, algumas
usinas podem realizar a combustão do enxofre elementar e, desse modo, obter o
SO2.
Uma vez que o enxofre elementar é descarregado nas usinas de contato, faz-
se a fundição do mesmo para o estado líquido, visto que isso facilita
sobremaneira o transporte (escoamento) do material ao longo do processo de
contato. A prática mais comum, no entanto, é que o enxofre elementar seja
fornecido para a empresa já no seu estado fluido, seguindo, então, diretamente
para uma etapa de remoção de cinzas por meio da filtração. Para a etapa de
queima do enxofre, deve-se empregar ar de combustão desidratado, pois ele não
pode conter umidade, a fim de evitar-se a corrosão dos equipamentos e das
tubulações do processo. Somente então, o enxofre fluido é alimentado ao
queimador da caldeira com ar desidratado por um bocal atomizador.
Desde o fornecimento de enxofre para a usina até a caldeira a calor perdido,
passando pela torre de secagem e o queimador de enxofre. A partir do momento
em que o enxofre elementar foi oxidado e transformado em dióxido de enxofre,
todo o processo de contato restante baseia-se em duas reações químicas, a
saber: a oxidação do dióxido de enxofre em trióxido de enxofre com posterior
conversão em ácido sulfúrico.
A oxidação do SO2, assim como todas as outras reações do processo de
síntese do ácido sulfúrico, é exotérmica, e o calor liberado é empregado na a
produção de vapor superaquecido. Por isso, os produtos das reações de síntese
do ácido sulfúrico são encaminhados a trocadores de calor, superaquecedores de
vapor ou caldeiras, aumentando a eficiência energética da produção. Além disso,
as temperaturas das correntes reacionais são ajustadas de acordo com o
necessário para a etapa de conversão catalítica.
A última etapa do processo de contato é a concentração do trióxido de enxofre
produzido em coluna absorvedora contendo o ácido sulfúrico concentrado, visto
que este é o melhor agente absorvedor do SO3. Dessa forma, são formadas as
soluções de ácido sulfúrico com SO3 suficiente para formar a concentração do
ácido, digamos 98%, chamado de óleum. Portanto, o ácido sulfúrico é vendido na
forma de solução concentrada denominada óleum.
Obs: Um óleum com X% é uma solução de ácido sulfúrico e trióxido de enxofre
de tal forma que em 100 kg de solução estão contidos X kg de SO3 e (100 - X) kg
de HSO24. Portanto, a diluição desse óleum em água forneceria mais de 100 kg
de ácido sulfúrico.
Você também pode gostar
- MWM Catálogo de Peças Motor Sprint 4.07tcaDocumento224 páginasMWM Catálogo de Peças Motor Sprint 4.07tcaLEODECIO BELO DE OLIVEIRA84% (19)
- Ácidos InorganicosDocumento33 páginasÁcidos InorganicosNaeem SaleAinda não há avaliações
- Corrosão em CaldeirasDocumento15 páginasCorrosão em CaldeirasRafaela DóreaAinda não há avaliações
- Sabão Artesanal Por Cold Process PDFDocumento5 páginasSabão Artesanal Por Cold Process PDFlaiseanton75% (4)
- Processo de Obtenção - Ácido SulfricoDocumento24 páginasProcesso de Obtenção - Ácido Sulfricoquimicaufu100% (2)
- Ácido SulfúricoDocumento52 páginasÁcido SulfúricoDaniel MoreiraAinda não há avaliações
- A Produção de H2SO4 Pelo Processo de Contato EnvolveDocumento6 páginasA Produção de H2SO4 Pelo Processo de Contato EnvolveThiago FagundesAinda não há avaliações
- Produção Enxofre ResumoDocumento9 páginasProdução Enxofre ResumoDiogo HarduimAinda não há avaliações
- MB CONSULTORES - Manual de Acido SulfuricoDocumento41 páginasMB CONSULTORES - Manual de Acido SulfuricoLucas WatanabeAinda não há avaliações
- Conversão Do SO2Documento13 páginasConversão Do SO2kevin luisAinda não há avaliações
- Rebeca de Carvalho Farias Avaliação 3Documento4 páginasRebeca de Carvalho Farias Avaliação 3Rebeca De Carvalho FariasAinda não há avaliações
- Produção de Ácido Sulfúrico (2022)Documento7 páginasProdução de Ácido Sulfúrico (2022)Elzy PolicarpoAinda não há avaliações
- Aula Acido Sulfúrico + Exercicios - QIIDocumento12 páginasAula Acido Sulfúrico + Exercicios - QIIcristina_sccnAinda não há avaliações
- ÁCIDO NÍTRICO (Trabalho de Processos) PDFDocumento14 páginasÁCIDO NÍTRICO (Trabalho de Processos) PDFJoel Nakeni100% (2)
- Indústria Do Ácido SulfuricoDocumento14 páginasIndústria Do Ácido SulfuricoSuzanne AragãoAinda não há avaliações
- Ácido SulfúricoDocumento20 páginasÁcido SulfúricoJoao MarcosAinda não há avaliações
- Oleum e Ácido Sulfúrico FumeganteDocumento2 páginasOleum e Ácido Sulfúrico Fumegantecarlafavero0% (2)
- Mharaujo1993, ViniciusFinalDocumento6 páginasMharaujo1993, ViniciusFinalmecturbodieselAinda não há avaliações
- Câmara de ChumboDocumento5 páginasCâmara de ChumboJônatas MarinhoAinda não há avaliações
- Aula 5 - Ácido SulfúricoDocumento34 páginasAula 5 - Ácido SulfúricoPauloHenriqueRibeiroAinda não há avaliações
- Ácido SulfúricoDocumento36 páginasÁcido SulfúricoGuilherme MateusAinda não há avaliações
- Artigo Ácido SulfúricoDocumento5 páginasArtigo Ácido SulfúricoDoceria Feito de AmorAinda não há avaliações
- Trabalho de Q - 082526Documento11 páginasTrabalho de Q - 082526Teresa JorgeAinda não há avaliações
- Acido SulfuricoDocumento20 páginasAcido SulfuricoKarla Seabra0% (1)
- Sulfitação Dos Caldos de CanaDocumento14 páginasSulfitação Dos Caldos de CanaJavier Manuel IbanezAinda não há avaliações
- Indústrias Do Ácido SulfúricoDocumento11 páginasIndústrias Do Ácido SulfúricoFilipe LeitzkeAinda não há avaliações
- Questões PIDocumento10 páginasQuestões PImaria beatrizAinda não há avaliações
- ClausDocumento5 páginasClaushddeusAinda não há avaliações
- Industria de Cloro AlcalisDocumento13 páginasIndustria de Cloro AlcalisCaroline Caetano100% (2)
- ACIARIA - ConvertedoresDocumento55 páginasACIARIA - ConvertedoresMarduarte83100% (3)
- Trabalho HCLDocumento18 páginasTrabalho HCLNiltinhoRicardo100% (1)
- 705 4543 2 PB PDFDocumento9 páginas705 4543 2 PB PDFRenata LorenciniAinda não há avaliações
- Resumo Gases IndustriaisDocumento7 páginasResumo Gases IndustriaisMoacir JuniorAinda não há avaliações
- Arranjos IIDocumento10 páginasArranjos IISamantha TiburcioAinda não há avaliações
- TrabalhoDocumento8 páginasTrabalhoFEI produçãoAinda não há avaliações
- 07 CV5 Processo Claus para o EnxofreDocumento8 páginas07 CV5 Processo Claus para o EnxofreJorge AlbertoAinda não há avaliações
- Operações Unitarias e Conversões QuímicasDocumento8 páginasOperações Unitarias e Conversões QuímicasLorenaAinda não há avaliações
- SIDERURGIA Da Mat Prima Ao Lam 102 202Documento101 páginasSIDERURGIA Da Mat Prima Ao Lam 102 202Antonio MarinhoAinda não há avaliações
- Fabricação Da Soda Cáustica PDFDocumento8 páginasFabricação Da Soda Cáustica PDFFelipe GamaAinda não há avaliações
- 3º TQS Ácido SulfuricoDocumento3 páginas3º TQS Ácido SulfuricoRicardo OliveiraAinda não há avaliações
- O Enxofre É Um Sólido AmareloDocumento9 páginasO Enxofre É Um Sólido AmareloAnonymous rgPNr8Xa7Ainda não há avaliações
- Ácido Sulfúrico - ProcessoDocumento45 páginasÁcido Sulfúrico - ProcessoAline HunoAinda não há avaliações
- Indústria de Soda Cáustica e CloroDocumento16 páginasIndústria de Soda Cáustica e CloroBruna KuhnAinda não há avaliações
- O Que São As Chuvas ÁcidasDocumento2 páginasO Que São As Chuvas ÁcidasSara AzevedoAinda não há avaliações
- Sesquisulfato ABTCPDocumento17 páginasSesquisulfato ABTCPrhuanrdAinda não há avaliações
- Os Processos de Refino Primário Dos Aços Nos Conversores PDFDocumento14 páginasOs Processos de Refino Primário Dos Aços Nos Conversores PDFtristtessaAinda não há avaliações
- Processo Industrial Inorgânico Ácido SulfúricoDocumento19 páginasProcesso Industrial Inorgânico Ácido Sulfúricoaluiziogbj100% (1)
- Chuvas ÁcidasDocumento10 páginasChuvas ÁcidasDenilson MiguelAinda não há avaliações
- Dióxido de EnxofreDocumento9 páginasDióxido de EnxofreÁdamo Porto GamaAinda não há avaliações
- Tipos de FornosDocumento19 páginasTipos de FornostristtessaAinda não há avaliações
- Relatorio Sobre Chuva AcidaDocumento5 páginasRelatorio Sobre Chuva AcidaFelipe Fernades100% (1)
- Apostila 02 - Leitura - Chuva Ácida - Retorno AndersonDocumento8 páginasApostila 02 - Leitura - Chuva Ácida - Retorno Andersonanderson.anaAinda não há avaliações
- Chuvas Acidas FQDocumento13 páginasChuvas Acidas FQAntonio Jones JonexAinda não há avaliações
- Reações Do Enxofre - Importancia AmbientalDocumento3 páginasReações Do Enxofre - Importancia AmbientalFábio MoraisAinda não há avaliações
- PROCESSOS QUÍMICOS INDUSTRIAIS - Ácido Sulfúrico e Ácido FosfóricoDocumento38 páginasPROCESSOS QUÍMICOS INDUSTRIAIS - Ácido Sulfúrico e Ácido FosfóricoKaio Ferreira100% (1)
- AmôniaDocumento18 páginasAmôniaJoao MarcosAinda não há avaliações
- Acido SulfuricoDocumento7 páginasAcido SulfuricoMariana PegrucciAinda não há avaliações
- A sociedade do conhecimento e suas tecnologias: estudos em Ciências Exatas e Engenharias - Volume 8No EverandA sociedade do conhecimento e suas tecnologias: estudos em Ciências Exatas e Engenharias - Volume 8Ainda não há avaliações
- Emissões Atmosféricas e Mudanças ClimáticasNo EverandEmissões Atmosféricas e Mudanças ClimáticasAinda não há avaliações
- Aços Inoxidáveis - Corrosão E Métodos Para DetecçãoNo EverandAços Inoxidáveis - Corrosão E Métodos Para DetecçãoAinda não há avaliações
- Efeito da Adição de Coque Verde de Petróleo na Microestrutura e Características Metalúrgicas do CoqueNo EverandEfeito da Adição de Coque Verde de Petróleo na Microestrutura e Características Metalúrgicas do CoqueAinda não há avaliações
- Trabalho 2 - Questão 2 - Fernanda MaiaDocumento6 páginasTrabalho 2 - Questão 2 - Fernanda MaiaPedro NavarroAinda não há avaliações
- Tese Fabio Moreira - Correcoes FinaisDocumento72 páginasTese Fabio Moreira - Correcoes FinaisPedro NavarroAinda não há avaliações
- Abiclor Balanco Socioeconomico 2020Documento42 páginasAbiclor Balanco Socioeconomico 2020Pedro NavarroAinda não há avaliações
- 1 2 Dicloroetano EDC CUBATAODocumento2 páginas1 2 Dicloroetano EDC CUBATAOPedro NavarroAinda não há avaliações
- PanificaçãolevedurasDocumento17 páginasPanificaçãolevedurasPedro NavarroAinda não há avaliações
- FISPQ - PEBDL Copo 1-Buteno - BRA - PortuguesDocumento5 páginasFISPQ - PEBDL Copo 1-Buteno - BRA - PortuguesPedro NavarroAinda não há avaliações
- TESEDocumento100 páginasTESESilvânia Regina M. MoreschiAinda não há avaliações
- FISPQ Buteno-1 BRA PortuguesDocumento6 páginasFISPQ Buteno-1 BRA PortuguesPedro NavarroAinda não há avaliações
- Efeitos Colaterias Esteróides - ReviewDocumento11 páginasEfeitos Colaterias Esteróides - ReviewBegnailson RibeiroAinda não há avaliações
- Equipamentos e Vidrarias de Laboratorio - 27-03-2012 PDFDocumento25 páginasEquipamentos e Vidrarias de Laboratorio - 27-03-2012 PDFJoão Francisco Rodrigues Da Silva NetoAinda não há avaliações
- Slide Prevenção e Combate A IncendioDocumento47 páginasSlide Prevenção e Combate A IncendioluacolliAinda não há avaliações
- TRABALHO - Pilha (A.P.1)Documento12 páginasTRABALHO - Pilha (A.P.1)David ChavesAinda não há avaliações
- 803 - Apresentação OFSYDocumento19 páginas803 - Apresentação OFSYClaudio NovaisAinda não há avaliações
- Matérias-Primas ComestologiaDocumento10 páginasMatérias-Primas ComestologiaOhana ZuzaAinda não há avaliações
- FISPQ - Catalizador PUDocumento11 páginasFISPQ - Catalizador PUTécnico LemesAinda não há avaliações
- Atividade de Bromato Monitoria 1Documento4 páginasAtividade de Bromato Monitoria 1Celliny MelissaAinda não há avaliações
- Aços - ClassificaçãoDocumento127 páginasAços - ClassificaçãoNorberto A. GhiggiAinda não há avaliações
- Aula Materiais 1 2 20180312215339Documento32 páginasAula Materiais 1 2 20180312215339Bruno LimaAinda não há avaliações
- Hidróxido de Cálcio P.A. - BiodinamicaDocumento3 páginasHidróxido de Cálcio P.A. - BiodinamicaLeonardo SoaresAinda não há avaliações
- 5 QueimadurasDocumento34 páginas5 QueimadurasWagner NildaAinda não há avaliações
- Q I Relatorio Da Sintese Do Sulfato Ferroso PDFDocumento1 páginaQ I Relatorio Da Sintese Do Sulfato Ferroso PDFCarolina VersianiAinda não há avaliações
- Sebenta de Anatomia-SIMACDocumento177 páginasSebenta de Anatomia-SIMACSandra MarquesAinda não há avaliações
- Tabela ExercíciosDocumento12 páginasTabela ExercíciosGeilson SilvaAinda não há avaliações
- Ged 4137Documento13 páginasGed 4137CarloSilvaAinda não há avaliações
- Forças IntermolecularesDocumento26 páginasForças IntermolecularesjnfjjuniorAinda não há avaliações
- Metalurgia Dos Aços Inoxidáveis 2022 - 01 (3780)Documento82 páginasMetalurgia Dos Aços Inoxidáveis 2022 - 01 (3780)Isaque CarvalhoAinda não há avaliações
- História Da QuímicaDocumento2 páginasHistória Da Químicaadfs sadfasdfAinda não há avaliações
- Os 12 POPs Iniciais No Âmbito Da Convenção de EstocolmoDocumento4 páginasOs 12 POPs Iniciais No Âmbito Da Convenção de EstocolmoBárbara BomfimAinda não há avaliações
- Manual de Diretrizes Corsan PDFDocumento386 páginasManual de Diretrizes Corsan PDFJean CescaAinda não há avaliações
- Lista Aula 14 - Cálculo Estequiométrico - Pureza, Rendimento e Reações Sucessivas PDFDocumento8 páginasLista Aula 14 - Cálculo Estequiométrico - Pureza, Rendimento e Reações Sucessivas PDFbarrocapedro123Ainda não há avaliações
- Quitec - Aula 5 - Química Tecnológica - EstequiometriaDocumento31 páginasQuitec - Aula 5 - Química Tecnológica - EstequiometriagamalukasAinda não há avaliações
- Wmpr379-Soldagem GasodutosDocumento10 páginasWmpr379-Soldagem GasodutosBruno Fernandes Matos Santos SantosAinda não há avaliações
- Fenomenos Quimicos FisicosDocumento2 páginasFenomenos Quimicos FisicosLaura LoboAinda não há avaliações
- Microsoft PowerPoint - DEZ PASSOS PARA ALIMENTAÇÃO SAUDÁVEL - PIRÂMIDE ALIMENTARDocumento22 páginasMicrosoft PowerPoint - DEZ PASSOS PARA ALIMENTAÇÃO SAUDÁVEL - PIRÂMIDE ALIMENTARgigiohonda0% (1)
- Hidrolise Salina ExerciciosDocumento2 páginasHidrolise Salina ExerciciosJunior Duo EmidioAinda não há avaliações
- Comissionamento Trocadores de CalorDocumento111 páginasComissionamento Trocadores de CalorMarcio SilvaAinda não há avaliações