Escolar Documentos
Profissional Documentos
Cultura Documentos
Ciclo Celular, Mitose e Meiose - Maria Gabriela Franco de Lima
Enviado por
Maria Gabriela franco de lima0 notas0% acharam este documento útil (0 voto)
14 visualizações11 páginasResumo Ciclo celular, mitose e meiose
Título original
Ciclo Celular, Mitose e Meiose_Maria Gabriela Franco de Lima
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
DOCX, PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoResumo Ciclo celular, mitose e meiose
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato DOCX, PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
14 visualizações11 páginasCiclo Celular, Mitose e Meiose - Maria Gabriela Franco de Lima
Enviado por
Maria Gabriela franco de limaResumo Ciclo celular, mitose e meiose
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato DOCX, PDF, TXT ou leia online no Scribd
Você está na página 1de 11
Maria Gabriela Franco de Lima – 24/04/2019
Ciclo Celular, Mitose e Meiose
A divisão celular é o mecanismo que resulta em todos os organismos vivos,
desde a bactéria unicelular até o mamífero pluricelular. A reprodução de uma célula
envolve uma sequência organizada de eventos envolvendo a duplicação do seu conteúdo
seguida da divisão da mesma em duas, sendo estas idênticas à célula que as deu origem.
Para muitos organismos, como os unicelulares, a reprodução da célula e a reprodução
do próprio individuo, porém para organismos mais complexos e multicelulares, várias e
complexas divisões são necessárias para a produção de um organismo completo.
O principal objetivo da divisão celular é passar as informações genéticas para uma
próxima geração de células e, para isso, o DNA de cada cromossomo deve ser fielmente
duplicado para produzir duas cópias completas. Após a duplicação, os cromossomos
devem ser divididos com precisão, para que as células-filhas tenham uma quantidade
igual de DNA, que por sua vez é igual à quantidade de DNA da célula mãe. Outros
componentes que também devem ser duplicados são as organelas e macromoléculas.
Os processos de replicação do DNA e segregação do mesmo definem as duas
principais fases do ciclo de uma célula. A duplicação dos cromossomos ocorre durante a
chamada fase S, que ocupa cerca da metade do tempo de um ciclo celular típico. Já a
segregação do material genético, conhecida como fase M (Mitose) requer um tempo
menor e compreende dois eventos principais: a divisão do núcleo (ou mitose), na qual
os cromossomos já duplicados são distribuídos igualmente entre duas células-filhas e a
divisão do citoplasma, ou citocinese.
Além da fase S e fase M, o ciclo celular também apresenta outras duas fases, que
consistem em fases de intervalo: uma delas entre a fase M e a fase S, conhecida como
fase G1 e outra, chamada fase G2, entre a fase S e a mitose. Essas fases de intervalo,
além de consistirem em um retardo que garante o crescimento celular, também dão
tempo para que a célula monitore os ambientes interno e externo para assegurar que as
condições estejam favoráveis à divisão.
Através dessas condições, as células conseguem controlar o ciclo celular, ou seja,
retardar ou prosseguir com determinada fase dependendo das condições do ambiente ou
dos componentes necessários da própria célula. O sistema de controle do ciclo celular é
rigidamente programado para fornecer uma quantidade de tempo fixa para cada evento
do ciclo. Ele tem como base uma série conectada de interruptores bioquímicos, que são
capazes de iniciar eventos específicos do ciclo celular. Tais interruptores são binários,
ou seja, funcionam em um esquema de ativação e inativação e desencadeiam eventos de
maneira completa e irreversível.
O sistema de controle do ciclo celular controla a progressão do mesmo em três
pontos principais: (1) O Início, no final de G1, onde a célula se compromete a entrar no
ciclo e a duplicar os cromossomos; (2) Transição G2/M, na qual um evento mitótico é
disparado, levando à um alinhamento dos cromossomos no eixo mitótico na metáfase;
(3) Transição metáfase e anáfase, onde o sistema controla a separação das cromátides
irmãs, concluindo a mitose e a citocinese. Se o sistema percebe algum problema em
qualquer um desses pontos, ele impede a progressão do ciclo através de cada uma
dessas transições.
Os principais componentes do sistema de controle do ciclo são uma família de
cinases, chamadas de cinases dependentes de ciclinas (Cdks), cujas atividades
aumentam ou diminuem à medida que a célula avança no ciclo. As Cdks são
dependentes de ciclinas, ou seja, ao menos que estejam fortemente ligadas à essa
molécula, elas não apresentam atividade de cinase. Existem quatro classes de ciclinas,
definidas pelo estágio do ciclo celular no qual elas se ligam às cinases e em que atuam:
(1) G1/S-ciclinas: ativam Cdks no final de G1 e desencadeiam a progressão ao Início.
Diminuem na fase S; (2) S-ciclinas: se ligam às Cdks logo após a progressão ao Início e
ajudam a estimular a duplicação de cromossomos; (3) M-ciclinas: ativam Cdks que
estimulam a entrada na mitose na transição G2/M; (4) G1-ciclinas: ajudam a regular as
atividades das G1/S-cinases, que controlam a progressão do Início. A ciclina não
desencadeia diferentes eventos no ciclo celular somente ativação da sua Cdk parceira,
mas também pelo direcionamento de proteínas-alvo específicas. Consequentemente,
cada complexo ciclina-Cdk fosforila um conjunto diferente de proteínas-substrato.
A Cdk possui vários mecanismos adicionais que ajudam a controlar suas atividades
em estágios específicos do ciclo celular. A fosforilação de um par de aminoácidos no
sítio ativo da cinase inibe a atividade de um complexo ciclina-Cdk. Esse processo,
chamado de Weel inibe a atividade das Cdks, enquanto que a desfosforilação desses
sítios aumenta a atividade dessas cinases. Existem também as proteínas inibidoras de
Cdk, que inativam os complexos ciclina-Cdk, pelo estímulo à um grande rearranjo na
estrutura do sítio ativo da Cdk.
A atividade dos complexos ciclina-Cdk controla a progressão do ciclo celular
através do Início e transições G2/M. Já a transição metáfase-anáfase é desencadeada
pela degradação de proteínas. O principal regulador dessa transição é o complexo
promotor de anáfase, ou ciclossomo (APC/C), membro das ubiquitinas-ligase. O APC
catalisa a ubiquitinação e a destruição de duas proteínas, sendo a primeira a securina
que mantém as ligações dos pares de cromátides, que ficam unidas no início da mitose.
A destruição dessas proteínas na metáfase, ativa a protease que separa as cromátides-
irmãs, desencadeando a anáfase. Outras proteínas destruídas pela atividade do APC são
as S-ciclinas e as M-ciclinas, que leva à inativação da maioria dos Cdks das células e à
consequente desfosforilação de muitas proteínas antes fosforiladas por Cdks na fase S.
Isso leva conclusão da fase M.
O controle do ciclo celular depende exclusivamente de mecanismos pós-
transcricionais, envolvendo a regulação de Cdks e ubiquitinas-ligase e de suas
proteínas-alvo. O controle transcricional também proporciona um estágio adicional de
regulação do ciclo celular, por exemplo, pela mudança na transcrição dos genes de
ciclinas, ajudando no controle dos níveis dessas moléculas nas células.
O início do processo de divisão de uma célula se dá pela duplicação do material
genético, conhecida como fase S. A duplicação ocupa grande parte, uma fração
importante do ciclo celular. Nesse processo, não só a molécula de DNA deve ser
duplicada, mas também as proteínas que cercam a molécula. Existem dois problemas
que envolvem a duplicação: ela deve ser feita com extrema precisão, a fim de evitar
mutações nas células-filhas e também cada nucleotídeo deve ser copiado uma vez,
evitando os danos da amplificação gênica. O sistema de controle no momento da
replicação, tem a função de impedir que ela ocorra mais de uma vez por ciclo.
O início da replicação do material genético ocorre nas origens de replicação,
espalhadas por todo um cromossomo. A fase de iniciação ocorre em duas etapas
distintas, em diferentes momentos do ciclo celular. A primeira ocorre na mitose tardia e
G1 inicial, quando um par de helicases inativas se ligam à origem de replicação,
formando um complexo pré-replicativo (pré-RC). Já a segunda etapa, na fase S, ocorre
quando helicases são ativadas e consequentemente, desenrolam o DNA, dando início à
síntese. A síntese de DNA também é controlada pelo complexo de reconhecimento de
origem (ORC), que se liga à origens de replicação. Na mitose tardia e em G1 precoce,
proteínas Cdc6 e Cdt1 colaboram com ORC para ativar as helicases perto da origem. O
início da fase S também é controlada por S-Cdks que promovem a formação deum
complexo proteico, responsável pela ativação da helicase e do recrutamento da
maquinaria para a síntese de DNA. Existe também uma proteína, a DDK, que ajuda a
desencadear a ativação da origem pela fosforilação específica de subunidades da
helicase de DNA.
Existem também processos quer controlam a formação de novos pré-RCs pela
fosforilação de S-Cdks, que inibe proteínas ORC e Cdc6. Outro processo que impede
essa formação é pela inativação do APC/C no final de G1: na mitose tardia e G1
precoce, APC/C desencadeia a degradação de um inibidor de Cdt1, chamado geminina,
permitidindo que este se torne ativo. Quanto o APC/C é ativado, ocorre a acumulação
de geminina e a inibição de Cdt1. Dessa forma a formação de pré-RC é impedida,
assegurando que a origem seja ativada apenas uma vez por ciclo celular.
Além da duplicação dos cromossomos, é necessário que os componentes
proteicos, como histonas e proteínas reguladoras envolvidas no controle da expressão
gênica também sejam duplicados. A produção dessas proteínas aumenta durante a fase S
aumenta, para que sejam proteínas suficientes para empacotar o DNA recém-
sintetizado: as S-Cdks estimulam um grande aumento na síntese de histonas. Visto que
todas essas proteínas são importantes na regulação gênica, é de extrema importância que
a estrutura da cromatina, assim como a do DNA seja reproduzida de forma fiel durante a
fase S.
Ao final da fase S, temos uma cópia exata de cada cromossomo, consistindo em
um par de cromátides-irmãs idênticas. A coesão das cromátides-irmãs é essencial para a
uma divisão celular bem-sucedida, uma vez que facilita a ligação das duas cromátides a
polos opostos do fuso mitótico. Defeitos na coesão, levam, consequentemente, a
defeitos na segregação dos cromossomos. A proteína coesina é responsável pela coesão
das cromátides irmãs. Ela se liga a diversos locais ao longo do comprimento de cada
cromátide-irmã assim que o DNA é replicado na fase S.
Após a duplicação do material genético a célula entra, oficialmente, em processo
de divisão. A mitos é dividida em cinco fases (prófase, metáfase, anáfase, telófase e
citocinese), baseadas no comportamento dos cromossomos. De uma perspectiva dos
mecanismos de regulação, a mitose é dividida entre eventos que levam à transição
G2/M, marcada pela atividade de M-Cdk e que desencadeiam o início da mitose e os
eventos que levam a transição metáfase e anáfase e por consequência a separação as
cromátides-irmãs.
Os estágios iniciais da mitose são ocasionados por uma única proteína-cinase, a
M-Cdk: ela induz a formação do fuso mitótico e a sua ligação a cada cromátide-irmã à
polos opostos do fuso, desencadeia a condensação dos cromossomos, promove a
desintegração do envelope nuclear e rearranjos do citoesqueleto de actina ao aparelho de
Golgi.
O mecanismo que envolve o início da mitose pela ativação da M-Cdk se dá da
seguinte maneira: há um acúmulo de M-ciclina que leva a um consequente acúmulo de
M-Cdk à medida que a célula se aproxima da mitose. Nesse momento a cinase Wee1
mantém a M-Cdk em um estado inativo, devido à fosforilação inibidora. Dessa forma,
no momento que a célula chega ao fim de G2, ela possui uma grande quantidade de M-
Cdk pronta para agir, mas que está inibida por fosfatos que bloqueiam seu sítio ativo.
Quando ocorre a ativação da proteína fosfatase Cdc25, que remove esses fosfatos, a
atividade inibidora da proteína Wee1 é suprimida e a atividade da M-Cdk aumenta.
Para que o material genético seja dividido igualmente entre as células-filhas é
necessário que as cromátides-irmãs sejam reorganizadas em estruturas curtas e distintas
que possam ser separadas mais facilmente em anáfase, pois uma tentativa de separá-las
em um estado emaranhado de massa de DNA e proteínas poderia levar a quebras nos
cromossomos. Essa reorganização envolve dois processos: a condensação dos
cromossomos e a resolução das cromátides irmãs, no qual as cromátides são separadas
em duas unidades distintas. Como resultado as cromátides ficam fortemente unidas em
suas regiões centroméricas e apenas frouxamente ao longo dos braços cromossômicos.
A condensação dos cromossomos como já mencionado, é desencadeada pela M-
Cdk. Isso acontece através da fosforilação das subunidades da proteína condensina,
responsável pela condensação e resolução das cromátides-irmãs, pela M-Cdk. A
condensina forma uma estrutura similar a um anel que uma a energia da hidrólise de
ATP para promover a compactação e a resolução das cromátides.
Uma vez que os cromossomos estão duplicados e compactados, é necessário
que eles se liguem ao fuso mitótico para que enfim possam ser divididos entre as
células-filhas durante a anáfase. O fuso mitótico é formado por três arranjos diferentes
de microtúbulos: (1) Microtúbulos interpolares: que se sobrepõem com as extremidades
(+) de microtúbulos de outro polo, resultando em uma rede antiparalela na região média
do fuso; (2) Microtúbulos do cinetócoro: ligados aos pares de cromátides-irmãs pelo
cinetócoro, localizados no centrômero de cada cromátide; (3) Microtúbulos astrais: se
irradiam a partir dos polos e contatam o córtex da célula, ajudando no posicionamento
do fuso.
Nas células animais, cada polo do fuso é orientado em uma organela chamada
centrossomo, que consiste em uma matriz material amorfo que cerca um par de
centríolos. Células de plantas superiores e de ovócitos de muitos vertebrados não
possuem centrossomos e os polos do fuso são orientados por proteínas motoras
dependentes de microtúbulos e outras proteínas associadas às extremidades (-) dos
microtúbulos. A formação do fuso se dá no início da mitose, quando os dois
centrossomos (um centrossomo foi previamente duplicado no início do ciclo celular) se
separam ao longo do envelope nuclear e são puxados por dineínas que ligam
microtúbulos astrais ao córtex celular. O papel da M-Cdk se dá pela sua necessidade na
separação e maturação dos centrossomos. A M-Cdk e outras cinases mitóticas
fosforilam motores de cinesina-5 e os estimulam a conduzir a separação dos
centrossomos. Essas proteínas também fosforilam componentes do centrossomo,
promovendo sua maturação.
Os cromossomos também possuem um papel importante na formação do fuso.
Por exemplo se um único cromossomo é mal alinhado na placa metafásica, um conjunto
de novos microtúbulos é formado ao redor desse cromossomo. Essa propriedade dos
cromossomos, parece depender de um fator de troca de nucleotídeos de guanina, ligado
à cromatina. Esse fator estimula uma GTPase no citosol, a Ran, a ligar GTP no lugar de
GDP. A Ran-GTP libera proteínas estabilizadoras de microtúbulos, estimulando a
nucleação e a estabilização local de microtúbulos em torno dos cromossomos.
Uma vez que o fuso está formado no citoplasma, ele precisa se ligar às
cromátides-irmãs que se encontram no núcleo. Obrigatoriamente, a ligação do fuso aos
cromossomos necessita que essa barreira seja removida, ou seja, o próximo passo é a
fragmentação nuclear. Esse fenômeno se inicia quando a M-Cdk fosforila várias
subunidades dos complexos de poros nucleares. Essa fosforilação inicia a dissociação
dos complexos e, consequentemente, a dissociação do envelope. A M-Cdk também
fosforila os componentes da lâmina nuclear levando à sua despolimerização e
fragmentação das membranas do envelope em pequenas vesículas.
A ligação do fuso às cromátides-irmãs acontece na metáfase, onde as
extremidades (+) do cinetócoro dos microtúbulos são incorporadas aos sítios de ligação
a microtúbulos especializados na região externa do cinetócoro, mais afastada do DNA.
A fixação do microtúbulo depende de um complexo proteico ancorado no cinetócoro em
uma extremidade que interage com as laterais do microtúbulo, ligando-o ao cinetócoro.
Na ausência de centrossomos a ligação é feita por microtúbulos pequenos na vizinhança
dos cromossomos que se incorporam nas extremidades (+) do cinetócoro. As
extremidades (-) desses microtúbulos do cinetócoro são eventualmente ligadas em
sentido transversal à outras extremidades menos e orientadas por proteínas motoras no
polo do fuso.
A biorientação, como é chamada a ligação das cromátides-irmãs a polos opostos
do fuso mitótico, faz com que as cromátides se movem a extremidades opostas da célula
quando elas se separam na anáfase. Existem mecanismos que impedem a ligação de
ambos cinetócoros ao mesmo polo do fuso ou ainda a ligação de um mesmo cinetócoro
a dois polos diferentes. Como por exemplo, a disposição de cinetócoros-irmãos de
costas um para o outro, reduzindo a probabilidade de eles estarem voltados para o
mesmo polo do fuso. As ligações incorretas que venham a acontecer são corrigidas por
um sistema de tentativa e erro, o qual é baseado no seguinte princípio: ligações
incorretas são instáveis, ao passo que ligações corretas são mais fortes.
Após a ligação correta dos cromossomos ao fuso, eles são arrastados para trás e
para frente, até que cheguem a uma posição equidistante entre os dois polos, na
chamada placa metafásica. Uma das forças responsáveis por essa movimentação, puxa o
cinetócoro e sua cromátide ao longo do microtúbulo em direção ao polo do fuso. Esta é
produzida por proteínas do próprio cinetócoro. A energia que promove esse movimento
é armazenada no microtúbulo e é liberada quando este se despolimeriza e vem da
hidrólise de GTP. Uma segunda força que atua nessa movimentação é proporcionada
pelo fluxo de microtúbulos, de tal modo que os próprios são puxados em direção aos
polos do fuso e dissociados em sua extremidade menos. A terceira força de ação dos
cromossomos, é a chamada força de ejeção polar, ou vento polar. Nesse processo, os
motores de cinesina-4 e 10 orientados para a extremidade (+) nos braços
cromossômicos interagem com microtúbulos interpolares e transportam os
cromossomos para longe dos polos do fuso.
Após todos esses processos que levam ao início da divisão celular até a
metáfase, o clímax do ciclo celular é atingido com a separação das cromátides-irmãs na
transição metáfase-anáfase. Esse evento é regulado pela M-Cdk, mas principalmente
pelo complexo promotor de anáfase (APC/C), que desencadeia o processo que inicia a
separação das cromátides, ao ubiquitinar várias proteínas reguladoras mitóticas,
promovendo sua degradação.
As coesinas mantêm as cromátides-irmãs unidas durante a metáfase e resistem as
forças em direção aos polos que tentam separar essas cromátides. Durante a anáfase,
ocorre a perda súbita dessa coesão, permitindo que as cromátides-irmãs se separem.
Quem dá início a esse processo é o APC/C, pela marcação da proteína inibidora
securina para a degradação. A securina inibe uma protease chamada separasse, que com
a destruição da securina, fica livre para clivar subunidades de coesina.
Com a parda da coesão entre as cromátides-irmãs, elas estão prontas para serem
separadas. Os cromossomos se movem por meio de dois processos independentes e
sobrepostos. O primeiro, denominado Anáfase A, envolve o movimento inicial dos
cromossomos em direção aos polos acompanhado pelo encurtamento dos microtúbulos
do cinetócoro. Já a o segundo processo, Anáfase B, é caracterizado pela separação dos
próprios polos do fuso, que começa após as cromátides-irmãs terem se separado e os
cromossomos terem se distanciado. A conclusão de uma anáfase normal depende da
desfosforilação de substratos das Cdks, que na maioria das células resulta da destruição,
dependente de APC/C e ciclinas.
Ao final da anáfase, os cromossomos já estão segregados em dois grupos iguais
em extremidades opostas da célula. Na fase final da mitose, a telófase, os dois conjuntos
de DNA são empacotados em um par de núcleos-filhos. O primeiro evento
característico da telófase é a despolimerização do fuso mitótico, seguida pela formação
do envelope nuclear. Os complexos de poros nucleares são incorporados ao novo
envelope, a lâmina nuclear se forma novamente e o envelope se torna de novo, contínuo
com o retículo endoplasmático. Por fim, os cromossomos mitóticos são reorganizados
em seu estado interfásico, possibilitando a retomada da transcrição gênica. O que esta
agora para a conclusão da divisão celular é divisão do citoplasma ou citocinese.
A citocinese finaliza o ciclo celular, dividindo a própria célula, no caso o seu
citoplasma, em duas células-filhas idênticas à célula-mãe. Esse processo é dependente
de um anel de filamentos de actina e miosina que se contrai ao final da mitose em um
local equidistante dos cromossomos recém-segregados. Nas células animais, o
posicionamento desse local onde o citoplasma começa a se separar, denominado anel
contrátil, é determinado por sinais liberados por microtúbulos do fuso da anáfase. A
desfosforilação de moléculas-alvo de Cdks, resultante da sua inativação na anáfase,
desencadeia a citocinese no momento correto após a anáfase. Após a citocinese, a célula
entra em um estado de G1, no qual se encontra estável e com baixa atividade de Cdks.
Nesse momento, a célula aguarda por sinais para entrar em um novo ciclo celular.
Além da mitose regular, existem também um tipo específico de divisão celular
(nuclear) denominado meiose. Esse processo produz célula haploides, isto é que
apresentam somente uma cópia de cada cromossomo. A reprodução sexuada depende
desse processo para produzir gametas, ou seja, células com metade do número de
cromossomos da espécie, que ao final do ciclo reprodutivo, se fundem para formar um
zigoto diploide e darão origem a um novo indivíduo.
Assim como na mitose, a célula começa o processo de meiose pela duplicação
dos cromossomos na fase meiótica S, que tem como resultado pares de cromátides-
irmãs finamente ligadas ao longo de todo seu comprimento por complexos de coesina.
Contudo, na meiose, ocorrem dois ciclos sucessivos de segregação cromossômica. O
primeiro deles (meiose I) segrega os cromossomos homólogos, deixando assim, a célula
haploide e cumprindo o papel exclusivo desse tipo de divisão celular. Já na segunda
divisão, chamada de meiose II, ocorre sem que haja mais replicação do material
genético, de modo que as cromátides-irmãs são separadas e segregadas, assim como na
mitose, para que sejam produzidos núcleos-filhos haploides.
Durante a meiose, e essencial que os cromossomos homólogos se reconheçam e
se associem fisicamente para que os homólogos parentais sejam biorientados fuso
meiótico da primeira divisão. A justaposição dos homólogos ocorre durante a prófase I,
um período bastante prolongado da meiose I. Nessa fase, os homólogos começam a se
associar ao longo de seu comprimento em um processo chamado pareamento até que se
tornam intimamente justapostos, formando uma estrutura única de quatro cromátides,
denominada bivalente. Nesse momento ocorrem inúmeros eventos de recombinação
devido a quebras na fita dupla do DNA em várias partes em cada cromátide irmã.
O alinhamento dos cromossomos, denominado alinhamento pré-sináptico, é
seguido por uma sinapse, na qual o centro axial de um homólogo se torna intimamente
ligado ao centro axial de seu par, criando o chamado complexo sinaptonêmico. Nesse
momento, ocorrem diversas modificações morfológicas que determinam a divisão da
prófase meiótica em cinco fases: (1) Leptóteno: quando os homólogos se condensam e
pareiam, iniciando a recombinação genética; (2) Zigóteno: o complexo sinaptonêmico
começa a se formar em locais onde há a associação dos homólogos e ocorrem eventos
de recombinação; (3) Paquíteno: o processo de formação está completo e os homólogos
estão unidos por sinapses ao longo de todo seu comprimento; (4) Diplóteno: ocorre a
desorganização dos complexos sinaptonêmicos, e simultaneamente a condensação e o
encurtamentos dos cromossomos. Nessa fase, podemos ver os chamados quiasmas, os
eventos individuais de recombinação por entrecruzamento entre cromátides não irmãs;
(5) Diacinese.
Na meiose I, diferentemente da mitose, ocorre a separação entre os
cromossomos homólogos e não entre as cromátides irmãs. Essa diferença é
consequência de três características exclusivas da meiose I: (1) Ambos os cinetócoros
em um homólogo devem se ligar ao mesmo polo do fuso; (2) A recombinação por
entrecruzamento gera uma forte ligação física entre os homólogos, permitindo a
biorientação na placa equatorial do fuso; (3) A coesão é removida na anáfase I, apenas
dos braços dos cromossomos, mas não das regiões próximas aos centrômeros. A perda
dessa coesão desencadeia a separação homóloga no início da anáfase I.
A recombinação por entrecruzamento, além de possibilitar a manutenção dos
cromossomos homólogos juntos até que estes sejam segregados de forma adequada,
também contribui para a diversidade genética dos gametas. Essa recombinação é
altamente regulada: o número e a localização das quebras na fita dupla ao longo de cada
cromossomo são controlados, assim como a probabilidade de uma quebra ser convertida
em um ponto de entrecruzamento. As quebras não estão uniformemente distribuídas,
elas se localizam em locais de alta probabilidade, onde o DNA está mais acessível, ou
seja, regiões eucromáticas. Já em regiões de heterocromatina, onde o DNA está mais
condensado, elas são mais raras.
A distribuição dos cromossomos durante a meiose exige uma alta regulação dos
processos que dividem os homólogos e posteriormente as cromátides-irmãs. Dessa
forma é normal que ocorram erros durante essa divisão. Quando homólogos falham em
se separar de forma correta, temos como resultado gametas haploides que não
apresentam um cromossomo em particular ou ainda, gametas que apresentam uma cópia
a mais de determinado cromossomo.
Em animais pluricelulares, o tamanho, a divisão e a sobrevivência de uma célula
são altamente controlados, assegurando que um organismo e seus órgãos atinjam e
mantenham seus órgãos em um tamanho adequado. Existem três classes principais de
moléculas de sinalização extracelular que regulam esses processos: (1) Mitógenos:
estimulam a taxa de divisão celular removendo mecanismos moleculares intracelulares
que restringem a progressão do ciclo celular; (2) Fatores de crescimento: promovem o
crescimento celular pelo aumento da massa da célula, pela estimulação da síntese e
inibição da degradação de macromoléculas. Para manter o tamanho de uma célula
constante, células em proliferação empregam inúmeros mecanismos que asseguram o
crescimento celular, coordenando-o com a divisão celular; (3) Fatores de sobrevivência:
promovem a sobrevivência celular ao suprimir a apoptose.
Você também pode gostar
- Sistema Cardiovascular 9ºDocumento24 páginasSistema Cardiovascular 9ºExplica-meArouca0% (1)
- Rejuvenescer Com O Plasma Sanguíneo Dos JovensNo EverandRejuvenescer Com O Plasma Sanguíneo Dos JovensAinda não há avaliações
- E-Book L-PRF e Stick BoneDocumento22 páginasE-Book L-PRF e Stick BoneMac Prado Alves Mac100% (2)
- Aula 5-12-04 - 2022 Biofísica - UnipDocumento47 páginasAula 5-12-04 - 2022 Biofísica - Uniplauana RebecaAinda não há avaliações
- Ciclo Celular: Divisão e Reprodução das CélulasDocumento13 páginasCiclo Celular: Divisão e Reprodução das CélulasArthur AngeloAinda não há avaliações
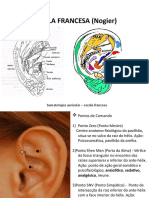
- Escola Francesa de AuriculoterapiaDocumento15 páginasEscola Francesa de AuriculoterapiaRoberta Higina KoralekAinda não há avaliações
- Apostila Do Curso Tratamento de Feridas e CurativosDocumento74 páginasApostila Do Curso Tratamento de Feridas e CurativosBeatriz Santos100% (1)
- Ciclo CelularDocumento49 páginasCiclo CelularIsaura Chiyeck100% (1)
- MitoseDocumento8 páginasMitosekadunetoAinda não há avaliações
- Manual de Formação CelularDocumento16 páginasManual de Formação CelularMafalda RamosAinda não há avaliações
- Aula 4 - Ciclo Celular Mitose e Meiose - Aspectos GenéticosDocumento30 páginasAula 4 - Ciclo Celular Mitose e Meiose - Aspectos GenéticosAdryelle Mendes100% (1)
- O ciclo celular e seu controleDocumento5 páginasO ciclo celular e seu controlemoematimoAinda não há avaliações
- 3 - O Ciclo de Divisão CelularDocumento13 páginas3 - O Ciclo de Divisão CelularEduardo MatosAinda não há avaliações
- Ciclo Celular e PontosDocumento6 páginasCiclo Celular e PontosRafaela CostaAinda não há avaliações
- Ciclo celular: interfase, mitose e regulaçãoDocumento22 páginasCiclo celular: interfase, mitose e regulaçãoAna CanastraAinda não há avaliações
- Genetica IiDocumento11 páginasGenetica IiAmaralAinda não há avaliações
- IntroduçãoDocumento26 páginasIntroduçãojotapinto22Ainda não há avaliações
- M1P2Documento13 páginasM1P2Hemily RodriguesAinda não há avaliações
- Ciclo CelularDocumento7 páginasCiclo CelularMatheus ToledoAinda não há avaliações
- Ciclo CelularDocumento10 páginasCiclo CelularMiguel Alberto LinoAinda não há avaliações
- Ciclo Celular e o Sistema de ControleDocumento4 páginasCiclo Celular e o Sistema de ControleGabriela LeãoAinda não há avaliações
- Ciclo Celular - JalekoDocumento21 páginasCiclo Celular - JalekoÉrica LageAinda não há avaliações
- Ciclo Celularbiologia2Documento16 páginasCiclo Celularbiologia2ana santosAinda não há avaliações
- O ciclo celular: compreendendo as fases da mitose e a importância da regulação do processoDocumento8 páginasO ciclo celular: compreendendo as fases da mitose e a importância da regulação do processovelascofonsecaAinda não há avaliações
- Ciclo celular: multiplicação, diferenciação e regulação do processoDocumento11 páginasCiclo celular: multiplicação, diferenciação e regulação do processoLuccaAinda não há avaliações
- Resumo P4Documento20 páginasResumo P4LuccaAinda não há avaliações
- O MISTERIOSO CORPO HUMANODocumento11 páginasO MISTERIOSO CORPO HUMANOEdmario De Jesus CorreiaAinda não há avaliações
- Octavia-Textos NormativosDocumento10 páginasOctavia-Textos NormativosArmando TamboAinda não há avaliações
- Ciclo CelularDocumento4 páginasCiclo CelularVero GuañunaAinda não há avaliações
- Ciclo Celular e ApoptoseDocumento6 páginasCiclo Celular e ApoptoseAna CristinaAinda não há avaliações
- (Alberts, 6 Ed) Cap. 17 - Ciclo CelularDocumento14 páginas(Alberts, 6 Ed) Cap. 17 - Ciclo CelularDenis NascimentoAinda não há avaliações
- Ciclo Celular e MitoseDocumento18 páginasCiclo Celular e MitoseBruna SilvaAinda não há avaliações
- Compreendendo os pontos de checagem do ciclo celular e o reparo do DNADocumento12 páginasCompreendendo os pontos de checagem do ciclo celular e o reparo do DNAWalterAinda não há avaliações
- Citologia, Histologia e GenéticaDocumento14 páginasCitologia, Histologia e Genéticafatimalima.nutriAinda não há avaliações
- Ciclo Celular e Suas FasesDocumento10 páginasCiclo Celular e Suas FasesLarissa Batista Carvalho SantosAinda não há avaliações
- Biologia 2Documento16 páginasBiologia 2Aluno Alice da Silva CalhauAinda não há avaliações
- Ciclo celular - Fases e regulaçãoDocumento8 páginasCiclo celular - Fases e regulaçãojoanaAinda não há avaliações
- Student 53572Documento6 páginasStudent 53572LuisNemGamerAinda não há avaliações
- Ciclo Celular: Interfase e MitoseDocumento12 páginasCiclo Celular: Interfase e MitoseLuizAinda não há avaliações
- A Divisão Celular e o Ciclo CelularDocumento6 páginasA Divisão Celular e o Ciclo CelularLorena CostaAinda não há avaliações
- Ciclo Celular - Cerca 2º AnoDocumento9 páginasCiclo Celular - Cerca 2º AnoJosé Pedro Moreirão Cerca Monteiro de OliveiraAinda não há avaliações
- Divisão Celular-Mitose e Meiose 1Documento55 páginasDivisão Celular-Mitose e Meiose 1Marineide AmorimAinda não há avaliações
- Ciclo celular, fases da mitose e sistema de controleDocumento5 páginasCiclo celular, fases da mitose e sistema de controleForwomenAinda não há avaliações
- Bio Celular II (1) - 022317 - 120206Documento99 páginasBio Celular II (1) - 022317 - 120206domindoma28Ainda não há avaliações
- Ciclo CelularDocumento11 páginasCiclo Celularmanueljpseabra3587Ainda não há avaliações
- Biologia 3Documento44 páginasBiologia 3sem limitesAinda não há avaliações
- Pontos de Checagem Do Ciclo CelularDocumento6 páginasPontos de Checagem Do Ciclo CelularAline GranatoAinda não há avaliações
- Trabalho de Pesquisa Ciclo CelularDocumento8 páginasTrabalho de Pesquisa Ciclo CelularHonoria KiwaAinda não há avaliações
- Reguladores do ciclo celular: ciclinas, Cdks e APC/CDocumento6 páginasReguladores do ciclo celular: ciclinas, Cdks e APC/CTúlio HenriqueAinda não há avaliações
- Ciclo Vegetal_125421Documento10 páginasCiclo Vegetal_125421joxdenzel977Ainda não há avaliações
- O ciclo celular: as etapas da divisão celularDocumento7 páginasO ciclo celular: as etapas da divisão celularInes GomesAinda não há avaliações
- Aula Ciclo, Mitose e Meiose PDFDocumento52 páginasAula Ciclo, Mitose e Meiose PDFfabilleneAinda não há avaliações
- Ciclo Celular: o Que É, Etapas, Controle, Resumo - Biologia NetDocumento3 páginasCiclo Celular: o Que É, Etapas, Controle, Resumo - Biologia NetlamdcoelhoAinda não há avaliações
- Tics Isis Ciclo CelularDocumento2 páginasTics Isis Ciclo CelularMaria DanieleAinda não há avaliações
- Regulação do ciclo celular eucariotaDocumento41 páginasRegulação do ciclo celular eucariotaJoão Frederico MusialAinda não há avaliações
- Estudo de Caso 2 - Guilherme Jesus Da SilvaDocumento8 páginasEstudo de Caso 2 - Guilherme Jesus Da SilvaeuguisilvajAinda não há avaliações
- Ciclo CelularDocumento9 páginasCiclo CelularViviane Carvalho SuethAinda não há avaliações
- Ciclo CelularDocumento6 páginasCiclo CelularMariana DiasAinda não há avaliações
- BiologiaDocumento8 páginasBiologiaRita RodriguesAinda não há avaliações
- Ciclo Celular e Mitose 2021 Com VídeosDocumento22 páginasCiclo Celular e Mitose 2021 Com VídeosBruna Nogueira de AraujoAinda não há avaliações
- Documento 1Documento8 páginasDocumento 1Taremy Gody69Ainda não há avaliações
- Documento Sem NomeDocumento17 páginasDocumento Sem NomeMatilde MendesAinda não há avaliações
- Resumo Ciclo CelularDocumento8 páginasResumo Ciclo CelularBruna KelletAinda não há avaliações
- Divisão celular e ciclo celularDocumento22 páginasDivisão celular e ciclo celularFabio Gonçalves Da SilvaAinda não há avaliações
- Citoesqueleto - Maria Gabriela Franco de LimaDocumento11 páginasCitoesqueleto - Maria Gabriela Franco de LimaMaria Gabriela franco de limaAinda não há avaliações
- ApresentaçãoDocumento32 páginasApresentaçãoMaria Gabriela franco de limaAinda não há avaliações
- Corantes e Aditivos Alimentares (Final)Documento38 páginasCorantes e Aditivos Alimentares (Final)Maria Gabriela franco de limaAinda não há avaliações
- SeminárioDocumento33 páginasSeminárioMaria Gabriela franco de limaAinda não há avaliações
- Yoga benefícios corpo menteDocumento2 páginasYoga benefícios corpo menteAna MariaAinda não há avaliações
- Aula 4 - Distúrbios Estéticos (Alopécia Androgênica) PDFDocumento44 páginasAula 4 - Distúrbios Estéticos (Alopécia Androgênica) PDFChristhyanne Dos Santos CarreiroAinda não há avaliações
- Tabela TubosDocumento1 páginaTabela TubosCad VetAinda não há avaliações
- O potencial de membrana em neurôniosDocumento26 páginasO potencial de membrana em neurôniosJéssica LeãoAinda não há avaliações
- Exercício de Neuroanatomia PRONTODocumento4 páginasExercício de Neuroanatomia PRONTOFernando MaiaAinda não há avaliações
- Lista de Teses e Dissertações do ICBDocumento39 páginasLista de Teses e Dissertações do ICBFilipe Camera de BonaAinda não há avaliações
- Sistema Sensorial - StryerDocumento31 páginasSistema Sensorial - StryerLucas Ferreira Gama MarquiniAinda não há avaliações
- Apostila Neurologia (Prova 1)Documento36 páginasApostila Neurologia (Prova 1)João Marcos Pereira Neiva RodriguesAinda não há avaliações
- Treinamento sensório-motorDocumento101 páginasTreinamento sensório-motorDoomerAinda não há avaliações
- Tecido CartilaginosoDocumento27 páginasTecido CartilaginosoMuryllo PossamaiAinda não há avaliações
- Cólica EquinaDocumento7 páginasCólica Equinaalejr896Ainda não há avaliações
- PP28 Célula - Unidade Estrutural e Funcional (Alunos)Documento60 páginasPP28 Célula - Unidade Estrutural e Funcional (Alunos)Gustavo LapoAinda não há avaliações
- Morfologia LeucocitáriaDocumento105 páginasMorfologia Leucocitáriaray_limaaAinda não há avaliações
- ECG Como Você Nunca Viu - Capítulo 1Documento23 páginasECG Como Você Nunca Viu - Capítulo 1Izamara SouzaAinda não há avaliações
- Biologia - Tipos de TecidosDocumento3 páginasBiologia - Tipos de TecidosJoao VictorAinda não há avaliações
- Mapa Mental - EnzimasDocumento1 páginaMapa Mental - EnzimasAna BeaAinda não há avaliações
- Exercícios - 2 Lei de Mendel e Grupos SanguíneosDocumento2 páginasExercícios - 2 Lei de Mendel e Grupos SanguíneosDaniel JatobaAinda não há avaliações
- Sistema Tegumentar: Estrutura e Funções da Pele e AnexosDocumento25 páginasSistema Tegumentar: Estrutura e Funções da Pele e AnexosLarissa Sena100% (1)
- Definição de hipóxia e hipoxemiaDocumento2 páginasDefinição de hipóxia e hipoxemiaJhuanna Carolina EcheveriaAinda não há avaliações
- Fisioterapia Dermato-Funcional: Mais que beleza, saúdeDocumento6 páginasFisioterapia Dermato-Funcional: Mais que beleza, saúdeJanneAinda não há avaliações
- Fisiologia do SNC e SNP emDocumento50 páginasFisiologia do SNC e SNP emVanderlan FranciscoAinda não há avaliações
- Estudo DirigidoDocumento9 páginasEstudo DirigidoStephany Summaya AmorimAinda não há avaliações
- 001.resumo - Sistema Circulatório - Coração e VasosDocumento10 páginas001.resumo - Sistema Circulatório - Coração e VasosNanami LinAinda não há avaliações
- Roteiro OSTEOLOGIADocumento7 páginasRoteiro OSTEOLOGIANayche TortatoAinda não há avaliações
- Estudo Dirigido I Anatomia Vegetal I Semestre Letivo de 2016 ProfDocumento8 páginasEstudo Dirigido I Anatomia Vegetal I Semestre Letivo de 2016 Prof202310469Ainda não há avaliações