Escolar Documentos
Profissional Documentos
Cultura Documentos
Estudo Dirigido Equilibrio Quimico Respostas
Enviado por
Norcéssio SanháTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Estudo Dirigido Equilibrio Quimico Respostas
Enviado por
Norcéssio SanháDireitos autorais:
Formatos disponíveis
Química 4 – Estudo Dirigido – Equilíbrio Químico
Nome: ____________________________________________________________________________
Pesquisar e anotar cada questão pedida abaixo (nessa mesma folha ou em folha à parte, para entregar
ao professor no final da aula):
a) O que é reação reversível?
É uma reação na qual os regentes interagem para formar produtos e os produtos podem
interagir entre si e formar os reagentes e iniciaram a reação. Isto pode acontecer
simultaneamente (levando a um equilíbrio) ou em momentos distintos.
b) O que é equilíbrio químico?
Do ponto de vista da Cinética Química, o Equilíbrio Químico é a situação na qual, em uma
reação reversível, a velocidade com que os reagentes se transformam em produtos se iguala a
velocidade com que esses produtos se transformam nos reagentes. O Equilíbrio Químico é
dinâmico, a reação de formação dos produtos (chamada direta) e a de restituição dos reagentes
(chamada inversa) não param de ocorrer, mesmo que visualmente aparenta não mais ocorrer a
reação.
c) Quando um equilíbrio é homogêneo e quando é heterogêneo?
O equilíbrio é chamado homogêneo quando todos os participantes se encontram na mesma
fase.
No equilíbrio heterogêneo é possível se identificar mais de uma fase.
d) O que é grau de equilíbrio?
Grau de equilíbrio é um número que expressa o quanto dos reagentes foi consumido até se
atingir o equilíbrio. Representado pela letra grega α (alfa), pode ser calculado dividindo-se a
quantidade, em mol, de reagente que se transformou em produto pela quantidade, também em
mol, inicialmente adicionada no recipiente onde ocorre a reação.
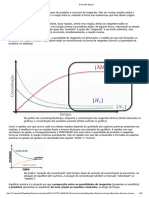
e) Escreva a expressão da constante de equilíbrio em função das concentrações molares,
Kc, para a reação
A constante de equilíbrio em função da concentração (Kc) é um número obtido por um cálculo
feito a partir das concentração de produtos e reagentes existente na situação de Equilíbrio
Químico. É o produto dos produtos, dividido pelo produto dos reagentes, todos elevados a seus
coeficientes estequiométricos.
f) Qual o valor máximo e o mínimo do grau de equilíbrio? A constante de equilíbrio possui
um valor máximo e um mínimo? Ela pode ser negativa?
O grau de equilíbrio é um número que varia de 0 a 1, não podendo ser 0, nem 1, do contrário
não existiria equilíbrio. A constante de equilíbrio também não pode ter valor igual a 0, portanto
seu valor mínimo pode ser algo muito pequeno, mas maior que 0. Pode apresentar valores muito
altos, mas nunca terá valor negativo, pois não existem concentrações em mol/L negativas.
g) O que é deslocamento do equilíbrio químico?
O deslocamento do Equilíbrio Químico é uma alteração na velocidade das reações direta e
inversa, que passam a ocorrer com valores distintos, após uma perturbação ser aplicada ao
sistema em equilíbrio.
h) O que enuncia a lei de Le Chatelier?
Quando um fator externo age sobre um sistema em equilíbrio, este se desloca, procurando
minimizar a ação do fator aplicado.
i) O que ocorre com o equilíbrio químico quando se adiciona nova porção de um
participante? E quando se retira uma porção de um dos participantes?
Adicionar nova porção de um participante, em geral, significa aumentar a concentração deste no
meio reacional. Isso desloca o equilíbrio no sentido oposto ao qual esse participante se
encontra. Se ele é um reagente, o deslocamento é no sentido dos produtos, por outro lado
adicionando-se um produto o equilíbrio será deslocado para o lado dos reagentes.
A retirada de um dos participantes terá efeito contrário, deslocando o equilíbrio no sentido
daquele que foi retirado. Tirou reagente, desloca para os reagentes. Tirou produto, desloca para
o lado dos produtos.
j) O que ocorre com o equilíbrio químico quando se aumenta a pressão total em uma reação
entre gases? E quando se diminui a pressão total?
Se a reação envolve apenas gases um aumento da pressão total deslocará o equilíbrio para o
lado (reagentes ou produtos) que apresente menor número de moléculas gasosas (identificado
pelos coeficientes estequiométricos).
Caso se diminua a pressão total, o equilíbrio será deslocado para o lado com maios número de
moléculas gasosas.
k) O que ocorre com o equilíbrio químico quando se aumenta a temperatura?
O aumento da temperatura favorece a ocorrência da reação endotérmica (que absorve calor).
Consequentemente, embora não foi perguntado nessa questão, a diminuição da temperatura
deslocará o equilíbrio no sentido da reação exotérmica.
l) Um catalisador altera o equilíbrio químico? Por quê?
Os catalisadores não alteram o estado de equilíbrio, mas atuam na rapidez com que a reação
vai ocorrer. Uma reação que tende ao equilíbrio chegará nessa situação mais rapidamente na
presença de catalisador, mas não deslocará para o equilíbrio para nenhum dos lados.
Você também pode gostar
- Equilíbrio Químico: Reações Reversíveis e Fatores que Alteram o SistemaDocumento6 páginasEquilíbrio Químico: Reações Reversíveis e Fatores que Alteram o SistemaEduarda SantannaAinda não há avaliações
- Equi Lib RioDocumento17 páginasEqui Lib RioRafael FerreiraAinda não há avaliações
- Apostila 5 - Equilíbrio QuímicoDocumento39 páginasApostila 5 - Equilíbrio QuímicoGustavo MarinhoAinda não há avaliações
- Equilíbrio químico: reações reversíveis e constante KcDocumento10 páginasEquilíbrio químico: reações reversíveis e constante KcAbreu Ngongo Filipa KasanjiAinda não há avaliações
- Equilíbrio Químico - 3° AnoDocumento17 páginasEquilíbrio Químico - 3° AnoJeyciane RosaAinda não há avaliações
- Equilíbrio Químico e Fatores que InfluenciamDocumento16 páginasEquilíbrio Químico e Fatores que InfluenciamMartinha LeãoAinda não há avaliações
- QMC AP Equilíbrio Químico Deslocamento de EquilíbrioDocumento11 páginasQMC AP Equilíbrio Químico Deslocamento de EquilíbrioGabriel Lima PizanoAinda não há avaliações
- Equilíbrio químico e suas constantesDocumento4 páginasEquilíbrio químico e suas constantesRodolfoAinda não há avaliações
- Quimica 11ºDocumento3 páginasQuimica 11ºSaraAinda não há avaliações
- Resumos - Quimica - 11º - Novo - Programa - 2016Documento10 páginasResumos - Quimica - 11º - Novo - Programa - 2016Margarida FonsecaAinda não há avaliações
- 2 Equilibrio Químico-1Documento24 páginas2 Equilibrio Químico-1Yago SilvaAinda não há avaliações
- 11ano Q 1 2 2 Extensao Das Reacoes QuimicasDocumento10 páginas11ano Q 1 2 2 Extensao Das Reacoes QuimicasHernani MartinsAinda não há avaliações
- Equilíbrio Químico e suas LeisDocumento6 páginasEquilíbrio Químico e suas LeisSonia Coelho0% (1)
- Equilíbrio Químico Yassin (Salvo Automaticamente)Documento19 páginasEquilíbrio Químico Yassin (Salvo Automaticamente)Fabio MarteAinda não há avaliações
- 2 Equilibrio Químico-1Documento24 páginas2 Equilibrio Químico-1Yago SilvaAinda não há avaliações
- Equilíbrio Químico e Cálculos EstequiométricosDocumento8 páginasEquilíbrio Químico e Cálculos EstequiométricosMariassAinda não há avaliações
- Kc e Kp.docxDocumento3 páginasKc e Kp.docxbaptistajanicengolofiAinda não há avaliações
- Cinemática QuímicaDocumento19 páginasCinemática Químicalaiane rabelo bragaAinda não há avaliações
- Trabalho de QuimicaDocumento9 páginasTrabalho de QuimicaMarciliaAinda não há avaliações
- Equilíbrio QuímicoDocumento4 páginasEquilíbrio QuímicoDiogo DiasAinda não há avaliações
- Equílibrio QuímicoDocumento2 páginasEquílibrio QuímicoKauan CamposAinda não há avaliações
- 3 - Equilíbrio Químico em Sistemas Ideais e Não IdeaisDocumento61 páginas3 - Equilíbrio Químico em Sistemas Ideais e Não IdeaisRosianeCristinaCandeuAinda não há avaliações
- Resumo 21 Introdução Ao Equilíbrio QuímicoDocumento6 páginasResumo 21 Introdução Ao Equilíbrio QuímicorafaelllllAinda não há avaliações
- Equilíbrio Químico: Propriedades e Fatores que InfluenciamDocumento4 páginasEquilíbrio Químico: Propriedades e Fatores que Influenciamantonio josé das chagas100% (1)
- QMC AP Equilíbrio Químico Equilíbrio QuímicoDocumento13 páginasQMC AP Equilíbrio Químico Equilíbrio QuímicoGabriel Lima PizanoAinda não há avaliações
- Cromato e DicromatoDocumento9 páginasCromato e DicromatoWolney PiresAinda não há avaliações
- Equilíbrio QuímicoDocumento2 páginasEquilíbrio QuímicoF TAGAinda não há avaliações
- QuimicaDocumento2 páginasQuimicaKauan CamposAinda não há avaliações
- Eq QuímicoDocumento12 páginasEq QuímicoluisaAinda não há avaliações
- Apontamento Cinética e Equilíbrio - PauloDocumento1 páginaApontamento Cinética e Equilíbrio - PauloRick EmanuelAinda não há avaliações
- Equilíbrio QuímicoDocumento4 páginasEquilíbrio QuímicoRucasRuiJorgeAinda não há avaliações
- Eq BasesDocumento93 páginasEq BasesPablo AlbinoAinda não há avaliações
- Relatório Do Experimento 7 - INLAB de QGDocumento11 páginasRelatório Do Experimento 7 - INLAB de QGmarianne carvalhoAinda não há avaliações
- Relatório 18 Deslocamento de Equilibrio 02Documento9 páginasRelatório 18 Deslocamento de Equilibrio 02Rodrigo SowaAinda não há avaliações
- Cinética Química e Equilíbrio QuímicoDocumento10 páginasCinética Química e Equilíbrio QuímicoMiguel Baptista RodriguesAinda não há avaliações
- Equilíbrio Químico: Fatores que Influenciam o DeslocamentoDocumento3 páginasEquilíbrio Químico: Fatores que Influenciam o DeslocamentoMatilde SaraAinda não há avaliações
- Equilíbrios Químicos HomogêneosDocumento19 páginasEquilíbrios Químicos HomogêneosDarllan R. BarrosAinda não há avaliações
- Apostila - Equlíbrio QuímicoDocumento2 páginasApostila - Equlíbrio QuímicoCamille SousaAinda não há avaliações
- Equilíbrio QuímicoDocumento21 páginasEquilíbrio Químicobrendarebeca67390Ainda não há avaliações
- Reacções Analíticas PDFDocumento83 páginasReacções Analíticas PDFCaltonAinda não há avaliações
- New Documento Do Microsoft WordDocumento10 páginasNew Documento Do Microsoft Wordanastancia mucuho100% (1)
- Equilíbrio QuímicoDocumento2 páginasEquilíbrio QuímicoF TAGAinda não há avaliações
- FQ - II - Eq Quimico e Eletroquimica1Documento41 páginasFQ - II - Eq Quimico e Eletroquimica1Fabiana Monteiro100% (1)
- ODocumento2 páginasOLany MesquitaAinda não há avaliações
- Equilibrio-quimicoDocumento7 páginasEquilibrio-quimicoAnna Clara Alves SáAinda não há avaliações
- 1711446339589_EQUILIBRIO QUIMICODocumento9 páginas1711446339589_EQUILIBRIO QUIMICOjk68jmtp97Ainda não há avaliações
- 610442Documento21 páginas610442hkaio0606Ainda não há avaliações
- Equilíbrio Químico: Estudo de Reações ReversíveisDocumento30 páginasEquilíbrio Químico: Estudo de Reações ReversíveisAna Raquel DamacenaAinda não há avaliações
- Material Química Módulo 5Documento19 páginasMaterial Química Módulo 5barbarasuellenquimicaAinda não há avaliações
- Relatório - Equilibrio QuimicoDocumento11 páginasRelatório - Equilibrio QuimicogcschaunAinda não há avaliações
- FQ11 Q1.2 2017-18Documento9 páginasFQ11 Q1.2 2017-18Sala 11Ainda não há avaliações
- Deslocamento do Equilíbrio Químico emDocumento2 páginasDeslocamento do Equilíbrio Químico emThuyline DyandraAinda não há avaliações
- Apfq05. Equilíbrios MolecularesDocumento18 páginasApfq05. Equilíbrios MoleculareselizaAinda não há avaliações
- Equilíbrio QuímicoDocumento21 páginasEquilíbrio QuímicoMaria RodriguesAinda não há avaliações
- Aula 1 Introdução À Química Analítica - 2012Documento75 páginasAula 1 Introdução À Química Analítica - 2012betowsantosAinda não há avaliações
- Equilibrio QuimicoDocumento20 páginasEquilibrio QuimicoGiulliano Carlos ThomazAinda não há avaliações
- Material de Apoio-QcaDocumento14 páginasMaterial de Apoio-Qcaadolfoprimeiro56Ainda não há avaliações
- Equilíbrio Químico e Lei de Le ChatelierDocumento12 páginasEquilíbrio Químico e Lei de Le ChatelierNicoly MoretoAinda não há avaliações
- Biofísica para ciências biomédicas – 4ª ediçãoNo EverandBiofísica para ciências biomédicas – 4ª ediçãoAinda não há avaliações
- ModeloDocumento2 páginasModeloNorcéssio SanháAinda não há avaliações
- Taxonomiaesistemática PDFDocumento52 páginasTaxonomiaesistemática PDFManoel Caetano DamascenoAinda não há avaliações
- .Sist Nervoso Generalid e Tecido Nerv - 1621716062000Documento40 páginas.Sist Nervoso Generalid e Tecido Nerv - 1621716062000Norcéssio SanháAinda não há avaliações
- Qualificacao Ato Transfusional Caderno ExerciciosDocumento67 páginasQualificacao Ato Transfusional Caderno ExerciciosNorcéssio SanháAinda não há avaliações
- Apostilaquimanalquali2010 PDFDocumento120 páginasApostilaquimanalquali2010 PDFRafael FerreiraAinda não há avaliações
- CFJ 9 AnoDocumento1 páginaCFJ 9 AnoNorcéssio SanháAinda não há avaliações
- EXERCÍCIOS Identificar As Diferenças Entre As Celulas A Cima Observando As ImagensDocumento1 páginaEXERCÍCIOS Identificar As Diferenças Entre As Celulas A Cima Observando As ImagensNorcéssio SanháAinda não há avaliações
- Currículo CV Biologia Química Professor Bissau-Guineense Norcéssio SanháDocumento1 páginaCurrículo CV Biologia Química Professor Bissau-Guineense Norcéssio SanháNorcéssio SanháAinda não há avaliações
- Caixas SOFNDocumento14 páginasCaixas SOFNrprojetos001tiAinda não há avaliações
- Raio X produçãoDocumento2 páginasRaio X produçãoFabio RodrigoAinda não há avaliações
- DDS - Temas LivrosDocumento53 páginasDDS - Temas LivrosRobson SantannaAinda não há avaliações
- NBR 7477 (1982) - Determinação Do Coeficiente de Conformação Superficial de Barras e Fios de Aço DesDocumento5 páginasNBR 7477 (1982) - Determinação Do Coeficiente de Conformação Superficial de Barras e Fios de Aço DesStenio Oliveira100% (1)
- Dia - Bio-Qui-GeoDocumento31 páginasDia - Bio-Qui-Geoivanir pazAinda não há avaliações
- Volume 1Documento114 páginasVolume 1Carolina FerreiraAinda não há avaliações
- Diferenças entre materiais amorfos e cristalinosDocumento4 páginasDiferenças entre materiais amorfos e cristalinosMalu OkAinda não há avaliações
- Estudo de Impacto Ambiental para Hidroelétrica de Mphanda Nkuwa em Tete, Moçambique - AnexosDocumento392 páginasEstudo de Impacto Ambiental para Hidroelétrica de Mphanda Nkuwa em Tete, Moçambique - AnexosRicardoMallmaAinda não há avaliações
- Compostos organometálicos: estrutura, síntese e aplicaçõesDocumento11 páginasCompostos organometálicos: estrutura, síntese e aplicaçõesTatianyAinda não há avaliações
- CCD de lipídios da gema de ovoDocumento7 páginasCCD de lipídios da gema de ovoPedro Henrique BastosAinda não há avaliações
- RadioatividadeDocumento10 páginasRadioatividadeprofxuxuAinda não há avaliações
- Fisiologia Da FBNDocumento18 páginasFisiologia Da FBNCarlos BinottoAinda não há avaliações
- NBR 14064 - 2003 - Atendimento A Emergencia No Transporte Rodoviario de Produtos PerigososDocumento12 páginasNBR 14064 - 2003 - Atendimento A Emergencia No Transporte Rodoviario de Produtos PerigososKelry Vasconcelos100% (1)
- Ficha de Segurança de Fungicida ConsentoDocumento10 páginasFicha de Segurança de Fungicida ConsentoRaquel SouzaAinda não há avaliações
- Raios mínimos de curvamento para tubosDocumento8 páginasRaios mínimos de curvamento para tubosEdmilson BarretoAinda não há avaliações
- Especificação técnica para identificação de tubagens e acessórios exterioresDocumento3 páginasEspecificação técnica para identificação de tubagens e acessórios exterioresAntonio BrasilAinda não há avaliações
- Aula 11 - Reações InorgânicasDocumento10 páginasAula 11 - Reações InorgânicasIgor EaengAinda não há avaliações
- Grade Agroq InseticidasDocumento10 páginasGrade Agroq InseticidasCássio FilhoAinda não há avaliações
- Monstro Da RealidadeDocumento2 páginasMonstro Da RealidadeAndressa SantosAinda não há avaliações
- Bioquimica - Sintese ProteicaDocumento13 páginasBioquimica - Sintese ProteicaMartha Maria S SouzaAinda não há avaliações
- Cálculos de empuxo em muros de contençãoDocumento6 páginasCálculos de empuxo em muros de contençãoVictor Cardoso0% (1)
- Aerofotogeologia - Rochas MetamórficasDocumento33 páginasAerofotogeologia - Rochas Metamórficaslukki_mariaAinda não há avaliações
- Modelo Pop AbastecimentoDocumento7 páginasModelo Pop Abastecimentoivoseixa100% (4)
- N 0108 PDFDocumento17 páginasN 0108 PDFRaphael Gomes GarciaAinda não há avaliações
- Hidrogenio PDFDocumento16 páginasHidrogenio PDFJuma Manual NahipaAinda não há avaliações
- Fermentação levedura CO2 sacaroseDocumento3 páginasFermentação levedura CO2 sacaroseRoselene Linden100% (1)
- Como confeccionar mala maternidadeDocumento9 páginasComo confeccionar mala maternidadeElder SilvaAinda não há avaliações
- Adepoxi 38 - ADVANCEDocumento4 páginasAdepoxi 38 - ADVANCEJoão Gilberto Vedana JúniorAinda não há avaliações
- Ubiquidade de Microorganismos PDFDocumento20 páginasUbiquidade de Microorganismos PDFNatalia CaldeiraAinda não há avaliações