Escolar Documentos
Profissional Documentos
Cultura Documentos
Apostila - Aminoácidos
Enviado por
Weslei CorreaDescrição original:
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Apostila - Aminoácidos
Enviado por
Weslei CorreaDireitos autorais:
Formatos disponíveis
Aminoácidos
No nosso sistema biológico estão presentes várias e diversificadas proteínas, todas com funções
completamente distintas. Essas biomoléculas são constituídas de aminoácidos.
Estrutura geral dos
aminoácidos na forma
ionizada em pH fisiológico
Todo aminoácido é constituído por um átomo central de carbono com quatro substituições diferentes.
Na verdade, existem 20 tipos de aminoácidos que compõe proteínas e 19 deles apresentam essa
característica de carbono assimétrico.O único que não apresenta isomeria é a glicina, pois a cadeia
lateral é um átomo de hidrogênio, ocasionando a ligação do carbono α com dois substituintes iguais.
Carbono assimétrico, também chamado de carbono quiral, são aqueles cuja a mudança de posição de
qualquer ligante levará a um enantiômero (espelhada) da molécula original.
Enantiômero
É uma molécula “espelhada”, simetricamente igual a original e tem a capacidade de desviar a luz para
a esquerda (levogiro) ou para a direita (dextrógeno). Embora alguns aminoácidos de proteínas sejam
dextrorrotatórios e alguns sejam levorrotatórios, todos compartilham a configuração absoluta do
L-glutaraldeído (convenção de Fisher) e assim, são definidos como L-aminoácidos.
Alguns exemplos de D-aminoácidos de relevância biológica incluem a ornitina e a citrulina que
participam da síntese da uréia, a tirosina na formação dos hormônios tireoidianos e o glutamato na
biossíntese de neurotransmissores.
Os aminoácidos são representados por símbolos (as 3 letras iniciais do seu nome correspondente ou
abreviados por uma letra em maiúscula).
Estude com a gente! www.biologiatotal.com.br 1
Aminoácidos
Os aminoácidos podem ser classificados em 5 classes principais baseadas nas propriedades das suas
cadeias laterias:
1 - Aminoácidos com cadeias laterais não-polares (hidrofóbicas)
2 - Aminoácidos com cadeias laterais aromáticas
3 - Aminoácidos com cadeias laterais polares não carregadas (mais hidrofílicas)
2 Estude com a gente! www.biologiatotal.com.br
Aminoácidos
4 - Aminoácidos com cadeias laterais carregadas positivamente (hidrofílicas)
5 - Aminoácidos com cadeias laterais carregadas negativamente (hidrofílicas)
Os grupamentos funcionais dos aminoácidos ditam as reações químicas dos aminoácidos. Os
aminoácidos podem formar polímeros lineares pela ligação de grupo α-carboxila de um aminoácido
com o grupo α-amino do outro.
Esta ligação carbono-nitrogênio é uma ligação amídica, chamada, no caso das proteínas de ligação
peptídica. Essa ligação é obtida por exclusão de uma molécula de água.
Através da ligação de dois ou mais aminoácidos pelas ligações peptídicas, há a formação dos peptídeos,
como por exemplo: Aspartame resultante da junção dos aminoácidos aspartato e fenilalanina.
Estude com a gente! www.biologiatotal.com.br 3
Os aminoácidos são
unidos por ligação
Aminoácidos
peptídica
Os aminoácidos podem ter carga total positiva, negativa ou neutra.
Embora tanto o R-COOH e o R-NH3 sejam ácidos fracos, o primeiro é muito mais forte que o segundo.
Assim, em pH fisiológico, os grupamentos carboxílicos existem praticamente todos como R-COO- e o
grupamento amino predominantemente como R-NH3+.
O ponto onde a carga líquida total da molécula de aminoácido ou proteína é nula e, tão importante,
que recebeu uma denominação especial. Assim, o valor de pH onde existe equivalência entre as cargas
positivas e negativas da molécula é denominado ponto isoelétrico (pI).
O pI é a média dos dois valores de pKa encontrados no aminoácido. Esses valores dependem do
aminoácido. Para aqueles que não contém grupamentos ionizáveis na cadeia lateral, utilizam-se os
valores de pKa dos grupos amino e carboxila. Para aqueles que apresentam três grupos ionizáveis,
utilizam-se os valores de pKa dos grupos com o mesmo sinal de carga. A única exceção é a tirosina onde
o pKa do grupo fenólico apresentará carga negativa em valores de pH maiores do que o pKa do grupo
amino, e o pI será então a média ente o pKa do grupo amino e do grupo carboxílico.
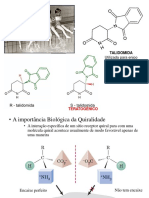
Selenocisteína o 21º L-alfa aminoácido
Esse aminoácido é encontrado nas proteínas originárias de todos os domínios da vida. Os seres
humanos apresentas duas dúzias de selenoproteínas como por exemplo a iodotironina deiodinases que
são responsáveis por converter o pró-hormônio tiroxina (T4) em T3. Conforme o próprio nome indica,
um átomo de selênio substitui o enxofre de seu análogo estrutura a cisteína. Contudo, diferente dos
20 aminoácidos geneticamente codificados, a selenocisteína é especificada por um elemento genético
mais complexo que o códon de 3 letras.
4 Estude com a gente! www.biologiatotal.com.br
Aminoácidos
EXERCÍCIOS.
questão enade
1. (ENADE 2014) Os aminoácidos, subunidades que
compõem as estruturas proteicas, apresentam
3. Qual é o único aminoácido que não apresenta
uma propriedade comum que os define: todos
isomeria óptica? Por que?
possuem um grupo ácido carboxílico e um grupo
amino, ambos ligados a um único átomo de
carbono, denominado carbono - α.
A variedade química dos aminoácidos deriva das
cadeias laterais ligadas ao carbono - α e de suas
características de carga, volume e reatividade com
a água.
Na constituição das proteínas, os aminoácidos 4. Por que os aminoácidos são considerados
são ligados um ao outro por meio da extremidade moléculas anfólitas?
carboxila de um e da extremidade amina do
outro, formando uma longa cadeia que, então, é
enovelada em uma estrutura tridimensional. Essa
estrutura é única para cada proteína.
ALBERTS, B. et al. Biologia Molecular da Célula.
Porto Alegre: ARTMED, 2 ed. 2004 (adaptado).
Com relação ao tema, para identificar os sítios 5. Construa a curva de titulação da glicina
reativos de determinada proteína, a fim de obter indicando os pontos de pK e pI.
sua estrutura primária, faz-se necessário o estudo
da conformação espacial de sua molécula. Para
atingir esse objetivo, deve-se avaliar:
a) as cadeias laterais de cada aminoácido.
b) os solventes nos quais essa proteína é solúvel.
c) o tipo de ligação que existe entre os
aminoácidos.
d) o tipo de ligação que existe no carbono - α de
cada aminoácido.
e) as extremidades amino e carboxila dessa
proteína, a fim de verificar se há compatibilidade
entre elas.
2. Escreva as classificações dos aminoácidos de
acordo com a cadeia lateral.
Estude com a gente! www.biologiatotal.com.br 5
Posição das amostras no inicio da eletroforese
Amostra A
Amostra B
Observação: O glutamato é um aminoácido com
um grupo carboxilo adicional. A valina possui
os grupos amino e carboxilo característicos de
6. Explique o significado e como é calculado o qualquer aminoácido.
ponto isoelétrico (pI).
EXERCÍCIOS
7. Os peptídeos Lys-Asp-Glu e Leu-Ala-Phe foram
adicionados a uma mistura de água e óleo com
posterior agitação. Prever a distribuição dos
peptídeos entre as duas fases.
JUSTIFIQUE SUA RESPOSTA.
8. Explique como é formada a ligação peptídica.
10. Cite peptídeos de relevância biológica.
9. A anemia falciforme é o resultado da mutação
nas cadeias beta da hemoglobinas, onde o
aminoácido glutamato é substituído pelo
aminoácido valina. Considerando que é aplicado
um campo elétrico em amostras de dois pacientes,
identifique na Figura a amostra de hemoglobina
apresentando a cadeia beta mutante.
Polo positivo (+)
Polo negativo (-)
6 Estude com a gente! www.biologiatotal.com.br
questão resolvida na aula
11. Considerando a estrutura química do
aspartato responda às questões abaixo.
questão enade
12. (ENADE 2011) A sequência de aminoácidos
exerce papel fundamental na determinação da
EXERCÍCIOS
a) Observando a cadeia lateral de um aminoácido, estrutura tridimensional de uma proteína e,
podemos diferenciá-lo de outros. Cite uma consequentemente, na sua função.
característica de acordo com as classificações
existentes que podemos atribuir a esse Com relação à separação e quantificação dos
aminoácido segundo a propriedade da sua cadeia aminoácidos presentes em uma mistura, analise
lateral. as seguintes proposições.
I. A cromatografia de troca iônica separa
os aminoácidos com base em sua carga
líquida,utilizando como fase móvel uma solução
tampão.
II. Na eletroforese, o aminoácido com
pontoisoelétrico maior do que o pH da solução
teráuma carga global positiva e migrará na direção
doânodo. .
b) Sabendo que o pI do aspartato é igual a III. A eletroforese é uma técnica que separa
2,77, indique as cargas efetivas prováveis desse aminoácidos com base em seus valores de ponto
aminoácido quando em meio de pH 1,0 , 2,8 e isoelétrico.
9,0. IV. A cromatografia líquido-líquido em papel
separaos aminoácidos com base no seu tamanho.
É correto apenas o que se afirma em:
a) I.
b) II.
c) I e III.
d) II e IV.
e) III e IV.
13. Como é caracterizado um aminoácido?
Estude com a gente! www.biologiatotal.com.br 7
14. Como podem ser classificados os aminoácidos? 17. Como se chama a ligação covalente
(representada na figura em amarelo) da
molécula dimerizada ?
15. Os aminoácidos são considerados moléculas
dipolares ou zwitteriônicas. Qual é a principal
característica deste grupo de moléculas? O que 18. Esse dímero pode ser novamente
faz dos aminoácidos moléculas dipolares? convertido ao aminoácido original. Com
qual reação química isso é possível?
EXERCÍCIOS
TEXTO PARA AS PRÓXIMAS QUESTÕES
19. O que são AAs especiais ou raros em proteínas?
Observe a figura abaixo e reponda às perguntas Exemplifique.
abaixo:
20. A ligação peptídica resulta da união entre o
grupo:
a) carboxila de um aminoácido e o grupo carboxila
do outro.
b) carboxila de um aminoácido e o grupo amina
do outro.
16. Na imagem acima vemos a oxidação
c) amina de um aminoácido e amina do outro.
(perda de elétrons) de duas moléculas de um
d) amina de um aminoácido e radical R do outro.
aminoácido formando um “dímero”. Qual é o
e) carboxila de um aminoácido e radical R do
aminoácido envolvido nessa reação e qual o
outro.
nome dado ao “dímero” desse aminoácido?
21. 0 aminoácido mais simples é a:
a) alanina
b) lisina
c) glicina
d) cisteína
e) triptofano
8 Estude com a gente! www.biologiatotal.com.br
gabarito.
Resposta da Questão 1: [C] Uma molécula anfólita é aquela capaz de doar ou
receber prótons ao mesmo tempo. Os aminoácidos
Resposta da Questão 2: possuem essa característica pela presença de seus
grupos amino e carboxílico (ele ainda conta com a
Os aminoácidos podem ser classificados de cadeia lateral, pois pode ainda apresentar grupos
acordo com a sua cadeia lateral. Propriedades ionizáveis).
como afinidade pela água são importantes para a
conformação das proteínas e por tanto para sua Resposta da Questão 5:
função. De acordo com a polaridade do grupo R, os
EXERCÍCIOS
aminoácidos são classificados em apolares (grupo pI= pK1 + pK2 / 2
R hidrofóbico) e polares (grupo R hidrofílico). pI= 2,34 + 9.6/2
Pertencem ao grupo dos aminoácidos apolares: pI= 11,94/2
glicina, alanina, valina, leucina, isoleucina, pI= 5,97
metionina, prolina, fenilalanina e triptofano.
Resposta da Questão 6:
Os aminoácidos polares podem apresentar carga
elétrica líquida e assim podem ser subdivididos em Ponto isoelétrico é o pH onde os aminoácidos
três categorias: aminoácidos básicos (se a carga comportam-se como moléculas neutras: não
for positiva), aminoácidos ácidos (se a carga for migram quando submetidos a um campo elétrico.
negativa) e aminoácidos sem carga. Generalizando, o pH em que a forma eletricamente
neutra do aminoácido é mais abundante, o pI
São aminoácidos básicos: lisina, arginina e é a média dos dois valores de pKa encontrados
histidina. no aminoácido. Esses valores dependem do
aminoácido.
São aminoácidos ácidos: aspartato e glutamato.
Para aqueles que não contém grupamentos
São aminoácidos polares sem carga: serina, ionizáveis na cadeia lateral, utilizam-se os valores
treonina e tirosina. de pKa dos grupos amino e carboxila. Para aqueles
que apresentam três grupos ionizáveis, utilizam-se
Resposta da Questão 3: os valores de pKa dos grupos com o mesmo sinal
de carga.
Dentre os 20 aminoácidos que constituem as
proteínas, todos possuem um grupo amino, um A única exceção é a tirosina onde o pKa do grupo
grupo carboxílico, um hidrogênio e uma cadeia fenólico apresentará carga negativa em valores de
lateral R variável ligados ao carbono α. Assim pH maiores do que o pKa do grupo amino, e o pI
podemos observar que esse carbono é assimétrico será então a média ente o pKa do grupo amino e
pois apresenta quatro grupos substituintes do grupo carboxílico.
diferentes.
Resposta da Questão 7:
Carbono assimétrico também chamado de
carbono quiral e correspondem aqueles cuja a Os aminoácido que compõe o peptídeo Lys-Asp-
mudança de posição de qualquer ligante levará a Glu são: Lisina, aspartato e glutamato. Todos eles
um enantiômero da molécula original. O único que são aminoácidos de característica polar, sendo
não apresenta isomeria é a glicina, pois a cadeia a lisina ainda classificada como um aminoácido
lateral é um átomo de hidrogênio, ocasionando da básico e os dois últimos como aminoácidos ácidos.
ligação do carbonoα com dois substituintes iguais. Esse peptídeo estará presente na fase da água.
Resposta da Questão 4: Os aminoácidos que compõe o peptídeo Leu-Ala-
Estude com a gente! www.biologiatotal.com.br 9
Phe são: Leucina, alanina e fenilalanina. Todos Aspartame - L-aspartil-L-fenilalanina metiléster,
esses aminoácidos são de natureza apolar e por adoçante artificial.
isso estrão presentes na fase do óleo.
Hormônios são peptídeos pequenos:
Resposta da Questão 8:
Ocitocina (estimula contração uterina),
Os aminoácidos podem formar polímeros Bradicinina (inibe inflamação dos tecidos),
lineares pela ligação de grupo α-carboxila de uma Tirotropina (hormônio da hipófise).
aminoácido com o grupo α-amino do outro. Esta
ligação carbono-nitrogênio é uma ligação amídica, Resposta da Questão 11:
chamada, no caso das preteínas de ligação
peptídica. Essa ligação é obtida por exclusão de a) Esse aminoácido pode ser classificado como
uma molécula de água e sua formação pode ser polar com carga negativa por causa do grupamento
representada pelo seguinte esquema: carboxílico extra localizado na sua cadeia lateral.
EXERCÍCIOS
Sendo assim esse aminoácido tenderá ainda um
comportamento de doador de próton sendo
classificado também como aminoácido ácido.
b)
Resposta da Questão 12: [C]
Resposta das Questão 9:
Resposta da Questão 13:
O aminoácido glutamato é classificado como
polar e com carga negativa. Dessa forma quando Todos os aminoácidos compartilham de grupos
submetido ao campo elétrico tenderá a migrar químicos comuns, com exceção de um. os grupos
para o polo positivo e se afastar do negativo. Por em comum a todos os aminoácidos são: amina,
outro lado a valina é um aminoácido apolar e por carboxila e o hidrogênio. O grupo variável é a
isso não possuirá o mesmo comportamento do cadeia lateral.
glutamato, podendo contribuir com seus grupos
ionizáveis apenas nas regiões carboxi e amino Resposta da Questão 14:
terminais.
Aminoácidos com cadeias laterais não-polares
Como estamos falando de proteína a valina estará (hidrofóbicas)
na cadeia polipeptídica e assim não possuirá essas Aminoácidos com cadeias laterais aromáticas
regiões expostas (carboxi e amino terminais) Aminoácidos com cadeias laterais polares não
pois estará fazendo ligação peptídica com outro carregadas (mais hidrofílicas)
aminoácido. O glutamato por sua vez também Aminoácidos com cadeias laterais carregadas
estará fazendo a ligação peptídica mas ele ainda positivamente (hidrofílicas) Aminoácidos com
possui um grupo carboxílico “extra” na cadeia cadeias laterais carregadas negativamente
lateral. Sendo assim a amostra que melhor (hidrofílicas)
representa a proteína mutante é a amostra em
negrito. Resposta da Questão 15:
Resposta da Questão 10: As moléculas dipolares ou zwitterriônicas, são
10 Estude com a gente! www.biologiatotal.com.br
moléculas que possuem dois grupos polares em sua
estrutura. Em solução, os grupos amina e carboxila
tendem a ficar ionizados e com isso tornam-se
polarizados (amina carregada positivamente e
carboxila carregada negativamente), sendo esta a
origem do caráter zwitteriônico dos aminoácidos.
Resposta da Questão 16:
O aminoácido oxidado é a cisteína e o dímero é
chamado de cistina.
Resposta da Questão 17:
EXERCÍCIOS
Ligação dissulfeto.
Resposta da Questão 18:
Sim, por meio de uma reação de redução.
Resposta da Questão 19:
Eles são especiais em proteínas, pois para que
as células possam produzir sua proteína, elas
precisam de aminoácidos, que podem ser obtidos
a partir da alimentação ou serem fabricadas pelo
próprio organismo. O animal é capaz de produzir
de 12 a 20 aminoácidos existentes já os vegetais
produzem outros essenciais.
Resposta da Questão 20: [B]
Resposta da Questão 21: [C]
Estude com a gente! www.biologiatotal.com.br 11
Você também pode gostar
- Teste BG10 - Maio 2019Documento6 páginasTeste BG10 - Maio 2019malcinacmatias17% (6)
- Estudo Dirigido 02 - Ligação PeptÍdica e Propriedades Dos Peptídeos (Nota 90 de 100)Documento9 páginasEstudo Dirigido 02 - Ligação PeptÍdica e Propriedades Dos Peptídeos (Nota 90 de 100)Emmanuelle FernandesAinda não há avaliações
- 2.1 Aminoácidos Peptídeos e Proteínas - ExercíciosDocumento1 página2.1 Aminoácidos Peptídeos e Proteínas - ExercíciosHenrique BarbosaAinda não há avaliações
- Resumo: Aminoácidos, Peptídeos e ProteínasDocumento7 páginasResumo: Aminoácidos, Peptídeos e ProteínasBeatriz SantosAinda não há avaliações
- Mapa Mental - LipidiosDocumento1 páginaMapa Mental - LipidiosBianca ValériaAinda não há avaliações
- Exercício AT8Documento5 páginasExercício AT8caiodt100% (2)
- GRAVIMETRIA OU ANLISE GRAVIMTRICA - Parte 1Documento24 páginasGRAVIMETRIA OU ANLISE GRAVIMTRICA - Parte 1pedro bulhoes100% (1)
- Exercícios Bioquímica PRIMEIRA PROVADocumento2 páginasExercícios Bioquímica PRIMEIRA PROVALucas Vilazante0% (1)
- Membranas 2016.1Documento50 páginasMembranas 2016.1Deusiane MuruciAinda não há avaliações
- Cardapio Low Carb SemanalDocumento2 páginasCardapio Low Carb Semanalb0jsanr131Ainda não há avaliações
- Introdução A NutriçãoDocumento24 páginasIntrodução A NutriçãoEliane MoreiraAinda não há avaliações
- Aminoácidos, Proteínas e EnzimasDocumento22 páginasAminoácidos, Proteínas e EnzimasRENATO MARTINS LIMA DE OLIVEIRAAinda não há avaliações
- Estudo Dirigido 01 - Aminoácidos e Água (Solução Tampão) e Propriedades Ácido-Base Dos Aminoácidos (Nota 90 de 100)Documento12 páginasEstudo Dirigido 01 - Aminoácidos e Água (Solução Tampão) e Propriedades Ácido-Base Dos Aminoácidos (Nota 90 de 100)Emmanuelle FernandesAinda não há avaliações
- Aula de ProteínasDocumento22 páginasAula de ProteínasMarcos Marzano100% (1)
- Aula VolumetriaDocumento30 páginasAula VolumetriaAndréBastosAinda não há avaliações
- Aula 3 ProteinasDocumento22 páginasAula 3 ProteinasLarisse SalvadorAinda não há avaliações
- Aula 2 - COMPOSIÇÃO QUÍMICA DO CORPO HUMANODocumento11 páginasAula 2 - COMPOSIÇÃO QUÍMICA DO CORPO HUMANOLiliana PonteAinda não há avaliações
- Aminoácidos e Proteínas PDFDocumento5 páginasAminoácidos e Proteínas PDFAndreAinda não há avaliações
- Volumetria IIDocumento45 páginasVolumetria IIAgar Abel MatsinheAinda não há avaliações
- Nomenclatura de CompostosDocumento19 páginasNomenclatura de CompostosRimla OtenAinda não há avaliações
- Exercícios de AminoacidosDocumento5 páginasExercícios de AminoacidosigubrunuAinda não há avaliações
- Questões de BioquímicaDocumento8 páginasQuestões de BioquímicavalentinAinda não há avaliações
- Aula 13 - Derivados de Ácidos CarboxílicosDocumento32 páginasAula 13 - Derivados de Ácidos CarboxílicosflorzinhaeuAinda não há avaliações
- Estudo DirigidoDocumento16 páginasEstudo DirigidoRenatoMatias100% (2)
- 1306 Hugo 3 Serie - Lista Recuperação PDFDocumento3 páginas1306 Hugo 3 Serie - Lista Recuperação PDFGuilherme KusterAinda não há avaliações
- Química Da Vida - Aula 14 - Biomoléculas I PDFDocumento28 páginasQuímica Da Vida - Aula 14 - Biomoléculas I PDFMundo_da_QuimicaAinda não há avaliações
- Aminoácidos, Peptídeos e ProteínasDocumento50 páginasAminoácidos, Peptídeos e ProteínasMarcoAinda não há avaliações
- Química Orgânica - CASD - Aula11 Funções Orgânicas Nitrogenadas IIDocumento3 páginasQuímica Orgânica - CASD - Aula11 Funções Orgânicas Nitrogenadas IIQuímica Caderno de Resoluções100% (1)
- Ácidos e BasesDocumento24 páginasÁcidos e BasesTonny Vila NovaAinda não há avaliações
- R1 PROTEINAS-Reacoes-de-coloracao-e-precipitacaoDocumento11 páginasR1 PROTEINAS-Reacoes-de-coloracao-e-precipitacaoJoao Pedro FidelisAinda não há avaliações
- Apostila k7qqt GravimetriaDocumento10 páginasApostila k7qqt Gravimetriaisabelle's UniverseAinda não há avaliações
- Biologia PPT - Enzimas IDocumento37 páginasBiologia PPT - Enzimas IBiologia ppt100% (2)
- Estudo Dirigido I UnidadeDocumento9 páginasEstudo Dirigido I UnidadeLUÍS FELIPE SANTANA AGUIAR100% (1)
- Questionário Bioquimica EstruturalDocumento7 páginasQuestionário Bioquimica EstruturalCoxe JonasAinda não há avaliações
- RELATORIO BIOQUIMICA Novo 3Documento11 páginasRELATORIO BIOQUIMICA Novo 3Lucas AguiarAinda não há avaliações
- Aula 3 Introdução Titulação QUI 094 2018 1 Alunos1Documento16 páginasAula 3 Introdução Titulação QUI 094 2018 1 Alunos1Neto GomesAinda não há avaliações
- Aula 02 Tabela PeriódicaDocumento46 páginasAula 02 Tabela PeriódicaJunior Lopes100% (1)
- Quimica Organica Exercicios Classificacao Nomenclatura GabaritoDocumento26 páginasQuimica Organica Exercicios Classificacao Nomenclatura GabaritoRones DiasAinda não há avaliações
- Estereoquímica PDFDocumento44 páginasEstereoquímica PDFRonaldo RochaAinda não há avaliações
- Ácidos e BasesDocumento26 páginasÁcidos e BasesMiriam_Bleggi_brAinda não há avaliações
- Bioquímica - Exercícios Com GabaritoDocumento19 páginasBioquímica - Exercícios Com GabaritoPaulo Henrique100% (1)
- Relátorio 1Documento4 páginasRelátorio 1MAGFNAinda não há avaliações
- Metabolismo Aula 1Documento8 páginasMetabolismo Aula 1AllanAinda não há avaliações
- A Matéria e Suas PropriedadesDocumento26 páginasA Matéria e Suas PropriedadesJuliana AssisAinda não há avaliações
- Fluxo Da Informação GenéticaDocumento55 páginasFluxo Da Informação GenéticaMary AguiarAinda não há avaliações
- Reacoes AromaticosDocumento59 páginasReacoes AromaticosGuilherme PereiraAinda não há avaliações
- Importancia Fisiologica de Alguns Aminoacidos e Aminoacidos Nao Proteicos PDFDocumento26 páginasImportancia Fisiologica de Alguns Aminoacidos e Aminoacidos Nao Proteicos PDFFCiências100% (5)
- Respostas Estudo Dirigido I 2023 - 2Documento8 páginasRespostas Estudo Dirigido I 2023 - 2larissagabriela.limaAinda não há avaliações
- Exercício Avaliativo - Carboidratos - CompletoDocumento3 páginasExercício Avaliativo - Carboidratos - CompletomarikfrAinda não há avaliações
- Apostila Bioquimica Uftpr PDFDocumento97 páginasApostila Bioquimica Uftpr PDFRafael GomesAinda não há avaliações
- Bioquímica - CarboidratosDocumento19 páginasBioquímica - CarboidratosGleisonAinda não há avaliações
- Estudo Dirigido de Bromatologia IDocumento6 páginasEstudo Dirigido de Bromatologia IJuliana WhitakerAinda não há avaliações
- Nomenclatura de Compostos OrgânicosDocumento47 páginasNomenclatura de Compostos OrgânicosnayaracoriolanoAinda não há avaliações
- Método de Bradford (1976)Documento23 páginasMétodo de Bradford (1976)cidclaypedagogo100% (2)
- Degradação de AminoácidosDocumento29 páginasDegradação de AminoácidosMike SternAinda não há avaliações
- Aula AFQA LipídeosDocumento21 páginasAula AFQA LipídeosIzabelli de Castro Baptista100% (1)
- Relatório 05 - Propriedades Gerais de Proteínas e AminoácidosDocumento8 páginasRelatório 05 - Propriedades Gerais de Proteínas e AminoácidosDanielle PessoaAinda não há avaliações
- Oxidação Lipídica E Antioxidantes Extraídos De Fontes NaturaisNo EverandOxidação Lipídica E Antioxidantes Extraídos De Fontes NaturaisAinda não há avaliações
- Avaliação da erva-mate como biossorventeNo EverandAvaliação da erva-mate como biossorventeAinda não há avaliações
- Eletroanálises: aspectos teóricos e práticosNo EverandEletroanálises: aspectos teóricos e práticosAinda não há avaliações
- Folhas, Talos, Cascas e Sementes de Vegetais - Composição NutricionalDocumento7 páginasFolhas, Talos, Cascas e Sementes de Vegetais - Composição NutricionalISADORA TUANNEAinda não há avaliações
- TCC Sabrina Engenharia de AlimentosDocumento47 páginasTCC Sabrina Engenharia de AlimentosIvie IvieAinda não há avaliações
- I - Importância Do Dna PDFDocumento21 páginasI - Importância Do Dna PDFSandra Nascimento0% (1)
- Milena Sefrin HelzelDocumento99 páginasMilena Sefrin HelzelSuelen DanielAinda não há avaliações
- Radiofrequencia EffectDocumento56 páginasRadiofrequencia EffectFranciele FonsecaAinda não há avaliações
- Teste de Avaliação 4Documento10 páginasTeste de Avaliação 4lara reisAinda não há avaliações
- BIOQUÍMICA - Experimento 2 - IDENTIFICAÇÃO E CARACTERIZAÇÃO DE AMINOÁCIDOS E PROTEÍNASDocumento13 páginasBIOQUÍMICA - Experimento 2 - IDENTIFICAÇÃO E CARACTERIZAÇÃO DE AMINOÁCIDOS E PROTEÍNASLucas Gomes da SilvaAinda não há avaliações
- Biomarcadores para A Avaliação Do Estado NutricionalDocumento7 páginasBiomarcadores para A Avaliação Do Estado NutricionalFabiane AlmeidaAinda não há avaliações
- Nutrição de Plantas FumoDocumento3 páginasNutrição de Plantas FumoJúnior FogaçaAinda não há avaliações
- FARMACOLOGIA - PPT FarmacodinâmicaDocumento40 páginasFARMACOLOGIA - PPT FarmacodinâmicaWellison NascimentoAinda não há avaliações
- Tratamento Nutricional Dos Desequilíbrios OrgânicosDocumento87 páginasTratamento Nutricional Dos Desequilíbrios Orgânicosjader cordeiro100% (1)
- Perfect GluteoDocumento47 páginasPerfect GluteoInjetando CiênciaAinda não há avaliações
- Sebenta de Bioquimica PDFDocumento83 páginasSebenta de Bioquimica PDFAna Lia MendesAinda não há avaliações
- A Vaca Leiteira Do Século 21: Lições de Metabolismo e NutriçãoDocumento348 páginasA Vaca Leiteira Do Século 21: Lições de Metabolismo e Nutriçãovenom sturckimAinda não há avaliações
- AMILOIDOSEDocumento31 páginasAMILOIDOSEFabiana Araújo RodriguesAinda não há avaliações
- FA 9 COM CCsDocumento7 páginasFA 9 COM CCsteresamartins100% (1)
- Caderno 2Documento11 páginasCaderno 2Professora CarolAinda não há avaliações
- Elaboracao de Apostila Didatica de Tecnologia de Massas e PanificacaoDocumento85 páginasElaboracao de Apostila Didatica de Tecnologia de Massas e PanificacaoEliardo CavalcanteAinda não há avaliações
- THOMPSON - Genética Médica - 8 Edição-51-80Documento30 páginasTHOMPSON - Genética Médica - 8 Edição-51-80Paula SVRAinda não há avaliações
- Análise de Alimentos Aula 5Documento33 páginasAnálise de Alimentos Aula 5backupmods19100% (1)
- Ix Comunicacao Cientifica em Saude e Meio Ambiente 26032018 PDFDocumento438 páginasIx Comunicacao Cientifica em Saude e Meio Ambiente 26032018 PDFJozzy FerreiraAinda não há avaliações
- Adriano Perrelli Pestana de Castro Corrigida PDFDocumento73 páginasAdriano Perrelli Pestana de Castro Corrigida PDFCarenAinda não há avaliações
- Curso de BiologiaDocumento689 páginasCurso de BiologiaJosué RodriguesAinda não há avaliações
- Ficha Biologia e Geologia 11º AnoDocumento7 páginasFicha Biologia e Geologia 11º AnoJoséLuísAlves0% (2)
- Ebook de Biologia 1º AnoDocumento50 páginasEbook de Biologia 1º AnoYlana100% (1)
- Interação Reversível de Uma Proteína Com Um LiganteDocumento2 páginasInteração Reversível de Uma Proteína Com Um Ligantemusica limaAinda não há avaliações