Escolar Documentos
Profissional Documentos
Cultura Documentos
Resolução Lista Bioquimica
Enviado por
Vitor SouzaDescrição original:
Título original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Resolução Lista Bioquimica
Enviado por
Vitor SouzaDireitos autorais:
Formatos disponíveis
1.
Descreva os tipos de lipídeos encontrados na nossa dieta e as
características de cada tipo.
Os lipídios mais simples são os triglicerídeos ou triacilgliceróis. Eles
são compostos por três ácidos graxos, unidos com ligações éster ao glicerol.
Os ácidos graxos são estruturas que armazenam energia, também chamada de
gordura de reserva, e são eficientes para o isolamento térmico. Ácidos graxos
também formam lipídios estruturais;
Os fosfolipídios ou fosfoglicerídios, resultam da união de lipídios com
fosfato. Eles estão presentes na estrutura das membranas celulares;
Os esterídeos ou esteróis são grupos mais complexos de lipídios.
Possuem quatro anéis e estrutura química contendo um ciclo-pentano-
fenantreno e um núcleo cíclico, como o colesterol. Além do colesterol, alguns
hormônios pertencem à classe de lipídios, como a progesterona e a
testosterona. Existem também lipídios com pigmento, os carotenoides.
Os cerídeos, por sua vez, têm função protetora e impermeabilizante. É o
caso do cerume ou cerúmen, popularmente conhecido como cera de ouvido,
produzido pelas glândulas sebáceas para proteção do canal auditivo. Também
estão presentes na superfície das folhas, no corpo de alguns insetos e na cera
produzida pelas abelhas.
2. Como se dá a emulsificação, digestão e absorção dos lipídeos?
Para que possam ser absorvidos, os lipídios precisam sofrer a digestão.
Dessa forma, os lipídios provenientes da dieta estimulam a secreção de
enzimas presentes em glândulas situadas na base da língua, conhecidas como
lipase lingual. Contudo, não ocorre a hidrólise dos lipídios na boca, que são
dirigidos até o estômago. Uma vez no estômago, a lipase gástrica promove a
continuidade do processo, contudo, o pH altamente ácido dificulta a ação
enzimática, onde a maior parcela da digestão acontece no intestino delgado.
Uma vez no duodeno, o bolo alimentar com o pH ácido acaba por induzir a
liberação do hormônio digestivo colecistocinina (CCK), também conhecido
como pancreozimina. O CCK faz com que a vesícula biliar sofra contração e
liberação da bile para o duodeno, também estimulando a secreção pancreática.
Os lipídios são emulsificados pela ação dos sais biliares, formando micelas
mistas de triacilgliceróis, que sofrem a digestão pela ação da lipase
pancreática, liberando ácidos graxos. Desta forma, os ácidos graxos podem ser
absorvidos pelas células que compõem o intestino, os enterócitos, e
reconvertidos em triacilgliceróis, onde juntamente com o colesterol e
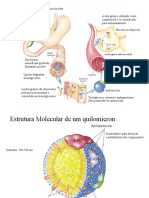
apoliproteínas, irão formar o quilomícron. Os quilomícrons (QM) são então
secretados nos vasos linfáticos e corrente sanguínea, sofrendo ação de lipases
lipoprotéicas e gerando ácidos graxos e glicerol. Esses ácidos graxos serão
oxidados e utilizados como fonte de energia, ou formar ésteres, para serem
armazenados nos adipócitos ou células musculares, principalmente.
3. Para onde são direcionados os lipídeos da dieta?
Os lipídeos da dieta humana são direcionados principalmente para o
tecido adiposo, onde podem desempenhar diversas funções. Em determinadas
situações, o tecido adiposo retira lipídios da circulação sanguínea e os
armazena na forma de gordura, os triacilgliceróis, para serem utilizados como
fonte de energia. Assim, quando necessário, os triacilgliceróis são hidrolisados,
formando glicerol e ácidos graxos, que caem na corrente sanguínea e são
utilizados pelos tecidos, como o fígado e os músculos. O fígado é o principal
sintetizador de lipídios endógenos. Os lipídeos armazenados são fontes de
fornecimento de energia, precursores de hormônios e de sais biliares,
transportadores de vitaminas lipossolúveis, isolantes térmicos e físicos e
impermeabilizantes de superfícies.
4. De qual forma os lipídeos são direcionados aos seus locais alvo?
Os lipídios são direcionados aos seus locais alvos através da corrente
sanguínea em forma de colesteróis, principalmente no formato LDL.
5. Comente sobre a formação das placas de ateroma e aterosclerose.
A aterosclerose pode ser desencadeada pelo excesso de colesterol na
corrente sanguínea, o que ocasiona uma reação inflamatória no endotélio, uma
capa celular que reveste as paredes internas das artérias. É nesses pontos que
começam a nascer os ateromas, as tais placas. Ao longo dos anos, formam-se
mais e mais camadas, congestionando o trânsito sanguíneo. A formação da
placa de ateroma inicia-se com a agressão ao endotélio vascular (revestimento
interno dos vasos) devida a diversos fatores de risco, como a elevação de
lipoproteínas (gorduras) aterogênicas (como o LDL- colesterol ou "colesterol
ruim"), hipertensão arterial, diabetes ou tabagismo. Como consequência, a
disfunção do endotélio aumenta a permeabilidade da íntima às lipoproteínas
plasmáticas (gorduras circulantes no sangue) favorecendo a retenção das
mesmas.
6. Em qual compartimento celular ocorre a beta-oxidação de ácidos
graxos?
A beta-oxidação de ácidos graxos ocorre nas mitocôndrias.
7. Como ocorre a ativação dos ácidos graxos e seu transporte para a
matriz mitocondrial?
Antes de entrarem na mitocôndria, os ácidos gordos são ativados. A
reação de ativação ocorre no citoplasma, e consiste na sua transformação em
acil-CoA. As ligações tio éster do ciclo de Krebs são muito energéticas: para a
fazer, um ATP é hidrolizado a AMP (equivalente à hidrólise de 2 ATP em 2
ADP). A membrana da mitocôndria é impermeável aos acil-CoA. Para entrarem
na mitocôndria estes reagem com um aminoácido "especial", a carnitina,
libertando a coenzima A. A carnitina esterificada é transportada para dentro da
mitocôndria por um transportador específico. Dentro da mitocôndria, a carnitina
transfere o grupo acilo para uma outra molécula de CoA. A carnitina livre volta
então para o citoplasma através do transportador
8. O que é o ciclo de Lynen? Cite as quatro reações envolvidas nesse
ciclo.
A acil-CoA presente na matriz mitocondrial é oxidada por uma via
denominada b-oxidação no ciclo de Lynen. Esta via consta de uma série cíclica
de quatro reações, ao final das quais a acil-CoA é encurtada de dois carbonos,
que são liberados sob a forma de acetil-CoA. As quatro reações são:
1. oxidação da acil-CoA a uma enoil-CoA (acil-CoA b-instaurada) de
configuração trans com formação de FADH2;
2. hidratação da dupla ligação, formando o isômero L da 3-
hidroxiacil-CoA;
3. oxidação do grupo hidroxila a carbonila, com formação de b-
cetoacil-CoA e NADH;
4. quebra da b-cetoacil-CoA por uma molécula de CoA, com
formação de acetil-CoA e uma acil-CoA com dois carbonos a
menos; está acil-CoA refaz o ciclo várias vezes, até ser totalmente
convertida a acetil-CoA.
9. Após uma volta do ciclo de Lynen, quais produtos são formados?
Em cada volta do ciclo de Lynen, há produção de 1 FADH2, 1 NADH, 1
acetil-CoA e 1 acil-CoA com dois átomos de carbono a menos que o ácido
graxo original.
10. Qual o principal órgão em que ocorre a síntese do colesterol?
A síntese de colesterol ocorre no citosol e no retículo endoplasmático de
todas as células nucleadas do organismo a partir da acetil-CoA. Em teoria,
todas as células dos mamíferos, excetuando eritrócitos maduros, têm a
capacidade de sintetizar colesterol. Contudo, a síntese endógena ocorre
primariamente, em mamíferos, em nível de fígado e intestino (cerca de 10% do
total do colesterol sintetizado no organismo), sendo que os tecidos extra-
hepáticos contribuem com uma fração menor.
11. Qual a quantidade aproximada de colesterol sintetizada diariamente nos
seres humanos (indivíduo com dieta contendo baixo teor de colesterol)?
O nível desejável de colesterol LDL é menos do que 100 mg/dL
(2,6 mmol/L), embora um novo alvo de <70 mg/dl pode ser considerado para
indivíduos em alto risco baseado em alguns dos testes mencionados acima. O
nível ideal de colesterol HDL é de >60 mg/dl(1.56 mmol/l) . Uma proporção de
colesterol total para o HDL — outra forma útil de medição — de menos de 5:1
acredita-se ser saudável. Como nota, os valores típicos de LDL para criança
antes que os estágios iniciais de ateroma comecem a se desenvolver é
35 mg/dL.
12. Qual a molécula precursora para a síntese do colesterol?
O colesterol é sintetizado primariamente da acetil CoA através da
cascata da HMG-CoA redutase em diversas células e tecidos.
13. Qual o agente redutor utilizado na síntese de colesterol?
A síntese de ácidos graxos tem malonil-CoA como doador de carbonos e
NADPH como agente redutor. Os NADPH têm duas origens: proveem da
reação catalisada pela enzima málica e das reações da via das pentoses-
fosfato catalisadas por desidrogenases. A importância relativa entre essas duas
fontes de poder redutor depende do tecido considerado.
14. Cite 3 moléculas produzidas a partir do colesterol.
Atua na síntese de hormônios esteroides, sais biliares e da vitamina D.
Que incluem o cortisol e a aldosterona nas glândulas suprarrenais, e os
hormônios sexuais progesterona, os diversos estrógenos, testosterona e
derivados.
15. As estatinas são fármacos que reduzem os níveis de colesterol. Qual
seu mecanismo de ação?
O mecanismo de ação das estatinas para obtenção da redução
do colesterol se deve a inibição da enzima HMG-CoA redutase, por meio de
uma afinidade destes fármacos com o sítio ativo da enzima. Esta
inibição é reversível e competitiva com o substrato HMG-CoA.
16. Em qual compartimento celular ocorre a síntese de ácidos graxos?
A síntese de ácidos graxos ocorre no citossol, para onde deve ser
transportada a acetil-CoA formada na mitocôndria.
17. Como se constrói um ácido graxo a partir de moléculas de acetil-CoA?
Em situações de abundância de acetil-CoA, o fígado e o tecido adiposo
sintetizam ácidos graxos. O processo de síntese apresenta bastantes
semelhanças com o inverso da b-oxidação, mas também tem diferenças
importantes:
ocorre no citoplasma, e não na mitocôndria.
usa NADPH como fonte de electrões
o transportador de grupos acilo é a ACP (Acyl Carrier Protein), e
não a coenzima A.
A síntese de ácidos graxos é feita a partir de acetil-CoA. No entanto, o
processo é endergónico, pelo que o acetil-CoA deve ser previamente ativado.
Este é, portanto, carboxilado pela acetil-CoA carboxilase, uma enzima que tal
como as outras carboxilases (p.ex., do piruvato ou do propionil-CoA) possui
biotina:
O malonil é então transferido para a proteína transportadora de acilos
(ACP), dando a origem a malonil-ACP. Este será então condensado com acetil-
ACP (sintetizado de forma semelhante a partir de acetil-CoA).
Em animais, todos os passos da síntese do ácido palmítico (o ácido
gordo saturado com 16 carbonos) são catalizados pela sintase dos ácidos
graxos, uma enzima bastante grande que leva a cabo todas as reações
seguintes desta via. O butiril-ACP produzido na primeira reação vai ser
transformado em butil-ACP. A sequência de reações é o inverso da que ocorre
na b-oxidação, i.e., redução, desidratação e hidrogenação:
O butil-ACP pode então condensar com outra molécula de malonil-ACP.
O ciclo repete-se sete vezes, até se formar palmitoil-ACP, que por hidrólise
produz ácido palmítico. A estequiometria da síntese do ácido palmítico é
portanto:
Acetil-CoA + 7 Malonil-CoA + 14 NADPH + 7 H + ---> palmitato + 7 CO2 +
14 NADP+ + 8 CoA + 6 H2O
Ácidos graxos insaturados ou de cadeia mais longa são produzidos a
partir do ácido palmítico por ação de elongases e desaturases.
18. Qual a primeira reação que a glicose sofre ao entrar em uma célula?
Esta reação é catalisada pela mesma enzima em todos os tecidos?
A primeira reação que ocorre na célula após a entrada de uma molécula
de glicose é a glicólise, pois a célula precisa quebrar a glicose para utiliza-la.
Cada reação da glicólise é catalisada por sua própria enzima. A enzima mais
importante na regulação da glicólise é a fosfofrutoquinase, a qual catalisa a
formação da molécula instável de açúcar com dois fosfatos, frutose-1,6-
bifosfato. A fosfofrutoquinase acelera ou reduz a velocidade da glicólise em
resposta à necessidade energética da célula. Dessa forma, essa enzima
catalisa a glicólise em todos os tecidos.
19. Quais as reações irreversíveis que aparecem no mapa? Cite o nome das
enzimas que as catalisam.
São três reações irreversíveis, possuem ∆ G maior, ou seja, são mais
negativas. Hexoquinase (reação 1) Fosfofrutoquinase (reação 3) Piruvato
quinase (reação 10) são as enzimas que as catalisam.
20. Quantas moléculas de piruvato se formam a partir de uma molécula de
glicose?
Duas moléculas de piruvato
21. Que hexose dá origem a trioses?
Glicose (hexose) na glicólise da origem ao piruvato (triose).
22. Considerando o número de moléculas de ATP consumidas e formadas,
estabelecer o saldo final de ATP na oxidação de uma molécula de
glicose pela via glicolítica.
O saldo energético da segunda fase da glicólise são duas moléculas de
NADH e quatro moléculas de ATP. Assim, o saldo final da glicólise, será de
duas moléculas de piruvato, duas moléculas de NADH e
duas moléculas de ATP, produzidas a partir de uma molécula de glicose.
23. Esboce a equação geral da glicólise (o que entra na via glicolítica e o
que a via produz)
24. Sabendo que a concentração intracelular de NAD+ é da ordem de 10 -5 M
(muito baixa), o que acontecerá se o NADH formado pela glicólise não
for reoxidado a NAD+ (como em casos de hipóxia muscular)? Como a
célula contorna o “problema” da baixa oferta de NAD+?
A via glicolítica pararia se o NADH formado nesta etapa da glicólise não
fosse continuamente reoxidado e reciclado.
25. Cite as enzimas e coenzimas do complexo multienzimático da piruvato-
desidrogenase.
Enzimas: Piruvato desidrogenase (E1); Diidrolipoil-transacetilase (E2);
Dihidrolipoil-desidrogenase (E3). Coenzimas: Pirofosfato de tiamina, CoA,
Lipoamida, FAD e NAD+.
26. Explique o propósito do Ciclo de Krebs e a sua localização celular.
O Ciclo de Krebs é uma das etapas do processo de respiração celular.
O Ciclo de Krebs é uma série de reações anabólicas e catabólicas com objetivo
de produzir energia para as células, sendo uma das três etapas do processo da
respiração celular. Nas células eucariontes, o ciclo acontece na matriz da
mitocôndria, já nos organismos procariontes essa etapa acontece no
citoplasma.
27. Quais são as vitaminas que participam do Ciclo de Krebs?
Tiamina (B1) e Ácido Pantatênico (B5).
28. De que modo um aumento na relação ADP/ATP influencia a atividade da
isocitrato desidrogenase?
A isocitrato desidrogenase controla a primeira fase do Ciclo de Krebs,
transformando uma molécula de seis carbonos em uma molécula de cinco
carbonos. Esta enzima é inibida por ATP e NADH, e é ativada por ADP. Logo,
quanto maior for a quantidade de ATP presente no sistema menor será sua
atividade e consequentemente o ciclo também diminuirá sua energia e, para
manter o equilíbrio constante quando é liberada uma molécula de ADP pelo
ciclo a isocitrato desidrogenase aumenta sua atividade.
29. Na oxidação completa de uma molécula de glicose a CO2, identifique as
reações que produzem NADH, FADH2 e ATP. Quantos destes são
produzidos? Quantos ATPs são produzidos?
São produzidas três moléculas NADH, uma de FADH2 e uma de ATP.
30. Como a célula converte a energia proveniente das oxidações de
substratos em energia útil (ATP)?
Ele capta a energia liberada nas reações que liberam energia, armazena
em ligações moleculares e transferem está para processos que necessitam de
energia. Para a geração de energia, moléculas maiores dos alimentos são
reduzidas a unidades menores: aminoácidos, glicerol e ácidos graxos. Em uma
segunda etapa, ocorre a glicólise. Após esse longo processo, há o terceiro e
último estágio, conhecido por "Ciclo de Krebs".
31. Como estão organizados os componentes da cadeia transportadora de
elétrons? Descreva o fluxo de elétrons proveniente das coenzimas
NADH e FADH2 até o oxigênio.
A cadeia transportadora de elétrons é um grupo de proteínas e
moléculas orgânicas inseridas na membrana, a maior parte delas organizadas
em quatro grandes complexos numerados de I a IV. Em eucariontes, muitos
exemplares dessas moléculas são encontrados na membrana mitocondrial
interna. Em procariontes, os componentes da cadeia transportadora de elétrons
são encontrados na membrana plasmática.
Os elétrons ao passarem pela cadeia, passam de um nível mais alto de
energia para outro mais baixo, movendo-se de moléculas menos ávidas por
elétrons para moléculas mais ávidas. Libera-se energia nessa transferência
"descendente" de elétrons, e muitos dos complexos de proteínas utilizam a
energia para bombear prótons da matriz mitocondrial para o espaço
intermembranar, formando um gradiente de prótons.
CADEIA TRANSPORTADORA DE ELETRONS
Todos os elétrons que entram na cadeia de transporte vêm das
moléculas de NADH e FADH2 produzidas durante os primeiros estágios da
respiração celular: glicólise, oxidação do piruvato e do ciclo do ácido cítrico.
O NADH é um bom doador de elétrons em reações redox (ou seja, seus
elétrons estão em um alto nível de energia), portanto ele pode transferir
seus elétrons diretamente para o complexo I, voltando a ser NAD+.
Conforme os elétrons percorrem o complexo I em uma série de reações
redox, energia é liberada e o complexo usa essa energia para bombear
prótons da matriz para o espaço intermembranar.
O FADH2 não é tão bom doador de elétrons quanto o NADH (ou seja,
seus elétrons estão em um nível de energia mais baixa), então não pode
transferir seus elétrons para o complexo I. Em vez disso, ele os leva pela
cadeia de transporte até o complexo II, que não bombeia prótons
através da membrana.
Por causa desse "atalho", cada molécula de FADH 2 faz com que menos
prótons sejam bombeados (e contribui menos ao gradiente de próton) do que
cada molécula de NADH.
Fora dos dois primeiros complexos, os elétrons de NADH e FADH 2
percorrem exatamente a mesma rota. Tanto o complexo I quanto o complexo II
passam seus elétrons para um pequeno e ágil carreador de elétrons
chamado ubiquinona (Q), que é reduzido para formar QH2 e atravessa a
membrana entregando os elétrons ao complexo III. Conforme os elétrons
percorrem o complexo III, mais íons H+ íons são bombeados através da
membrana, e os elétrons são finalmente entregues a outro ágil carreador
chamado citocromo C (cit C). O cit C carrega os elétrons até o complexo IV,
onde um último grupo de íons H+ é bombeado através da membrana. O
complexo IV passa os elétrons para o O 2, que se divide em dois átomos de
oxigênio que aceitam prótons da matriz, formando água. São necessários
quatro elétrons para reduzir cada molécula de O 2 e duas moléculas de água
são formadas no processo.
32. Como o NADH produzido no citosol é transportado para a matriz
mitocondrial?
A cadeia transportadora de elétrons é uma série de proteínas e
moléculas orgânicas encontradas na membrana interna da mitocôndria. Os
elétrons são passados de um componente da cadeia transportadora para outro
em uma série de reações redox. A energia liberada nestas reações é capturada
na forma de um gradiente de prótons, o qual é usado para produzir ATP em um
processo chamado quimiosmose. Juntas, a cadeia transportadora de elétrons e
a quimiosmose formam a fosforilação oxidativa. As principais etapas desse
processo, mostradas de maneira simplificada no diagrama acima, incluem:
Entrega de elétrons por NADH e FADH2. Os carreadores reduzidos
(NADH e FADH2) das outras etapas da respiração celular transferem
seus elétrons para moléculas próximas ao início da cadeia de transporte.
No processo, eles voltam a ser NAD+ e FAD, que podem ser reutilizados
em outras etapas da respiração celular.
Transferência de elétrons e bombeamento de prótons. Conforme os
elétrons passam pela cadeia, eles se movem de um nível de energia
mais alta para um de mais baixa, liberando energia. Parte dessa energia
é usada para bombear íons H+ tirando-os da matriz celular e jogando-os
no espaço intermembranar. Esse bombeamento estabelece um
gradiente eletroquímico.
Divisão do oxigênio, formando água. No final da cadeia de transporte de
elétrons, os elétrons são transferidos para a molécula de oxigênio, que é
se divide ao meio e se junta ao H+ formando água.
Síntese de ATP causada pelo gradiente. Conforme os íons H+ fluem a
favor do gradiente para a matriz, eles passam por uma enzima chamada
ATP sintase, que aproveita o fluxo de prótons para sintetizar ATP.
33. Descreva a hipótese do acoplamento quimiosmótico para a fosforilação
oxidativa.
No processo de transporte de elétrons, as proteínas dos complexos
respiratórios recebem prótons da matriz para transferi-los em reações redox;
ao serem reoxidados, esses transportadores de elétrons liberam prótons
para dentro do espaço intemembranas, criando um gradiente de prótons.
Como resultado, há uma concentração mais elevada de prótons no espaço
intermembranas que na matriz.
Os prótons fluem de volta para a matriz pelos canais de íons na ATP
sintase. Esse fluxo é acompanhado pela formação de ATP, que ocorre na
unidade de F1. A característica marcante d o acoplamento quimiosmótico
é a ligação direta do gradiente de prótons com a reação de fosforilação.
34. Qual o mecanismo de toxicidade do 2,4-DNP (dinitrofenol)? Por que esta
molécula foi utilizada para emagrecimento?
Ele desacopla a fosforilação oxidativa por meio do transporte de prótons
através da membrana mitocondrial, levando a um rápido consumo de energia
sem a geração de ATP.
O Dinitrofenol foi utilizado como emagrecedor por que provoca:
Um aumento notório do ritmo metabólico
Na temperatura corporal, o suficiente para promover a perda de
gordura
E também o ganho de massa muscular a um ritmo acelerado.
O DNP atua sobretudo provocando alterações na membrana interna das
mitocôndrias. Elas reduzem a produção normal de ATP e que, em vez disso,
promovem a libertação de energia em forma de calor. Isto por sua vez faz com
que o DNP aumente a utilização de carboidratos e de gordura a um ritmo mais
acelerado. Isso conduz à perda de peso. Podemos dizer que o DNP atua como
como o tecido adiposo marrom cuja função é sobretudo gerar calor em vez de
gerar ATP.
35. Qual o mecanismo de toxicidade do cianeto?
O cianeto liga-se avidamente ao íon férrico (Fe3 +) da citocromo oxidase
a3, bloqueando a fosforilação oxidativa. A célula deve, então, mudar para o
metabolismo anaeróbico da glicose para gerar ATP. O metabolismo anaeróbico
leva à formação de ácido láctico e ao desenvolvimento de acidose metabólica e
assim, ocorre a toxicidade do cianeto.
36. Cite e comente sobre as principais fontes do pool de aminoácidos
(conjunto de aminoácidos) livres no organismo.
As proteínas constituintes dos organismos estão continuamente sendo
renovadas (turnover das proteínas).
Os aminoácidos presentes nas células animais originam-se das
proteínas da dieta (1/4) e das proteínas endógenas (3/4), constituindo um pool.
Esse pool de aminoácidos é usado para a síntese de proteínas endógenas e de
outras moléculas que contenham nitrogênio (bases nitrogenadas, nitrogenadas,
aminas e seus derivados, derivados, como adrenalina, adrenalina, histamina).
Dos 75% dos aminoácidos obtidos pela hidrólise das proteínas corporais são
recapturados na biossíntese de novas proteínas teciduais. 25% são
metabolizados para servir como precursores para síntese de: creatina,
neurotransmissores, purinas, pirimidinas.
A digestão das proteínas dos alimentos é obtida por hidrólise catalisada
por enzimas proteolíticas localizadas no estômago e no intestino delgado. Os
aminoácidos resultantes são absorvidos pela mucosa intestinal e distribuídos
para os tecidos.
Os seres vivos não são capazes de armazenar aminoácidos nem
proteínas e, portanto, satisfeitas as necessidades de síntese, os aminoácidos
excedentes são degradados.
Existem aminoácidos essenciais e não essenciais. Um aminoácido
essencial é aquele que o organismo (considerado normalmente, o humano)
não é capaz de sintetizar, mas é requerido para o seu funcionamento. O
organismo humano é incapaz de sintetizar cerca de metade dos vinte
aminoácidos comuns. Tem então de obtê-los através da dieta, pela ingestão de
alimentos ricos em proteínas.
Os aminoácidos não essenciais são também necessários para o
funcionamento do organismo, mas podem ser sintetizados in vivo a partir de
determinados metabolitos. Existem aminoácidos que são essenciais apenas
em determinadas situações patológicas ou em organismos jovens e em
desenvolvimento. A estes convencionou-se a designação "condicionalmente
essenciais". Estes aminoácidos são normalmente fonte de divisão entre os
cientistas, havendo os que consideram estes como essenciais e os que não os
consideram essenciais.
Entre os aminoácidos 8 são considerados essenciais (o organismo não é
capaz de sintetizar, devendo provir da alimentação), incluem a isoleucina,
leucina, lisina, metionina, treonina, fenilalanina, triptofano, valina. Consumindo
uma variedade de alimentos proteicos há como obter aminoácidos essenciais.
Fontes de proteína animal, como carnes, peixes, ovos e lácteos (são
consideradas proteínas completas) contêm todos os aminoácidos essenciais.
Plantas como a quinoa, semente de cânhamo, amaranto e soja também,
embora a utilização deste Aminoácido esteja influneciada pelo aminoácido
limitante.
No feijão: metionina (cisteína); arroz e trigo: lisina; milho e cereais: lisina
e triptofano; legumes: triptofano; Vegans sabem que necessitam de boas
combinações para obter aminoácidos essenciais. O destino pode ser
cetogênico ou glicogênico.
O Destino cetogênico quando o álcool restante da quebra dos
aminoácidos vai para qualquer fase do ciclo de Krebs na forma de acetil
coenzima A ou outra substância. Os aminoácidos que são degradados a acetil-
CoA ou acetoacetil-coa são chamados de cetogênicos porque dão origem a
corpos cetônicos. A sua capacidade de formação de corpos cetônicos fica mais
evidente quando o paciente tem a diabetes melitus, o que vai fazer com que o
fígado produza grande quantidade dos mesmos.
Destino glicogênico quando o álcool restante da quebra dos aminoácidos
vai para a via glicolítica. Os aminoácidos que são degradados a piruvato, a-
cetoglutarato, succinil-coa, fumarato ou oxaloacetato são denominados
glicogênicos.
A partir desses aminoácidos é possível fazer a síntese de glicose,
porque esses intermediários e o piruvato podem ser convertidos em
fosfoenolpiruvato e depois em glicose ou glicogênio. Do conjunto básico dos 20
aminoácidos, os únicos que são exclusivamente cetogênicos são a leucina e a
lisina. A fenilalanina, triptofano, isoleucina e tirosina são tanto cetogênicos
quanto glicogênicos. E os aminoácidos restantes (14) são estritamente
glicogênicos.
37. Faça um resumo das principais proteases que atuam na digestão de
proteínas no sistema digestório.
Os principais tipos de protease encontrados no corpo humano
são: pepsina e peptidase. Outra das enzimas do sistema digestivo é a lipase. A
função da lipase é decompor as gorduras, como as encontradas em óleos,
carnes e laticínios. Alguma lipase é gerada na boca e no estômago, mas a
maioria provém do pâncreas e atua no intestino delgado. Aqui, ele trabalha
com a bile, gerada pelo fígado, que emulsiona as grandes moléculas de
gordura, tornando-as menores para que a lipase possa quebrá-la ainda mais
em glicerol e ácidos graxos.
As peptidases atuam sobre os oligopeptídeos presentes nos alimentos e
sobre os peptídeos formados pela decomposição enzimática das proteínas, a
qual se inicia apenas no estômago, através da ação da pepsina, uma protéase
capaz de atuar em meio ácido. A pepsina é uma enzima digestiva produzida
pelas paredes do estômago e secretada pelo suco gástrico, sua função é
desdobrar as proteínas em peptídeos mais simples. Ela só reage em meio
ácido, por isso o estômago também produz ácido clorídrico (HCl).
38. O que é a via ubiquitina-proteassomo? Explique sua função.
A via da ubiquitina-proteossoma é o principal mecanismo para o
catabolismo de proteínas no citosol e no núcleo de mamíferos, possuindo
enorme importância para a destruição de proteínas durante o Ciclo Celular.
Isso ocorre devido ao fato de haver ampla necessidade de se haver uma
degradação ordenada de proteínas para a progressão normal do Ciclo Celular.
Dessa forma, a via ubiquitina-proteassoma atua como o principal processo de
degradação de proteínas em células eucarióticas.
A partir das ubiquitinas disponíveis, há a formação de cadeias de
poliubiquitinas, as quais são ligadas covalentemente a outras proteínas. Tal
complexo é reconhecido e proteolisado por um complexo multiproteico
denominado proteassomo 26S.
Essa conjugação é um processo bastante complexo o qual é mediado
por três grupos de enzimas:
A primeira é o grande grupo de enzimas que ativam a ubiquitina,
sendo classificadas como E1.
A segunda envolve as enzimas conjugadoras de Ubiquitina,
classificadas como E2.
A terceira envolve a presença das enzimas ubiquitina-ligases,
classificadas como E3.
39. Qual a função das enzimas ALT e AST? Explique sua importância no
metabolismo de aminoácidos.
Um passo inicial para detectar problemas no fígado é um exame de
sangue para determinar a presença de certas enzimas no sangue, comumente
chamadas de transaminases. Debaixo de circunstâncias normais, estas
enzimas residem dentro das células do fígado. Mas quando o fígado está com
problemas, estas enzimas são derramadas no fluxo de sangue.
Entre as mais sensíveis destas enzimas são as mais representativas estão
as transaminases. Elas incluem a aminotransferase de aspartato (AST ou
SGOT ou TGO ou GOT) e a aminotransferase de alanina (ALT ou SGPT ou
TGP ou GPT). Estas enzimas normalmente são contidas dentro das células do
fígado. Se o fígado estiver com algum problema, as células derramam as
enzimas na corrente sanguínea, elevando os níveis destas enzimas no sangue
e sinalizando o problema que possa existir.
As transaminases catalisam reações químicas nas células nas quais um
grupo de amino é transferido de uma molécula doadora a uma molécula
recipiente. Consequentemente, disto deriva o nome “transaminases”.
Enzimas dependentes desse fator estão envolvidas em uma série de
reações metabólicas de aminoácidos, bem como reações de fosforilação e de
quebra de glicogênio, nessas reações, o piridoxal fosfato se liga
covalentemente a um resíduo de lisina de enzimas das quais é cofator. A
suplementação das reações de transaminação com piridoxal fosfato garante a
total utilização das enzimas durante seu doseamento, evitando atividades
diminuídas em amostras com deficiência de enzima.
40. Como a amônia é transportada dos tecidos periféricos pela circulação
sanguínea até o fígado? Descreva ainda o principal mecanismo de
transporte de aminoácidos do músculo para o fígado.
No caso de alguns tecidos a amônia livre é combinada ao glutamato
para formar glutamina e ser transportada até o fígado, pela ação da glutamina
sintetase em uma reação que requer ATP para ativar o glutamato. Quando
chega a mitocôndria hepática a amônia é liberada da glutamina por ação da
glutaminase e retorna a glutamato. A glutamina é um importante transportador
de grupos amino no sangue, pois não possui cargas elétricas o que lhe confere
capacidade de atravessar com facilidade as membranas. A formação de
glutamina é essencial para o transporte de grupos amino para muitos
processos biológicos, além é claro, de conduzi-los até o ciclo da ureia para
excreção, quando estão em excesso.
Os grupos amino liberados nos músculos se ligam ao glutamato e este
pode ser convertido à glutamina (receber amônia) ou transferir seu grupo α-
amino para o piruvato pela ação da alanina-aminotransferase formando
alanina, para serem levados até o fígado. Essa reação pode ser revertida em
ambos os tecidos e a alanina também não possui cargas elétricas o que lhe
permite passar facilmente pelas membranas. A alanina também pode remover
piruvato do músculo e leva-lo até o fígado para servir de precursor da glicose
na via de gliconeogênese e a glicose produzida pode voltar para o músculo
para servir de energia no ciclo conhecido como glicose-alanina. Ocorre que no
citosol hepático a alanina aminotransferase transfere o grupo amino da alanina
para o α-cetoglutarato formando piruvato e glutamato. O glutamato entra na
mitocôndria para liberar a amônia e o piruvato será convertido em glicose.
41. Faça um esquema mostrando as reações do ciclo da ureia.
42. Qual a importância da via das pentoses fosfato para o metabolismo
celular?
A via das pentoses-fosfato é uma via alternativa de oxidação de glicose-
6-fosfato, que leva à produção de três compostos, a ribose-5-fosfato, CO2 e
o NADPH e é importante para as seguintes reações:
A ribose-5-fosfato, produto da reação da ribulose-5-fosfato com a
enzima ribulose-5P isomerase, é a pentose constituinte
dos nucleotídeos, que vão compor os ácidos nucleicos, e de
muitas coenzimas, como o ATP, NADH, FADH2 e coenzima A.
O NADPH que atua como coenzima doadora
de hidrogênio em sínteses redutoras e em reações para proteção
contra compostos oxidantes.
43. Onde ocorre a Via das Pentoses?
Esta via alternativa de oxidação das hexoses, independente da glicólise,
está presente em muitos organismos e em mamíferos, especialmente no
fígado. No músculo, onde os carboidratos são utilizados quase que
exclusivamente na geração de energia, as enzimas necessárias não são
encontradas. As funções principais são: produção de NADPH e ribose-5-P.
44. Onde está rota metabólica apresenta maior importância no organismo.
Explique as etapas oxidativa e não oxidativa da via no organismo?
A via inicia-se a partir da oxidação da glicose-6-P a CO2 a um açúcar-P
de 5 carbonos. Os carbonos das pentoses são então distribuídos em várias
vias por duas enzimas que catalisam a transferência de pedaços de 2 e 3
carbonos entre as moléculas. Os produtos finais podem conter de 3 a 7 átomos
de carbono.
Transferência de unidade 2C e 3C entre as aldoses e cetoses na via das
pentoses.
A via pode ser assim dividida em duas etapas:
Primeiramente ocorre a formação de ribulose-5-P que, entretanto, não
possui a configuração certa para servir de substrato às enzimas-chave da
próxima etapa: transaldolase e translocase. Ambas requerem uma cetose
como doador e uma aldose como receptor. A conversão da ribulose-5-P à
ribose-5-P é uma simples isomerização cetose-aldose. Já a conversão a
xilulose-5-P envolve uma epimerização.
Uma vez que tenha sido formada uma molécula doadora (xilulose-5-P) e
uma receptora (ribose-5-P), várias vias são possíveis e, provavelmente,
ocorrem simultaneamente. A reação abaixo é a que caracteriza o ciclo de
formação de NADPH+ H+:
6 glicose-6-P + 12 NADP+ 6 CO2 + 5 frutose-6-P + 12 NADPH + H+.
O NADPH+ H+ é utilizado nas vias biossintéticas. Outros dos produtos
formados na via das pentoses e de grande importância biológica são:
triose-P - que pode alimentar a via glicolítica;
eritrose-4-P - utilizada na síntese de muitos aminoácidos;
ribose-5-P - requerido na síntese de nucleotídeos;
Pode ainda haver regeneração das hexoses. As vias sempre serão
direcionadas de acordo com a necessidade da célula. Em divisão por exemplo,
a síntese de nucleotídeos exige grande produção de riboses, enquanto que o
gasto de energia demanda maior produção de hexoses. Quando há
necessidade de NADPH, também há reciclagem das pentoses a glicose-6-P,
pois é este caminho que conduz à formação desta molécula.
45. Descreva uma patologia que envolva a Via das Pentoses Fosfato.
Exclua a discutida no caso clínico (Deficiência da enzima Glicose-6-
fosfato desidrogenase)
A deficiência em G6PD é o defeito genético mais comum na população
humana, levando a níveis reduzidos de NADPH nos eritrócitos e predispondo
ao aparecimento de anemia hemolítica induzida por stress oxidativo.
Recentemente, foram descritas duas novas deficiências enzimáticas na via das
pentoses fosfato: a deficiência em ribose-5-fosfato isomerase (RPI) e a
deficiência em transaldolase (TALDO). A primeira deficiência enzimática está
associada a leucoencefalopatia progressiva e ligeira neuropatia periférica. O
perfil metabólico da doença revela níveis elevados dos polióis: ribitol e arabitol
no cérebro, tal como demonstrado por ressonância magnética, na urina,
plasma e líquido cefalorraquidiano (LCR). Por outro lado, a deficiência em
transaldolase está associada a alterações hepáticas, havendo um grau variado
de comprometimento por parte de outros órgãos. O fenótipo metabólico desta
deficiência está associado à excreção de níveis elevados dos polióis: eritritol,
arabitol, ribitol, sedoheptitol, perseitol e dos açúcares: sedoheptulose e
manoheptulose, bem como de sedoheptulose-7-fosfato. A forte influência da
transaldolase nos níveis de NADPH em situações de disfunção mitocondrial e
stress oxidativo é atribuída ao bloqueio da reciclagem da glucose-6-fosfato a
partir da ribose-5-fosfato e à hipotética ligação à actividade de aldoses
redutases (AR), responsáveis pela conversão dos açúcares-C5-fosfatados a
C5- polióis, às custas de NADPH. A disfunção mitocondrial associada à
deficiência em transaldolase leva a uma doença hepática progressiva que se
inicia com o aparecimento do fígado gordo não alcoólico (NAFLD), passando a
esteatohepatite não alcoólica (NASH), cirrose e carcinoma hepatocelular
(CHC). Assim, a deficiência em transaldolase está associada a doença
hepática de variado grau de severidade.
O diagnóstico dos defeitos da via das pentoses fosfato é possível pela análise
dos perfis bioquímico dos açúcares e polióis nos fluidos biológicos.
Concentrações elevadas destes compostos aparecem em diversas situações
patológicas, tais como a diabetes mellitus, a doença renal e hepática e vários
erros hereditários do metabolismo dos hidratos de carbono, tais como a
galactosemia. Assim, torna-se imperativo ter em conta a grande variabilidade
de perfis metabólicos e o conhecimento dos seus significados.
46. O que são corpos de Heinz?
Os corpos de Heinz consistem na precipitação de cadeias de globina
que libertam-se do heme quando a hemoglobina é oxidada. Normalmente são
removidos pelo baço.
47. Explique como a via das pentoses fosfato é controlada, tendo em vista
que grande parte das reações dessa via é reversível.
A primeira reação da via das pentoses, a desidrogenação da glicose-6-
fosfato, é praticamente irreversível. E é essa a reação em que a via das
pentoses é controlada. O fator regulatório mais importante é o nível de NADP+,
o receptor de elétrons na oxidação da glicose-6-fosfato a 6-
fosfogluconolactona. Além disso, NADPH compete com NADP+ pela ligação à
enzima. A parte não oxidativa da via das pentoses é controlada principalmente
pela disponibilidade de substratos.
Você também pode gostar
- Aula 9 - Integração MetabólicaDocumento6 páginasAula 9 - Integração MetabólicaArielle MoraesAinda não há avaliações
- Estudo DirigidoDocumento16 páginasEstudo DirigidoRenatoMatias100% (2)
- 3 Resumo Fotossintese 2020 21Documento9 páginas3 Resumo Fotossintese 2020 21Laura MonteiroAinda não há avaliações
- Metabolismo Energético PDFDocumento10 páginasMetabolismo Energético PDFEu Sou BobinhoAinda não há avaliações
- Estudo Dirigido 1 - Bioquímica - Janeiro 2023Documento6 páginasEstudo Dirigido 1 - Bioquímica - Janeiro 2023AMANDA GLÓRIA100% (1)
- Resumo Bioquímica CarboidratosDocumento7 páginasResumo Bioquímica CarboidratosIana MagalhãesAinda não há avaliações
- Via Das Pentoses FosfatoDocumento1 páginaVia Das Pentoses FosfatoMarion SoaresAinda não há avaliações
- Questões de BioquimicaDocumento7 páginasQuestões de BioquimicaPatrícia AlmeidaAinda não há avaliações
- Aminoácidos e Proteínas PDFDocumento5 páginasAminoácidos e Proteínas PDFAndreAinda não há avaliações
- Estudo Dirigido - Glicólise PDFDocumento2 páginasEstudo Dirigido - Glicólise PDFCatarina Rodrigues50% (2)
- Exercícios Bioquímica - RespostasDocumento29 páginasExercícios Bioquímica - RespostasThalita Yock88% (8)
- Material de Apoio para EstudoDocumento6 páginasMaterial de Apoio para EstudoNathália MeloAinda não há avaliações
- Fosforolização OxidativaDocumento16 páginasFosforolização Oxidativabrunowarley1982Ainda não há avaliações
- Fotossintese 3Documento13 páginasFotossintese 3Máicon KilppAinda não há avaliações
- Estudo Dirigido I UnidadeDocumento9 páginasEstudo Dirigido I UnidadeLUÍS FELIPE SANTANA AGUIAR100% (1)
- Estudo Dirigido - Metabolismo EnergeticoDocumento10 páginasEstudo Dirigido - Metabolismo EnergeticoVanessa Meirelles100% (2)
- AD2 Bioquímica IIDocumento2 páginasAD2 Bioquímica IIGabriel MagalhãesAinda não há avaliações
- Lista de Exercicios LipideosDocumento3 páginasLista de Exercicios LipideosMily SilvaAinda não há avaliações
- QB75E Lista Exerc 5Documento3 páginasQB75E Lista Exerc 5Lucineia Pinho0% (1)
- Introdução Ao MetabolismoDocumento38 páginasIntrodução Ao MetabolismoNayara GuedesAinda não há avaliações
- Estudo Dirigido BioquímicaDocumento9 páginasEstudo Dirigido BioquímicaMaria Eduarda BragaAinda não há avaliações
- Estudo DirigidoDocumento4 páginasEstudo DirigidoGabriel Moreira100% (1)
- Síntese ProteicaDocumento6 páginasSíntese ProteicaDííh GarciaAinda não há avaliações
- GlicoseDocumento8 páginasGlicoselaviAinda não há avaliações
- Ciclo de Krebs - Explicação QuímicaDocumento3 páginasCiclo de Krebs - Explicação QuímicaItamar Jesus100% (1)
- 1740718 (2).pptDocumento20 páginas1740718 (2).pptAle Araujo100% (1)
- Metabolismo CarboidratoDocumento9 páginasMetabolismo CarboidratoSabrina Xavier100% (1)
- Estudo Sobre Ácido Graxo - Lista ResolvidaDocumento8 páginasEstudo Sobre Ácido Graxo - Lista Resolvidajuliana100% (1)
- Bioquímica: Aula 3Documento16 páginasBioquímica: Aula 3Tuani de MirandaAinda não há avaliações
- Exercícios Introdução Ao MetabolismoDocumento13 páginasExercícios Introdução Ao MetabolismoanaAinda não há avaliações
- Cap. 8 - Metabolismo Energético Da CélulaDocumento12 páginasCap. 8 - Metabolismo Energético Da CélulaLuiz Pedro Lucas Da SilvaAinda não há avaliações
- Metabolismo Dos CarboidratosDocumento4 páginasMetabolismo Dos CarboidratosTaissa VitóriaAinda não há avaliações
- Metabolismo Dos CarboidratosDocumento4 páginasMetabolismo Dos CarboidratosTaissa VitóriaAinda não há avaliações
- Capítulo 3 - Estrutura e Funcionamento Da CélulaDocumento48 páginasCapítulo 3 - Estrutura e Funcionamento Da CélulaMegan Katherine Melling100% (2)
- Cola P2Documento3 páginasCola P2zepaflaAinda não há avaliações
- Metabolismo Dos Carboidratos e LipídiosDocumento4 páginasMetabolismo Dos Carboidratos e LipídiosNetto LacerdaAinda não há avaliações
- Metabolismo de Lipídeos KahioDocumento16 páginasMetabolismo de Lipídeos Kahiokahionz100% (2)
- Bioquimica - Digestão e Absorção Dos LipídiosDocumento5 páginasBioquimica - Digestão e Absorção Dos LipídiosRafael Rudá Coelho100% (1)
- Microsoft Word - Estudo Dirigido - Bloco LipídiosDocumento4 páginasMicrosoft Word - Estudo Dirigido - Bloco LipídiosFelipe MagalhaesAinda não há avaliações
- Aula 9 Metabolismo Dos LipídiosDocumento44 páginasAula 9 Metabolismo Dos Lipídiosaracnomarques100% (2)
- Aula 7-Digestão e Transporte de Lipídeos - 2022Documento59 páginasAula 7-Digestão e Transporte de Lipídeos - 2022Marco Antonio Damaceno100% (1)
- Ciclo de KrebsDocumento6 páginasCiclo de KrebsRichard WooliteAinda não há avaliações
- GlicóliseDocumento3 páginasGlicóliseTay100% (1)
- Metabolismo MicrobianoDocumento5 páginasMetabolismo MicrobianokassoroAinda não há avaliações
- Bioquímica - Aula 3 - CarboidratosDocumento38 páginasBioquímica - Aula 3 - CarboidratosElitePoa RsAinda não há avaliações
- Relatório 2 - Bioquímica 2 - Dosagem de Glicose e Fermentação em Saccharomyces CerevisiaeDocumento22 páginasRelatório 2 - Bioquímica 2 - Dosagem de Glicose e Fermentação em Saccharomyces CerevisiaeJheyce Moraes0% (1)
- Resumos de BioenergéticaDocumento22 páginasResumos de BioenergéticaHugo NicolauAinda não há avaliações
- 2 Prova de BioquímicaDocumento6 páginas2 Prova de BioquímicaMary FreitasAinda não há avaliações
- Enzimas (Questões Respondidas)Documento3 páginasEnzimas (Questões Respondidas)Nayara SantiagoAinda não há avaliações
- GlicóliseDocumento1 páginaGlicóliseConsolia DibAinda não há avaliações
- P1 Bioquímica PROVA 1Documento6 páginasP1 Bioquímica PROVA 1jaraAinda não há avaliações
- Lista Exercícios 2 - Bioquímica MetabólicaDocumento1 páginaLista Exercícios 2 - Bioquímica MetabólicaLucas PintanelAinda não há avaliações
- Lista de Exercícios - Bioquimica - 1 PDFDocumento4 páginasLista de Exercícios - Bioquimica - 1 PDFFabio Cavalcante da Silva0% (1)
- PEROXISSOMOSDocumento4 páginasPEROXISSOMOSCíntia FariaAinda não há avaliações
- Questões de BioquímicaDocumento8 páginasQuestões de BioquímicavalentinAinda não há avaliações
- Roteiro 1 - Metabolismo de Carboidratos!Documento3 páginasRoteiro 1 - Metabolismo de Carboidratos!Mariana ArgenteAinda não há avaliações
- Exercicos AminoácidosDocumento10 páginasExercicos AminoácidospscacaoAinda não há avaliações
- Fisiologia Hepática PDFDocumento5 páginasFisiologia Hepática PDFRenata Lima de FreitasAinda não há avaliações
- Gabarito de Biologia Celular - Prova 01Documento3 páginasGabarito de Biologia Celular - Prova 01Thaís LuzAinda não há avaliações
- Prova Bioquimica AB 2 CompletaDocumento3 páginasProva Bioquimica AB 2 CompletaEversonAinda não há avaliações
- Metabolismo de LipídiosDocumento26 páginasMetabolismo de LipídiosAmanda Luíze100% (3)
- BioenergéticaDocumento44 páginasBioenergéticaFranciedna AlcobaçaAinda não há avaliações
- Da Antiguidade à Redescoberta das Leis de MendelNo EverandDa Antiguidade à Redescoberta das Leis de MendelAinda não há avaliações
- FT 2-Ob Materia Autotroficos Sem CorrecaoDocumento4 páginasFT 2-Ob Materia Autotroficos Sem Correcaojoaomanuel monteiroteixeiraAinda não há avaliações
- Apostila Modulo XI Biossintese de LipideosDocumento33 páginasApostila Modulo XI Biossintese de LipideosVinicius RiannAinda não há avaliações
- Ae Bg10 B PPT FotossinteseDocumento16 páginasAe Bg10 B PPT FotossinteseMarcus LimaAinda não há avaliações
- Bqi 100 - Aula 08 - Catabolismo de CarboidratosDocumento33 páginasBqi 100 - Aula 08 - Catabolismo de CarboidratosAlícia TerbutinoAinda não há avaliações
- AutotrofiaDocumento23 páginasAutotrofiaLucas Pimentel AlemãoAinda não há avaliações
- Mapa MetabolicoDocumento1 páginaMapa MetabolicoAlisson MahechaAinda não há avaliações
- Metabolismo e Catabolismo - BioquimicaDocumento28 páginasMetabolismo e Catabolismo - BioquimicaHermes Sales CamposAinda não há avaliações
- Bio Ficha Unidade 2Documento17 páginasBio Ficha Unidade 2Matilde RodriguesAinda não há avaliações
- Aula 5 - Fotossíntese - Reações de CarboxilaçãoDocumento35 páginasAula 5 - Fotossíntese - Reações de CarboxilaçãoLuana Rodrigues CastiglioniAinda não há avaliações
- SimuladoDocumento7 páginasSimuladoManu DenckAinda não há avaliações
- Ficha Fotossintese VI CorreçãoDocumento1 páginaFicha Fotossintese VI CorreçãoVladyslav BaranenkoAinda não há avaliações
- Bioquímica MetabólicaDocumento3 páginasBioquímica MetabólicaGiovanna FerreiraAinda não há avaliações
- LipídiosDocumento25 páginasLipídiosMaria Rita SalesAinda não há avaliações
- Bioquímica 2 - Síntese de Acídos GraxosDocumento10 páginasBioquímica 2 - Síntese de Acídos GraxosGiulliene SousaAinda não há avaliações
- Metabolismo Do ColesterolDocumento54 páginasMetabolismo Do ColesterolAlvezz MarcoAinda não há avaliações
- Morfofisiologia Vegetal: Faculdade de Ciências BiológicasDocumento60 páginasMorfofisiologia Vegetal: Faculdade de Ciências BiológicasgonjurAinda não há avaliações
- Ficha Transportes FotossinteseDocumento6 páginasFicha Transportes Fotossintesegranja2023Ainda não há avaliações
- 8Bioq2L - Biossintese de Acidos Gordos - 2023s2 - 231110 - 120207Documento56 páginas8Bioq2L - Biossintese de Acidos Gordos - 2023s2 - 231110 - 120207Emerson De AguiarAinda não há avaliações
- Etanol Lignocelulosicorg PDFDocumento102 páginasEtanol Lignocelulosicorg PDFRanteAinda não há avaliações
- Aula10abril - Discussao - Stojkov22 - NETs - Fisiologia - Fisiopatologia - Viasmetabolicas (1) EM PORTUGUESDocumento21 páginasAula10abril - Discussao - Stojkov22 - NETs - Fisiologia - Fisiopatologia - Viasmetabolicas (1) EM PORTUGUESJEFFERSON VINICIUS DA SILVAAinda não há avaliações
- NAD+ No Envelhecimento Mecanismos Moleculares eDocumento5 páginasNAD+ No Envelhecimento Mecanismos Moleculares eRodrigo AlvesAinda não há avaliações
- Prova - Fisiologia VegetalDocumento23 páginasProva - Fisiologia VegetalvanderlanAinda não há avaliações
- FTRevisões CC FotossínteseDocumento12 páginasFTRevisões CC FotossíntesePaula LopesAinda não há avaliações
- Fotossintese 2014Documento113 páginasFotossintese 2014Josenildo Alves da SilvaAinda não há avaliações
- Apostila - Aula 1Documento53 páginasApostila - Aula 1rayane thaynara santosAinda não há avaliações