Escolar Documentos
Profissional Documentos
Cultura Documentos
Cálculos Com A Lei de Proust
Enviado por
Pedro Luiz Cezar Campos0 notas0% acharam este documento útil (0 voto)
3 visualizações36 páginasTítulo original
Cálculos Com a Lei de Proust
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
PPTX, PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PPTX, PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
3 visualizações36 páginasCálculos Com A Lei de Proust
Enviado por
Pedro Luiz Cezar CamposDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PPTX, PDF, TXT ou leia online no Scribd
Você está na página 1de 36
Construção Molecular:
Símbolos, Massa Atômica, Número Atômico
UNIDADE TEMÁTICA: Matéria e Energia
HABILIDADES:(EM13CNT101) Analisar e representar, com ou sem o uso de dispositivos e de
aplicativos digitais específicos, as transformações e conservações em sistemas que envolvam
quantidade de matéria, de energia e de movimento para realizar previsões sobre seus
comportamentos em situações cotidianas e em processos produtivos que priorizem o
desenvolvimento sustentável, o uso consciente dos recursos naturais e a preservação da vida em
todas as suas formas.
OBJETOS DE CONHECIMENTO QUÍMICA: Símbolos, Massa Atômica, Número Atômico
Objetivos da aula:
•Compreender como as moléculas são formadas e sua
estrutura;
•Identificar os diferentes tipos de ligações químicas
presentes nas moléculas;
•Conhecer a geometria molecular e sua importância
na química.
Introdução: Nesta aula, vamos falar sobre construção
molecular. Para entender como as moléculas são formadas,
precisamos saber sobre as ligações químicas que as unem e
como a geometria molecular é importante na química.
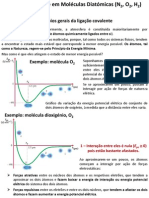
A ligação iônica ocorre quando há transferência de elétrons entre os átomos,
resultando em íons positivos e negativos que se atraem. Na ligação covalente,
os átomos compartilham elétrons para formar moléculas estáveis. Já na ligação
metálica, os átomos são mantidos juntos por uma nuvem de elétrons
compartilhados.
A estrutura da molécula é determinada pela geometria molecular. A geometria
molecular descreve a disposição tridimensional dos átomos em uma molécula
e é importante porque afeta as propriedades físicas e químicas da molécula,
como polaridade e reatividade.
Existem várias teorias e modelos que ajudam a explicar a geometria molecular.
Um desses modelos é o modelo VSEPR, que utiliza a repulsão entre os pares
de elétrons em torno do átomo central para prever a geometria molecular.
Substância – Nome : Quantificando Construção de Moléculas
H² - gás hidrogênio
H²O - água
Co² gás carbônico
Elemento Químico Número atômico Massa atômica (u) Substância qualquer Massa Molecular da
(Símbolo – Nome) que contenha este substância (u)
elemento
H – Hidrogênio 1 1 H2 O – água líquida (2 x 1) + 16 = 18
N – Nitrogênio 7 14 N2 – gás nitrogênio 2 x 14 = 28
O – Oxigênio 8 16 O2 – gás oxigênio 2 x 16 = 32
C – Carbono 6 12 CO2 – gás carbônico 12 + (2 x 16) = 12 +
32 = 44
He – Hélio 2 2 Um dos componente do (2 x 1) = 2 He – trata-
Sol, o gás hélio também se de um gás nobre
é usado para encher
bexigas ou cilindros de
ar
Fe – Ferro 26 56 FeSO4 – Sulfato 56 + 32 + (4 x 16) =
Ferroso 152
Ligações Químicas:
As ligações químicas correspondem à união dos átomos para a
formação das substâncias químicas.
Em outras palavras, as ligações químicas acontecem quando os
átomos dos elementos químicos se combinam uns com os outros
e os principais tipos são:
Regra do Octeto
A Teoria do Octeto, criada por Gilbert Newton Lewis
(1875-1946), químico estadunidense, e Walter Kossel
(1888-1956), físico alemão, surgiu a partir da observação
dos gases nobres e algumas características como, por
exemplo, a estabilidade dos elementos que apresentam 8
elétrons na Camada de Valência.
Portanto, a Teoria ou Regra do Octeto explica a
ocorrência das ligações químicas da seguinte forma:
“Muitos átomos apresentam estabilidade
eletrônica quando possuem 8 elétrons na camada
de valência (camada eletrônica mais externa).”
Para tanto, o átomo procura sua estabilidade doando ou compartilhando elétrons
com outros átomos, donde surgem as ligações químicas.
Vale lembrar que existem muitas exceções à Regra do Octeto, principalmente entre
os elementos de transição.
Tipos de Ligações Químicas
Ligação Iônica
Também chamada de ligação eletrovalente, esse tipo de ligação é realizada entre íons
(cátions e ânions), daí o termo "ligação iônica".
Para ocorrer uma ligação iônica os átomos envolvidos apresentam tendências opostas: um
átomo deve ter a capacidade de perder elétrons enquanto o outro tende a recebê-los.
Portanto, um ânion, de carga negativa, se une com um cátion, de carga positiva, formando um
composto iônico por meio da interação eletrostática existente entre eles.
Exemplo: Na+Cl- = NaCl (cloreto de sódio ou sal de cozinha). Nesse composto, o sódio (Na) doa
um elétron para o cloro (Cl) e se torna um cátion (carga positiva), enquanto o cloro torna-se
um ânion (carga negativa).
Ligação Covalente
Também chamada de ligação molecular, as ligações covalentes são
ligações em que ocorre o compartilhamento de elétrons para a
formação de moléculas estáveis, segundo a Teoria do Octeto;
diferentemente das ligações iônicas, em que há perda ou ganho de
elétrons.
Além disso, pares eletrônicos é o nome dado aos elétrons cedidos por
cada um dos núcleos, figurando o compartilhamento dos elétrons das
ligações covalentes.
Exemplo: H2O: H - O - H (molécula de água) formada por dois átomos de
hidrogênio e um de oxigênio. Cada traço corresponde a um par de
elétrons compartilhado formando uma molécula neutra, uma vez que
não há perda nem ganho de elétrons nesse tipo de ligação.
Ligação Covalente Dativa
Também chamada de ligação coordenada, ocorre quando um dos átomos
apresenta seu octeto completo, ou seja, oito elétrons na última camada e o outro,
para completar sua estabilidade eletrônica, necessita adquirir mais dois elétrons.
Esse tipo de ligação é representada por uma seta e um exemplo é o composto
dióxido de enxofre SO2: O = S → O.
Isso ocorre porque é estabelecida uma dupla ligação do enxofre com um dos
oxigênios para atingir sua estabilidade eletrônica e, além disso, o enxofre doa um
par de seus elétrons para o outro oxigênio para que ele fique com oito elétrons na
sua camada de valência.
Ligação Metálica
É a ligação que ocorre entre os metais, elementos
considerados eletropositivos e bons condutores térmico e
elétrico. Para tanto, alguns metais perdem elétrons da
sua última camada chamados de "elétrons livres"
formando assim, os cátions.
A partir disso, os elétrons liberados na ligação metálica
formam uma "nuvem eletrônica", também chamada de
"mar de elétrons" que produz uma força fazendo com
que os átomos do metal permaneçam unidos.
Geometria molecular: definição e exemplos
A geometria molecular é a forma com que cada molécula se
arranja no espaço. Confira mais definições e exemplos!
A geometria molecular é a forma com que cada molécula se arranja no espaço. As
moléculas não são planas, mas têm forma e volume!
A geometria de cada molécula depende do número de ligações que o átomo central faz. Em
resumo, o átomo central é aquele que faz o maior número de ligações em uma molécula.
Antes de mais nada, para descobrirmos a geometria de uma molécula, precisamos
conhecer a Teoria da Repulsão Eletrônica da Camada de Valência (em inglês, Valence Shell
Electron Pair Repulsion Theory, VSEPR). Parece difícil, mas não é!
A VSEPR diz que todos os elétrons da camada de valência repelem uns aos outros. Essa
repulsão acontece porque todos eles têm carga negativa, e dois corpos não ocupam o
mesmo lugar no espaço. Consequentemente, cada nuvem eletrônica (a região do espaço
onde está cada par de elétrons) vai estar o mais longe possível uma da outra, em torno do
átomo central.
A nuvem eletrônica é a região do espaço ocupada por um par de elétrons. Pode ser um
par isolado ou uma ligação química.
Por exemplo, sabemos que a molécula de amônia (NH3) tem 4 nuvens eletrônicas: 3
ligações químicas N-H e um par isolado sobre o átomo de nitrogênio. Em seguida, na
esquerda, representamos as 4 nuvens eletrônicas da amônia:
Note que o par eletrônico também ocupa lugar no espaço! Por isso a
molécula de amônia não é plana, e sim, tridimensional. Assim, essa
organização espacial é a que permite maior distância entre todas as nuvens
eletrônicas, sejam ligações químicas ou pares isolados.
Tipos de geometria molecular
A geometria da molécula depende do número de nuvens eletrônicas ao redor do átomo
central. Independente se são pares isolados ou ligações químicas. Por isso, vamos analisar as
geometrias de acordo com o número de átomos na molécula, sempre relacionando com as
nuvens eletrônicas.
Geometria linear
A geometria mais simples é a linear. Dessa forma, podemos encontrar geometrias lineares em
moléculas com 2 ou 3 átomos.
Quando as moléculas só têm dois átomos, é impossível que a geometria seja diferente! Não
existe átomo central, então os dois átomos só podem estar em linha reta um do outro.
A estrutura molecular se refere à organização dos átomos em uma molécula. Essa
organização é determinada pelas ligações químicas presentes entre os átomos, bem como
pela geometria molecular resultante.
As ligações químicas são responsáveis por unir os átomos na molécula. Existem três tipos
principais de ligações químicas: iônica, covalente e metálica.
Na ligação iônica, os elétrons são transferidos de um átomo para outro, formando íons com
cargas opostas que se atraem e se unem para formar a molécula. Um exemplo comum é o
cloreto de sódio (NaCl), que é formado pela união de íons sódio (Na+) e cloreto (Cl-).
Na ligação covalente, os átomos compartilham elétrons para formar uma molécula estável.
Existem duas variações principais de ligação covalente: a ligação covalente simples e a
ligação covalente dupla. Um exemplo de ligação covalente simples é a molécula de água
(H2O), que é formada pela ligação entre um átomo de oxigênio e dois átomos de hidrogênio.
Já um exemplo de ligação covalente dupla é a molécula de gás oxigênio (O2), que é formada
pela ligação entre dois átomos de oxigênio.
Por fim, a ligação metálica é caracterizada por átomos de metais que compartilham uma
nuvem de elétrons em comum. Essa nuvem de elétrons é responsável por manter os átomos
unidos na molécula. Um exemplo de molécula formada por ligação metálica é o ouro (Au),
que é composto por átomos de ouro que se unem através da ligação metálica
Além das ligações químicas, a geometria molecular é um aspecto importante da
estrutura molecular. A geometria molecular se refere à disposição tridimensional
dos átomos na molécula. Ela é determinada pela quantidade e posição dos pares
de elétrons em torno do átomo central.
Um exemplo de molécula com geometria molecular importante é a amônia (NH3).
A amônia tem uma geometria molecular trigonal piramidal, com um átomo de
nitrogênio no centro e três átomos de hidrogênio ao redor. Essa geometria
molecular é importante porque torna a molécula polar, o que a torna solúvel em
água.
Em resumo, a estrutura molecular é composta pelas ligações químicas e pela
geometria molecular presentes na molécula. Ela é essencial para entender as
propriedades físicas e químicas das substâncias.
Existem muitos exemplos de geometria molecular que podem ajudar a entender como os átomos estão
organizados em uma molécula.
Aqui estão alguns exemplos:
1.Geometria molecular linear: a molécula de dióxido de carbono (CO2) tem uma geometria molecular linear. Isso
significa que os átomos de carbono e oxigênio estão alinhados em uma linha reta. Essa geometria é possível
porque o átomo de carbono tem dois pares de elétrons não compartilhados ao redor de si, o que faz com que os
átomos de oxigênio sejam posicionados em extremidades opostas da molécula.
2.Geometria molecular angular: a molécula de água (H2O) tem uma geometria molecular angular. Isso ocorre
porque o átomo de oxigênio no centro tem dois pares de elétrons não compartilhados ao redor dele, o que coloca
os dois átomos de hidrogênio em uma posição angular em relação ao átomo de oxigênio.
3.Geometria molecular tetraédrica: a molécula de metano (CH4) tem uma geometria molecular tetraédrica. Isso
ocorre porque os quatro átomos de hidrogênio estão posicionados em torno do átomo de carbono central de
forma que cada átomo de hidrogênio está na extremidade de um tetraedro.
4.Geometria molecular trigonal plana: a molécula de cloreto de boro (BCl3) tem uma geometria molecular trigonal
plana. Isso ocorre porque o átomo de boro central tem apenas três pares de elétrons compartilhados ao seu redor,
o que coloca os átomos de cloro em uma posição plana ao redor dele.
5.Geometria molecular piramidal: a molécula de amônia (NH3) tem uma geometria molecular piramidal. Isso
ocorre porque o átomo de nitrogênio central tem um par de elétrons não compartilhados, além dos três átomos
de hidrogênio, que são posicionados em uma forma piramidal ao redor do átomo de nitrogênio.
Esses são apenas alguns exemplos de
geometria molecular. É importante lembrar
que a geometria molecular é determinada
pelos pares de elétrons ao redor do átomo
central, e pode afetar as propriedades
químicas e físicas da molécula.
Conclusão:
Nesta aula, aprendemos como as moléculas são
formadas através de diferentes tipos de ligações
químicas e como a geometria molecular é importante
na química. Espero que tenham entendido bem e
estejam preparados para aplicar esse conhecimento
em suas próximas atividades. Até a próxima aula!
Questionário:
Exercício 1: Qual é a geometria molecular da molécula de água (H2O)?
a) Linear
b) Trigonal plana
c) Tetraédrica
d) Angular
Exercício 2: Qual é a geometria molecular da molécula de
amônia (NH3)?
a) Linear
b) Trigonal plana
c) Piramidal
d) Angular
Exercício 3: Qual é a geometria molecular da molécula de metano (CH4)?
a) Linear
b) Trigonal plana
c) Tetraédrica
d) Piramidal
Exercício 4: Qual é a geometria molecular da molécula de dióxido de carbono (CO2)?
a) Linear
b) Trigonal plana
c) Tetraédrica
d) Angular
Exercício 5: Qual é a geometria molecular da molécula de dióxido de enxofre (SO2)?
a) Linear
b) Trigonal plana
c) Tetraédrica
d) Angular
Exercício 6: Qual é a geometria molecular da molécula de dióxido de enxofre (SO3)?
b) Linear
c) b) Trigonal plana
c) Tetraédrica
d) Piramidal
Exercício 7: Qual é a geometria molecular da molécula de metanol (CH3OH)?
a) Linear
b) Trigonal plana
c) Piramidal
d) Angular
Exercício 8: Qual é a geometria molecular da molécula de ácido clorídrico (HCl)?
a) Linear
b) Trigonal plana
c) Piramidal
d) Angular
Exercício 9: Qual é a geometria molecular da molécula de dióxido de nitrogênio (NO2)?
a) Linear
b) Trigonal plana
c) Tetraédrica
d) Angular
Exercício 10: Qual é a geometria molecular da molécula de metilamina (CH3NH2)?
b) Linear
b) Trigonal plana
c) Piramidal
d) Angular
Você também pode gostar
- Série Didática para o Apoio a Formação de Professores de Química: Volume 2: MoléculasNo EverandSérie Didática para o Apoio a Formação de Professores de Química: Volume 2: MoléculasNota: 5 de 5 estrelas5/5 (1)
- Simetria Molecular III: Série Didática para o apoio a formação de professores de QuímicaNo EverandSimetria Molecular III: Série Didática para o apoio a formação de professores de QuímicaAinda não há avaliações
- Trabalho - Ligações QuímicasDocumento25 páginasTrabalho - Ligações QuímicascarolineaugustaAinda não há avaliações
- Estrutura MolecularDocumento336 páginasEstrutura MolecularwarleyAinda não há avaliações
- Ligações Químicas e A Estrutura Das MoléculasDocumento68 páginasLigações Químicas e A Estrutura Das MoléculasRaquel De Deus FreiAinda não há avaliações
- Ligações QuímicasDocumento19 páginasLigações QuímicasTatianyAinda não há avaliações
- Compostos de Coordenação - Parte 1Documento43 páginasCompostos de Coordenação - Parte 1Náthaly CoelhoAinda não há avaliações
- Escola Estadual de Ensino Médio Demétrio Ribeiro: QuímicaDocumento92 páginasEscola Estadual de Ensino Médio Demétrio Ribeiro: QuímicaMerlohnAinda não há avaliações
- Estudos Das Propriedades Químicas Dos Sais Duplos de Compostos Complexos PDFDocumento16 páginasEstudos Das Propriedades Químicas Dos Sais Duplos de Compostos Complexos PDFMargarita CaceresAinda não há avaliações
- Ligacao CovalenteDocumento12 páginasLigacao CovalenterodrigomenegazgoularAinda não há avaliações
- Unid 1Documento21 páginasUnid 1danniamatosAinda não há avaliações
- Moléculas Na Troposfera IDocumento14 páginasMoléculas Na Troposfera IpccsimoesAinda não há avaliações
- 2 Avaliação - Dissertação - 2 Chamada - Emilia - Inorganica 2Documento28 páginas2 Avaliação - Dissertação - 2 Chamada - Emilia - Inorganica 2Emília SantosAinda não há avaliações
- Apostila Ligação QuímicaDocumento8 páginasApostila Ligação Químicaerickcarmo725Ainda não há avaliações
- Ligação e Estrutura Molecular - Parte1 PDFDocumento31 páginasLigação e Estrutura Molecular - Parte1 PDFJunior DuarteAinda não há avaliações
- Capítulo III Ligações QuímicasDocumento70 páginasCapítulo III Ligações QuímicasPedro SilvaAinda não há avaliações
- Introdução À Química OrgânicaDocumento47 páginasIntrodução À Química OrgânicaThiago Terra NovaAinda não há avaliações
- Texto de Apoio 10 Classe 2Documento32 páginasTexto de Apoio 10 Classe 2Julieta MuandimoAinda não há avaliações
- Apresentação 1 - Compostos de Coordenação e Complexos Metálicos - 2020 PDFDocumento93 páginasApresentação 1 - Compostos de Coordenação e Complexos Metálicos - 2020 PDFDany CristinaAinda não há avaliações
- Ligações Químicas: Nome: Rafaela CardosoDocumento1 páginaLigações Químicas: Nome: Rafaela CardosoRafaelaAinda não há avaliações
- Estudo Da MateriaDocumento9 páginasEstudo Da MateriaMarcos ErikeAinda não há avaliações
- Ligações QuímicasDocumento7 páginasLigações QuímicasLobato PauloAinda não há avaliações
- Roteiro de Estudo - Ligação Covalente 25 de Ago. 2021Documento4 páginasRoteiro de Estudo - Ligação Covalente 25 de Ago. 2021Romario Silva SilvaAinda não há avaliações
- Teoria Da Ligação de Valência (RPECV)Documento16 páginasTeoria Da Ligação de Valência (RPECV)TatianyAinda não há avaliações
- QG 2Documento60 páginasQG 2Ana CarolinaAinda não há avaliações
- Edil Química Orgânica Unidade 1 - Teoria EstruturalDocumento132 páginasEdil Química Orgânica Unidade 1 - Teoria Estruturalleticia trindadeAinda não há avaliações
- 1 - Introdução A Química Organica (Slide)Documento16 páginas1 - Introdução A Química Organica (Slide)jojojAinda não há avaliações
- FICHA QUIMICA 11a Classe 2021 2 TrimestreDocumento7 páginasFICHA QUIMICA 11a Classe 2021 2 Trimestreabel manuel chico oleceAinda não há avaliações
- Aula 6 - Ligações QuímicasDocumento61 páginasAula 6 - Ligações QuímicasAngel60% (5)
- Universidade Estadual de Feira de SantanaDocumento11 páginasUniversidade Estadual de Feira de SantanaEdmondDantesAinda não há avaliações
- Ligacoes Quimicas2Documento52 páginasLigacoes Quimicas2JOSE DINIZ DOS SANTOS JUNIORAinda não há avaliações
- Aula - 4 - Ligações Químicas e GeometriaDocumento65 páginasAula - 4 - Ligações Químicas e GeometriaLucas FreitasAinda não há avaliações
- Estudo DirigidoDocumento25 páginasEstudo DirigidoCarlos SilvaAinda não há avaliações
- MoleculeDocumento11 páginasMoleculePrincepe NamorAinda não há avaliações
- Compostos ComplexosDocumento9 páginasCompostos ComplexosAlbino José JoaquimAinda não há avaliações
- Plano de Aula Ligações QuimicasDocumento10 páginasPlano de Aula Ligações QuimicasHelena Brites RodriguesAinda não há avaliações
- Uma Breve História Da Química de CoordenaçãoDocumento22 páginasUma Breve História Da Química de CoordenaçãoDharma InitiativeAinda não há avaliações
- ATIVIDADeDocumento4 páginasATIVIDADePablo ViniciusAinda não há avaliações
- Matéria Ligações GeometriaDocumento18 páginasMatéria Ligações GeometriaPaula SantosAinda não há avaliações
- Ligações Químicas - Prof. Sérgio MatosDocumento5 páginasLigações Químicas - Prof. Sérgio MatosÉrica RamosAinda não há avaliações
- Ligações QuímicasDocumento57 páginasLigações Químicasnezukokamado635Ainda não há avaliações
- Química Inorgânica 1Documento43 páginasQuímica Inorgânica 1Daniele ZafraAinda não há avaliações
- Aula+6+-+Ligações+Quimicas Fabiana+AlmeidaDocumento49 páginasAula+6+-+Ligações+Quimicas Fabiana+AlmeidaBené JúniorAinda não há avaliações
- CAPITULO 1.qmcorDocumento78 páginasCAPITULO 1.qmcorAgustín SilesAinda não há avaliações
- Ligacoes QuimicasDocumento7 páginasLigacoes QuimicasLúbio LuisAinda não há avaliações
- Material Complementar Unidade 4 Quimica Organica Lig Quim HibridizacaoDocumento28 páginasMaterial Complementar Unidade 4 Quimica Organica Lig Quim HibridizacaoepambarbaAinda não há avaliações
- Geometria MolecularDocumento54 páginasGeometria MolecularJoão VíctorAinda não há avaliações
- Ligaes QumicasDocumento3 páginasLigaes QumicasBrendaAinda não há avaliações
- Modelos AtômicosDocumento11 páginasModelos AtômicosTiagodepdAinda não há avaliações
- Compostos ComplexosDocumento14 páginasCompostos ComplexosAlbino José JoaquimAinda não há avaliações
- Respostas de Química Lista 1Documento9 páginasRespostas de Química Lista 1Matheus MartinsAinda não há avaliações
- Aula03 - Ligações QuímicasDocumento39 páginasAula03 - Ligações QuímicastalissaAinda não há avaliações
- RESUMO Ligações Químicas 04junhoDocumento3 páginasRESUMO Ligações Químicas 04junhoDANIELE DANNYAinda não há avaliações
- Resumo - QuímicaDocumento7 páginasResumo - QuímicaLETICIA CAUANE SANTOS VITALAinda não há avaliações
- Ligações QuímicasDocumento63 páginasLigações QuímicaswilliamAinda não há avaliações
- Aula3ligações Químicas QGDocumento69 páginasAula3ligações Químicas QGErika BuzeliAinda não há avaliações
- Aula 2 Ligações QuimicasDocumento16 páginasAula 2 Ligações QuimicasJanaina Rigotti KubiszeskiAinda não há avaliações
- 4 - Ativ. Ciencias 9o AnoDocumento13 páginas4 - Ativ. Ciencias 9o AnoAdriana JesusAinda não há avaliações
- Ligacao QuimicaDocumento12 páginasLigacao QuimicagabidamasAinda não há avaliações
- Enlaces Químicos Da Matéria 171119Documento18 páginasEnlaces Químicos Da Matéria 171119marcoAinda não há avaliações
- Melhore A Resistência Com AlongamentoDocumento2 páginasMelhore A Resistência Com AlongamentoRac A BruxaAinda não há avaliações
- Proc - Sejus - Tortura Psma IIDocumento202 páginasProc - Sejus - Tortura Psma IIAmafavv AmafavvAinda não há avaliações
- Como Calcular o Stock de Segurança de Um ProdutoDocumento3 páginasComo Calcular o Stock de Segurança de Um Produtotozenarciso3804Ainda não há avaliações
- Apostila - História e Peculiaridades Do Método Pilates, Uma Abordagem InterdisciplinarDocumento44 páginasApostila - História e Peculiaridades Do Método Pilates, Uma Abordagem InterdisciplinarPedala FormosaAinda não há avaliações
- Bula Herbicida DontorDocumento6 páginasBula Herbicida DontormarcusdelbelAinda não há avaliações
- AULA 9 - Texto - Citoesqueleto e Movimentos CelularesDocumento2 páginasAULA 9 - Texto - Citoesqueleto e Movimentos CelularesKeyla SilvaAinda não há avaliações
- Apostila de NeurologiaDocumento237 páginasApostila de NeurologiaRalf Peixoto100% (1)
- Ginástica Rítmica - Masculina e Componentes de DificuldadeDocumento36 páginasGinástica Rítmica - Masculina e Componentes de Dificuldadematheus henriqueAinda não há avaliações
- Identificar As Áreas Cerebrais de Controle RespiratórioDocumento16 páginasIdentificar As Áreas Cerebrais de Controle RespiratórioGustavo CamposAinda não há avaliações
- Introducao A Biblioteconomia e Ciencia Da InformacaoDocumento5 páginasIntroducao A Biblioteconomia e Ciencia Da InformacaoWeilaAinda não há avaliações
- 2 - Roteiro de Projetos FAPEGDocumento3 páginas2 - Roteiro de Projetos FAPEGguidhuAinda não há avaliações
- Tabela Dieta PontosDocumento20 páginasTabela Dieta PontosJosi TeixeiraAinda não há avaliações
- Purê de BatatasDocumento2 páginasPurê de BatatasVagner Marinho100% (1)
- IT 57 Munições Gold HexDocumento2 páginasIT 57 Munições Gold HexLucius bemAinda não há avaliações
- Sequencia DidaticaDocumento5 páginasSequencia DidaticaIcaro Benevides100% (2)
- Modulo IV Via em CurvaDocumento45 páginasModulo IV Via em CurvafilipeAinda não há avaliações
- Monografia FinalDocumento84 páginasMonografia FinalJéssica de OliveiraAinda não há avaliações
- Genetica IiDocumento11 páginasGenetica IiAmaralAinda não há avaliações
- 97 Redações Modelo Enem: Ebook PARA 2022Documento6 páginas97 Redações Modelo Enem: Ebook PARA 2022Neuzi Rezende100% (1)
- Criado Gratuitamente Com: Ebookmaker - AiDocumento29 páginasCriado Gratuitamente Com: Ebookmaker - Ailui532016Ainda não há avaliações
- DINÂMICADocumento5 páginasDINÂMICALucas AppeltAinda não há avaliações
- Plano de Aula 1º e 2º Ano ModeloDocumento3 páginasPlano de Aula 1º e 2º Ano Modeloraiane santosAinda não há avaliações
- Textos Do Missal para Votação - 59 AG - FINALDocumento133 páginasTextos Do Missal para Votação - 59 AG - FINALEverthOliveiraAinda não há avaliações
- AutoCad - Como Organizar Blocos e Inserir em Qualquer ProjetoDocumento7 páginasAutoCad - Como Organizar Blocos e Inserir em Qualquer Projetoleandro_rafaelAinda não há avaliações
- Dicionario RomaniDocumento9 páginasDicionario RomaniLuã Venancio75% (8)
- Tecn - Labor - Gastronomia FURBDocumento7 páginasTecn - Labor - Gastronomia FURBKimAinda não há avaliações
- Elenco Bluebook 805Documento652 páginasElenco Bluebook 805damminsonAinda não há avaliações
- Atividade de Recuperação Da Aprendizagem.Documento2 páginasAtividade de Recuperação Da Aprendizagem.VALQUIRIA FERREIRA CAMPOSAinda não há avaliações
- Requerimento A Interpor Recurso de Agravo Com Pedido de Efeito Suspensivo 2020 11-04-06!25!49 479Documento1 páginaRequerimento A Interpor Recurso de Agravo Com Pedido de Efeito Suspensivo 2020 11-04-06!25!49 479Qualbeck, S.A.Ainda não há avaliações
- Receitas PDFDocumento4 páginasReceitas PDFsuellenbnasto77Ainda não há avaliações