Escolar Documentos
Profissional Documentos
Cultura Documentos
Pectin As Es
Pectin As Es
Enviado por
Mah NovaesTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Pectin As Es
Pectin As Es
Enviado por
Mah NovaesDireitos autorais:
Formatos disponíveis
Quim. Nova, Vol. 30, No.
2, 388-394, 2007
Reviso
PECTINASES: APLICAES INDUSTRIAIS E PERSPECTIVAS
Mariana Uenojo* e Glaucia Maria Pastore
Departamento de Cincia de Alimentos, Faculdade de Engenharia de Alimentos, Universidade Estadual de Campinas, CP 6121,
13083-862 Campinas SP, Brasil
Recebido em 15/8/05; aceito em 16/5/06; publicado na web em 19/1/07
PECTINOLYTIC ENZYMES. INDUSTRIAL APPLICATIONS AND FUTURE PERSPECTIVES. Pectic substances are structural
heteropolysaccharides that occur in the middle lamellae and primary cell walls of higher plants. They are composed of partially methylesterified galacturonic acid residues linked by -1, 4-glycosidic bonds. Pectinolytic enzymes are complex enzymes that degrade
pectic polymers and there are several classes of enzymes, which include pectin esterases, pectin and pectate lyases and
polygalacturonases. Plants, filamentous fungi, bacteria and yeasts are able to produce pectinases. In the industrial world, pectinases
are used in fruit juice clarification, in the production of wine, in the extraction of olive oil, fiber degumming and fermentation of
tea, coffee and cocoa.
Keywords: pectic substances; pectinolytic enzymes; industrial applications.
INTRODUO
As pectinases formam um grupo de enzimas que degradam substncias pcticas, hidrolisando ligaes glicosdicas ao longo da cadeia carbnica. Podem ser despolimerizantes ou desesterificantes e
so produzidas por plantas, fungos filamentosos, bactrias e leveduras. Algumas das aplicaes destas enzimas nas indstrias de alimentos incluem amadurecimento de frutas, clarificao e reduo
de viscosidade em sucos de frutas, tratamento preliminar do suco de
uva para indstrias vincolas, extrao de polpa de tomate, fermentao de ch e chocolate, tratamento de resduos vegetais, degomagem
de fibras nas indstrias txtil e de papel, nutrio animal, enriquecimento protico de alimentos infantis e extrao de leos.
HISTRICO
As pectinases foram algumas das primeiras enzimas a serem utilizadas comercialmente nas preparaes de vinhos e sucos de frutas ao
redor de 19301,2 e somente a partir de 1960, quando os estudos sobre a
natureza qumica de tecidos vegetais se tornaram mais aparentes,
que os cientistas comearam a utilizar as enzimas mais eficientemente2. Durante as duas ltimas dcadas, o uso de celulases, hemicelulases
e pectinases tm aumentado consideravelmente, especialmente nas
indstrias de alimentos, bebidas e vinhos, txtil e de papel e celulose1.
Diversas companhias na Europa (Novo Nordisk, Miles KaliChemie, Swiss Ferment Co., Novartis, Roche), Estados Unidos
(Miles Laboratories, Rohm and Raas Co.) e no Japo (Kikkoman
Shoyu Co.) produzem pectinases e preparaes comerciais de
pectinases1,3,4. Atualmente, essas enzimas correspondem a cerca
de 25% do mercado mundial de enzimas5. O valor estimado de
vendas em 1995 foi de US$ 1 bilho, dos quais US$ 75 milhes
somente com pectinases2,3. Para 2005, o valor de vendas esperado
para a indstria de enzimas de US$ 1,7 a 2 bilhes2.
camada de material adesivo extracelular entre as paredes primrias de
clulas de vegetais superiores5-7. Quimicamente, so um complexo
coloidal de polissacardeos cidos, composto de resduos de cido
galacturnico unidos por ligaes -1,4, parcialmente esterificados
por grupos metil ster2,3,8,9 e parcial ou completamente neutralizadas
por uma ou mais bases (ons sdio, potssio ou amnio)2,4,5.
Ao contrrio das protenas, lipdeos e cidos nuclicos, e sendo
polissacardeos, as substncias pcticas no possuem massa
molecular definida, variando de 25 a 360 kDa4.
A Sociedade Americana de Qumica (American Chemical
Society) classificou as substncias pcticas em: protopectina, cido
pectnico, cido pctico e pectina, sendo estes trs ltimos total ou
parcialmente solveis em gua2,6.
Protopectina insolvel em gua, a forma nativa unida com
outros constituintes das clulas vegetais10 e, em condies de hidrlise
restrita, produzem cidos pectnicos ou pectina2,4,5,11. cido pctico
uma designao aplicada a substncias pcticas compostas de cido
poligalacturnico coloidal2,4, onde os grupos carboxilas esto essencialmente livres de grupos metil ster2,4,10 e seus sais so pectatos neutros ou cidos5,11. cido pectnico um grupo de compostos contendo
cido poligalacturnico coloidal com poucos grupos metil ster4,5,10.
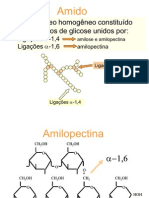
O termo geral pectina (Figura 1) designa cidos pectnicos solveis em gua, com grau varivel de grupos metil ster e um grau
de neutralizao capaz de formar gel com acares e cidos em
condies adequadas4. Consiste em uma estrutura de ligaes axiais
de unidades de cido -1, 4-D-galacturnico e contm molculas
de L-ramnose, arabinose, galactose e xilose como correntes laterais3,6,12-14. Pectinas com alto teor de metoxilas (acima de 50%)
so freqentemente denominadas apenas pectinas e tm poder
de geleificao na presena de acares e cidos, enquanto que a
geleificao de pectinas com baixo teor de metoxilao possvel
na ausncia de acares e na presena de alguns ons metlicos4,13.
SUBSTNCIAS PCTICAS
Substncias pcticas so macromolculas glicosdicas de alto peso
molecular que formam o maior componente da lamela mdia, uma fina
*e-mail: mariu@fea.unicamp.br
Figura 1. Estrutura primria de uma molcula de pectina. No esto includos
resduos de ramnose, galactose, arabinose e xilose. Adaptado da ref. 6
Vol. 30, No. 2
Pectinases
ENZIMAS PECTINOLTICAS
As substncias pcticas podem ser degradadas por enzimas
pectinolticas, produzidas em diferentes combinaes pelas plantas e por microrganismos como fungos, leveduras e bactrias12,15,16.
So muito utilizadas nas indstrias de sucos de frutas para reduzir
viscosidade e melhorar e aumentar a eficincia de filtrao e de
clarificao3,7,13,17-24; no tratamento preliminar da uva em indstrias
vincolas; na macerao, liquefao e extrao de tecidos vegetais;
na fermentao de ch, caf e cacau7,12; para melhorar a extrao
de leos vegetais12,21-24; na extrao de polpa de tomate7 e no tratamento e degomagem de fibras naturais para as indstrias txtil e de
papel7,18,21-24.
As pectinases tambm so utilizadas para reduir o de amargor
excessivo em cascas de citrus, restaurar o aroma perdido durante
secagem e melhorar a firmeza de pssego e picles processados. A
infuso de pectinase e -glicosidase aumenta o aroma e as substncias volteis de frutas e vegetais, aumenta a quantidade de agentes
antioxidantes em leo de oliva extravirgem e reduz a induo ao
rano1, alm de outras aplicaes (Tabela 1).
A habilidade para sintetizar enzimas pectinolticas muito comum entre os grupos de microrganismos (Tabela 2), mas os fungos
so os preferidos em escala industrial, pois cerca de 90% das enzimas
produzidas podem ser secretadas no meio de cultura23.
A sntese destas enzimas sofre influncia dos componentes do
meio de cultura, particularmente da fonte de carbono, presena de
indutores (pectina e derivados)3,23 e das condies de cultivo, como
389
pH, temperatura, aerao, agitao e tempo de incubao20. Com
relao s tcnicas de fermentao, a fermentao em estado slido geralmente preferida por permitir a produo de enzimas brutas mais concentradas e, conseqentemente, com menores custos
de extrao e purificao 25,26. Substratos tpicos so resduos
agroindustriais, como cascas de frutas ctricas, bagao de beterraba doce e extratos de farelo de trigo23,27, por serem fontes de energia alternativa para crescimento e metabolismo e por estarem abundantemente disponveis18,26,27.
A classificao das enzimas pcticas est baseada no ataque ao
esqueleto galacturnico6, pela preferncia de substrato (pectina,
cido pctico ou protopectina), ao por transeliminao ou hidrlise
e por clivagem randmica (enzima endo-, liqidificante ou
despolimerizante) ou terminal (enzima exo- ou sacarificante)2,4,22,26.
Existem basicamente trs tipos de pectinases (Figura 2): pectina
esterase (desesterificante ou desmetoxilante) remove os grupos metil
ster; as despolimerizantes (incluem as enzimas hidrolticas e as
liases) catalisam a clivagem das ligaes glicosdicas das substncias pcticas e, as protopectinases que solubilizam protopectina
para formar pectina4,5. Estas enzimas foram classificadas e nomeadas de acordo com a Enzyme Comission (EC), segundo as recomendaes da IUPAC-IUB3,5 (Tabela 3).
Enzima desmetoxilante ou desesterificante
A pectina esterase (polimetilgalacturonato esterase, PMGE)
catalisa a hidrlise dos grupos metil ster da pectina, liberando metanol
Tabela 1. Funes e aplicaes das pectinases na indstria de alimentos e de vinhos
ENZIMA
FUNO
APLICAO
Enzimas de macerao
(pectinases, celulases e hemicelulases).
Hidrlise de pectina solvel e de componentes
de paredes celulares, diminuio de viscosidade
e manuteno de textura de sucos de frutas.
Melhoramento na extrao de sucos de frutas e
de leo de oliva, liberao de aromas, enzimas,
protenas, polissacardeos, amido e gar.
Pectinase cida e termo-estvel com
poligalacturonase, pectina esterase e
pectina transeliminase.
Rpida diminuio de viscosidade e
quebra dos tecidos vegetais.
Melhora o rompimento da fruta e aumenta
a extrao de pigmentos de cor.
Poligalacturonase com alta atividade
de pr-pectinase e baixa celulase.
Hidrlise parcial de pr-pectina.
Produo de purs com alta viscosidade.
Poligalacturonase e pectina transeliminase com baixa atividade de pectina
esterase e hemicelulase.
Hidrlise parcial de pr-pectina e de pectina
solvel em fragmentos de tamanho mdio,
formao de precipitado e remoo de hidrocolides de celulose.
Produo de sucos vegetais no clarificados
de baixa viscosidade.
Poligalacturonase, pectina transeliminase e hemicelulase.
Hidrlise completa de pectina e de
polissacardeos ramificados.
Clarificao de sucos de frutas.
Pectinase e -glicosidase.
Infuso de pectinase e glicosidase para facilitar
Alterao das propriedades sensoriais de
o descascamento e melhorar a firmeza de frutas e frutas e vegetais.
vegetais.
Pectina esterase com atividade de
poligalacturonase e de pectina liase.
Processamento de frutas.
Produo de ketchup de alta qualidade e de
polpas de frutas.
Pectina esterase.
Desesterificao e geleificao de pectina.
Melhoramento na clarificao de cidra.
Enzimas de macerao
(pectinases, celulases e hemicelulases).
Hidrlise de polissacardeos das paredes
celulares vegetais.
Melhoramento da macerao da casca e
extrao de pigmentos de cor de uvas, qualidade,
estabilidade, filtrao e clarificao de vinhos.
Adaptada da ref. 1
390
Uenojo e Pastore
Quim. Nova
Tabela 2. Ocorrncia de enzimas pcticas em alguns microrganismos
MICRORGANISMO
Aspergillus niger
Aspergillus sojae
Aspergillus saito
Bacillus sp
Bacillus subtilis
Bacillus polymixa
Bacillus pumilus
Bacillus sphaericus
Bacillus stearothermophilus
Cercocpora arachidicola
Cephalosporium sp
Clostridium multifermentans
Clostridium aurantibutyricum
Clostridium felsineum
Cytophaga johnsonii
Cytophaga deprimata
Cytophaga albogilva
Erwinia aroideae
Erwinia carotovora
Fusarium culmorum
Fusarium oxysporum
Fusarium solani
Penicillium expansum
Penicillium italicum
Penicillium digitatum
Penicillium chrysogenum
Pseudomonas sp
Pseudomonas fluorescens
Pseudomonas marginalis
Rhizoctania fragariae
Rhizoctania solani
Rhizopus arrhizus
Streptomyces nitrosporeus
Trichoderma koningii
Trichoderma pseudokoningii
Xanthomonas sp
Xanthomonas campestris
Xanthomonas cyanopsidis
PMGE
PG
PGL
PMG
PMGL
+
+
OG
OGL
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
PMGE: pectina esterase, PG: poligalacturonase, PGL: poligalacturonato liase, PMG: polimetilgalacturonase, PMGL: polimetilgalacturonato
liase, OG: oligogalacturonase, OGL: oligogalacturondeo liase. Adaptada das refs. 4, 5, 14 e 28
Tabela 3. Classificao das enzimas pcticas
Tipo de pectinase
Nome sugerido pela EC
Sigla
Nome comum
Nmero EC
Desesterificante
Hidrolase
polimetilgalacturonase esterase
endo poligalacturonase
exo poligalacturonase 1
exo poligalacturonase 2
endo polimetilgalacturonase
exo polimetilgalacturonase
endo poligalacturonase liase
exo poligalacturonase liase
endo polimetilgalacturonato liase
exo polimetilgalacturonato liase
PMGE
endo-PG
exo-PG 1
exo-PG 2
endo-PMG
exo-PMG
endo-PGL
exo-PGL
endo-PMGL
exo-PMGL
pectina esterase
poligalacturonase
poligalacturonase
poligalacturonase
pectina hidrolase
pectina hidrolase
pectato liase
pectato liase
pectina liase
pectina liase
3.1.1.11
3.2.1.15
3.2.1.67
3.2.1.82
Liase
4.2.2.2
4.2.2.9
4.2.2.10
Pectinases que atuam sobre oligogalacturonatos no esto includas na tabela porque no so muito abundantes e possuem pouco interesse
industrial na degradao de pectina. Adaptada das refs. 5 e 6
Vol. 30, No. 2
Pectinases
391
Liases
As liases, tambm chamadas transeliminases, rompem ligaes
glicosdicas resultando em galacturondeos com uma ligao insaturada
entre os carbonos 4 e 5 do final no redutor do cido galacturnico
formado5,28 e incluem as pectina liases e as pectato liases.
Pectina liase (polimetilgalacturnato liase, PMGL) catalisa a eliminao entre dois resduos de cido galacturnico mais ou menos esterificados. Quebram as ligaes por transeliminao do hidrognio dos carbonos das posies 4 e 5 da poro aglicona do
substrato (pectina)10,15,32 de modo endo- ou exo-. O pH timo em
torno de 5,533 e temperatura tima entre 40 e 50 C5.
Pectato liase (poligalacturonato liase, PGL) catalisa a clivagem
de ligaes -1,4 de cido pctico de modo endo- ou exo- por transeliminao28, requer Ca2+ para atividade e tem pH timo na regio
alcalina, entre 7,5 e 10 e temperatura tima entre 40 e 50 C4,5,33.
Protopectinases
Figura 2. Modo de ao enzimtica das pectinases em uma molcula de pectina.
PMGL: polimetilgalacturonato liase. PMG: polimetilgalacturonase. PMGE:
polimetilgalacturonato esterase (pectina esterase). PGL: poligalacturonato
liase (pectato liase). PG: poligalacturonase. Adaptado da ref. 6
e convertendo pectina em pectato (polmero no esterificado)3,5,29. Age
preferencialmente no grupo metil ster da unidade de galacturonato
prxima a uma unidade no esterificada28, apresenta valores de pH
timo variando de 4 a 8 e temperatura tima de 40 a 50 C5. Est
presente em praticamente todas as preparaes enzimticas comerciais para proteo e melhoramento da textura e firmeza de frutas e
vegetais processados e na extrao e clarificao de sucos de frutas.
Pode estar envolvida em mudanas das substncias pcticas durante
amadurecimento, estocagem e processamento de frutas e vegetais5,6.
Enzimas despolimerizantes
As enzimas despolimerizantes so classificadas de acordo com
a clivagem hidroltica (hidrolases) ou transeliminativa (liases) das
ligaes glicosdicas; mecanismos endo- (randmica) ou exo- (a
partir do final da molcula) de ao e preferncia por cido pctico
ou pectina como substrato. Envolvem as hidrolases (catalisam a
hidrlise de ligaes -1,4) e as liases (catalisam a -eliminao)6,15.
Estas enzimas solubilizam protopectina, formando pectina solvel altamente polimerizada28. Com base nas suas aplicaes, so
principalmente de dois tipos: protopectinase tipo A (PPase-A), que
reage com o stio interno, isto , a regio do cido poligalacturnico
da protopectina e, protopectinase tipo B (PPase-B) que reage com
o stio externo, ou seja, com as cadeias de polissacardeos que podem estar conectadas s cadeias de cido poligalacturnico, constituintes das paredes celulares5. No so muito abundantes e possuem pouco interesse industrial na degradao da pectina6.
UTILIZAO DE RESDUOS AGROINDUSTRIAIS PARA
PRODUO DE ENZIMAS PECTINOLTICAS
A economia brasileira uma das mais importantes economias do mundo baseadas na agricultura, produzindo e exportando
caf, acar de cana, soja, mandioca, frutas, entre outros. Entretanto, a grande produo desses produtos agrcolas gera uma grande quantidade de resduos34. Nos ltimos anos houve um aumento na tentativa de tornar mais eficiente a utilizao desses resduos, cuja disposio no meio ambiente causa srios problemas de
poluio. Com o advento da inovao biotecnolgica na rea de
enzimas e tecnologia das fermentaes, novas perspectivas esto
sendo criadas35. Umas das aplicaes em potencial desses resduos pode ser sua utilizao como fonte de carbono em bioprocessos
para obteno de produtos qumicos e de produtos de maior valor
agregado, como enzimas, lcoois, protenas, cidos orgnicos,
aminocidos, metablitos secundrios biologicamente ativos e
compostos de aroma27,34,36.
APLICAES DAS ENZIMAS PECTINOLTICAS
Hidrolases
As hidrolases incluem as polimetilgalacturonases e as
poligalacturonases.
A polimetilgalacturonase (PMG) presumivelmente hidrolisa
polimetil-galacturonatos a oligometilgalacturonatos30 por clivagem
de ligaes -1,4, podendo ser endo- ou exo-PMG28. Apesar da PMG
ser citada em algumas literaturas, sua existncia questionada por
alguns autores4,30.
As poligalacturonases (PG) hidrolisam -1,4 ligaes
glicosdicas entre dois resduos de cido galacturnico31. a maior
enzima com funo hidroltica, podendo apresentar ao endo(hidrlise randmica) ou exo- (hidrlise seqencial) do cido
pctico5,28. As poligalacturonases fngicas so teis pela alta atividade enzimtica e possuirem pH timo de atividade na regio levemente cida e temperatura tima entre 30 e 50 C5,22.
Indstrias de sucos de frutas
As substncias pcticas so responsveis pela consistncia,
turbidez e aparncia dos sucos das frutas, e sua presena causa um
aumento considervel na viscosidade do suco, dificultando a filtrao e a concentrao6,13. A adio de enzimas pectinolticas nos
purs de frutas e vegetais resulta na degradao da pectina e outros
componentes de alto peso molecular25,37, diminuindo a viscosidade
e aumentando o rendimento dos sucos ocasionando uma aparncia
cristalina no produto final e reduzindo em at 50% o tempo de
filtrao5,13,20.
Durante meados da dcada de 30, quando as indstrias de frutas comearam a produzir sucos, o rendimento era baixo e muitas
dificuldades foram encontradas para filtrar o suco e se atingir uma
392
Uenojo e Pastore
clarificao estvel. A partir de ento, pesquisas utilizando
pectinases, celulases e hemicelulases de microrganismos, juntamente com o conhecimento dos componentes vegetais das frutas,
diminuram essas dificuldades1,5.
A combinao de pectinases, celulases e hemicelulases, chamadas coletivamente de enzimas de macerao, usada na extrao e
clarificao de sucos de frutas e vegetais12,18-20. A adio de -amilase e amiloglicosidase, ativas a pH cido, usada no processamento
de frutas contendo amido, especialmente ma, para prevenir turvao1,4,14,38,39.
O tratamento enzimtico conduz a uma extensa degradao da
lamela mdia e da pectina das paredes celulares por ao de
poligalacturonase, pectina metil esterase e pectina liase. O efeito
sinergstico da combinao de pectinases e celulases um processo
crucial no tratamento enzimtico da polpa para uma quase completa liquefao das frutas e dos vegetais17,40. A hidrlise enzimtica
das paredes celulares aumenta o rendimento de extrao, diminui o
contedo de acares, de matria seca solvel, de cidos
galacturnicos e a acidez titulvel. A polpa resultante tem baixa
viscosidade e a quantidade de resduos da polpa reduzida40.
O uso de enzimas de macerao aumenta o rendimento da extrao e melhora o processamento, sem aumento de custos. Essas
enzimas so utilizadas aps o corte da matria-prima, para macerar
a polpa at a liquefao parcial ou total da fruta, diminuindo o
tempo de processamento e melhorando a extrao dos componentes da fruta. Aps a extrao, pectinases so adicionadas para clarificao e diminuio de viscosidade para facilitar a filtrao e
concentrao1.
Em sucos clarificados, como no de ma, as pectinases so utilizadas na separao de partculas sedimentveis, na filtrao ou
centrifugao. As vantagens do uso de pectinases em sucos incluem: utilizao em diversos tipos de produtos, isto , sucos clarificados, no clarificados, concentrados, polpas, purs etc.; reduo do
tempo total para extrao do suco em relao aos processos clssicos, auxiliam na produo de sucos e concentrados estveis com
reduo de resduos da polpa; custos de produo reduzidos e possibilidade de processamento de diferentes frutas28.
Em sucos no clarificados, como o de laranja, feita a
desnaturao da pectina esterase com o aquecimento do suco, para
prevenir a perda da turbidez desejada, ou congela-se o suco concentrado para manter a enzima em estado inativo28. O tratamento trmico brando pode resultar em produtos de alta qualidade, com melhor qualidade de aroma e maior contedo vitamnico17. Durante o
processo de extrao do suco, as enzimas podem ser adicionadas no
final da extrao da polpa lavada para diminuir a viscosidade ou
aps a extrao final, para aumentar a liberao de acares e slidos solveis, melhorando o rendimento e diminuindo a viscosidade. O tratamento enzimtico melhora a estabilidade da turvao,
pois a degradao da pectina limitada28.
Recuperao de leos essenciais
Os leos essenciais esto localizados especialmente nas clulas
do albedo de frutas ctricas e contm hidrocarbonetos (terpenos e
sesquiterpenos), compostos oxigenados (aldedos, steres, lcoois,
cetonas e fenis) e resduos no volteis (ceras, flavonides e cidos graxos)28. Aps a extrao do suco, as partculas de albedo e a
emulso leo-gua so separadas. Esta emulso passada em um
ciclone e, a seguir, centrifugada para produzir uma emulso rica
em leo, que concentrada28. A aplicao de pectinases hidrolisa
os complexos de pectina-protena, liberando o leo, aumentando o
rendimento, diminuindo o tempo de processo e melhorando a qualidade do produto final5,28.
Quim. Nova
Indstrias de vinhos
Pectinases, em conjunto com -glucanases e hemicelulases,
tm sido utilizadas na produo de vinho. As vantagens do uso das
trs enzimas so: melhor macerao da casca e aumento da extrao de pigmentos, facilita a clarificao e a filtrao do mosto e
aumenta a qualidade e a estabilidade do vinho1,41,42.
A adio de pectinases durante o esmagamento das uvas ou no
mosto de vinho melhora a extrao do suco, reduz o tempo de clarificao e aumenta o contedo de terpenos no vinho. Preparaes
comerciais de pectinases com alta atividade de pectina liase e baixa
atividade de pectina metil esterase so preferidas por minimizarem
a liberao de metanol dos cidos poligalacturnicos metilados durante a produo de vinho1.
Enzimas pectinolticas adicionadas durante a macerao das uvas
para produo de vinho tinto resultam no melhoramento das caractersticas visuais (cor e turbidez), quando comparadas com vinhos
no tratados, apresentando caractersticas cromticas consideradas
melhores que os vinhos controle5.
Extrao de leos vegetais
leos de canola, coco, semente de girassol, palma e oliva so
tradicionalmente produzidos por extrao com solventes orgnicos,
mais comumente o hexano. A degradao da parede celular por
enzimas pectinolticas permite seu uso para extrao de leo vegetal em processo aquoso, pela liquefao dos componentes estruturais das paredes celulares das sementes que contm leo28.
Preparaes comerciais enzimticas contendo pectinases,
celulases e hemicelulases comearam a ser utilizadas para extrao de leo de oliva, sendo adicionadas durante a prensagem das
azeitonas para melhorar o processo de extrao1,28.
O uso de enzimas de macerao aumenta a quantidade de agentes anti-oxidantes e de vitamina E em leo de oliva extravirgem,
reduze a induo ao rano, aumenta a extrao, melhora o
fracionamento na centrifugao e produz leo com baixo teor de
umidade1.
Alimentos funcionais
Pectina e polissacardeos pcticos esto emergindo como ingredientes alimentares bioativos. Pectina de grapefruit, usado industrialmente como estabilizante e como suplemento de alimentos infantis, melhora a nutrio e o desenvolvimento fsico infantil14. Esses oligogalacturondeos e seus produtos de degradao por enzimas
pectinolticas so classificados como probiticos, por serem no
digerveis, ou seja, no so hidrolisados na parte superior do trato
gastrintestinal, e podem ser usados como promotores de sade em
nutrio humana e animal por estimularem seletivamente o crescimento e/ou a atividade de espcies de bactrias residentes no colo
intestinal14.
Melhoramento na extrao de amido de mandioca
Polpa de mandioca, o resduo slido produzido aps a extrao
do amido, contm uma proporo significante de grnulos de amido
(68%, base seca) e de fibras (27%, base seca). O alto contedo de
fibras provavelmente diminui a extrao do amido remanescente,
mantendo os grnulos juntos e presos em uma rede fibrosa, que
pode ser rompida por mtodos enzimticos, baseados na aplicao
de uma mistura de pectinases e celulases que destroem a integridade estrutural da matriz responsvel pelo aprisionamento dos grnulos, expondo e liberando o amido43.
Vol. 30, No. 2
Pectinases
Fermentao de caf e ch
Pectinases so importantes na fermentao de caf e ch, pois
aceleram o processo de fermentao28,44, melhorando a qualidade
do produto final19.
Enzimas pcticas so adicionadas para remover a camada de
mucilagem do gro, constituda de trs quartos de substncias pcticas.
Celulases e hemicelulases, presentes em preparaes comerciais, so
aspergidas nos gros, acelerando o processo de fermentao. Como o
tratamento dos gros de caf em larga escala com enzimas comerciais
custoso e no econmico, so utilizadas enzimas pcticas microbianas
obtidas da fermentao de resduos da mucilagem5,28.
Indstria txtil
Enzimas pectinolticas podem ser usadas nas indstrias txteis
para degradar a camada de pectina que recobre as fibras de celulose, liberando-as para posterior processamento28,45,46, no tratamento
do resduo lquido e na degomagem das fibras naturais18.
Pectinases alcalinas so utilizadas para macerao das fibras
vegetais, como linho, cnhamo e juta, na biopreparao de algodo e
no polimento enzimtico de tecidos mistos de juta e algodo19.
A degomagem de fibras de rami com pectina liase produz fibras com qualidade superior quelas produzidas por complexos
enzimticos comerciais ou utilizando processo qumico com soda
alcalina, alm de reduzir a poluio ambiental provocada pela liberao da soda custica28,46.
Em algodo cru, a remoo da pectina, cera e agentes de goma
com a utilizao de pectinases em conjunto com amilases, lipases e
hemicelulases em condies adequadas, substitui o uso da soda custica e gera produtos de alta qualidade, para posterior tingimento e
processo de tecelagem com menor consumo de energia47.
Indstria de papel e celulose
Durante a fabricao de papel, pectinases podem despolimerizar
substncias pcticas e, subseqentemente, diminuir a demanda
catinica das solues pcticas e do filtrado resultantes do branqueamento com perxido5, solucionar problemas de reteno no
branqueamento mecnico da celulose e no tratamento dos efluentes
dos moinhos de papel19.
Rao animal
Pectinases so utilizadas em conjunto com outras enzimas para
reduzir a viscosidade da rao animal, a fim de aumentar a absoro e a liberao de nutrientes atravs da hidrlise das fibras no
biodegradveis e dos nutrientes bloqueados pelas fibras5.
CONSIDERAES FINAIS E PERSPECTIVAS
Muitos estudos tm sido realizados para isolamento, seleo,
produo, caracterizao e aplicaes de enzimas pectinolticas no
somente em processamento de alimentos, mas tambm para outras
aplicaes industriais.
A elucidao de pectinases atravs de tcnicas de alta resoluo, como cristalografia e ressonncia nuclear magntica, est sendo
realizada, permitindo o entendimento de mecanismos regulatrios
de secreo destas enzimas molecularmente e da sua ao cataltica
nas substncias pcticas.
O melhoramento da produo de pectinases pode ser obtido por
tcnicas moleculares, como DNA recombinante ou mutao
randmica, e os genes podem ser facilmente introduzidos em mi-
393
crorganismos selecionados, que utilizam esse novo material gentico atravs de uma expresso direta. Leveduras normalmente no
produzem ou no secretam pectina metil esterase, entretanto, suas
pectinases podem ser usadas na clarificao de sucos e vinhos,
indicando que genes codificadores de pectinases tm sido clonados
com sucesso e introduzidos em cepas de Saccharomyces cerevisiae
codificadores de enzimas biologicamente ativas17.
A importncia biotecnolgica de microrganismos e de suas
enzimas promove um grande interesse em direo ao entendimento da regulao e da expresso gnica de enzimas extracelulares. O
nmero de seqenciamentos genticos tem aumentado rapidamente, disponibilizando informaes para genmica comparativa,
elucidao de rotas regulatrias e para estudos quantitativos de
polissacardeos vegetais e seus derivados.
AGRADECIMENTOS
Fundao de Amparo Pesquisa do Estado de So Paulo,
FAPESP, pela bolsa de mestrado concedida.
REFERNCIAS
1. Bhat, M. K.; Biotechnol. Adv. 2000, 18, 355.
2. Kashyap, D. R.; Chandra, S.; Kaul, A.; Tewari, R.; World J. Microbiol.
Biotechnol. 2000, 16, 277.
3. Gummadi, S. N.; Panda, T.; Process Biochem. 2003, 38, 987.
4. Sakai, T.; Sakamoto, T.; Hallaert, J.; Vandamme, E.; Adv. Appl. Microbiol. 1993,
39, 213.
5. Jayani, R. S.; Saxena, S.; Gupta, R.; Process Biochem., no prelo.
6. Alkorta, I.; Garbisu, C.; Llama, M. J.; Serra, J. L.; Process Biochem. 1998,
33, 21.
7. Almeida, C.; Brnyik, T.; Moradas-Ferreira, P.; Teixeira, J.; Process Biochem.
2005, 40, 1937.
8. Limberg, G.; Krner, R.; Buchholt, H. C.; Christensen, T. M. I. E.; Roepstorff,
P.; Mikkelsen, J. D.; Carbohydr. Res. 2000, 327, 293.
9. Vilario, C.; Del Giorgio, J. F.; Hours, R. A.; Cascone, O.; Lebensm.-Wiss. u.
Technol. 1993, 26, 107.
10. Whitaker, J. R.; Principles of Enzimology for the Food Sciences, 2nd ed., Marcel
Dekker, Inc.: New York, 1994, p. 425 436.
11. Maiorano, A. E.; Tese de Doutorado, Universidade de So Paulo, Brasil, 1990.
12. da Silva, E. G.; Borges, M. F.; Medina, C.; Piccoli, R. H.; Schwan, R. F.; FEMS
Yeast Res. 2005, 5, 859.
13. Fernndez-Gonzlez, M.; beda, J. F.; Vasudevan, T. G.; Otero, R. R. C.;
Biones, A. I.; FEMS Microbiol. Lett. 2004, 237, 261.
14. Lang, C.; Drnenburg, H.; Appl. Microbiol. Biotechnol. 2000, 53, 366.
15. Gainvors, A.; Frzier, V.; Lemaresquier, H.; Lequart, C.; Aigle, M.; Belarbi,
A.; Yeast 1994, 10, 1311.
16. Tsuyumu, S.; Ishii, S.; Nakamura, M.; Agricultural and Biological Chemistry
1989, 53, 2509.
17. Sorensen, J. F.; Krag, K. M.; Sibbesen, O.; Delcur, J.; Goesaert, H.; Svensson,
B.; Tahir, T. A.; Brufau, J.; Perez-Vendrell, A. M.; Bellincamp, D.; DOvidio,
R.; Camardella, L.; Giovane, A.; Bonnin, E.; Juge, N.; Biochim. Biophys. Acta
2004, 1696, 275.
18. Kaur, G.; Kumar, S.; Satyanarayama, T.; Bioresour. Technol. 2004, 94, 239.
19. Sharma, D. C.; Satyanarayama, T.; Bioresour. Technol., no prelo.
20. Souza, J. V. B.; Silva, E. S.; Maia, M. L. S.; Teixeira, M. F. S.; Process Biochem.
2003, 39, 455.
21. Taragano, V. M.; Pilosof, A. M. R.; Enzyme Microb. Technol. 1999, 25, 411.
22. Zheng, Z.; Shetty, K.; Process Biochem. 2000, 35, 825.
23. Blandino, A.; Dravillas, K.; Cantero, D.; Pandiella, S. S.; Webb, C.; Process
Biochem. 2001, 37, 497.
24. Lima, A. S.; Alegre, R. M.; Meirelles, A. J. A.; Carbohydr. Polym. 2000, 50, 63.
25. de Gregorio, A.; Mandalani, G.; Arena, N.; Nucita, F.; Tripodo, M. M.; lo Curto,
R. B.; Bioresour. Technol. 2002, 83, 89.
26. Silva, D.; Tokuioshi, K.; Martins, E. S.; da Silva, R.; Gomes, E.; Process
Biochem. 2005, 40, 2885.
27. Uenojo, M.; Dissertao de Mestrado, Universidade Estadual de Campinas,
Brasil, 2003.
28. Kayshap, D. R.; Vohra, P. K.; Chopra, S.; Tewari, R.; Bioresour. Technol. 2001,
77, 215.
29. Shen, Z.; Manning, G.; Reese, J. C.; Reeck, G. R.; Insect Biochem. Mol. Biol.
1999, 29, 209.
394
Uenojo e Pastore
30. Rizzatto, M. L.; Dissertao de Mestrado, Universidade Estadual de Campinas,
Brasil, 1999.
31. Mutlu, M.; Sarioglu, K.; Demir, N.; Ercan, M. T.; Acar, J.; J. Food Eng. 1999,
41, 147.
32. Karam, N. E.; Belarbi, A.; World J. Microbiol. Biotechnol. 1995, 11, 559.
33. Mayans, O.; Scott, M.; Connerton, I.; Gravesen, T.; Benen, J.; Visser, J.;
Pickersgill, R.; Jenkins, J.; Structure 1997, 5, 677.
34. Soccol, C. R.; Vandenberghe, L. P. S.; Biochem. Eng. J. 2003, 13, 205.
35. Brand, D.; Pandey, A.; Roussos, S.; Soccol, C. R.; Enzyme Microb. Technol.
2000, 27, 127.
36. Medeiros, A. B. P.; Pandey, A.; Freitas, R. J. S.; Christen, P.; Soccol, C. R.;
Biochem. Eng. J. 2000, 6, 33.
37. Sarioglu, K.; Demir, N.; Acar, J.; Mutlu, M.; J. Food Eng. 2001, 47, 271.
38. Tajchakavit, S.; Boye, J. I.; Couture, R.; Food Res. Int. 2001, 34, 415.
39. Vaillant, F.; Millan, A.; Millan, P.; Dornier, M.; Decloux, M.; Reynes, M.;
Process Biochem. 2000, 35, 989.
Quim. Nova
40. Demir, N.; Acar, J.; Sarioglu, K.; Mutlu, M.; J. Food Eng. 2001, 47, 275.
41. Frnandez, M.; beda, J. F.; Briones, A. I.; Int. J. Food Microbiol. 2000, 59,
29.
42. Takayanagi, T.; Uchibori, T.; Yokutsuka, K.; American Journal of Enology &
Viticulture 2001, 52, 41.
43. Sriroth, K.; Chollakup, R.; Chotineeranat, S.; Piyachomkwan, K.; Oates, C.
G.; Bioresour. Technol. 2000, 71, 63.
44. Silva, C. F.; Schwan, R. F.; Dias, E. S.; Wheals, A. E.; Int. J. Food Microbiol.
2000, 60, 251.
45. Minussi, R. C.; Bacarat-Pereira, M. C.; Coelho, J. L. C.; Silva, D. O.; Lett.
Appl. Microbiol. 1997, 24, 369.
46. Piccoli-Valle, R. H.; Passos, F. M. L.; Passos, F. J. V.; Silva, D. O.; Brazilian
J. Microbiol. 2001, 32, 135.
47. Sawada, K.; Ueda, M.; J. Biotechnol. 2001, 89, 263.
Você também pode gostar
- Guia de Enzimas - OficialDocumento17 páginasGuia de Enzimas - OficialCaiqueAinda não há avaliações
- Lit MediatoneDocumento8 páginasLit MediatoneTertaliana Pires100% (1)
- AULA PRATICA II Proteínas EnzimasDocumento2 páginasAULA PRATICA II Proteínas Enzimasfabio mirandaAinda não há avaliações
- Nutrição e Metabolismo: A importância do consumo equilibrado dos nutrientes no processo metabólicoNo EverandNutrição e Metabolismo: A importância do consumo equilibrado dos nutrientes no processo metabólicoNota: 3 de 5 estrelas3/5 (2)
- GliconeogeneseDocumento32 páginasGliconeogenesesevenmiranda100% (4)
- Pectinases - Aplicação em Industrias de Sucos de FrutasDocumento10 páginasPectinases - Aplicação em Industrias de Sucos de FrutasAlisson AndreiAinda não há avaliações
- Pectinases - Aplicações Industriais e PerspectivasDocumento37 páginasPectinases - Aplicações Industriais e PerspectivasProf. Magoo FortunaAinda não há avaliações
- PECTINA Características e Propriedades Da FibraDocumento6 páginasPECTINA Características e Propriedades Da FibraMariana de AquinoAinda não há avaliações
- Pectina PDFDocumento3 páginasPectina PDFLu GaldinoAinda não há avaliações
- Pectina Caracteristicas e Aplicacoes em AlimentosDocumento33 páginasPectina Caracteristicas e Aplicacoes em AlimentosTamiris ChagasAinda não há avaliações
- Enzimas PectinolíticasDocumento9 páginasEnzimas PectinolíticasDanielPiauAinda não há avaliações
- PECTINASES - Aplicações Industriais e PerpectivasDocumento28 páginasPECTINASES - Aplicações Industriais e PerpectivasJéssica TelesAinda não há avaliações
- Pectina Propriedades Quimicas e Importancia SobreDocumento17 páginasPectina Propriedades Quimicas e Importancia SobresefereinAinda não há avaliações
- Pectina - Propriedades Químicas e ImportânciaDocumento16 páginasPectina - Propriedades Químicas e ImportânciatarcisiosoraresAinda não há avaliações
- Texto Sobre o Uso de Enzimas em Sucos de FrutaDocumento4 páginasTexto Sobre o Uso de Enzimas em Sucos de FrutaJonnathan Amaral de FreitasAinda não há avaliações
- Pectina Caracteristicas e Aplicacoes em AlimentosDocumento33 páginasPectina Caracteristicas e Aplicacoes em AlimentosAlessandraMoeckelAinda não há avaliações
- Relatorio 03 - Desnaturação e Precipitação de ProteínasDocumento16 páginasRelatorio 03 - Desnaturação e Precipitação de ProteínasjefftigasAinda não há avaliações
- Artigo Julho 2021 3Documento14 páginasArtigo Julho 2021 3VanMarvasAinda não há avaliações
- Utilização de Enzimas Na Industria AlimentarDocumento20 páginasUtilização de Enzimas Na Industria AlimentarJoana Afonso FernandesAinda não há avaliações
- Extração de PectinaDocumento14 páginasExtração de PectinaCarol AgostiniAinda não há avaliações
- ENZIMASDocumento26 páginasENZIMASsahsah182004Ainda não há avaliações
- CAROTENOIDESDocumento25 páginasCAROTENOIDESCarlos Silva100% (1)
- Pectin ADocumento9 páginasPectin AmarcelibAinda não há avaliações
- EspessanteDocumento9 páginasEspessanteProjetosAinda não há avaliações
- Apostila 3 - Agentes Tóxicos Naturalmente Presentes Nos Alimentos - Origem VegetalDocumento10 páginasApostila 3 - Agentes Tóxicos Naturalmente Presentes Nos Alimentos - Origem VegetalWagner ReisAinda não há avaliações
- Bioquímica - Questões Aula PráticaDocumento6 páginasBioquímica - Questões Aula PráticaIsabela SotanaAinda não há avaliações
- Actividade Enzimática No TomateDocumento15 páginasActividade Enzimática No TomatesandraazevedoAinda não há avaliações
- 3 FARMACOonline 3Documento8 páginas3 FARMACOonline 3borboletinhabio29Ainda não há avaliações
- Artigo Sobre MaltodextrinaDocumento17 páginasArtigo Sobre MaltodextrinaNaiara EmersonAinda não há avaliações
- Perfil Químico e Biossíntese Dos Policetídeos, Quinonas, Terpenos, Heterosídeos CardiotônicosDocumento65 páginasPerfil Químico e Biossíntese Dos Policetídeos, Quinonas, Terpenos, Heterosídeos CardiotônicosPaula DiasAinda não há avaliações
- Aula05 OPMPOV HormôniosDocumento7 páginasAula05 OPMPOV HormôniosIzabelli de Castro BaptistaAinda não há avaliações
- 3 - Tecidos Vegetais ComestiveisDocumento11 páginas3 - Tecidos Vegetais ComestiveisArthur Traferi NassifAinda não há avaliações
- Trabalho Composição Dos AlimentosiiDocumento11 páginasTrabalho Composição Dos AlimentosiicarolineAinda não há avaliações
- Lista 3 Carboidratos Quimica Dos AlimentosDocumento5 páginasLista 3 Carboidratos Quimica Dos Alimentostainaramachoca23Ainda não há avaliações
- Metabolismo SecundárioDocumento31 páginasMetabolismo SecundárioRafael Henrique Rodrigues Alves100% (1)
- 214 Enzimas Proteolíticas Presentes No Mamão e No Abacaxi. Pág. 2106 2113Documento8 páginas214 Enzimas Proteolíticas Presentes No Mamão e No Abacaxi. Pág. 2106 2113Delegada Da Acla-mg Gabriela De Brito SantosAinda não há avaliações
- Aula Pectinases GCA240Documento27 páginasAula Pectinases GCA240jennyfer.oliveiraAinda não há avaliações
- Polifenóis Cacau, ChocolateDocumento21 páginasPolifenóis Cacau, ChocolateRama ShaktiAinda não há avaliações
- Tecnologia Das FermentaçõesDocumento2 páginasTecnologia Das FermentaçõesTacio DiasAinda não há avaliações
- Proteína Das FolhasDocumento18 páginasProteína Das FolhasespocinAinda não há avaliações
- CAPÍTULO 3 Do Livro de Plantas MedicinaisDocumento4 páginasCAPÍTULO 3 Do Livro de Plantas MedicinaisNayara Cristina PereiraAinda não há avaliações
- Protease Apl, Icação Na Industria de AlimentosDocumento19 páginasProtease Apl, Icação Na Industria de AlimentosWillian MarronAinda não há avaliações
- Prática 05Documento3 páginasPrática 05Christopher IngramAinda não há avaliações
- XilófagosDocumento15 páginasXilófagoswelderAinda não há avaliações
- Apresentação Verde e Branca de Conferência AgroDocumento30 páginasApresentação Verde e Branca de Conferência Agroalborges506Ainda não há avaliações
- Revisão Herbicidas Mimetizadores de AuxinasDocumento7 páginasRevisão Herbicidas Mimetizadores de AuxinasAna Paula S MambriAinda não há avaliações
- Destoxificação HepáticaDocumento75 páginasDestoxificação HepáticaManoela DantasAinda não há avaliações
- Atividade Prática - Enzimas 1Documento8 páginasAtividade Prática - Enzimas 1Larissa CostaAinda não há avaliações
- LigninaDocumento13 páginasLigninaFLAVIO MOREIRA DE ALMEIDAAinda não há avaliações
- TocoferolDocumento12 páginasTocoferolOtilia Marcelino AfonsoAinda não há avaliações
- Arquivo 02Documento2 páginasArquivo 02Natarcia BubolzAinda não há avaliações
- F.C. Caviar OralDocumento6 páginasF.C. Caviar OralRoberto VillarroelAinda não há avaliações
- Atividade Enzimática Da PeroxidaseDocumento3 páginasAtividade Enzimática Da PeroxidaseCarol SanttosAinda não há avaliações
- Ulva lactuca: Aspectos Químicos na Determinação da Atividade Antioxidante TotalNo EverandUlva lactuca: Aspectos Químicos na Determinação da Atividade Antioxidante TotalAinda não há avaliações
- Ecologia FlorestalDocumento42 páginasEcologia FlorestalBurt SousaAinda não há avaliações
- Relatório Geleia de MirtiloDocumento4 páginasRelatório Geleia de MirtiloIzabella QueirozAinda não há avaliações
- Aps - Aplicação Da Cinética Enzimática Nos Processos Farmacêuticos FermentativosDocumento14 páginasAps - Aplicação Da Cinética Enzimática Nos Processos Farmacêuticos FermentativosLucy ModoloAinda não há avaliações
- CTC Fermentação 001Documento126 páginasCTC Fermentação 001denotecprojetosAinda não há avaliações
- Fungos em MaçãDocumento6 páginasFungos em MaçãandreanutricaoAinda não há avaliações
- A Utilização De Material Lignocelulósico Na Produção De BioetanolNo EverandA Utilização De Material Lignocelulósico Na Produção De BioetanolAinda não há avaliações
- Corante natural de flor comestível (Clitória ternatea): extração e avaliação da estabilidadeNo EverandCorante natural de flor comestível (Clitória ternatea): extração e avaliação da estabilidadeAinda não há avaliações
- Aula 3 - Metabolismo MicrobianoDocumento21 páginasAula 3 - Metabolismo MicrobianoFranciele Finck100% (18)
- ME - Resumo de Vias MetabólicasDocumento103 páginasME - Resumo de Vias MetabólicasThiagorochapersonalAinda não há avaliações
- Sintese de AGDocumento24 páginasSintese de AGJosef KislanskyAinda não há avaliações
- Aplicações EnzimáticasDocumento60 páginasAplicações Enzimáticasthubinha100% (1)
- Fosfatos em AlimentosDocumento9 páginasFosfatos em AlimentosJosef KislanskyAinda não há avaliações
- Aula Prática de GlicidiosDocumento19 páginasAula Prática de GlicidiosJosef KislanskyAinda não há avaliações