Escolar Documentos
Profissional Documentos
Cultura Documentos
Comprimento de Ligação
Enviado por
Diogo Alexandre0 notas0% acharam este documento útil (0 voto)
43 visualizações3 páginasO comprimento da ligação N-N será maior na molécula N2H4 do que na molécula N2 porque a ordem de ligação é menor em N2H4 (1 em vez de 3 em N2), e o comprimento da ligação varia inversamente com a ordem de ligação. A ligação H-S na molécula H2S terá maior comprimento do que a ligação H-O na molécula H2O porque o enxofre é maior do que o oxigênio. As moléculas de NH3 estarão ligadas por ligações de hidrogênio enquant
Descrição original:
Título original
Comprimento de ligação.docx
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
DOCX, PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoO comprimento da ligação N-N será maior na molécula N2H4 do que na molécula N2 porque a ordem de ligação é menor em N2H4 (1 em vez de 3 em N2), e o comprimento da ligação varia inversamente com a ordem de ligação. A ligação H-S na molécula H2S terá maior comprimento do que a ligação H-O na molécula H2O porque o enxofre é maior do que o oxigênio. As moléculas de NH3 estarão ligadas por ligações de hidrogênio enquant
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato DOCX, PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
43 visualizações3 páginasComprimento de Ligação
Enviado por
Diogo AlexandreO comprimento da ligação N-N será maior na molécula N2H4 do que na molécula N2 porque a ordem de ligação é menor em N2H4 (1 em vez de 3 em N2), e o comprimento da ligação varia inversamente com a ordem de ligação. A ligação H-S na molécula H2S terá maior comprimento do que a ligação H-O na molécula H2O porque o enxofre é maior do que o oxigênio. As moléculas de NH3 estarão ligadas por ligações de hidrogênio enquant
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato DOCX, PDF, TXT ou leia online no Scribd
Você está na página 1de 3
Comprimento de ligação:
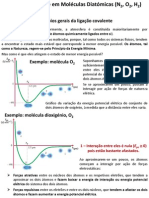
Ordem de ligação
Preveja, justificando, em que moléculas 𝑵𝟐 𝑯𝟒 ou em 𝑵𝟐 será maior o
comprimento da ligação 𝑵 − 𝑵.
Como o comprimento de ligação entre átomos iguais varia na razão inversa
com a ordem de ligação, dado que quanto maior for o número de pares eletrónicos
partilhados, mais intensas serão as interações eletrostáticas atrativas entre os
núcleos e os eletrões dos átomos ligados, sendo menor a distância internuclear
para a qual se verifica um equilíbrio das interações eletrostáticas atrativas e
repulsivas. É de prever que, sendo a ordem de ligação em N2 três (dado que N ≡
N) e em N2 H4 um (dado que N − N), a ligação N − N em N2 H4 possua maior
comprimento de ligação do que a ligação N ≡ N em N2 .
Tamanho dos átomos envolvidos na ligação
Indique, justificando, qual a ligação com maior comprimento, 𝑯 – 𝑺 ou 𝑯 – 𝑶,
em 𝑯𝟐 𝑺 e 𝑯𝟐 𝑶, respetivamente.
O oxigénio (O) antecede o enxofre (S) no mesmo grupo da Tabela Periódica.
Como o raio atómico tende a aumentar ao longo grupo, pois apesar do aumento da
carga nuclear, o aumento do número de níveis preenchidos provoca a expansão da
nuvem eletrónica, é de prever, portanto, que o enxofre (S) tenha maior raio atómico
do que o oxigénio (O), sendo o átomo maior.
Em H2 S e H2 O, os átomos de enxofre e de oxigénio, respetivamente,
encontram-se ligados a átomos do mesmo elemento (de hidrogénio), através de
ligações covalentes simples (H – S e H – O). Como tamanho dos átomos envolvidos
influência na razão direta o comprimento da ligação, dado que quanto maior for o
átomo envolvido na ligação, mais afastados do núcleo estarão os eletrões de
valência (responsáveis por estabelecer a ligação), sendo maior a distância
internuclear (maior comprimento de ligação). É assim de prever que a ligação H – S
na molécula de H2 S tenha maior comprimento do que a ligação H – O na molécula
de H2 O.
Geometria molecular ⇔ Polaridade molecular ⇔ Ligações intermoleculares ⇔ Miscibilidade
Explica, tendo por base a polaridade das moléculas, que tipo de ligações
intermoleculares irão estabelecer-se entre moléculas de 𝐍𝐇𝟑 numa substância
e entre moléculas de 𝐂𝐇𝟒 noutra substância. Preveja se as substâncias serão
miscíveis ou imiscíveis, justificando.
A molécula de amoníaco (𝑁𝐻3 ) possuí átomos de hidrogénio covalentemente
ligados a átomos com elevada tendência para atrair eletrões (átomos de nitrogénio).
É assim de prever que entre moléculas de 𝑁𝐻3 numa substância ocorram ligações
de hidrogénio onde um hidrogénio de uma ligação polar 𝑁 − 𝐻 irá interagir
intermolecularmente com um par de eletrões não ligantes de um átomo de
nitrogénio (N) vizinho e assim sucessivamente, ao longo da substância.
A molécula de metano (𝐶𝐻4 ) apresenta ligações polares 𝐶 − 𝐻 (dado que
sendo os átomos de diferentes elementos, um deles irá atrair mais para si os
eletrões partilhados causando uma diferente densidade eletrónica ao longo dos
átomos ligados). A molécula de 𝐶𝐻4 apresenta ao redor do seu átomo central
somente pares eletrónicos ligantes. Como existem 4 pares de eletrões ligantes em
torno do átomo central (de carbono), segundo o modelo VSEPR, a geometria
molecular que permite a minimização das interações eletrostáticas repulsivas entre
os pares eletrónicos ligantes acontece com a geometria tetraédrica. Sendo os
átomos das extremidades da molécula iguais, apesar da existência somente de
ligações C- H polares como átomo central (de carbono), a geometria tetraédrica
destas moléculas permite uma distribuição simétrica das cargas elétricas em torno
do átomo central, sendo, portanto, as moléculas de 𝐶𝐻4 apolares. Entre as
moléculas de 𝐶𝐻4 , apolares, irão ocorrer forças de dispersão de London onde
moléculas, devido a uma polarização momentânea, se tornam dipolo instantâneos
que irão criar dipolos induzidos nas moléculas vizinhas (ligando as moléculas na
substância).
Neste contexto é de prever que as substâncias serão imiscíveis, isto porque
a intensidade das moléculas isoladas é muito distinta, dado que as ligações de
hidrogénio (em 𝑁𝐻3 ) são muito mais intensas do que as forças de dispersão de
London (em 𝐶𝐻4).
Explica porque é que enquanto o tetraclorometano é líquido, à temperatura
ambiente, o metano é gasoso o que sugere que as ligações intermoleculares
são mais intensas no tetraclorometano.
Ambas as moléculas de tetraclorometano (𝐶𝐶𝑙4) e de metano (𝐶𝐻4 ) possuem
somente pares ligantes em torno do seu átomo central, pelo que, segundo o modelo
VSEPR, existindo 4 ligação entre o átomo central e os átomos das extremidades, a
geometria que permite a minimização das repulsões eletrónicas entre os pares
ligantes acontece com a geometria tetraédrica.
Apesar de ambas as moléculas possuírem ligações intramoleculares polares
e sendo os átomos das extremidades iguais, em cada molécula, a geometria
tetraédrica permite uma distribuição simétrica das cargas em torno do átomo central,
pelo que as moléculas de 𝐶𝐶𝑙4 e 𝐶𝐻4 apolares.
Sendo ambas as moléculas apolares, é de prever que possuam forças de
dispersão de London (típicas de moléculas apolares). Como a molécula de
tetraclorometano é maior do que a molécula de metano (pois o átomo de cloro
presente em 𝐶𝐶𝑙4 é maior do que o átomo de hidrogénio presente em 𝐶𝐻4 , devido
ao maior número de níveis preenchidos que o cloro possuí, relativamente ao
hidrogénio) é de prever que será, portanto, mais polarizável originando, entre
moléculas de 𝐶𝐶𝑙4, ligações mais intensas, estando por isso o tetraclorometano no
estado líquido, enquanto que o metano (devido à menor intensidade das suas
ligações intermoleculares) estará no estado gasoso, à temperatura ambiente.
Você também pode gostar
- #16-Ligação Covalente em Moléculas PoliatómicasDocumento26 páginas#16-Ligação Covalente em Moléculas PoliatómicasAfonso CanelhoAinda não há avaliações
- FF2.2 - 2.1.2Documento3 páginasFF2.2 - 2.1.2iolaAinda não há avaliações
- Unidade 4-2010Documento26 páginasUnidade 4-2010Mango lavoAinda não há avaliações
- Aula 7 - QuímicaDocumento31 páginasAula 7 - QuímicaBeatriz Mariana De Castro Menezes100% (1)
- Parametros Lig - Ligacão QuímicaDocumento16 páginasParametros Lig - Ligacão QuímicaEzeqnewtonAinda não há avaliações
- Química GeralDocumento6 páginasQuímica GeralannaAinda não há avaliações
- Tipos de Ligações Químicas 2Documento12 páginasTipos de Ligações Químicas 2Maria TrindadeAinda não há avaliações
- AulaIVc - QGIDocumento31 páginasAulaIVc - QGIEduardo PaivaAinda não há avaliações
- Ligacao CovalenteDocumento12 páginasLigacao CovalenterodrigomenegazgoularAinda não há avaliações
- Geometria MolecularDocumento54 páginasGeometria MolecularJoão VíctorAinda não há avaliações
- Teoria Da Ligação de Valência (RPECV)Documento16 páginasTeoria Da Ligação de Valência (RPECV)TatianyAinda não há avaliações
- Revisão e Questões Da Prova de QuimicaDocumento6 páginasRevisão e Questões Da Prova de QuimicaAna Carolina Valverde da CostaAinda não há avaliações
- Ae rq10 d2s1 1 3 Geometria e PolaridadeDocumento19 páginasAe rq10 d2s1 1 3 Geometria e PolaridadeMatilde C.Ainda não há avaliações
- Ligação QuímicaDocumento2 páginasLigação QuímicaJoao MAchadoAinda não há avaliações
- Quimica Dos Compostos Inorganicos I Aula 6Documento28 páginasQuimica Dos Compostos Inorganicos I Aula 6Caroline FerreiraAinda não há avaliações
- Hibridização e Geometria Molecular IsmepDocumento37 páginasHibridização e Geometria Molecular Ismepthales machadoAinda não há avaliações
- Ligação QuímicaDocumento50 páginasLigação QuímicaMarcio Luis Oliveira FerreiraAinda não há avaliações
- Teoria Da Repulsão Dos Pares Eletrônicos Da Camada de ValênciaDocumento4 páginasTeoria Da Repulsão Dos Pares Eletrônicos Da Camada de ValênciaElton CruzAinda não há avaliações
- Geometria MolecularDocumento4 páginasGeometria MolecularrafaeljosesAinda não há avaliações
- Força e Comprimentos Das LigaçõesDocumento7 páginasForça e Comprimentos Das LigaçõesRansMilerDantasAinda não há avaliações
- Ligações Químicas III 050614Documento64 páginasLigações Químicas III 050614wrafael1Ainda não há avaliações
- Geometria Das MoléculasDocumento6 páginasGeometria Das MoléculasEverton PiresAinda não há avaliações
- Ligações Covalentes - PesquisaDocumento2 páginasLigações Covalentes - PesquisaPortgas D. AceAinda não há avaliações
- ResumosDocumento43 páginasResumosGuilherme RodriguesAinda não há avaliações
- 13 - Ligação Química (Teoria de Lewis) e Geometria MolecularDocumento22 páginas13 - Ligação Química (Teoria de Lewis) e Geometria Molecularsousarita2663Ainda não há avaliações
- Ligações IntramolecularesDocumento4 páginasLigações IntramolecularesAnaAinda não há avaliações
- Universidade Estadual de Feira de SantanaDocumento11 páginasUniversidade Estadual de Feira de SantanaEdmondDantesAinda não há avaliações
- Propriedades e Transformação Da MatériaDocumento7 páginasPropriedades e Transformação Da MatériahizadraAinda não há avaliações
- Apostila 7 - Substâncias MolecularesDocumento24 páginasApostila 7 - Substâncias MolecularesNycollas SilvaAinda não há avaliações
- MoleculeDocumento11 páginasMoleculePrincepe NamorAinda não há avaliações
- Moleculas A TroposferaDocumento15 páginasMoleculas A TroposferaFrancisco Sousa VieiraAinda não há avaliações
- Polaridade Das MoléculasDocumento10 páginasPolaridade Das MoléculasTallita BarbosaAinda não há avaliações
- Regra Do OctetoDocumento4 páginasRegra Do OctetoIsabela De Carvalho CavalcanteAinda não há avaliações
- Ficha Trabalho - Polaridade e Geometria MolecularDocumento4 páginasFicha Trabalho - Polaridade e Geometria Moleculara14841Ainda não há avaliações
- Tipos de Ligações QuímicasDocumento11 páginasTipos de Ligações QuímicasPedro SoaresAinda não há avaliações
- A27 Lig - QuimDocumento11 páginasA27 Lig - QuimKailane CostaAinda não há avaliações
- 03 - Geometria Molecular e Polaridade de Moléculas PDFDocumento13 páginas03 - Geometria Molecular e Polaridade de Moléculas PDFAdoniran JoséAinda não há avaliações
- Exercícios 2 - Resolvidos Por Aluno (André C.N.)Documento6 páginasExercícios 2 - Resolvidos Por Aluno (André C.N.)Isabela Dias100% (3)
- Lucas QuímicaDocumento60 páginasLucas QuímicaJeronimo Waterloo MonteiroAinda não há avaliações
- A Repulsão Dos Pares Eletrônicos e A Geometria MolecularDocumento9 páginasA Repulsão Dos Pares Eletrônicos e A Geometria MolecularscruutAinda não há avaliações
- Enlaces Químicos Da Matéria 171119Documento18 páginasEnlaces Químicos Da Matéria 171119marcoAinda não há avaliações
- Aula - Introdução OrganicaDocumento56 páginasAula - Introdução OrganicaIusseny do Nascimento Soares SouzaAinda não há avaliações
- Tipos de Ligações QuímicasDocumento5 páginasTipos de Ligações QuímicasMaria TrindadeAinda não há avaliações
- FT 7 RespostasDocumento5 páginasFT 7 RespostasptpbzpwtqdAinda não há avaliações
- Ligações Quimicas - Quimica GeralDocumento52 páginasLigações Quimicas - Quimica GeralYurick Wênio Melo de QueirozAinda não há avaliações
- Conceito de Ligação Química e Estrutura de Lewis de Adelaide - II Unidade TeóricaDocumento11 páginasConceito de Ligação Química e Estrutura de Lewis de Adelaide - II Unidade TeóricaLaryssa NascimentoAinda não há avaliações
- Capitulo 2 Lista de ExerciciosDocumento8 páginasCapitulo 2 Lista de ExerciciosMaykon TuraAinda não há avaliações
- 02 Ligações Químicas - IMPDocumento4 páginas02 Ligações Químicas - IMPLADY LAURA PANTOJA PEREIRA DE CARVALHOAinda não há avaliações
- 05 - Ligação Química III - IQG111Documento30 páginas05 - Ligação Química III - IQG111Rachel DiasAinda não há avaliações
- Moléculas Na Troposfera IDocumento14 páginasMoléculas Na Troposfera IpccsimoesAinda não há avaliações
- Química Orgânica GeralDocumento15 páginasQuímica Orgânica GeralngdqyvcyopckcyjtsnAinda não há avaliações
- F4.1 Ficha1 QuímicaDocumento5 páginasF4.1 Ficha1 QuímicaOlivia GomesAinda não há avaliações
- Resumo 10Q2.1 - N.º 1Documento7 páginasResumo 10Q2.1 - N.º 1marianaAinda não há avaliações
- Aula 01 - Introdução A Ciencia Dos MateriaisDocumento18 páginasAula 01 - Introdução A Ciencia Dos MateriaisMichele SilvaAinda não há avaliações
- Ligacoes QuimicasDocumento121 páginasLigacoes QuimicasmanudaoAinda não há avaliações
- Lista 2 - Fernanda AzevedoDocumento7 páginasLista 2 - Fernanda AzevedoferAinda não há avaliações
- Aula 9 - Notas de AulaDocumento6 páginasAula 9 - Notas de AulaDanielAinda não há avaliações
- Série Didática para o Apoio a Formação de Professores de Química: Volume 2: MoléculasNo EverandSérie Didática para o Apoio a Formação de Professores de Química: Volume 2: MoléculasNota: 5 de 5 estrelas5/5 (1)
- Apresentação OralDocumento5 páginasApresentação OralDiogo AlexandreAinda não há avaliações
- Química 10Documento39 páginasQuímica 10Diogo AlexandreAinda não há avaliações
- Conceitos de Monotonia e Extremos de Uma FunçãoDocumento1 páginaConceitos de Monotonia e Extremos de Uma FunçãoDiogo AlexandreAinda não há avaliações
- AVALIAÇÃODocumento3 páginasAVALIAÇÃODiogo AlexandreAinda não há avaliações
- Orações CoordenadasDocumento4 páginasOrações CoordenadasDiogo AlexandreAinda não há avaliações
- Apreciação Crítica Da Visita de Estud1Documento1 páginaApreciação Crítica Da Visita de Estud1Diogo AlexandreAinda não há avaliações
- HISTÓRIADocumento3 páginasHISTÓRIADiogo AlexandreAinda não há avaliações
- Ficha de TrabalhoDocumento6 páginasFicha de TrabalhoDiogo AlexandreAinda não há avaliações
- Apresentação OralDocumento2 páginasApresentação OralDiogo AlexandreAinda não há avaliações
- Documento Sem TítuloDocumento2 páginasDocumento Sem TítuloReginaldo Myas OficialAinda não há avaliações
- PT 3Documento10 páginasPT 3Diogo Alexandre0% (1)
- Observação de Células Eucarióticas Ao MocDocumento3 páginasObservação de Células Eucarióticas Ao MocDiogo AlexandreAinda não há avaliações
- Boa Tarde Colegas e Excelentíssimo Professor ManuelDocumento1 páginaBoa Tarde Colegas e Excelentíssimo Professor ManuelDiogo AlexandreAinda não há avaliações
- 2 A Globalização e A Regionalização Económica Do MundoDocumento15 páginas2 A Globalização e A Regionalização Económica Do MundoDiogo Alexandre100% (2)
- Comprimento de LigaçãoDocumento1 páginaComprimento de LigaçãoDiogo AlexandreAinda não há avaliações
- Grupo IDocumento5 páginasGrupo IDiogo AlexandreAinda não há avaliações
- Engaged!Documento43 páginasEngaged!Diogo AlexandreAinda não há avaliações
- Comprimento de LigaçãoDocumento1 páginaComprimento de LigaçãoDiogo AlexandreAinda não há avaliações
- Engaged!Documento43 páginasEngaged!Diogo AlexandreAinda não há avaliações
- Far Sade Ines PereiraDocumento4 páginasFar Sade Ines PereiraDiogo AlexandreAinda não há avaliações
- Exercicio de Inquerito CientificoDocumento3 páginasExercicio de Inquerito CientificoDiogo AlexandreAinda não há avaliações
- Comprimento de LigaçãoDocumento3 páginasComprimento de LigaçãoDiogo AlexandreAinda não há avaliações
- BiologiaDocumento1 páginaBiologiaDiogo AlexandreAinda não há avaliações
- Observação de Células Eucarióticas Ao MocDocumento3 páginasObservação de Células Eucarióticas Ao MocDiogo AlexandreAinda não há avaliações
- OutroDocumento1 páginaOutroRodrigo BarbieriAinda não há avaliações
- Patologia Dos Edifícios em Estrutura MetálicaDocumento204 páginasPatologia Dos Edifícios em Estrutura Metálicalarofa79Ainda não há avaliações
- Apostilando IISDocumento91 páginasApostilando IISPedro Correia100% (2)
- Documento Técnico: Consórcio Monotrilho Integração Consórcio Outec / PronDocumento88 páginasDocumento Técnico: Consórcio Monotrilho Integração Consórcio Outec / PronAndersonAinda não há avaliações
- M I C 009-C-SOLAR-TITAN - Rev 00Documento33 páginasM I C 009-C-SOLAR-TITAN - Rev 00Herick TallesAinda não há avaliações
- SP 2400A - UserDocumento48 páginasSP 2400A - UserRicardo Da Silva SantanaAinda não há avaliações
- Envio de Email Com Anexos Utilizando PL-SQL e JSPDocumento6 páginasEnvio de Email Com Anexos Utilizando PL-SQL e JSPMegan Sloan GomesAinda não há avaliações
- Comportamento de Seccoes de Betao ArmadoDocumento58 páginasComportamento de Seccoes de Betao ArmadoArilson NgocaAinda não há avaliações
- RESOLU+ç+âO CONFEA 335 89 (MODALIDADE ENGENHARIA)Documento5 páginasRESOLU+ç+âO CONFEA 335 89 (MODALIDADE ENGENHARIA)Flávio HenriqueAinda não há avaliações
- Propagação de ErroDocumento3 páginasPropagação de ErroHenrick ReisAinda não há avaliações
- Catalogo Tecnico Caixa Dagua BrasilitDocumento8 páginasCatalogo Tecnico Caixa Dagua BrasilitFlávio AlvesAinda não há avaliações
- Guia Do Usuário - Shop Control 8Documento357 páginasGuia Do Usuário - Shop Control 8Ayrton Medeiros100% (2)
- Fibras Sintéticas, Plástico e ElásticoDocumento22 páginasFibras Sintéticas, Plástico e ElásticoBeatrizAinda não há avaliações
- Mirella Okumura RevisadaDocumento54 páginasMirella Okumura RevisadaMisael Albuquerque LiraAinda não há avaliações
- Manual Básico de FanucDocumento50 páginasManual Básico de FanucMarcos Becerra100% (11)
- 2 Relatório Lab ConfortoDocumento15 páginas2 Relatório Lab ConfortoBrayan Henrique Cano BenitezAinda não há avaliações
- Curriculum Vitae HelderDocumento3 páginasCurriculum Vitae Helderhelder_santos2Ainda não há avaliações
- ( (Catalogo HAMP 2019) )Documento2 páginas( (Catalogo HAMP 2019) )Jokar Motos PeçasAinda não há avaliações
- Aula 5 - 5W 2H + GUT PDFDocumento19 páginasAula 5 - 5W 2H + GUT PDFVinícius SoaresAinda não há avaliações
- PlasmaXGas PDFDocumento32 páginasPlasmaXGas PDFdesetekAinda não há avaliações
- 1 Lei de OhmDocumento30 páginas1 Lei de OhmRafael Bán JacobsenAinda não há avaliações
- Normas Técnicas para Construção Civil - Relação de NBRS para Construção CivilDocumento2 páginasNormas Técnicas para Construção Civil - Relação de NBRS para Construção CivilLiliana BernardinoAinda não há avaliações
- Apresentação Pá Carregadeira Nr-12 GenildoDocumento34 páginasApresentação Pá Carregadeira Nr-12 GenildoTarcisio Oliveira MateusAinda não há avaliações
- Capacitância e DielétricosDocumento21 páginasCapacitância e DielétricosLara Viana Aires100% (1)
- Materiais BetuminososDocumento48 páginasMateriais BetuminososAiury Pereira100% (1)
- Fire 2002 BoschDocumento1 páginaFire 2002 BoschRonaldo JúniôrAinda não há avaliações
- Prática 6 Osciloscopio, Gerador de Sinais e MultímetroDocumento5 páginasPrática 6 Osciloscopio, Gerador de Sinais e MultímetroAbraãoBorgesAinda não há avaliações
- Apostila Proteção RespiratóriaDocumento9 páginasApostila Proteção RespiratóriaSandro Lucio de OliveiraAinda não há avaliações
- Diagrama Elétrico 2144GDocumento189 páginasDiagrama Elétrico 2144GJoaci Pacheco100% (1)
- 642 Manipulador TelescopicoDocumento2 páginas642 Manipulador TelescopicoWaldo AlejandroAinda não há avaliações