Escolar Documentos
Profissional Documentos
Cultura Documentos
Propriedades Coligativas
Enviado por
Ericson Sousa0 notas0% acharam este documento útil (0 voto)
7 visualizações20 páginasTítulo original
propriedades-coligativas
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
PPT, PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PPT, PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
7 visualizações20 páginasPropriedades Coligativas
Enviado por
Ericson SousaDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PPT, PDF, TXT ou leia online no Scribd
Você está na página 1de 20
PROPRIEDADES
COLIGATIVAS
-Pressão de vapor/ tonoscopia
-Ebulioscopia
-Crioscopia
-Pressão osmótica
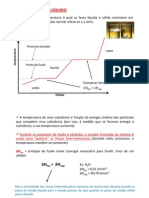
Diagrama de fases da água
A pressão de vapor de um líquido
• Pressão de vapor: pressão que o vapor
de um líquido exerce sobre sua
superfície em um sistema fechado,
onde há equilíbrio químico entre as
duas fases.
Considerações:
• O volume das fases não afeta a pressão de
vapor de um líquido;
• A pressão de vapor depende do líquido;
• Por meio da pressão de vapor pode-se
avaliar os pontos de ebulição e volatilidade
de líquidos diferentes.
Gráfico das curvas de pressão de vapor para
diferentes líquidos
MAS, O QUE É PROPRIEDADE
COLIGATIVA?
• Do latim, co = participação simultânea e
ligare = unir, ligar.
• São propriedades que dependem da
quantidade de partículas de soluto
dissolvidas em uma certa quantidade de
solvente, mas não da natureza das partículas
dissolvidas.
Abaixamento da pressão de vapor
(efeito tonoscópico)
Ebulioscopia
Igual quantidade de matéria de diferentes
solutos não-eletrolíticos e não-voláteis,
dissolvidos numa mesma quantidade de
solvente, causa igual aumento na temperatura
em que se inicia a ebulição desse solvente na
solução.
Crioscopia
Igual quantidade de matéria de diferentes
solutos não-eletrolíticos e não-voláteis,
dissolvidos numa mesma quantidade de
solvente, causa igual abaixamento na
temperatura em que se inicia o congelamento
desse solvente na solução.
Osmose
• Fluxo efetivo de solvente através de uma
membrana permeável apenas ao solvente.
• Fluxo ocorre espontaneamente do meio
menos concentrado para o meio mais
concentrado.
Microscopicamente
A pressão osmótica
• Quando uma solução aquosa está separada
da água por uma membrana permeável
apenas à água, o valor exato de pressão que
se deve aplicar sobre a solução para impedir
a osmose é denominado pressão osmótica, п.
A osmose reversa
Bibliografia
PERUZZO, F. M., CANTO, E. L. do,
Química na abordagem do cotidiano, 3 ed.,
São Paulo, Modrena, 2003, pg. 35-56.
Você também pode gostar
- Propriedades ColigativasDocumento4 páginasPropriedades ColigativasNonato PereiraAinda não há avaliações
- Propriedades ColigativasDocumento20 páginasPropriedades ColigativasAlessandra CarolinaAinda não há avaliações
- Capítulo - 11 - Propriedades - Coligativas 2Documento16 páginasCapítulo - 11 - Propriedades - Coligativas 2Amanda TravassoAinda não há avaliações
- Propriedades ColigativasDocumento23 páginasPropriedades ColigativasAnne IngridAinda não há avaliações
- Escola Estadual Padre Alberto FugerDocumento18 páginasEscola Estadual Padre Alberto FugerRosimeire Aparecida Gonçalves AzaraAinda não há avaliações
- OsmosDocumento23 páginasOsmosThiêssy Lúcio100% (1)
- Pet 02 - 2º emDocumento21 páginasPet 02 - 2º emAna Elisa Teixeira AlcobaAinda não há avaliações
- Aluna: Amanda Kelly Roseno de Souza Série: 2 Ano" C"Documento2 páginasAluna: Amanda Kelly Roseno de Souza Série: 2 Ano" C"Maria SouzaAinda não há avaliações
- Aula 2 - Propriedades ColigativasDocumento44 páginasAula 2 - Propriedades ColigativasBeatriz NunesAinda não há avaliações
- Congelamento Dos LíquidosDocumento5 páginasCongelamento Dos LíquidosJamesCRBAinda não há avaliações
- Revisão Teórica Fenômenos Dos TransportesDocumento3 páginasRevisão Teórica Fenômenos Dos TransportesPaulo RicardoAinda não há avaliações
- Propriedades ColigativasDocumento7 páginasPropriedades ColigativasMaurício PaixãoAinda não há avaliações
- ESTUDO DAS SOLUÇÕES - Slide 2º AnoDocumento19 páginasESTUDO DAS SOLUÇÕES - Slide 2º AnoAlberio Rocha100% (1)
- 7898-2 - PROPRIEDADES COLIGATIVAS - Propriedades ColigativasDocumento9 páginas7898-2 - PROPRIEDADES COLIGATIVAS - Propriedades ColigativasMarcelo GfteamAinda não há avaliações
- Propriedades Coligativas Das Soluções 1Documento37 páginasPropriedades Coligativas Das Soluções 1BruAinda não há avaliações
- Propriedades Coligativas - SlideDocumento11 páginasPropriedades Coligativas - SlideAllan CiceroAinda não há avaliações
- Aula 11 - Notas de AulaDocumento17 páginasAula 11 - Notas de AulaDanielAinda não há avaliações
- Trabalho de Des ColigativasDocumento10 páginasTrabalho de Des ColigativasJorgenilson SandraAinda não há avaliações
- Aula de Propriedades Coligativas em Power Point Pronta 23.08.2023Documento26 páginasAula de Propriedades Coligativas em Power Point Pronta 23.08.2023BrunodsAinda não há avaliações
- OsmosDocumento11 páginasOsmosCarmelinoAinda não há avaliações
- Propriedades ColigativasDocumento8 páginasPropriedades ColigativasVanessa CorreiaAinda não há avaliações
- OsmosDocumento11 páginasOsmosCarmelinoAinda não há avaliações
- Modelo - Slides - ISPB - 2023 - (1) (1) 1aula # 6 Liquidos e Solucoes 2Documento16 páginasModelo - Slides - ISPB - 2023 - (1) (1) 1aula # 6 Liquidos e Solucoes 2Jackson CacondaAinda não há avaliações
- Química Lista 02 - Propriedades ColigativasDocumento14 páginasQuímica Lista 02 - Propriedades ColigativasHugo CimehrioAinda não há avaliações
- FQExpServ P6 Ebuliometria PDFDocumento4 páginasFQExpServ P6 Ebuliometria PDFAntonio Roque CardosoAinda não há avaliações
- Propriedades ColigativasDocumento19 páginasPropriedades ColigativasJuliano SmaAinda não há avaliações
- 2017 08 17 Propriedades Coligativas SerDocumento33 páginas2017 08 17 Propriedades Coligativas SerEugenio ManuelAinda não há avaliações
- Propriedades Coligativas Da Água. Sistemas Dispersos - 2022-2023 - AULA 2Documento40 páginasPropriedades Coligativas Da Água. Sistemas Dispersos - 2022-2023 - AULA 2Dorivaldo GomesAinda não há avaliações
- Propriedades Coligativas - IfrnDocumento42 páginasPropriedades Coligativas - Ifrnvictor.costa1Ainda não há avaliações
- ImportDocumento29 páginasImportCarmelinoAinda não há avaliações
- Hidraulica e Hidrologia - Aula04Documento14 páginasHidraulica e Hidrologia - Aula04Tiago CarvalhoAinda não há avaliações
- Propriedades Coligativas I: QuímicaDocumento21 páginasPropriedades Coligativas I: Químicapatricia primonAinda não há avaliações
- Propriedade QuímicasDocumento13 páginasPropriedade QuímicasEder Cezano GonçalvesAinda não há avaliações
- Curso de Destilação e Extração - COFIC - Destilação - 07 e 08Documento118 páginasCurso de Destilação e Extração - COFIC - Destilação - 07 e 08Fabricio Ilidio DiasAinda não há avaliações
- Relatorio de Quimica Solubilidade 02Documento13 páginasRelatorio de Quimica Solubilidade 02Marcus Vinícius Nascimento FreireAinda não há avaliações
- Química RG PPT - Propriedades ColigativasDocumento10 páginasQuímica RG PPT - Propriedades ColigativasQuímica PPT100% (2)
- Prop ColigativasDocumento17 páginasProp ColigativasVerônica ReinosoAinda não há avaliações
- Aula 2 - Propriedades Da ÁguaDocumento34 páginasAula 2 - Propriedades Da Águaarthur hennys barbosaAinda não há avaliações
- Quimica 18Documento29 páginasQuimica 18ascatanho100% (1)
- Propriedades ColigativasDocumento11 páginasPropriedades Coligativaszenta.angoAinda não há avaliações
- Extração Líquido-LíquidoDocumento9 páginasExtração Líquido-LíquidoMariana da CunhaAinda não há avaliações
- RESUMAODocumento6 páginasRESUMAONeimar Carlos PereiraAinda não há avaliações
- Propriedades ColigativasDocumento28 páginasPropriedades Coligativasmatson0806Ainda não há avaliações
- Ae rq11 d2s3 3 1 Mineraliz AguasDocumento27 páginasAe rq11 d2s3 3 1 Mineraliz AguasflaviorabacalAinda não há avaliações
- Destilação Simples É Um Processo Que Permite A Separação de Um Líquido de Uma Substância Não VolátilDocumento13 páginasDestilação Simples É Um Processo Que Permite A Separação de Um Líquido de Uma Substância Não VolátilValsergio BarrosAinda não há avaliações
- Propriedades Coligativas Das SolucoesDocumento2 páginasPropriedades Coligativas Das SolucoesAvelino Vagner Da SilvaAinda não há avaliações
- Rev - Prov DestilaçãoDocumento2 páginasRev - Prov DestilaçãoPollyanna Silva BessaAinda não há avaliações
- Trabalho de QF 1 Grupo,,.Documento22 páginasTrabalho de QF 1 Grupo,,.Rolleyn MachocoAinda não há avaliações
- P Coligativas 1Documento21 páginasP Coligativas 1Jairo Ribeiro SousaAinda não há avaliações
- Experimento 3-CriosDocumento3 páginasExperimento 3-CriosMayconAinda não há avaliações
- Pressao Capilar Molhabilidade e OutrosDocumento26 páginasPressao Capilar Molhabilidade e OutrosDiego AlexsanderAinda não há avaliações
- Apostila Físico-Química1Documento29 páginasApostila Físico-Química1Diego E MarinaAinda não há avaliações
- Biofísica para ciências biomédicas – 4ª ediçãoNo EverandBiofísica para ciências biomédicas – 4ª ediçãoAinda não há avaliações
- Termoquc 3 AdmicaDocumento30 páginasTermoquc 3 AdmicaEricson SousaAinda não há avaliações
- Hibridizaçao Do CarbonoDocumento7 páginasHibridizaçao Do CarbonoEricson SousaAinda não há avaliações
- Slide - 2º DiaDocumento17 páginasSlide - 2º DiaEricson SousaAinda não há avaliações
- Aula 19-03-24 LumemDocumento51 páginasAula 19-03-24 LumemEricson SousaAinda não há avaliações
- Historico Da Tabela PerrodicaDocumento37 páginasHistorico Da Tabela PerrodicaEricson SousaAinda não há avaliações
- Hibridizaçao Do CarbonoDocumento7 páginasHibridizaçao Do CarbonoEricson SousaAinda não há avaliações
- BNCC - Ensino FundamentalDocumento4 páginasBNCC - Ensino FundamentalEricson SousaAinda não há avaliações
- BNCC - Ensino FundamentalDocumento4 páginasBNCC - Ensino FundamentalEricson SousaAinda não há avaliações
- Uma Vida Com PropósitosDocumento4 páginasUma Vida Com PropósitosEricson SousaAinda não há avaliações
- Aula 12-03 LumemDocumento77 páginasAula 12-03 LumemEricson SousaAinda não há avaliações
- Isomeria MadreDocumento55 páginasIsomeria MadreEricson SousaAinda não há avaliações
- BNCC - Ensino FundamentalDocumento4 páginasBNCC - Ensino FundamentalEricson SousaAinda não há avaliações
- ISOMERIADocumento55 páginasISOMERIAEricson SousaAinda não há avaliações
- Forcas Intermoleculares Solido SolucoesDocumento8 páginasForcas Intermoleculares Solido SolucoesEricson SousaAinda não há avaliações
- BNCC - Ensino Fundamental - 6° AnoDocumento4 páginasBNCC - Ensino Fundamental - 6° AnoEricson SousaAinda não há avaliações
- BNCC - Ensino FundamentalDocumento4 páginasBNCC - Ensino FundamentalEricson SousaAinda não há avaliações
- BNCC - Ensino FundamentalDocumento4 páginasBNCC - Ensino FundamentalEricson SousaAinda não há avaliações
- 2fase Obmep2008n1.inddDocumento532 páginas2fase Obmep2008n1.inddEricson SousaAinda não há avaliações
- Planejamento 2022 - Vortex Educação - Química - Ensino Médio - 1 AnoDocumento18 páginasPlanejamento 2022 - Vortex Educação - Química - Ensino Médio - 1 AnoEricson SousaAinda não há avaliações
- Quimica - MEDICINADocumento254 páginasQuimica - MEDICINAEricson SousaAinda não há avaliações
- Revisão ALFABTOCDocumento14 páginasRevisão ALFABTOCEricson SousaAinda não há avaliações
- 6º Ano - Programação Anual - Ensino Fundamental - Anos Finais - 2022 14-12Documento33 páginas6º Ano - Programação Anual - Ensino Fundamental - Anos Finais - 2022 14-12Ericson SousaAinda não há avaliações
- Manual Do Professor - Ciencias Livro 01 (7°ano)Documento29 páginasManual Do Professor - Ciencias Livro 01 (7°ano)Ericson SousaAinda não há avaliações